Na2CO3盐胁迫对10个苜蓿品种生长初期地下指标的影响
王运涛, 于林清, 远 婷, 王晓杰, 解继红
(1. 张家口学院, 河北 张家口 075000;2. 中国农业科学院草原研究所, 内蒙古 呼和浩特 010010)
苜蓿(Medicagosativa.)是一种优良的豆科牧草,具有营养价值高、适口性好、栽培范围广等特点,被人们冠以“牧草之王”的美称[1]。我国苜蓿栽培面积约133万hm2[2-3],在草食畜牧业发展中占有重要的地位[4]。
我国有盐碱地670万hm2,约占全国耕地面积的7%左右[5]。土壤盐渍化已成为当今世界农业发展所面临的重要问题[6]。在盐碱地土壤中,农作物产量很低,甚至无法耕种。利用耐盐、抗盐植物是进行盐碱地改良经济有效的措施[7]。而苜蓿具有一定的耐盐碱能力,在中性土壤或轻度盐碱土壤中生长良好[8],但其品种间的耐盐性差异较大[9-10]。对苜蓿品种的耐盐性鉴定是苜蓿品种选育的基础。因此,深入研究苜蓿的耐盐性,加速苜蓿的耐盐育种,克服土壤盐渍化对苜蓿栽培的制约,不仅可以有效改良盐碱地,还可以生产优质的蛋白质饲料,为我国畜牧业的发展奠定基础[11]。而根系是植物从土壤中吸收水分和矿质营养的主要器官,根系特征是牧草水分和养分管理、刈割和放牧利用的基本依据,亦与土壤耕作及作物种植制度密切相关[12],其生长发育状况直接影响着地上生物量[13]。不同品种植物的根系在不同环境条件下表现出不同的特点,也表现出各自的根系发育特性[14-15]。植物根据主根是否发达分为直根系和须根系,而苜蓿多属于直根系。根颈是由真叶以下的胚轴发育而成,其上能够形成大量的芽,是产生分枝的重要部位,同时也是吸收、运输、储存养分和水分的重要器官,根颈直接影响着苜蓿的生产性能和可持续利用[16-17]。侧根是由主根生长到一定长度,在一定部位上侧向地从内部生出许多支根,侧根一般是由和原生质部邻接的中柱鞘的细胞形成的。侧根对于固定植株和从土壤中吸收水分具有重要作用。根系可以通过不同生理或形态变化来响应逆境胁迫信号[18]。盐分积聚可使根际环境的渗透势升高,造成根系对水分和矿质营养吸收困难,从而严重影响根系的构建和发育。本研究通过对10个苜蓿品种在盆栽情况下进行Na2CO3盐胁迫处理,对他们生长初期的地下指标进行比较分析,以便筛选出在碱性盐胁迫下根系发育好的苜蓿品种,为盐碱地苜蓿人工草地的开发奠定基础。
1 材料与方法
1.1 试验材料
试验于2015年5月-8月在张家口学院进行,试验材料均由中国农业科学院草原研究所提供, 选择来源国内外的 10个苜蓿种质材料,种子名录及来源如表1所示。
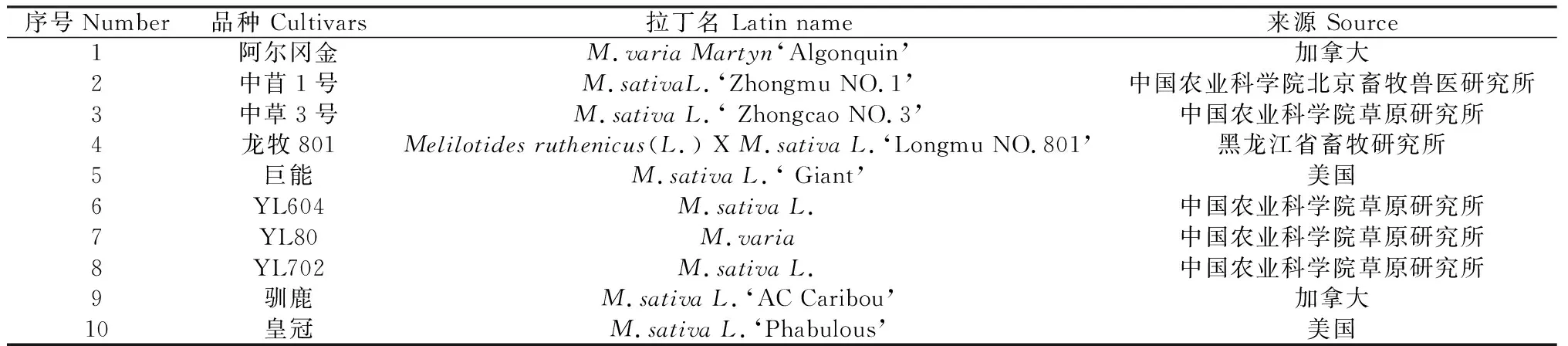
表1 苜蓿种子材料名录及来源Table 1 Sources of different alfalfa cultivars
1.2 试验方法
试验于2015年5月28日开始,采用无孔的朔料花盆150个,口径23 cm×15 cm。在花盆中放入2.0 kg土壤(土壤的Na2CO3浓度梯度为0.0%(CK),0.3%,0.6%,0.9%和1.2%)。然后将各苜蓿种子(25粒)置于花盆土壤表面,并撒上一层土。每个处理设置3次重复。定期浇水,保持土壤湿润。待花盆中种子全部发芽后,间苗。每盆保留15株。于生长期内测定相关指标。
1.3 指标测定
供试苜蓿品种于播种当年的8月初进行指标测定,每个处理选取长势均匀的10棵植株。测定指标如下:
根颈指标:根颈直径是指主茎与主根相连处的膨大部位的直径;根颈入土深度是指从地表到根颈上端的距离[19]。
根系指标:主根直径是指距离根颈1 cm处的主根直径;侧根位置是指主根上面距离根颈最近的且直径大于1 mm的侧根与根颈之间的距离,侧根直径是指第一条靠近主根处侧根的直径[20]。
单项指标耐盐系数=(不同浓度处理下平均测定值/对照测定值)×100%
1.4 数据分析
用Excel 2003软件对数据进行基本处理,再用SAS 8.1统计分析软件对数据进行方差分析,结果用平均值的形式表示。
2 结果与分析
2.1 盐胁迫下供试苜蓿品种根颈指标差异比较
在相同盐浓度胁迫下,不同苜蓿品种的根颈直径具有明显差异,如表2所示。在对照中,‘中草3号’的根颈直径最大,为6.78 mm;‘YL702’的根颈直径较小,为4.83 mm,两者差异显著(P<0.05)。在盐浓度为0.9%时,‘驯鹿’的根颈最粗,直径为5.75 mm;‘龙牧801’次之;‘YL702’的根颈最小,仅为4.32 mm,且与前两者差异显著(P<0.05),其余品种居中。在盐浓度为1.2%时:同样是‘驯鹿’的根颈最粗,为6.78 mm;‘中苜1号’次之;‘YL80’的根颈最细,仅为3.74 mm,且与前两者差异显著(P<0.05)。各苜蓿品种的根颈直径随着盐浓度梯度的变化情况如下:‘巨能’、‘YL604’和‘YL702’的根颈直径在不同盐浓度下差异不显著;而其他品种的根颈直径在不同盐浓度下差异显著(P<0.05),就均值来看,供试苜蓿品种的根颈直径随盐浓度的增加呈逐渐变小的趋势。
在相同盐浓度胁迫下,不同苜蓿品种间的根颈入土深度具有显著差异,如表2所示。在对照中,‘龙牧801’的根颈入土较深,为0.80 cm;‘YL604’次之,两者差异不显著;‘阿尔冈金’根颈入土较浅,为0.30 cm,与前者差异显著(P<0.05)。盐浓度为0.9%时同样为‘龙牧801’的根颈离地面最远,为0.90 cm;‘皇冠’的根颈离地面次之;‘阿尔冈金’的根颈离地面最近,仅为0.52 cm,且他与前两者的差异显著(P<0.05)。在盐浓度为1.2%时,‘巨能’的根颈入土较深为1.08 cm;‘中草3号’次之,两者差异不显著;‘皇冠’的根颈入土较浅为0.44 cm,其与前者差异显著(P<0.05)。各苜蓿品种的根颈入土深度随盐浓度梯度的变化如下:‘中苜1号’、‘YL604’、‘YL80’、‘YL702’和‘驯鹿’的根颈入土深度在不同盐浓度下差异显著(P<0.05),就均值来看,供试苜蓿品种的根颈入土深度在不同盐浓度下差异不显著,而其他品种的根颈入土深度随盐浓度的增加呈逐渐增大的趋势。
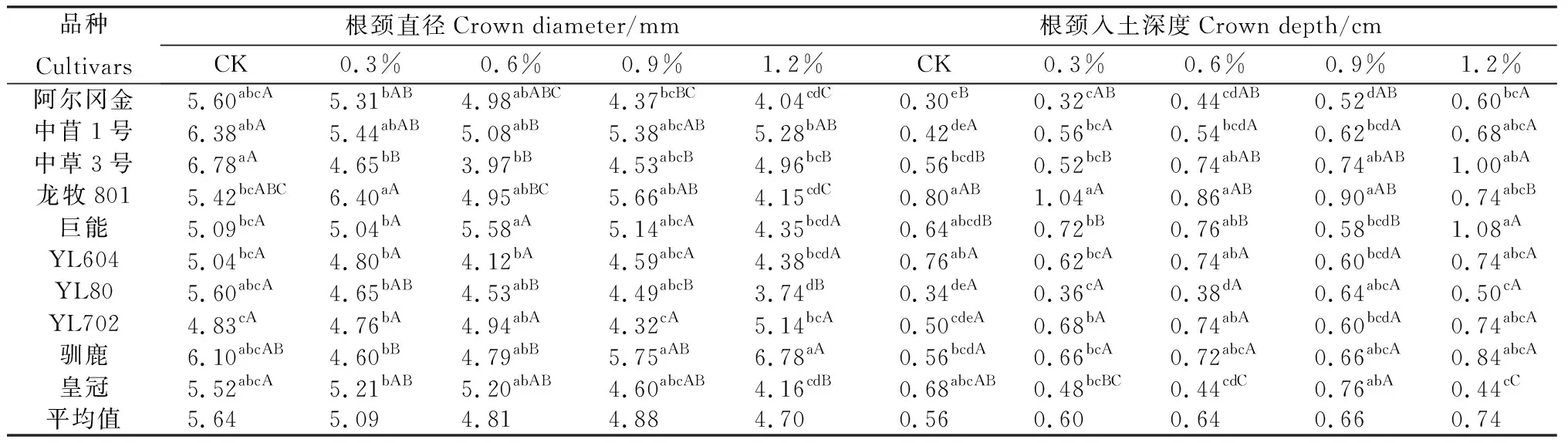
表2 盐胁迫下供试苜蓿品种根颈指标间的差异比较Table 2 Comparison of crown indexes of different alfalfa cultivars under salt stress
2.2 盐胁迫下供试苜蓿品种主根直径的差异比较
在相同盐浓度胁迫下,不同苜蓿品种的主根直径具有明显差异,如表3所示。在对照中,‘中草3号’的主根较粗大,达6.46 mm;‘中苜1号’次之,两者差异不显著;‘YL702’的主根直径较小,仅为4.15 mm,与前者差异显著(P<0.05)。在盐浓度为0.9%时,‘驯鹿’的主根较粗大,为4.70 mm;‘中苜1号’次之,两者差异不显著;‘阿尔冈金’主根较细,为3.52 mm,与前者差异显著(P<0.05)。在盐浓度为1.2%时,‘驯鹿’的主根直径最大,为4.79 mm;‘中草3号’的次之;‘阿尔冈金’的主根最细,仅为3.06 mm,与前两者差异显著(P<0.05)。各苜蓿品种的主根直径随盐浓度梯度的变化情况如下:不同盐浓度下‘YL702’和‘驯鹿’的主根直径差异不显著,其他品种的主根直径在不同浓度下差异显著(P<0.05),就均值来看,供试苜蓿品种的主根直径随盐浓度的增加呈现逐渐减小的趋势。

表3 盐胁迫下供试苜蓿品种主根直径的差异比较Table 3 Comparison of taproot diameter of different alfalfa cultivars under salt stress
2.3 盐胁迫下供试苜蓿品种侧根指标间的差异比较
在相同盐浓度胁迫下,不同苜蓿品种的侧根直径具有明显差异,如表4所示。在对照中,‘阿尔冈金’的侧根直径较大为1.84 mm;‘中草3号’次之,与前者差异不显著;‘YL702’较细,为1.03 mm,与前者差异显著(P<0.05)。在盐浓度为0.9%时,‘YL604’的侧根直径最大为1.90 mm;‘中草3号’的次之;‘YL702’的侧根最细,仅为1.09 mm,与‘YL604’差异显著(P<0.05),与‘中草3号’的差异不显著。在盐浓度为1.2%时,‘驯鹿’的侧根最粗大,为1.97 mm;‘YL80’的次之;‘YL604’和‘阿尔冈金’的侧根最细,均为1.03 mm,均与‘驯鹿’差异显著(P<0.05),与‘YL80’差异不显著。但随着盐浓度梯度的增加,各苜蓿品种的侧根直径变化趋势不是很明显。

表4 盐胁迫下供试苜蓿品种侧根指标间的差异比较Table 4 Comparison of lateral root indexes of different alfalfa cultivars under salt stresses
在相同盐浓度胁迫下,不同苜蓿品种的侧根位置具有明显差异,如表4所示。在对照中,‘YL702’的侧根离根颈较远,为1.20 cm;‘阿尔冈金’次之;‘中草3号’的侧根离根颈较远,为0.52 cm,与‘YL702’差异显著(P<0.05),与‘阿尔冈金’差异不显著。在盐浓度为0.9%时,‘阿尔冈金’的侧根离根颈最远,为1.60 cm;‘YL80’的次之;‘巨能’的侧根离根颈最近,仅为0.56 cm,且与前两者差异显著(P<0.05)。在盐浓度为1.2%时,同样为‘阿尔冈金’的侧根离根颈最远,为1.92 cm;‘龙牧801’的次之;‘中草3号’的侧根离根颈最近,为0.88 cm,与‘阿尔冈金’差异显著(P<0.05),与‘中草3号’差异不显著。各苜蓿品种的侧根位置随盐浓度梯度的变化情况如下:‘中苜1号’、‘中草3号’、‘巨能’、‘YL80’、‘YL702’、‘驯鹿’和‘皇冠’的侧根位置,在不同盐浓度梯度下无显著差异,其他品种的侧根位置在不同浓度下具有显著差异(P<0.05),就均值来看,供试苜蓿品种侧根位置随盐浓度梯度的增加呈逐渐增大的趋势(P<0.05)。
2.4 供试苜蓿品种的耐盐性评价
由表5可知,盐胁迫处理后苜蓿根系各指标变化各不相同。根颈直径和主根直径变小,根颈入土深度和侧根位置变大,侧根直径变化趋势不明显。因此盐胁迫对苜蓿的影响是复杂的,不能用某一个指标来评价苜蓿品种的耐盐性强弱。综合0.9%和1.2%Na2CO3盐胁迫下的根系发育状况,综合各指标评价处于生长初期的苜蓿品种的耐盐性(表6),结果表明:耐盐性由强到弱依次为:‘驯鹿’>‘中苜1号’>‘中草3号’=‘巨能’>‘龙牧801’>‘皇冠’>‘YL702’>‘YL604’>‘YL80’>‘阿尔冈金’。
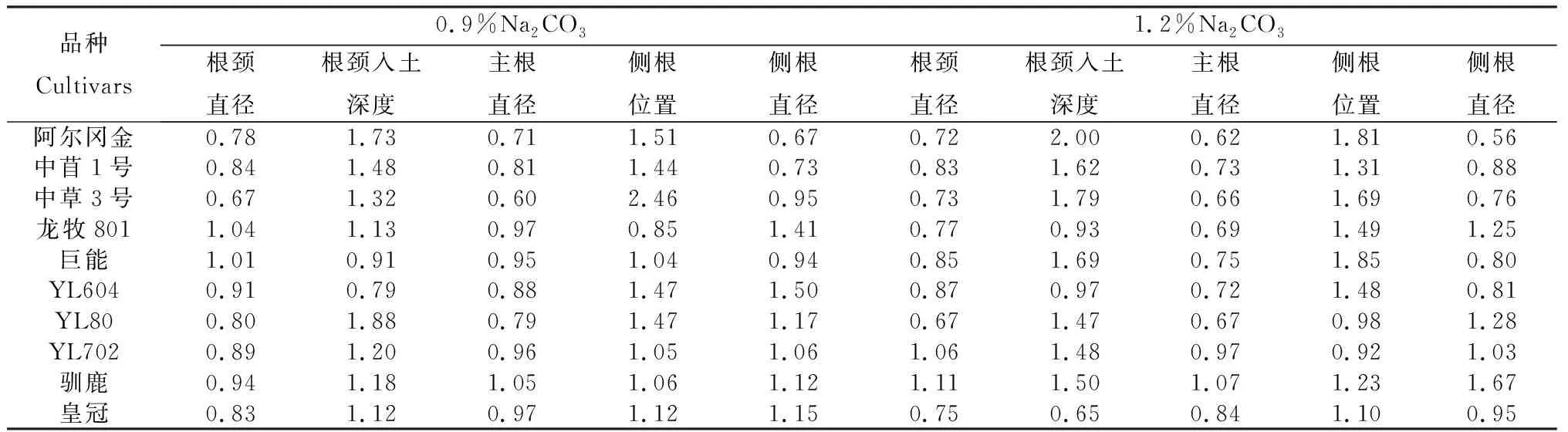
表5 供试苜蓿品种的耐盐系数Table 5 Salt tolerance value of different alfalfa cultivars
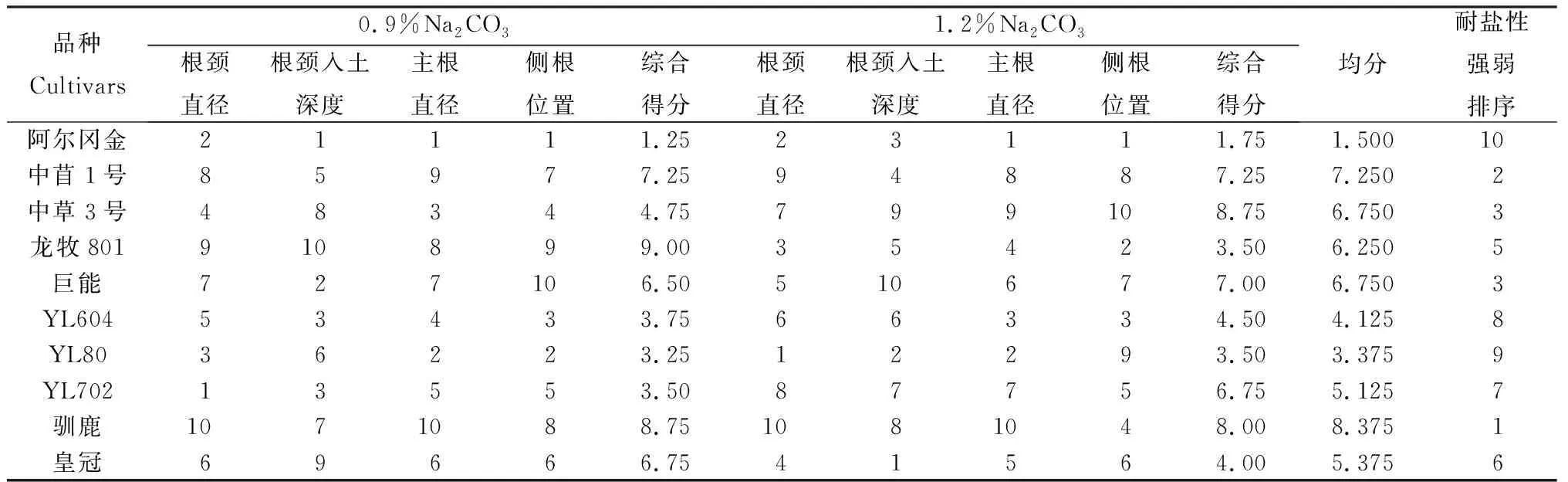
表6 供试苜蓿品种的耐盐性评价Table 6 Salt tolerance evaluation of different alfalfa cultivars
3 讨论
植物根系生长在土壤中,他将从土壤中吸收的各种营养成分通过根的维管组织运输到地上部分,而叶片将制造的有机物运送回根部,促进其生长发育。根系作为联系地上与地下的重要纽带,其形态结构不仅能反映植物根系的生长状况,也能在很大程度上体现地上部分的生长状况[21]。植物最先感受地下逆境胁迫的器官也是根系,逆境胁迫下根系形态上的变化是最直观的,但根系恰恰又是最不为人们所了解的植物器官。土壤中可溶性盐过多会降低土壤的水势,使植物的根系吸水能力下降,甚至导致根系内的水分外渗,对盐离子的吸收不均衡,导致植物营养失调,生长发育受到抑制,严重时还会发生单盐毒害作用,从而影响植物根系的正常发育[22]。
苜蓿根颈是产生分枝的重要部位,同样也是冬季植物体的最上部休眠器官,为冻害的最敏感部位,对苜蓿越冬和春季返青时的萌芽发枝至关重要,直接影响苜蓿生产性能和可持续利用,如再生性、耐寒性、抗旱性和抗病虫害性等都与其密切相关。有研究表明苜蓿品种间根颈特性有明显的差异[23],本试验中的对照也证实了这一点。在相同Na2CO3浓度胁迫下,供试苜蓿品种的根颈直径和根颈入土深度均存在显著差异;随着盐浓度梯度的增加,各苜蓿品种的根颈直径逐渐变小,根颈入土深度逐渐增大。这说明盐胁迫对根颈的发育具有一定的抑制作用。在盐胁迫下,苜蓿生长不良,根颈变细与入土加深可能是一种补偿机制,是对逆境的一种适应[24]。
大部分苜蓿栽培品种的根系为直根型,由主根和侧根组成[25]。苜蓿根系发育状况可以反映其利用土壤中营养物质,水分和微量元素的能力强弱。根系直径的大小直接影响着根系体积和根系生物量,根系体积越大,所接触的土壤面积越大,地下空间占有量越大,越有利于植物大范围吸收土壤水分、养分。侧根在主根上的发生部位,可以反映植物利用土壤水分、养分和微量元素的立体分异性。在盐胁迫下,根系的总长度、表面积、平均直径、总体积、根尖数、鲜重和干重均会受到抑制。碱性盐对植物的毒害主要是盐胁迫和高pH胁迫及这两种因素的相互作用产生的复合毒害,这比单独的盐胁迫危害更大。在盐碱条件下,细胞间质的pH升高,阻碍细胞壁的疏松,进而阻碍细胞延伸,影响植物生长。高pH会抑制根毛发生,进而影响植物对水分和养分的吸收以及植物正常的生长发育[26]。尤其是根际的PH改变可以从多方面影响植物的根际环境,诸如根际土壤中矿质养分的化学和生物学有效性、根系对营养元素的吸收利用、根系细胞膜的透性、根系的生长状况以及根际酶的活性等[27]。本研究发现,在相同浓度盐胁迫下,供试苜蓿品种间主根直径、侧根直径和侧根发生部位均差异显著;且随着盐浓度的增加,供试苜蓿品种的主根直径均呈现逐渐减小、侧根位置离根颈距离逐渐增大的趋势,说明盐胁迫可以抑制根系直径的发育和侧根的发生,且浓度越高抑制效果越明显。韩清芳等[28]、王征宏等[29]认为低盐浓度会促进苜蓿根的生长,高盐浓度才会抑制根系发育。但本试验只表现出了抑制作用,这可能与本试验选取的盐的种类或盐浓度梯度有关。而且各指标在胁迫下的变化幅度各不相同,若用不同指标评价苜蓿的耐盐性,其结果会有所不同[30]。因此评价苜蓿的耐盐性强弱应该将多个指标综合起来进行评价,使结果更加准确和全面。
由于试验条件的限制,对于苜蓿碱性盐胁迫下的根系空间分布、体积、表面积、走向以及根系自身对盐碱的调节能力还有待于进一步研究。
4 结论
在相同Na2CO3浓度胁迫下,供试苜蓿品种间生长初期的根系指标均差异显著。随着Na2CO3浓度梯度的变化,同一品种的根系指标变化具有一定的规律性:根颈直径和主根直径呈逐渐变小的趋势,根颈入土深度和侧根位置呈逐渐变大的趋势,但侧根直径变化趋势不明显。
在生长初期,供试的10种苜蓿材料耐盐性强弱存在种间差异。综合0.9%和1.2%Na2CO3胁迫下的根系指标发育状况可知,供试苜蓿品种的耐盐性强弱依次为‘驯鹿’>‘中苜1号’>‘中草3号’=‘巨能’>‘龙牧801’>‘皇冠’>‘YL702’>‘YL604’>‘YL80’>‘阿尔冈金’。因此在碱性盐较为严重的区域种植苜蓿时,应对苜蓿的品种具有选择性,如‘驯鹿’和‘中苜1号’的耐盐性较强,可在适当地区推广种植。

