柳枝稷体外诱导花器官逆转与非逆转穗芽生理特性差异研究
王勇锋, 李 毛, 崔桂宾, 徐开杰, 孙风丽, 张 超, 刘曙东, 奚亚军*
(1. 西北农林科技大学农学院, 陕西 杨凌 712100; 2. 中国农业科学院棉花研究所, 河南 安阳 455000)
开花是一个复杂的生命进程,其发生受到光周期、温度、春化作用、植物激素等多因素的影响[1-5]。正常情况下,植物个体成熟以后即可进行开花、授粉、结实等一系列的生命过程,然而某些植物在进入成熟期后遇到不利于开花的外界环境,如持续降雨[6]、气温骤变[7]、人为改变光周期[8]等,部分已分化并发育的花器官组织将停止发育或逆向发育,最终再次形成营养器官或类似营养器官的组织,这种现象被称为花器官逆转。花器官逆转根据逆转来源不同又被分为花逆转(花的部分结构发生逆转)和花序逆转(花序上的小花发生逆转)[7,9]。花器官逆转现象最早在凤仙花(Impatiensbalsamina)中有详细报道,研究发现将开花期的凤仙花从短日照环境转移到长日照环境下,花序终端将由花转变成叶[7,9]。模式植物拟南芥(Arabidopsisthaliana)在短日照条件下也有部分小花逆向发育形成花序的现象,然而该现象只在其Landsberg erecta生态型中发现,且逆转频率不高,而其突变体lfy-6和ag-1在短日照条件下发生逆转频率升高[8,9]。在单子叶植物中同样有花器官逆转相关报道,Joseph等、Wang等分别研究发现,玉米(Zeamays)突变体id1无雄花发育[10],水稻(Oryzasativa)突变体pho不能形成正常小花[6],相应的花器官均发育形成新生幼苗。
在影响花发育的众多因素中,植物激素被认为是一种至关重要的因子。在前人的研究中发现,多数影响到花发育的环境条件(光周期、温度等)在诱导花器官形成的过程中都会引起植物体内激素水平变化[4,5,11]。Kesy等发现短日照植物矮牵牛(Pharbitisnil.)在开花前人为打断黑暗条件将会显著抑制开花,研究表明该过程中植物体内生长素(IAA)和乙烯(Eth)含量急剧升高,并且外源施加IAA和Eth同样能起到抑制开花的效果[1];Sringarm等研究表明龙眼树(Dimocarpuslongan, Lour.)在低温诱导开花的过程中内源异戊烯基腺嘌呤/异戊烯基腺苷(iP/iPA)和吲哚乙酸(IAA)含量急剧升高,而玉米素(ZR)和赤霉素(GA)含量却明显降低[3]。细胞分裂素(CTK)在花发育过程中也起到重要的作用,多数研究者认为CTK在植物开花过程中起到促进作用[5,12],然而也有研究认为,细胞分裂素含量过高时,不利于植物从营养生长向生殖生长转变[13]。
柳枝稷(PanicumvirgatumL.)是短日照开花植物[14-15],在陕西杨凌其抽穗期为每年7-8月,不同纬度间进行引种会引起开花期的改变。之前的研究中我们发现,将柳枝稷幼穗置于含有高水平外源细胞分裂素的培养基上进行体外培养时,部分已分化的花器官停止生殖生长,转而逆向发育,经花器官逆转途径形成逆转穗芽[16]。人们对花器官逆转的研究由来已久,然而之前的研究多集中在花器官逆转的诱导方法以及现象描述等方面[17-18],很少有人对花器官逆转的生理特性进行较为详细的研究。柳枝稷体外花器官逆转诱导穗芽与前人通过改变环境诱导花器官逆转的方法相比具有易操作、效率更高、结果更稳定等优势[9,19]。本文参照前人研究,结合本实验室前期柳枝稷人工穗芽诱导相关工作,从生理学方面对柳枝稷花器官逆转现象进行探索,以期在一定程度上揭示柳枝稷花器官逆转发生的机理,为柳枝稷及其他植物花器官逆转研究和花发育研究提供参考。
1 材料与方法
1.1 试验材料
柳枝稷为异花授粉植物,同一品种不同植株间性状存在一定差异[14,20]。为验证体外诱导花器官在不同类型柳枝稷材料中的一致性,试验以柳枝稷栽培品种“Alamo”两个植株为材料,编号分别为“4-6”和“14-7”,其中“14-7”与“4-6”相比植株更高大且分蘖更集中。材料种植于温室中,每天光照16 h,温度为恒温30℃。
1.2 柳枝稷穗芽诱导
当柳枝稷发育至伸长期第4期(E4期)时[21],茎端发育出1~2 cm长幼穗,取下茎端(保留幼穗上下各2 cm),先用体积分数70%的酒精消毒1 min,然后用体积分数8%的次氯酸钠(有效氯5.5%)再次消毒1~2 min,无菌水冲洗3~4次[16]。将处理后的材料在超净工作台中切去两端各0.5 cm,并将其纵向切成两半,接种到穗芽诱导培养基(Shoot Induction Medium, SIM)或MS基本培养基(Murashige and Skoog, MS)[22]上,之后置于25℃恒温光照培养箱中培养,光周期为20 h白天/4 h黑暗。来自于两棵柳枝稷单株的试验材料分别培养和研究。
MS培养基:MS培养基无机盐和有机物 + 30 g·L-1蔗糖 + 7 g·L-1琼脂粉,pH 5.8;
SIM培养基:MS培养基无机盐和有机物 + 3 mg·L-16-BA + 30 g·L-1蔗糖 + 7 g·L-1琼脂粉,pH 5.8。
1.3 穗芽继代培养
穗芽诱导培养30 d后,将材料在超净工作台中取出,切除芽块上部叶片,留下基部1~1.5 cm,然后将其接种到新鲜培养基中。继代培养所使用培养基与穗芽诱导培养一致,仍为SIM培养基或MS基本培养基。之后再次将材料置于25℃恒温光照培养箱中培养,光周期保持20 h白天/4 h黑暗不变。继代培养30 d后(共培养60 d),再次将材料取出并重复一次继代培养。
1.4 生理指标测定及方法
试验使用裂区设计,其中培养基类型(SIM和SM)和柳枝稷材料(4-6和14-7)为主处理,诱导时间(30 d,60 d,90 d)为副处理,试验材料每30 d继代一次。取不同处理的柳枝稷穗芽分别进行生理指标的测定,并进行主处理和副处理的差异性分析,每个处理重复3次。测定的生理指标包括可溶性糖含量[23]、游离氨基酸含量[24]、可溶性蛋白含量、总氮含量、叶绿素含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、多酚氧化酶(PPO)活性[25]。利用酶联免疫法对不同处理3个培养时期的柳枝稷穗芽测定生长素(IAA)、赤霉素(GAs)、细胞分裂素(ZRs)和脱落酸(ABA)含量,并进行处理间和培养时期间的差异性分析,每个样品重复3次。
1.5 数据分析
数据整理及图表绘制使用Excel 2013,数据统计分析使用软件DPS 7.05。
2 结果与分析
2.1 柳枝稷穗芽诱导特点
当柳枝稷4-6和14-7在SIM培养基和MS基本培养基上进行诱导培养30 d以后,不同处理的材料在形态上出现了明显的差异。外植体在SIM培养基上(图1c,1e)的生长速率较MS基本培养基(图1d,1f)更快,产生逆转穗芽数量大;与MS培养基上的非逆转穗芽相比,逆转穗芽长度较短,但整体更粗壮,节间更密集;在MS基本培养基上培养30 d后,幼穗继续生长发育,长出小花(图1d,1f),与之相比, SIM培养基上幼穗的小花发育更为缓慢或出现花器官逆转现象(图1c,1e);柳枝稷4-6和14-7逆转穗芽诱导也表现出一定的差异,14-7生长速度较4-6更快,逆转穗芽产生数量也较4-6更多,表明其具有更强的活性。

图1 柳枝稷穗芽诱导Fig.1 Spike buds induction of switchgrass
2.2 柳枝稷穗芽发育中叶绿素含量的变化
培养30 d后,两种柳枝稷材料的逆转穗芽和非逆转穗芽叶绿素含量并未发现明显差异;60 d后,两种柳枝稷逆转穗芽均发生明显的叶绿素含量降低的现象,而与此同时,非逆转穗芽叶绿素含量并未发生明显下降,方差分析结果显示逆转穗芽叶绿素含量极显著低于非逆转穗芽;与此类似,培养90 d的逆转穗芽叶绿素含量极显著低于非逆转穗芽(表1)。两种类型柳枝稷叶绿素含量差异不显著(P= 0.5365),但就不同时期而言,培养30 d的材料与培养60 d和90 d的材料差异极显著(P< 0.01),但后两者差异不显著(表1)。

表1 柳枝稷穗芽形成期间叶绿素含量变化Table 1 Chlorophyll content variation of different switchgrass spike buds
2.3 柳枝稷穗芽发育中总糖含量的变化
两种类型柳枝稷的逆转穗芽和非逆转穗芽总糖含量在培养30 d、60 d和90 d时差异均未达到显著水平,这表明外植体在各时期不同培养基上对糖的吸收、代谢差异不明显(表2)。两种柳枝稷之间比较总糖含量差异未达到显著水平(P=0.5113),但随着培养时间的延长,总糖含量表现下降的趋势,培养90 d的穗芽总糖含量极显著低于培养30 d的穗芽(P< 0.01,表2)。这可能是因为多次继代的穗芽块具有更多的穗芽,对培养基中糖的消耗更快,从而引起后期培养基碳源供应不足。

表2 柳枝稷穗芽形成期间总糖含量变化Table 2 Total sugar content variation of different switchgrass spike buds
2.4 柳枝稷穗芽发育中可溶性蛋白、游离氨基酸及总氮含量的变化
在培养30 d时,逆转穗芽可溶性蛋白含量总体高于非逆转穗芽,但只有柳枝稷14-7达到显著水平(表3);与之相反,同时期的逆转穗芽游离氨基酸的含量总体低于非逆转穗芽,且均达到显著水平(表4),而总氮含量差异不显著(表5),这表明逆转穗芽和非逆转穗芽在培养早期对氮的吸收速率差异不明显,但逆转穗芽氮的代谢效率更高。培养60 d时,逆转穗芽可溶性蛋白含量总体低于非逆转穗芽,柳枝稷14-7达到显著水平(表3),然而游离氨基酸和总氮含量差异不显著(表3,4),这可能是因为继代后逆转穗芽数量和生长速度更快,对氮的消耗更快,从而表现出培养基氮缺乏现象。培养90 d时,逆转穗芽可溶性蛋白含量总体低于非逆转穗芽,游离氨基酸和总氮含量表现出相同的趋势(表3,4),这可能是因为继代培养对氮的消耗进一步加快,从而表现出更严重的培养基氮缺乏现象。两种柳枝稷之间的可溶性蛋白、游离氨基酸和总氮含量差异均不显著(P=0.0608,P=0.0611,P=0.4494),而逆转穗芽与非逆转穗芽之间均表现显著或极显著差异(P=0.0404,P=0.0048,P=0.0024),各时期间相比较可溶性蛋白含量整体下降,而游离氨基酸和总氮含量均为先升后降的趋势。综合考虑可溶性蛋白、游离氨基酸和总氮含量的变化以及SIM培养基后期氮供应不足可以推断出逆转穗芽具有更高的氮代谢效率。

表3 柳枝稷穗芽形成期间可溶性蛋白含量变化Table 3 Soluble protein content variation of different switchgrass spike buds
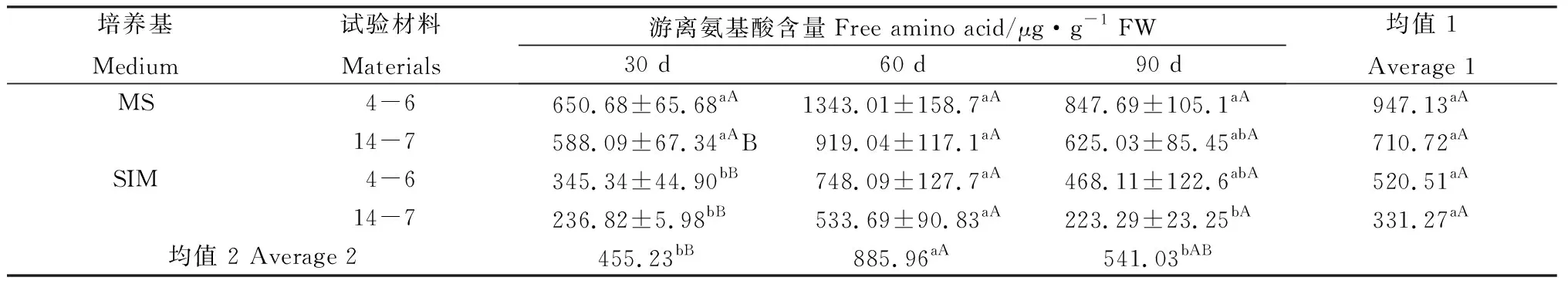
表4 柳枝稷穗芽形成期间游离氨基酸含量变化Table 4 Free amino acid content variation of different switchgrass spike buds

表5 柳枝稷穗芽形成期间总氮含量变化Table 5 Total nitrogen content variation of different switchgrass spike buds
2.5 柳枝稷穗芽发育中SOD、POD、CAT活性变化
在培养30 d后,两种培养基上的逆转穗芽和非逆转穗芽SOD活性无显著差异,但培养60 d和90 d后,逆转穗芽SOD活性总体高于非逆转穗芽(表6)。培养30 d后,柳枝稷4-6的逆转穗芽POD活性显著高于其他3组处理;培养至60 d时活性有所下降,与柳枝稷14-7逆转穗芽总体低于非逆转穗芽,但未达到显著水平;培养90 d后,柳枝稷14-7的逆转穗芽POD活性急剧上升,极显著高于其他3组处理,并且逆转穗芽POD酶活性总体高于非逆转穗芽,这表明在继代2次培养基碳源和氮源缺乏的情况下,POD酶产生响应,以起到保护的作用(表7)。CAT活性在培养30 d后各处理间未表现出显著差异,但培养60 d后逆转穗芽酶活性显著高于非逆转穗芽,而培养90 d后,柳枝稷14-7的逆转穗芽CAT活性却急剧下降,与SOD和POD酶活性变化截然相反,这表明CAT活性并未因碳源和氮源缺乏而产生响应,相反的是其活性受到明显的抑制(表8)。两种柳枝稷之间的SOD、POD和CAT差异均极显著(P=0.0013,P=0.0003,P=0.0011),然而SOD和POD均表现为柳枝稷14-7活性更高,而CAT表现为4-6活性更高,这可能是不同类型抗氧化酶对碳氮缺乏响应的差异所引起;SOD各时期差异不显著,而诱导90 d的穗芽POD和CAT活性与其他两个时期差异均达到极显著水平。

表6 柳枝稷穗芽形成期间SOD活性变化Table 6 SOD activity variation of different switchgrass spike buds

表7 柳枝稷穗芽形成期间POD活性变化Table 7 POD activity variation of different switchgrass spike buds

表8 柳枝稷穗芽形成期间CAT活性变化Table 8 CAT activity variation of different switchgrass spike buds
2.6 柳枝稷穗芽发育中PPO活性的变化
方差分析发现,在培养30 d、60 d和90 d时,两种柳枝稷材料的逆转穗芽和非逆转穗芽PPO活性差异均不显著,但总体上逆转穗芽酶活性比非逆转穗芽略高(表9)。两种柳枝稷之间PPO酶活性无显著差异(P= 0.7645);各培养时期间相比较发现PPO活性整体呈现先降后升的趋势。

表9 柳枝稷穗芽形成期间PPO活性变化Table 9 PPO activity variation of different switchgrass spike buds
2.7 柳枝稷穗芽发育中ZR、IAA含量的变化
对两种类型柳枝稷逆转和非逆转穗芽的ZR含量分析发现,培养30 d和60 d后,逆转和非逆转穗芽间均未体现出显著的差异;培养90 d后柳枝稷4-6的非逆转穗芽ZR含量显著高于其他处理但未达到极显著水平(表10)。材料培养30 d后,非逆转穗芽IAA含量显著高于逆转穗芽,培养60 d和90 d后穗芽IAA含量虽然也有差异,但两种柳枝稷却并未表现出一致的趋势;此外该结果还表明外源6-BA的施加对IAA的合成体现出一定的抑制作用。通过对IAA/ZR分析,结果与IAA含量类似,整体而言,逆转穗芽IAA/ZR高于非逆转穗芽(表12)。两种柳枝稷ZR含量差异不显著(P=0.0757),但IAA含量和IAA/ZR差异达到显著或极显著水平(P=0.0063,P=0.0148);不同时期相比较发现,ZR含量、IAA含量和IAA/ZR均表现先升后降的趋势,且时期间差异均达到极显著水平(P<0.0601)。
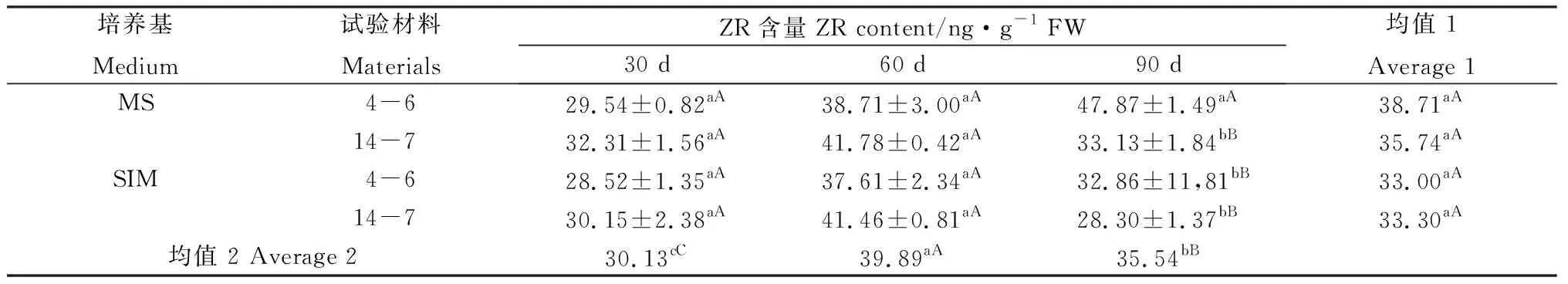
表10 柳枝稷穗芽形成期间ZR含量变化Table 10 ZR content variation of different switchgrass spike buds

表11 柳枝稷穗芽形成期间IAA含量变化Table 11 IAA content variation of different switchgrass spike buds

表12 柳枝稷穗芽形成期间IAA/ZR变化Table 12 The value of IAA/ZR variation of different switchgrass spike buds
2.8 柳枝稷穗芽发育中ABA含量的变化
培养30 d后,柳枝稷4-6的逆转穗芽ABA含量显著或极显著高于其他3组处理,但其他3组处理间差异不显著;培养至60 d时, 柳枝稷14-7的逆转穗芽ABA含量有所上升,但4-6的逆转穗芽ABA含量仍高于其他3组处理,且差异均达到极显著;培养到90 d时,柳枝稷14-7的逆转穗芽ABA含量有显著上升,与4-6的逆转穗芽ABA含量水平一致,并且均显著高于MS培养基(表13)。两种类型柳枝稷所形成的穗芽ABA含量差异极显著(P= 0.0002),表明两种柳枝稷的ABA响应存在一定的差异;3个培养时期相比较,差异虽未达到显著水平,但整体呈上升趋势,结合逆转穗芽ABA含量更高的结果可推断,ABA可能在穗芽发育的后期起到重要的作用。

表13 柳枝稷穗芽形成期间ABA含量变化Table 13 ABA content variation of different switchgrass spike buds
2.9 柳枝稷穗芽发育中GAs含量的变化
当培养至30 d时,两种类型柳枝稷逆转穗芽GAs含量均高于非逆转,差异达到显著或极显著水平(表14),表明早期穗芽起始诱导的过程中GAs发挥着重要的作用;培养至60 d和90 d时,两种类型柳枝稷逆转穗芽GAs含量仍显著或极显著高于非逆转穗芽,表明在后期逆转穗芽发育过程中,GAs同样行使着重要的功能(表14)。就两种类型柳枝稷而言,14-7的GAs水平整体极显著高于4-6,结合柳枝稷14-7穗芽生长速度较4-6快,而SIM培养基上的穗芽生长速度较MS培养基快,我们可以推断GAs对穗芽形成时的快速生长起到重要的作用;3个培养时期比较分析表明,GAs含量随着培养时间总体呈上升趋势,并且培养至90 d时其水平极显著高于前两个时期,表明GAs在逆转穗芽形成初期及发育后期均起到重要的作用。

表14 柳枝稷穗芽形成期间GAs含量变化Table 14 GAs content variation of different switchgrass spike buds
3 讨论与结论
在花发育的研究进程中,人们往往更关注植物从营养生长向生殖生长的转变,而对花器官逆向发育的关注较少[26]。本试验利用体外花器官逆转诱导方法,通过比较SIM培养基上逆转穗芽和MS基本培养基上非逆转穗芽的部分生理指标和激素水平,发现逆转穗芽具有较低的叶绿素水平,但具有更高的糖含量(前两个时期30 d、60 d),这可能是因为体外培养过程中的碳源更多来自培养基,而逆转穗芽叶绿素含量低并非导致其发育速度快的原因。综合考虑两种培养基上的穗芽可溶性蛋白、游离氨基酸和总氮含量的变化以及SIM培养基后期氮供应不足可以推断出,与非逆转穗芽相比,逆转穗芽具有更高的氮代谢效率。逆转穗芽和非逆转穗芽抗氧化酶活性比较发现,逆转穗芽整体抗氧化酶系统具有更高的活性。外源施加6-BA对柳枝稷内源ZR的合成无显著影响,但对IAA的合成可能起到一定的抑制作用,这对穗芽起始诱导起到关键的作用。ABA可能在穗芽发育的后期阶段起到重要的作用,而GAs可能在穗芽发育的整个时期都有行使重要的功能。
激素是调控植物生长发育的重要物质,在花发育和花器官逆转过程中也起到至关重要的作用。Gaudinová等在研究病毒引起的黑醋栗(Ribesnigrum)花器官逆转的现象中发现,被病毒感染的花器官与正常组织相比细胞分裂素含量异常升高[13]。Young等研究表明细胞分裂素在玉米雌蕊发育以及雌蕊发育方向决定中起到重要的作用[27]。这些结果都与本试验相一致。Jack等在研究中指出赤霉素是花器官形成过程中传递光周期信号的重要物质,对花芽的形成起到促进作用,花器官逆转可能通过降低植物体内赤霉素水平而发生[8]。然而本试验发现穗芽形成过程中具有较高的赤霉素水平,这可能是因为本试验中高浓度的外源6-BA主导柳枝稷花器官逆转的发生,而赤霉素可能起到加快发育进程的作用。此外,Cai等和Yuan等的研究表明,茉莉酸甲酯在花发育中起到促进的作用[11,28]。
在花器官逆转诱导条件研究中,光周期和温度被认为是启始花器官逆转的重要因素[7,9]。Okamuro等通过研究光周期和激素对拟南芥花器官逆转的影响试验发现,LFY和AG在花分生组织保持中起到重要作用,而其突变体发生的花器官逆转可能与光敏色素和赤霉素信号传导有关[8]。本试验进行过程中,外植体培养光周期为20 h白天/4 h黑暗,该条件是不利于短日照植物柳枝稷正常花器官发育的[14]。然而在相同光周期条件的MS基本培养基上无花器官逆转现象发生,表明在柳枝稷幼穗体外培养过程中,单独改变光周期无法诱导其花器官逆向发育,外源施加高浓度细胞分裂素是柳枝稷花器官逆转诱导的必要条件。光周期在诱导柳枝稷花器官逆转中是否起到一定的作用仍需进一步试验验证。
植物花器官逆转现象能够使我们从反方向研究花发育,为花发育研究和基因功能验证提供新的思路。Wang等通过对水稻花器官逆转现象的研究发现DEP和AFO基因在决定花的形成中起到重要的作用[6]。Ampomah-Dwamena等通过对西红柿中的SEP同源基因TM29共抑制和RNA干扰研究发现,转基因植株在一定程度上表现出花器官逆转的现象,甚至在部分畸形果实上能够长出新的叶子或芽[29]。本试验采用体外诱导方法获得柳枝稷花器官逆转,通过对逆转穗芽和非逆转穗芽的比较研究,在一定程度上揭示了柳枝稷穗芽形成过程中的生理生化特性。同时本试验存一定的不足之处,为确保结果一致性,所选柳枝稷材料只有栽培种Alamo的两个单株,试验结果具有一定的局限性,但二者结果整体表现一致,对研究花发育以及花器官逆转能够提供一定的参考作用。
——现代牙刷的由来

