模拟增温下短花针茅实时荧光定量内参基因的筛选及验证
高金玉, 郭慧琴, 曹 路, 韩 冰,2*
(1.内蒙古农业大学生命科学学院, 内蒙古 呼和浩特 010018; 2.中国农业科学院草原研究所, 内蒙古 呼和浩特 010018)
实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)是一种基于普通PCR定性技术发展而来的新型的核酸定量技术,具有定量准确、重现性高、灵敏度高和高通量等特点,已被广泛应用于微生物检测、单个核酸多态性分析和基因表达研究。在基因表达分析过程中,结果时常会受到不同变量的影响,如起始RNA的质量和数量、反转录合成[1]。在qRT-PCR试验中,为了使结果可信,需要筛选表达稳定的内参基因作为标准[2-3]。在基因定量表达的研究中,通常选用看家基因(House-keeping gene)作为内参基因,因为看家基因是全部细胞中均要表达的一类基因,其产物对于维持细胞各种基本生命活动是必需的,比如常用的糖酵解酶系基因、微管蛋白基因和核糖体蛋白基因等。一般认为看家基因的表达只受机体RNA聚合酶或启动子相互作用的影响,并不受其他机制调节,看家基因的表达受环境因素的影响较小。但随着研究的深入,发现看家基因在不同组织部位或者不同处理下的表达量并不稳定,导致试验结果的准确性降低,甚至发生错误[4]。关波[5]曾经发现18srRNA在不同组织细胞中的表达量是不同的,在细胞有丝分裂期间,其表达量近乎为零。这些结果使得人们在直接选择18srRNA、TUB等常规的看家基因作为内参基因时产生了怀疑[6],因此对最适内参基因的筛选成为了对基因表达进行定量研究前所必需的工作。
短花针茅(Stipabreviflora)属于禾本科,针茅属。是荒漠草原的建群种,又是优良的牧草,具有十分重要的生态和饲用价值,对荒漠地区恶劣生境具有极强的适应性,是探究荒漠草原区重要野生牧草对全球变暖响应机制的良好材料。然而关于短花针茅的研究,目前还主要集中在生理生态等方面,在分子遗传等方面的研究进展缓慢。为了揭示短花针茅在增温处理下基因的表达机制,本研究分析9个常见候选基因的表达稳定性,筛选出稳定表达的内参基因,为后续研究奠定基础。
1 材料与方法
1.1 试验材料
供试材料短花针茅叶片,采集于内蒙古四子王旗乌兰花镇的“内蒙古农牧科学院四子王旗实验基地”,在短花针茅果后营养期采集增温区和对照区的短花针茅叶片组织,液氮冷冻,-80℃冰箱保存。
1.2 试验方法
1.2.1总RNA提取及cDNA的合成 用Trizol Reagen试剂盒提取样品总RNA,用核酸定量仪和1.5%琼脂糖凝胶电泳检测总RNA的浓度、纯度以及完整性。利用PrimeScript RT reagent Kit with gDNA Eraser 试剂盒进行反转录,合成cDNA,于-20℃储藏备用。
1.2.2候选内参基因的选择与引物设计 具体参考Karunesh Kumar在谷子中筛选内参基因的引物序列[7],合成本试验所用引物,引物序列如表1所示。

表1 候选内参基因的引物序列Table 1 The primers of candidate reference genes
1.2.3普通PCR 普通PCR为20 μL的反应体系:5×PrimerSTARTMBuffer(Mg2+plus)5 μL,dNTP Mixture(2.5 mM each)1 μL,上游引物(20 μM) 0.5 μL,下游引物(20 μM)0.5 μL,短花针茅cDNA 1 μL,PrimerSTARTMHS DNA Ploymerase 1 μL,RNase Free dH2O 11 μL。反应程序为:94℃预加热3 min,94℃模板变性30 sec,60℃退火30 sec,72℃模板延伸30 sec,72℃保持5 min使产物延伸完整,35个循环。
1.2.4实时荧光定量PCR 20 μL的荧光定量PCR反应体系包括:SYBRPremixExTaqTM(2×)10 μL,上游引物和下游引物各1 μL,cDNA模板2 μL,RNase Free dH2O 6 μL。qRT-PCR的反应程序为:95℃预变性5 min;95℃变性5 sec,60℃退火30 sec,45个循环。扩增完毕后,进行熔解曲线分析以确定扩增产物的特异性,温度从60℃缓慢递增到95℃,连续测定样品的荧光强度以获取熔解曲线。
1.2.5数据处理及分析 使用Delta-Ct法和geNorm, Normfinder, BestKeeper 3个软件分析候选基因的表达稳定性。其中geNorm是将每个平行反应样品的平均Ct值转换为相应的数据,计算出内参基因表达稳定性的M值,M值越大稳定性越差,M值越小稳定性越好。一般情况下M值大于1.5为不可接受,表明该内参基因不可用。这个软件可计算引入1个新的内参基因后标准化因子的配对变异V值,可根据Vn/Vn+1比值来判定所需新的内参基因的数目。一般默认的V值为0.15,如果Vn/Vn+1大于0.15,则有必要引入第n+1个内参基因,如果小于0.15,则不必引入新的内参基因。Normfinder软件的原理是基于方差分析对内参基因的表达稳定性进行直接评价,产生基因表达稳定值,然后根据稳定值的大小排序,最终将表达稳定值最小的基因作为最稳定的基因。
BestKeeper软件主要通过比较a值的标准偏差和变异系数从而选择表达稳定的基因,标准偏差和变异系数越小稳定性越好,反之,稳定性越差。其中标准偏差(SD)是最关键的因素,SD值小于1看作是可以接受的范围之内的变异。
RefFinder在线综合分析软件是对上述3种软件及评价方法的整合,它通过对4种方法给出的稳定性排名进行加权几何平均数的计算,最终得出综合排名系数。
1.2.6内参基因的验证 从模拟增温处理的短花针茅果后营养期转录组数据库中随机挑选2个上调基因,2个下调基因和1个表达量不变的基因,利用Premier5.0软件,在转录组测序获得的基因序列基础上设计5个基因的特异性引物(表2),通过qRT-PCR试验验证内参基因的准确性。
普通PCR扩增反应体系、反应程序及实时荧光定量PCR扩增反应体系及反应程序与上述相同。

表2 5个验证基因的引物序列及注释结果Table 2 The primers and annotation results of 5 validation genes
注:转录组测序及相对表达量变化倍率均为增温组比对照组
Note: The change rate of the transcription group sequencing and relative expression rate are increased in the temperature group than in the control group
2 结果与分析
2.1 RNA样品质量检测
琼脂糖凝胶电泳结果(图1)显示,短花针茅各样品的RNA电泳图谱带型清晰,28S RNA的亮度约为18S RNA亮度的2倍,且5S RNA条带亮度较弱,所有RNA样品符合qRT-PCR的试验要求,其中SD1样品的RNA有gDNA污染,用DNA酶消化纯化可以进行后续试验。核酸定量检测显示,各样品OD260/280值均在1.8~2.1之间,表明RNA纯度较好,可以满足后续试验研究的需要。
2.2 候选内参基因的普通PCR分析
运用设计的特异引物对短花针茅cDNA进行普通PCR扩增,用1.5%的琼脂糖凝胶电泳检测结果如图2所示,结果显示9个候选基因中有6个呈现的条带单一明亮,说明引物特异性好,可以进行实
时荧光定量PCR。TUBβ,RNAPOLII及GAPDH未获得良好扩增,在后续试验中予以剔除。
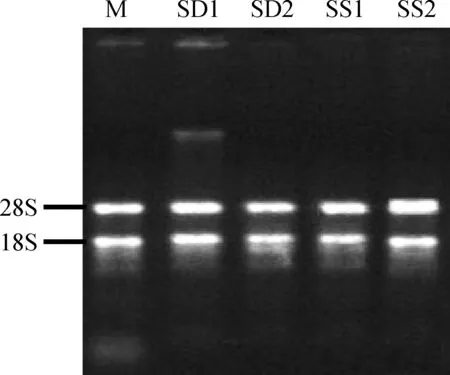
图1 转录组测序短花针茅总RNA琼脂糖凝胶电泳检测结果Fig.1 The agarose gel electrophoresis result of rna-seq Stipa breviflora total RNA注:M为total RNA标准品,SS为增温处理,SD为试验对照Note: M: Total RNA standard; SS: Warming treatment; SD: Experiment control

图2 9个候选内参基因的琼脂糖凝胶电泳结果Fig.2 The agarose gel electrophoresis resultsof 9 candidate reference genes
2.3 内参基因实时荧光定量PCR分析
实时荧光定量PCR扩增结果如表3所示,6个候选内参基因的cq值范围都在25以下,表明短花针茅cDNA样品中6个候选内参基因都有较好的表达丰度。其中18srRNA的cq值最小为12.4917,APRT的cq值最大为23.6783,TLF,EF-1α,Actin2,TUBα的cq值分别为15.9183,18.5283,20.7217和20.7333。各候选内参基因存在表达差异,表明不同内参基因的表达量在模拟增温处理条件下存在较大差异。

表3 6个候选内参基因的qRT-PCR结果Table 3 The qRT-PCR results of six candidate reference genes
6个候选内参基因的熔解曲线如图3所示,都呈单峰型,不同曲线间的重复性高,表明引物特异性良好,所得数据可用于进一步的分析。

图3 6个候选内参基因的熔解曲线Fig.3 The melting curve of 6 candidate reference genes
2.4 内参基因的表达稳定性分析
4种内参基因筛选方法所给出的分析结果不完全相同(图4)。其中在normFinder软件的分析结果中,数值越低表明候选内参基因的稳定性越高。由图4-A可知,18srRNA的稳定性最高,稳定性为0.179;其次为TLF,稳定性为0.23;APRT为0.401;EF-1α为0.543;TUBα为0.642;Actin2最不稳定为0.659。
运用geNorm软件对短花针茅6个候选内参基因进行稳定性(M值)分析,当M值<1.0时,认为候选内参基因可以作为内参基因使用,M值越低越好。结果显示,6个候选内参基因都可以作为内参基因来使用,其中TLF和APRT同为表达最稳定的候选内参基因,M值为0.207;TUBα其次,M值为0.304;18srRNA的M值为0.4;EF-1α的M值为0.54;Actin2表现最不稳定,M值为0.596(图4-B)。
用Delta-CT法计算短花针茅6个候选内参基因的稳定性,结果显示18sRrRNA的稳定性最高为0.473,其次TLF为0.501,APRT为0.557,EF-1α为0.639,TUBα为0.699,Actin2最不稳定,其稳定性为0.710(图4-C)。
BestKeeper软件主要通过计算标准差(SD值)来衡量候选内参基因的稳定性。数值越小越稳定。由图4-D可知,TLF在6种候选内参基因中最稳定,SD值为0.108;APRT(0.136)次之,TUBα,18srRNA,EF-1α,Actin2的SD值依次为0.294,0.422,0.772,0.822。虽然4种分析方法得出的稳定性排名不同,但是这6个候选内参基因都可以作为内参基因来使用。尤其是TLF,18srRNA和TUBα,这3个候选内参基因在不同评价方法中排名均靠前。

图4 4种方法筛选候选内参基因的结果Fig.4 The results of 4 candidate reference gene analysis methods
RefFinder在线综合分析得出的综合排名如图5所示,其中TLF的稳定性最高,综合排名系数为1.414;其次为18srRNA,综合排名系数为2.000;APRT为2.060,TUBα为3.873,EF-1α为4.472,Actin2最不稳定,其综合排名系数为6.000。所以选择TLF作为短花针茅模拟增温下的内参基因进行后续试验。

图5 RefFinder分析结果Fig.5 The result of RefFinder analysis
2.5 内参基因的稳定性验证
2.5.1验证基因的普通PCR扩增 运用设计好的特异性引物对5个验证基因进行普通PCR扩增,用琼脂糖凝胶电泳检测扩增产物,结果如图6所示,条带均单一明亮,所选引物可以用于后续试验。

图6 5个验证基因的琼脂糖凝胶电泳结果Fig.6 The agarose gel electrophoresis results of 5 verification gene
2.5.2验证基因的qRT-PCR 以筛选出的TLF作为内参基因,进行qRT-PCR试验。图7为5个验证基因的熔解曲线。可以看出,5个基因的引物特异性良好峰型呈现单峰状,且不同曲线间重复性高。

图7 5个验证基因的熔解曲线Fig.7 The melting curve of 5 verification genes
将5个验证基因在qRT-PCR中获得的增温和对照之间的相对表达量与转录组测序中获得的变化倍率进行比较,结果显示5个基因在qRT-PCR试验与转录组测序中的变化趋势一致。DHZM-L776和DHZM-L2454 2个基因在RNA-seq中增温与对照相比都是下调基因,分别下调0.06倍和0.12倍;在qRT-PCR试验中分别下调0.05倍和0.17倍。DHZM-L1899在RNA-seq中表达量不变,其比率为1.02;在qRT-PCR试验中,其比率为0.92。DHZM-L12725和DHZM-L15404两个基因在RNA-seq中为上调基因,分别上调44.63倍 和168.4倍;在qRT-PCR试验中分别上调49.60倍和71.93倍(表2,图8)。
3 讨论
在以往的研究中,研究者经常使用GAPDH[8]、Actin[9]、TUBα[10]等看家基因对目的基因进行定量分析,但是许多看家基因在不同的试验处理下表达量具有很大差异。盲目的选择内参基因,往往会造成试验结果不理想,甚至出现错误。Long[11]等在对小麦(Triticumaestivum)的研究中曾经发现,Actin是最不稳定的候选内参基因,与本研究结果一致。Kim[12]在对不同发育时期及紫外照射下水稻黄化苗的内参基因筛选中发现18srRNA是最稳定的。黄文华[13]在对干旱处理下蒙古冰草(Agropyronmongolicum)的内参基因筛选中分析了Actin2,18srRNA,APRT,EF-1α,RNApollⅡ,TUBα,TUBβ,GAPDH,TLF9个看家基因,发现18srRNA表达最稳定。Jian[14]等发现大豆(Glycinemax)中表达最稳定的内参基因是ELF1b和CYP2。EF-1α也常被当作内参基因来使用,但是在不同的物种、生长时期和处理中得到的结果却完全不同,例如当拟南芥受到生物与非生物胁迫时内参基因EF-1α的表达很不稳定[15],在本研究中却相对稳定,可以考虑作为内参基因来使用。

图8 5个验证基因的相对表达量Fig.8 The relative expression of 5 verification genes
本研究发现6个基因都可以作为内参基因来使用,这与模拟增温处理属于较温和的处理有关,但这6个内参基因的表达稳定性依然存在巨大差异,其中最适合本研究的内参基因是TLF。
4 结论
本研究基于Delta-CT法,geNorm,normFinder和BestKeeper软件以及RefFinder工具分析比较了9个内参基因18srRNA,Actin2,APRT,EF-1α,TLF,TUBα,TUBβ,GAPDH和RNApollⅡ在短花针茅叶片组织的表达稳定性。Delta-CT和normFinder分析结果显示,表达最稳定的内参基因为18srRNA;geNorm和BestKeeper分析结果显示,TLF为表达最稳定的内参基因。运用RefFinder软件综合分析,TLF基因表达最稳定,依次为 18srRNA,APRT,TUBα,EF-1α,Actin2。以TLF为内参基因进行验证,结果表明TLF为短花针茅模拟增温处理下的最佳内参基因。

