小鼠胰腺炎模型中胰腺导管腺体与导管上皮修复再生的研究
刘旭呈,王立山,周家华
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 肝胆胰中心,江苏 南京 210009)
·论 著·
小鼠胰腺炎模型中胰腺导管腺体与导管上皮修复再生的研究
刘旭呈1,王立山1,周家华2
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 肝胆胰中心,江苏 南京 210009)
目的:探讨在炎症情况下胰腺导管腺体(PDG)与胰腺导管上皮修复再生过程的关系。方法:采用病理学评分评估雨蛙肽诱导急慢性胰腺炎小鼠模型的建立,采用病理组织学方法观察胰腺组织中PDG及导管结构病理学变化;免疫组化检测PDG及胰腺导管上皮细胞中Pdx1、Sox9、Ngn3的表达情况,利用免疫组化评分(HIS评分)评估其阳性表达率。结果:成功建立小鼠急慢性胰腺炎模型,其病理学评分分别为3.33±0.52和8.50±0.55,与对照组相比差异有统计学意义;在慢性胰腺炎模型中,PDG结构出现明显的增殖变化,且Pdx1、Sox9、Ngn3的表达均有阳性,HIS评分分别为1.966 7±0.233 8、0.700 0±0.209 8、0.900 0±0.209 8,与对照组相比差异有统计学意义。结论:PDG结构与胰腺导管上皮组织的修复再生相关,且与成体胰腺的分化成熟有联系,可能以胰腺干细胞巢的形式分布于胰腺组织中。
胰腺炎模型; 胰腺导管腺体; 修复再生; 胰腺干细胞标志物; 小鼠
上皮组织的修复和再生通过某些细胞的增殖分化来完成,而这类细胞通常都具有自我复制能力和分化潜能,称之为成体干细胞。在多种上皮组织中,成体干细胞通过增殖或分化迁移至上皮来维持组织的正常结构或完成病理状态下的修复再生[1];但在正常情况下,胰腺上皮组织中上皮细胞的更新速率却是极低的[2]。然而,胰腺在炎症损伤的情况下却能很快地完成自身的修复再生[3],这说明胰腺中同样存在成体干细胞,但我们对成体干细胞在胰腺组织中的分布以及在胰腺炎症的修复再生的具体作用知之甚少。
胰腺导管腺体(PDG)于20世纪60年代首次被发现[4],它含有丰富的胞浆和较大的基底核,主要分布于胰腺主导管及小叶间导管上皮组织中,是一种囊状腺体样或卷曲腺体样的特殊结构。PDG可能与胰腺导管上皮的修复再生及胰腺导管内乳头状黏液瘤(IPMN)的形成也有一定的相关性[5],然而我们对PDG与炎症及肿瘤之间的关系仍知之甚少。
本研究通过建立急慢性胰腺炎的小鼠模型,观察胰腺导管周围PDG以及导管上皮组织的变化情况,并通过检测Pdx1、Sox9、Ngn3等相关蛋白的表达情况,来观察导管上皮组织与炎症的关系以及PDG与上皮修复再生的关系。
1 材料和方法
1.1 动物及主要试剂
32只雄性SPF级C57小鼠(20 g左右,6~8周)购自扬州大学比较医学中心,饲养于东南大学动物实验中心;主要试剂有雨蛙肽(CAS:17650- 98- 5 yeasen)、Anti- Pdx1(bs- 0922R bioss)、Anti- Sox9(bs- 4177R bioss)、Anti- Ngn3(bs- 0922R bioss)、Anti- CK19(bs- 2190R bioss)及Anti- Ki67(bs- 23104R bioss)。
1.2 方法
1.2.1 胰腺炎模型的建立 将32只C57小鼠随机分为对照组(n=12)、急性胰腺炎组(AP组,n=6)和慢性胰腺炎组(CP组,n=14)。AP组予以雨蛙肽50 μg·kg-1腹腔注射6次,间隔1 h;CP组予以雨蛙肽50 μg·kg-1腹腔注射6次·d-1,间隔1 h,5 d·周-1,连续6周;对照组予以生理盐水腹腔注射6次·d-1,间隔1 h。AP组于第2天造模20 h后腹腔麻醉,取胰腺组织于10%福尔马林中固定;CP组分别于第2、4、6周取材。
1.2.2 组织病理学观察 胰腺组织固定后脱水,石蜡包埋并按10 μm厚度切片,苏木精-伊红染色,盲法观察每一张切片。参照Schmidt等[6]的报道,对胰腺损伤程度进行评分,评分标准为胰腺小叶间或腺泡细胞的水肿、炎症细胞的浸润和胰腺腺泡细胞的坏死。
1.2.3 AB- PAS染色 石蜡切片脱蜡至水,蒸馏水冲洗,70%酒精冲洗,加高碘酸酒精溶液10 min。用70%酒精洗后,加入还原液中1 min。再用70%酒精冲洗,滴入无色盐基性品红溶液1~1.5 h,再用流水冲洗10 min,用Mayer’s苏木素复染液复染细胞核3~5 min,再用1%盐酸酒精分化。流水冲洗后,脱水、透明、封固。
1.2.4 免疫组织化学染色 胰腺切片脱蜡后用pH 7.4的磷酸盐缓冲液(PBS)洗3次,每次5 min,3%过氧化氢溶液浸泡15 min以灭活内源酶,再经5%牛血清白蛋白孵育30 min后加入一抗(Anti- Pdx1),湿盒4 ℃孵育过夜,以PBS洗3次,每次5 min。然后滴加生物素化二抗,置于室温2 h,以PBS洗3次,每次5 min。加入滴加链霉亲和素-生物素复合物(SABC)液室温2 h,以PBS洗3次,每次5 min。以二甲基联苯胺(DBA)显色,显色3~7 min,镜下标记物质呈棕黄色,并常规干燥、透明、树胶封片。阴性对照组实验切片不加第一抗体孵育,其他步骤相同;Anti- Sox9、Anti- Ngn3、Anti- CK19、Anti- Ki67步骤与以上相同。
1.2.5 免疫组化结果判定方法 结构清晰,着色明显高于背景,在相应部位出现棕黄色颗粒者为阳性细胞;不着色或显色强度与背景无差别者为阴性细胞。每例切片随机选择5个高倍(400×)视野,统计阳性细胞数量和着色程度,取平均值。免疫组化评分(HIS值)法进行统计:A为阳性细胞数,0%为0,1%~10%为1,11%~50%为2,51%~80%为3,81%~100%为4;B为阳性细胞显色强度,分为0(无显色,阴性)、1(浅黄色,弱阳性)、2(棕黄色,阳性)、3(棕褐色,强阳性)。以A与B之乘积作为HIS值,用于免疫组化评分。
1.3 统计学处理
应用SPSS 18.0统计软件进行分析,组间评分比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠炎症模型的建立
在雨蛙肽的反复刺激下,成功建立了小鼠的急慢性胰腺炎模型,AP组胰腺组织病理学评分为3.33±0.52,高于对照组评分(P<0.001);CP组胰腺组织病理学评分为8.50±0.55,也高于对照组的病理学评分(P<0.001)。AP组小鼠胰腺组织出现腺泡水肿、组织充血、炎症细胞浸润等现象;CP组小鼠胰腺组织出现腺泡萎缩、组织纤维化等现象,胰腺导管系统周围出现特征明显的PDG结构(图1)。
2.2 胰腺导管系统周围存在着PDG结构
在正常小鼠及急性胰腺炎模型中,小鼠导管系统周围的PDG结构出现较少;但在慢性胰腺炎模型小鼠中,PDG结构明显增多,且多分布于胰腺主胰管及小叶间导管周围,在小叶内导管及闰管等周围未发现PDG的分布(图2)。这说明PDG结构的增殖与胰腺的慢性炎症有较大的关系,与胰腺导管上皮的修复在结构上有着一定的关联性。在长期炎症情况下小鼠的胰腺导管上皮组织发生自身的修复再生,而导管上皮组织的修复再生可能是通过PDG的增殖来完成的。
此外,在慢性胰腺炎模型的建立过程中,2周时小鼠胰腺导管周围就出现了特征明显的PDG结构,且随着时间的推移PDG结构的数量呈增多的趋势,6周时PDG增殖最为明显,结构上与主胰管的导管上皮组织相似(图3)。在慢性胰腺炎模型中PDG结构与导管均能分泌黏蛋白,导管结构中的细胞分泌中性黏蛋白,呈均质红染,而PDG结构除了能分泌中性黏蛋白之外,还能特异性分泌酸性黏蛋白,染色表现为混合性黏蛋白的蓝紫色(图4),两者的黏蛋白表达相近,PDG结构特异性分泌的酸性黏蛋白很可能参与慢性胰腺炎导管上皮组织的修复再生。所以,PDG结构与胰腺导管上皮组织的修复有着密切的关系。
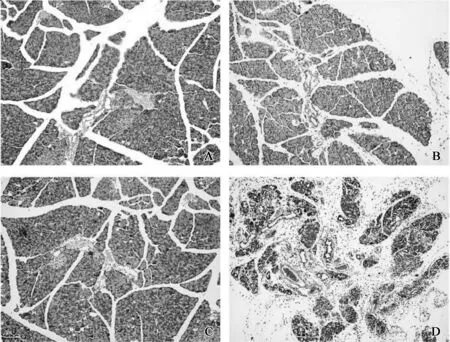
A、C.正常小鼠胰腺组织的病理学表现;B.AP组小鼠胰腺组织轻度水肿,局部炎症细胞浸润,小叶结构正常;D.CP组小鼠胰腺组织大量腺泡坏死灶和炎症细胞浸润,小叶结构被破坏,出现间质纤维化等
图1 在雨蛙肽的诱导下小鼠胰腺组织的病理学改变
Fig 1 The pathology of pancreatic tissues of mice was changed under the induction of caerulein
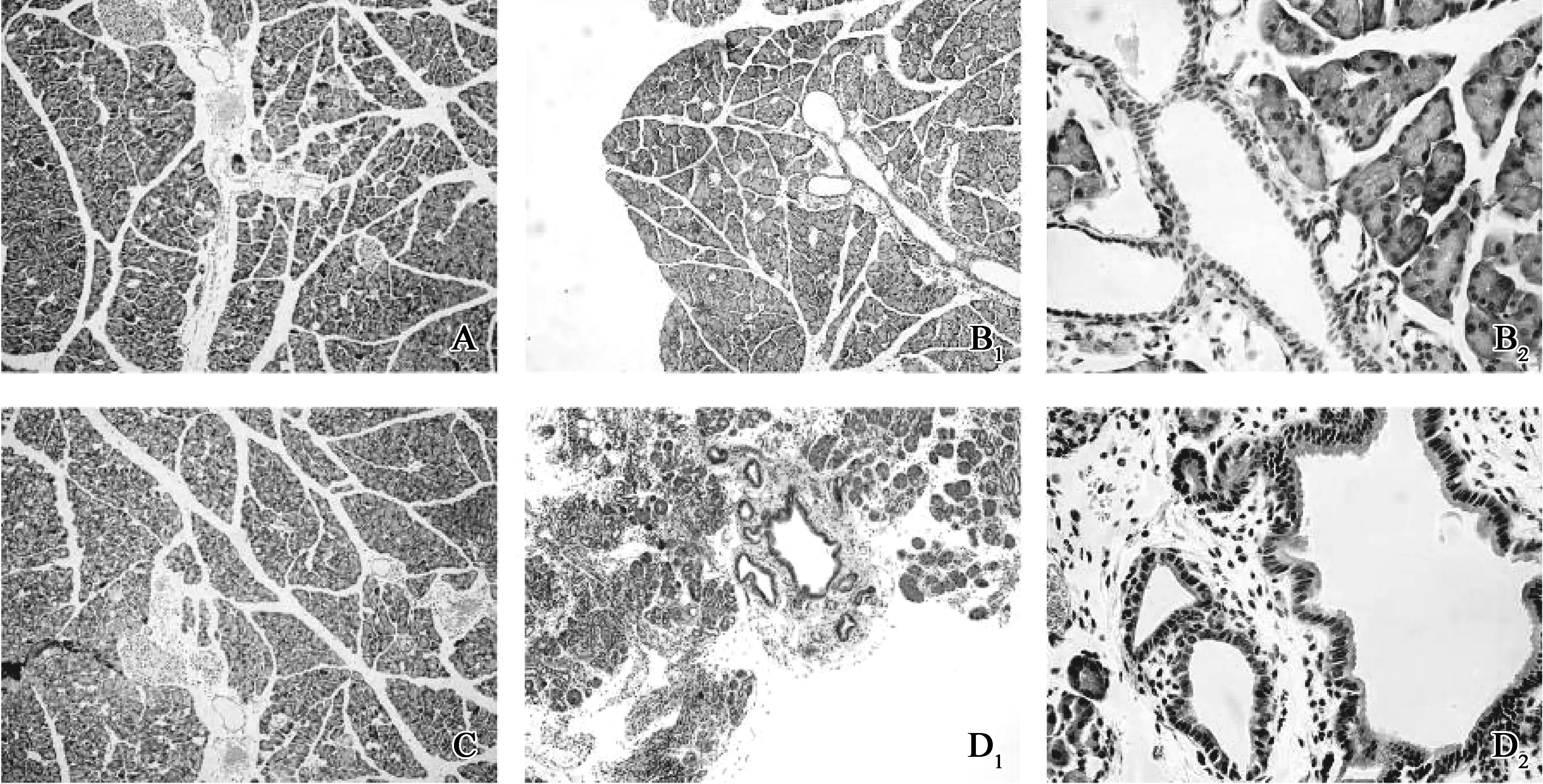
A、C.对照组模型小鼠胰腺导管周围组织未见明显的PDG;B.AP组模型小鼠胰腺导管周围组织可见少量的PDG分布于主导管周围,B2为B1的400×光镜下表现; D.CP组模型小鼠胰腺导管周围组织导管周围有大量PDG增殖,D2为D1的400×光镜下表现
图2 小鼠急慢性炎症胰腺炎模型下胰腺导管周围PDG的改变
Fig 2 The PDG structures around the pancreatic ducts were changed in mice with acute and chronic pancreatitis
A.2周时小鼠胰腺导管周围出现较为明显的PDG,与主胰管毗邻;B.为A图400×光镜下表现,PDG囊腔扩张,细胞形态与导管细胞类似;C.4周时小鼠胰腺导管周围的PDG数目增多;D.为C图400×光镜下表现,PDG数目增多,但囊腔大小无明显变化;E.6周时小鼠胰腺导管周围的PDG形态改变,表现为不规则管形;F.为E图400×光镜下表现,PDG囊腔明显扩张,且形态多呈不规则形
图3 在不同时间点CP组小鼠胰腺导管周围PDG的变化
Fig 3 The PDG structures around the pancreatic ducts in chronic pancreatitis model mice were changed at different time points

A.对照组小鼠胰腺导管上皮和PDG分泌中性黏蛋白,染色呈红色;B.CP组小鼠胰腺导管上皮和PDG分泌大量黏蛋白,胰腺导管分泌中性黏蛋白,染色呈深红色;PDG分泌混合性黏蛋白,染色呈蓝紫色
图4 CP组小鼠胰腺导管上皮和PDG黏蛋白的表达
Fig 4 Mucins were expressed in pancreatic ductal epithelium and PDG structures in mice with chronic pancreatitis
2.3 PDG结构参与成体胰腺组织的分化成熟
在慢性炎症的影响下,胰腺导管系统的增殖能力被激活,胰管及PDG中均可见Ki67阳性的细胞,其HIS评分分别为1.133 3±0.326 6和3.567 7±0.585 4,较对照组的0.066 7±0.103 3和0.266 7±0.103 3有明显差异(图5)。此外在PDG中出现Pdx1阳性的细胞,其HIS评分为1.966 7±0.233 8,较对照组的0.033 3±0.081 7明显增高,差异具有统计学意义(图6)。这说明在慢性炎症的刺激下,PDG结构中存在胰腺干细胞特性的细胞,参与导管上皮的修复再生。
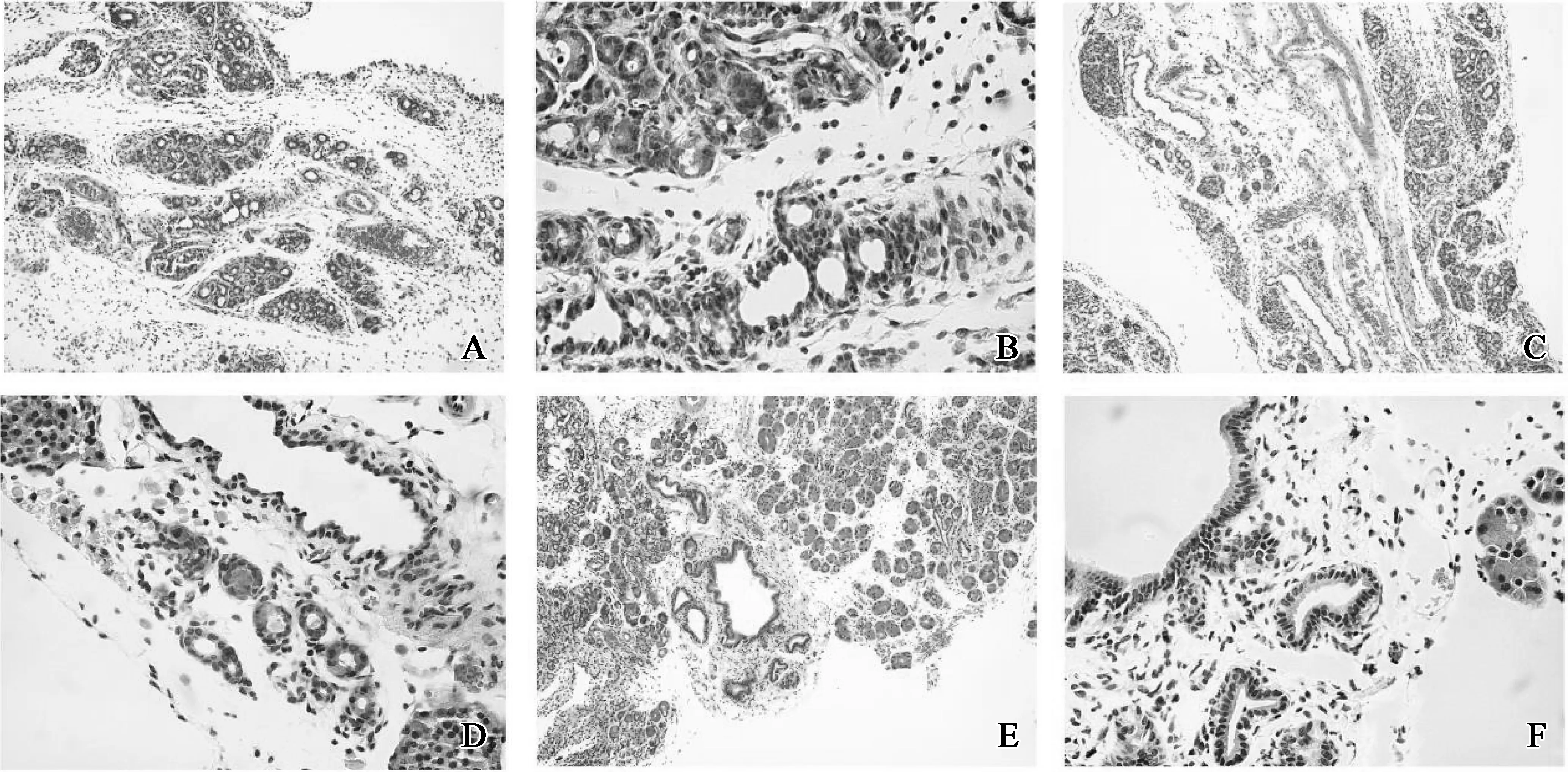
在慢性胰腺炎模型中,PDG结构中存在CK19阳性和Sox9阳性的细胞,其HIS评分分别为1.000 0±0.178 9和0.700 0±0.209 8,较对照组的0.466 7±0.242 2和0.033 3±0.081 7升高,差异具有统计学意义(图7、8)。Sox9与胰腺导管的分化成熟相关,而CK19是胰腺导管上皮细胞的标志物,说明在PDG结构中存在一种参与胰腺导管细胞分化成熟的细胞;此外,PDG结构中还少量存在Ngn3阳性的细胞,其HIS评分为0.900 0±0.209 8,较对照组的0.000 0±0.000 0升高,差异具有统计学意义(图7、8)。Ngn3主要多表达于胰岛及少量腺泡细胞中,与胰岛细胞分化成熟密切相关,说明在PDG结构中还存在着参与胰岛细胞分化成熟的细胞。所以,PDG结构参与成体胰腺组织的分化成熟,以胰腺干细胞巢的形式广泛存在于胰腺组织中。
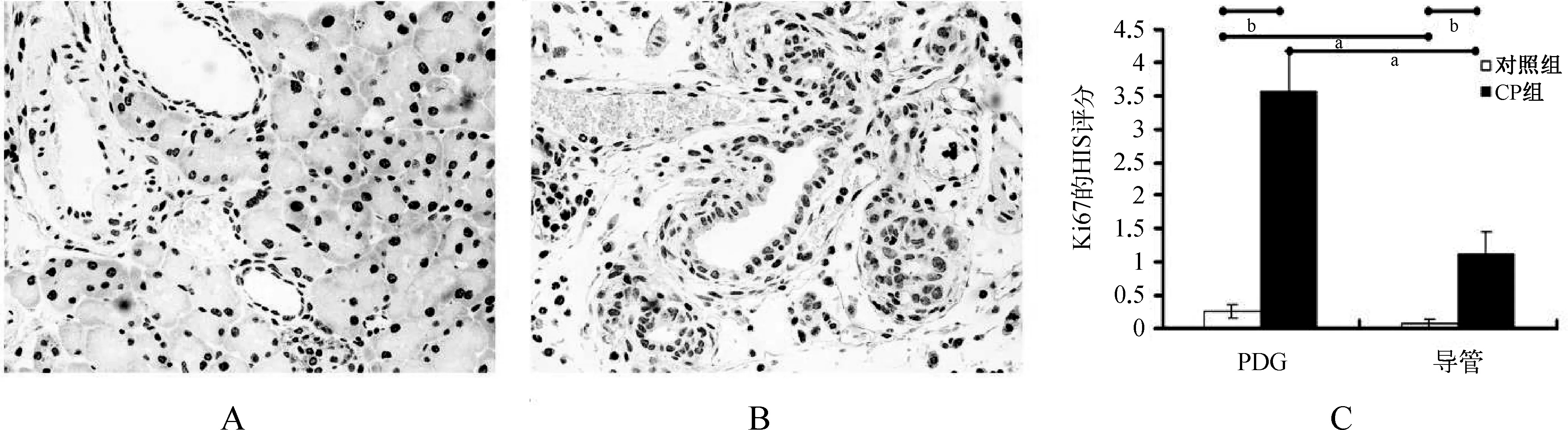
A.对照组小鼠胰腺组织Ki67免疫组化的结果呈阴性,染色无显色;B.CP组小鼠胰腺组织Ki67免疫组化结果,胰腺导管及PDG阳性表达,染色呈浅黄色;C.对照组和CP组小鼠胰腺组织Ki67免疫组化的HIS评分。aP<0.05,bP<0.001
图5 对照组和CP组小鼠胰腺组织Ki67的免疫组化结果和其HIS评分
Fig 5 Pancreatic tissues of mice were evaluated by immunohistochemical staining and HIS score of Ki67 in group Control and group CP

A.对照组小鼠胰腺组织Pdx1免疫组化的结果呈阴性,染色无显色;B.CP组小鼠胰腺组织Pdx1免疫组化结果,PDG有阳性表达,染色呈浅黄色;C.对照组和CP组小鼠胰腺组织Pdx1免疫组化的HIS评分。aP<0.05,bP<0.001
图6 对照组和CP组小鼠胰腺组织Pdx1的免疫组化结果和其HIS评分
Fig 6 Pancreatic tissues of mice were evaluated by immunohistochemical staining and HIS score of Pdx1 in group Control and group CP
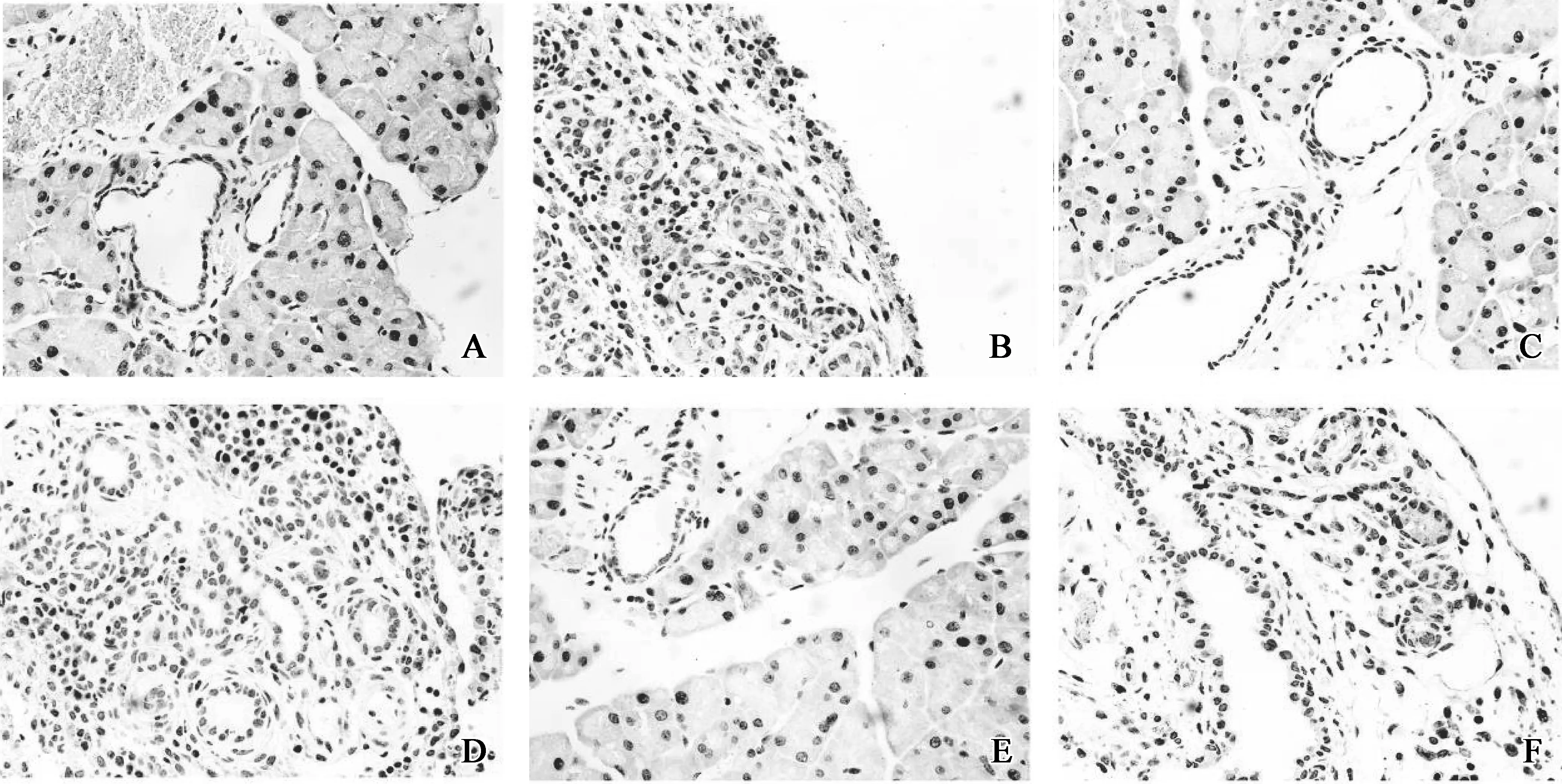
A.对照组小鼠胰腺组织PDG管CK19为阳性表达,染色呈棕黄色;B.CP组小鼠胰腺组织PDG有CK19阳性表达,染色呈浅黄色;C.对照组小鼠胰腺组织PDG有Sox9阳性表达,染色呈浅黄色;D.CP组小鼠胰腺组织PDG有Sox9阳性表达,染色呈浅黄色;E.对照 组小鼠胰腺组织Ngn3呈阴性;F.CP组小鼠胰腺组织PDG有Ngn3阳性表达,染色呈浅黄色
图7 对照组和CP组小鼠胰腺组织CK19、Sox9和Ngn3的免疫组化结果
Fig 7 Pancreatic tissues of mice were evaluated by immunohistochemical stainings of CK19,Sox9 and Ngn3 in group Control and group CP
3 讨 论
对胰腺组织中的成体干细胞以及其参与完成上皮组织修复再生的过程,我们还知之甚少。本研究我们通过雨蛙肽诱导建立急慢性胰腺炎模型发现,PDG的大量增殖主要和慢性胰腺炎的发生相关,急性胰腺炎模型小鼠胰腺组织除了轻度水肿充血以外,未见明显的PDG增殖,这说明在急性胰腺炎的自限性中PDG并不占据主要作用,这可能和胰腺炎症的严重程度相关。急性胰腺炎模型小鼠的病理学表现大多呈现急性水肿型胰腺炎的病理特征,未见明显的腺泡坏死及导管系统损伤,我们猜测PDG的大量增殖与细胞坏死后释放的大量因子相关。急性水肿型胰腺炎主要表现为组织水肿,并无大量细胞坏死,不能刺激PDG的大量增殖,而慢性胰腺炎模型小鼠中,腺泡细胞大量坏死,导管上皮组织损伤严重,PDG出现了大量增殖的变化。我们推断在胰腺组织上皮损伤的情况下,PDG开始大量增殖,参与完成导管上皮组织的修复再生。此外,在PDG中还表达与导管上皮、胰腺发育和内分泌腺细胞分化相关蛋白标志物,所以我们认为PDG作为胰腺成体干细胞巢广泛存在于胰腺组织中。

A.对照组和CP组小鼠胰腺组织PDG和胰腺导管中CK19免疫组化的HIS评分;B.对照组和CP组小鼠胰腺组织PDG和胰腺导管中Sox9免疫组化的HIS评分;C.对照组和CP组小鼠胰腺组织PDG和胰腺导管中Ngn3免疫组化的HIS评分。aP<0.05,bP<0.001
图8 对照组和CP组小鼠胰腺组织CK19、Sox9和Ngn3的免疫组化的HIS评分
Fig 8 Pancreatic tissues of mice were evaluated by HIS scores of CK19,Sox9 and Ngn3 in group Control and group CP
胰腺组织具有异质性,不同的结构有不同的增殖机制。胰腺β细胞以及腺泡细胞主要通过自我复制来完成增殖的过程。虽然在研究中有学者认为,泡心细胞及终末导管细胞具有潜在干细胞特性,能分化增殖形成β细胞以及腺泡细胞,但其增殖最主要的来源还是通过自身复制而不是干细胞的分化来完成的。目前关于胰腺导管上皮细胞增殖的研究较少,主要认为导管细胞的增殖多依赖于干细胞巢的分化。
我们发现,胰腺在慢性炎症情况下出现多种结构的增殖,如PDG、胰岛、腺泡、终末导管细胞。Strobel等[7]通过系谱追踪标记的方法标记β细胞以及腺泡细胞,诱导炎症后未在导管上皮细胞中发现标记的细胞,这说明胰腺导管细胞的增殖不依赖于胰岛及腺泡细胞。Carpino等[8]发现,PDG主要分布于不小于300 μm的导管系统周围,而在终末导管系统中未发现PDG的存在。在炎症损伤时胰腺终末导管系统有较高的增殖率,其机制仍不清楚,目前认为终末导管的增殖与PDG无关。
在小鼠和人胚胎胰腺发育过程中,多种基因起着重要的作用:Pdx1多表达于胰腺前体细胞,与胰腺发育和β细胞成熟密切相关[9];Sox9多表达于胰腺发育的前期阶段,与前体细胞的成熟分化相关[10];Ngn3在内分泌细胞发育、胰岛素的产生和分泌及重编程干细胞或非β细胞生成胰岛素分泌β细胞中起着重要的调控作用等[11]。我们发现,PDG有着特异性的结构并表达特异性的分子标志物,在长期炎症诱导后PDG表达Pdx1、Sox9、Ngn3蛋白标志物。敲除小鼠的Pdx1基因后其胰芽无法正常发育形成胰腺,还有实验表明外源性的Pdx1表达能诱导腺泡细胞分化成β细胞,因此Pdx1被视为胰腺干细胞的标志物[12]。我们通过长期刺激胰腺诱导炎症模型后发现,PDG中Pdx1阳性表达,说明PDG中很有可能存在着胰腺干细胞。此外,在PDG中我们还发现了Ngn3的阳性表达。Ngn3的表达和β细胞的成熟有着密切关系,是胰腺内分泌腺分化的关键因子,在正常胰腺组织的少数腺泡和导管组织中也有表达。外源性Ngn3表达能够诱导腺泡及导管细胞向β细胞分化[13],而在炎症情况下PDG中Ngn3有着较高的表达,说明与胰岛细胞的分化有着联系。除了与内分泌腺细胞分化相关,PDG与导管细胞的增殖也有着密切联系。PDG在炎症的刺激下出现导管上皮细胞的分子特征,胰腺导管细胞均表达CK19和Sox9。CK19作为导管上皮细胞的标志物,表达于正常胰腺导管组织,而Sox9的表达与导管的形成相关。Chen等[14]通过诱导Sox9的表达使腺泡细胞转分化形成导管样细胞,说明Sox9在胰腺导管细胞形成中起着重要作用。总的来说,PDG很可能以干细胞巢的形式存在于胰腺组织中,在炎症损伤的刺激下能分化增殖形成多种胰腺细胞参与完成组织的修复再生,所以我们推断PDG很可能是胰腺干细胞结构。
干细胞和肿瘤之间也有着密切联系,它们之间有着很多共性。干细胞的基因突变或者功能失调是形成肿瘤的重要因素。Notch通路和胰腺癌的发生和进展有着密切联系[15]。在正常胰腺组织中,Notch通路在胰腺的发育、分化以及修复再生的过程中扮演着重要的角色[16]。而胰腺癌中Notch过表达促进胰腺癌血管生成,从而诱导胰腺癌的形成、发展及浸润、转移[17]。在小鼠模型中Notch持续活化,出现腺泡-导管化生(ADM),发展为PanINs,最终发展成胰腺癌。而在胰腺发育的过程中,Ngn3作为Notch的下游通路,它的过度表达和胰腺癌发生发展的关系仍不清楚。目前认为依赖于Shh通路的Sox9的过度表达与胰腺癌的发生发展也有着密切关系[18],但PDG与肿瘤之间关系的研究甚少,Ngn3、Sox9等蛋白的表达与胰腺癌的发生发展的关系有待进一步研究。
[1] BARKER N,BARTFELD S,CLEVERS H.Tissue- resident adult stem cell populations of rapidly self- renewing organs[J].Cell Stem Cell,2010,7(6):656- 670.
[2] GRAPINBOTTON A.Ductal cells of the pancreas[J].Int J Biochem Cell Biol,2005,37(3):504- 510.
[3] NEUSCHWANDERTETRI B A,BURTON F A,PRESTI M E,et al.Repetitive self- limited acute pancreatitis induces pancreatic fibrogenesis in the mouse[J].Dig Dis Sci,2000,45(4):665- 674.
[4] MCMINN R M,KUGLER J H.The glands of the bile and pancreatic ducts:autoradiographic and histochemical studies[J].J Anat,1961,95(95):1- 11.
[5] YAMAGUCHI J,MINOKENUDSON M,LISS A S,et al.Loss of trefoil factor 2 from pancreatic duct glands promotes formation of intraductal papillary mucinous neoplasms in mice[J].Gastroenterology,2016,151(6):1232- 1244.
[6] SCHMIDT J,RATTNE D M,LEWANDROWSKI K,et al.A better model of acute pancreatitis for evaluating therapy[J].Ann Sury,1992,215(1):44- 56.
[7] STROBEL O,DOR Y,ALSINA J,et al.Invivolineage tracing defines the role of acinar- to- ductal transdifferentiation in inflammatory ductal metaplasia[J].Gastroenterology,2007,133(6):1999- 2009.
[8] CARPINO G,RENZI A,CARDINALE V,et al.Progenitor cell niches in the human pancreatic duct system and associated pancreatic duct glands:an anatomical and immunophenotyping study[J].J Anat,2016,228(3):474- 486.
[9] DAMOUR K A,BANG A G,ELIAZER S,et al.Production of pancreatic hormone- expressing endocrine cells from human embryonic stem cells[J].Nat Biotechnol,2006,24(11):1392- 1401.
[10] MCDONALD E,LI J,KRISHNAMURTHY M,et al.SOX9 regulates endocrine cell differentiation during human fetal pancreas development[J].Int J Biochem Cell Biol,2012,44(1):72- 83.
[11] VILLASENOR A,CHONG D C,CLEAVER O.Biphasic Ngn3 expression in the developing pancreas[J].Dev Dyn,2008,237(11):3270- 3279.
[12] LIEW C G,SHAH N N,BRISTON S J,et al.PAX4 enhances beta- cell differentiation of human embryonic stem cells[J].PLoS One,2008,3(3):e1783.
[13] SERAFIMIDIS I,RAKATZI I,EPISKOPOU V,et al.Novel effectors of directed and Ngn3- mediated differentiation of mouse embryonic stem cells into endocrine pancreas progenitors[J].Stem Cells,2008,26(1):3- 16.
[14] CHEN N M,SINGH G,KOENIG A,et al.NFATc1 links EGFR signaling to induction of Sox9 transcription and acinar- ductal transdifferentiation in the pancreas[J].Gastroenterology,2015,148(5):1024- 1034 e9.
[15] HARBUZARIU A,RAMPOLDI A,DALEYBROWN D S,et al.Leptin- Notch signaling axis is involved in pancreatic cancer progression[J].Oncotarget,2017,8(5):7740- 7752.
[16] LI H J,KAPOOR A,GIELMOLONEY M,et al.Notch signaling differentially regulates the cell fate of early endocrine precursor cells and their maturing descendants in the mouse pancreas and intestine[J].Dev Biol,2012,371(2):156- 169.
[17] PONNURANGAM S,DANDAWATE P R,DHAR A,et al.Quinomycin A targets Notch signaling pathway in pancreatic cancer stem cells[J].Oncotarget,2016,7(3):3217- 3232.
[18] GRIMONT A,PINHO A V,COWLEY M J,et al.SOX9 regulates ERBB signalling in pancreatic cancer development[J].Gut,2015,64(11):1790- 1799.
Study on the relationship between PDG and pancreatic ductal epithelium regeneration in mouse model of pancreatitis
LIU Xu- cheng1,WANG Li- shan1,ZHOU Jia- hua2
(1.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China; 2.DepartmentofHepatobiliaryandPancreaticCenter,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
Objective: Exploring the relationship between PDG and regeneration of pancreatic ductal epithelium under the stimulation of inflammation. Methods: We evaluate whether the mouse model of acute and chronic pancreatitis was established successfully by pathological score;Histopathological changes of PDG and ducts in pancreatic tissue were observed by histopathological methods;The expression of Pdx1, Sox9 and Ngn3 in PDG and pancreatic ductal epithelial cells were observed by immunohistochemistry,and the positive expression rate of markers was evaluated by HIS score. Results: Mouse models of acute and chronic pancreatitis were successfully established, and the pathological scores of group AP and group CP were 3.33±0.52 and 8.50±0.55. There were significant differences compared with the control group with a statistical significance; In the models of chronic pancreatitis, proliferation of PDG were obvious, and the expression of both Pdx1, Sox9 and Ngn3 was positive, The HIS scores were 1.966 7±0.233 8, 0.700 0±0.209 8, 0.900 0±0.209 8 respectively. There was a significant difference compared with the control group with a statistical significance. Conclusion: PDG is related with the regeneration of pancreatic ductal epithelium and the differentiation and maturation of adult pancreas. PDG may be distributed in pancreatic tissue in the form of pancreatic stem cell nests.
pancreatitis models; pancreatic ductal gland regeneration; regeneration; pancreatic stem cell markers; mice
2017- 03- 23
2017- 04- 28
国家自然科学基金资助项目(6590000141)
刘旭呈(1991-),男,江苏南通人,在读硕士研究生。E- mail:18626014180@163.com
周家华 E- mail:zhoujiahua64@163.com
刘旭呈,王立山,周家华.小鼠胰腺炎模型中胰腺导管腺体与导管上皮修复再生的研究[J].东南大学学报:医学版,2017,36(4):505- 512.
R- 332; R657.51
A
1671- 6264(2017)04- 0505- 08
10.3969/j.issn.1671- 6264.2017.04.001

