无尾果黄酮类化学成分的UHPLC-Q-TOF-MS/MS分析※
● 朱继孝 文 乐 魏春华 慕泽泾 钟国跃 曾金祥
无尾果黄酮类化学成分的UHPLC-Q-TOF-MS/MS分析※
● 朱继孝*文 乐 魏春华 慕泽泾 钟国跃 曾金祥▲
目的:通过UHPLC-Q-TOF-MS/MS技术对无尾果中的化学成分进行定性分析。方法:采用UHPLC-Q-TOF-MS/MS,YMC-ULtraHT Pro C18色谱柱(100 mm×3 mm,2μm)以甲醇-0.5%甲酸水溶液为流动相梯度洗脱;质谱采用电喷雾(ESI)离子源,在负离子模式下采集数据,通过保留时间、精确分子离子峰和二级质谱裂解碎片,对无尾果进行成分鉴定。结果:初步鉴定了无尾果中10个黄酮类成分。结论:UHPLC-Q-TOF-MS/MS方法能快速鉴别无尾果中的黄酮类化学成分,该方法简单、快速,结果准确,为无尾果的药效物质研究奠定基础。
无尾果 UHPLC-Q-TOF-MS/MS 化学成分 裂解规律 黄酮
无尾果(ColurialongifoliaMaxim),藏药名为热衮巴,是蔷薇科无尾果属的植物,分布于中国大陆的甘肃、云南、西藏、四川、青海等地,全草入药,有止血止痛、清热作用。藏药志记载,热衮巴能治疗高血压引起的发烧、神经性发烧、疝痛等,具有清热解毒功效[1]。无尾果在藏区使用广泛。目前国内外对于无尾果化学成分的研究并不多见。本课题组前期对无尾果的抗炎、镇痛、解热作用进行了研究。前期研究结果表明,无尾果具有显著的抗炎、镇痛、解热作用,其抗炎作用与提高抗氧化能力、抑制脂质过氧化、抑制炎症因子TNF-α、PGE2的释放有关。但其药效物质基础仍不清楚,限制了无尾果的进一步开发与应用。因此,建立一种有效、准确的方法对无尾果进行化学成分研究具有重要意义。近年来,液质联用在中药领域应用广泛,已成为分离鉴定各种化合物的重要手段之一[2-3]。液质联用技术弥补了传统检测器的不足,它集LC的高分离能力和MS的高灵敏度、高选择性于一体[4]。因此,本实验以无尾果为研究对象,应用UHPLC-Q-TOF-MS/MS技术对无尾果甲醇提取物的化学成分进行研究,根据其准分子离子以及二级碎片离子、文献数据等鉴定无尾果的化学成分,并总结其质谱裂解规律,为无尾果活性成分的鉴定和研究提供科学依据,同时为藏药化学成分的研究奠定了基础。
1 仪器与材料
1.1仪器岛津LC-30A超高效液相色谱仪,PDA紫外检测器;Triple-TOF 5600+高分辨质谱仪,配备 ESI 离子源及 Analyst 1.6 数据处理软件、PeakView数据处理软件(A美国B SCIEX 公司);KQ-5200DB 型超声清洗机(昆山市超声波仪器公司);AL204 型电子分析天平(Mettler Toledo 仪器(上海)有限公司); Millipore-Simplicity 超纯水处理系统(德国默克密理博公司)。
1.2药物与试剂异槲皮苷对照品(纯度≥98%,批号:MUST-16051010)、金丝桃苷对照品(纯度≥98%,批号:MUST-16032113)、木犀草素对照品(纯度≥98%,批号:MUST-16011015)均购自成都曼思特生物科技公司;甲醇( HPLC 级,美国天地有限公司),甲酸( HPLC 级,山西西亚化工有限公司),水为Milli-Q 系统纯化水(美国Millipore 公司)。
无尾果由课题组采自云南怒江贡山县,经江西中医药大学钟囯跃研究员鉴定为蔷薇科无尾果属植物无尾果 (C.longigoliaMaxim)的干燥全草。
2 方法
2.1供试品溶液制备无尾果粉碎,称取约2.0g置于50mL锥形瓶,加入25mL 75% 甲醇超声提取45min,抽滤、旋干、定容至5mL容量瓶中,取定容后药液过0.22μm 微孔滤膜过滤,供UHPLC-Q-TOF-MS/MS分析。
2.2标准品溶液的制备分别精密称取2mg对照品(金丝桃苷、异槲皮苷、木犀草素)于5mL容量瓶中,用75%甲醇溶解稀释至刻度,过0.22μm微孔滤膜,待分析。
2.3 LC-MS条件
2.3.1 色谱条件 色谱柱:YMC-ULtraHT Pro C18 色谱柱(100 mm×3 mm,2μm);流动相:0.5%甲酸水溶液(A),甲醇(B),梯度洗脱:0~30min,8%~60% B;30~40min,60%~95% B;40~42min,95%~8% B;42~47min,8%~8% B;流速:0.4mL/min;柱温:32℃;进样量:4μL。
2.3.2 质谱条件 离子源为电喷雾离子化源(ESI),负离子模式;质量扫描范围m/z100~1000;喷雾电压:-4500V,雾化气温度:500℃,气帘气:140.745kPa,辅助气:344.74 kPa;去簇电压(DP):-100V;采用AB analyst TF软件采集数据,TOF/MS 一级预扫描和触发的二级扫描TOF/MS/MS 离子累积时间分别为200、100 ms,碰撞能量CE为40eV,CES碰撞能量叠加为(40±10)eV。
2.4数据处理采用AB Sciex公司 Peak View 1.6软件,对UHPLC-Q-TOF-MS/MS采集的数据进行处理。
3 结果
3.1无尾果化学成分分析采用 UHPLC-Q-TOF-MS/MS 对75%甲醇提取无尾果药材成分进行定性分析,(-) ESI-MS 的质谱总离子流图(TIC)见图1。应用Peak View 1.6软件分析75% 甲醇提取无尾果中各化学成分的保留时间及其质谱信息,并结合分子离子峰与对照品、相关文献报道数据进行对比,对其中的化学成分进行确认,初步鉴定出无尾果提取物中黄酮类化合物10个,见表1。

图1 无尾果提取物在负离子模式下总离子流图
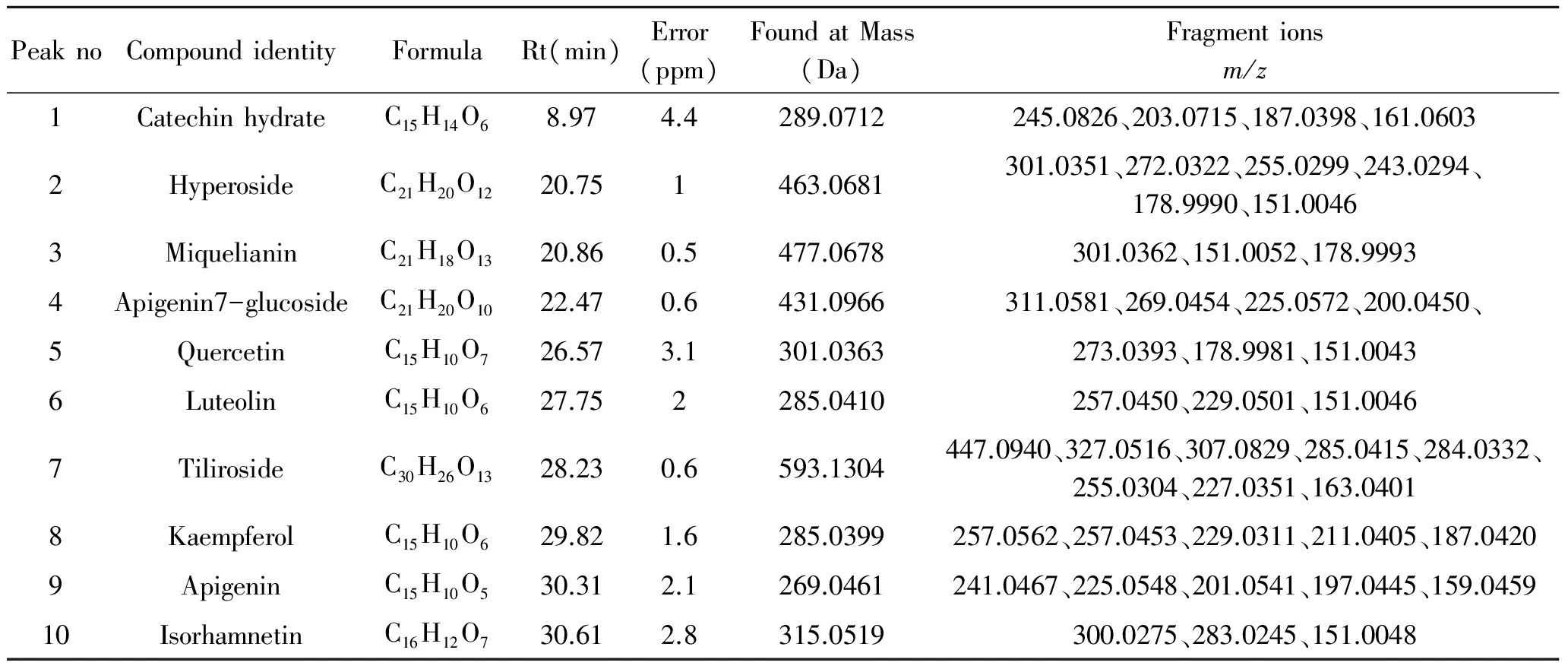
PeaknoCompoundidentityFormulaRt(min)Error(ppm)FoundatMass(Da)Fragmentionsm/z1CatechinhydrateC15H14O68.974.4289.0712245.0826、203.0715、187.0398、161.06032HyperosideC21H20O1220.751463.0681301.0351、272.0322、255.0299、243.0294、178.9990、151.00463MiquelianinC21H18O1320.860.5477.0678301.0362、151.0052、178.99934Apigenin7-glucosideC21H20O1022.470.6431.0966311.0581、269.0454、225.0572、200.0450、5QuercetinC15H10O726.573.1301.0363273.0393、178.9981、151.00436LuteolinC15H10O627.752285.0410257.0450、229.0501、151.00467TilirosideC30H26O1328.230.6593.1304447.0940、327.0516、307.0829、285.0415、284.0332、255.0304、227.0351、163.04018KaempferolC15H10O629.821.6285.0399257.0562、257.0453、229.0311、211.0405、187.04209ApigeninC15H10O530.312.1269.0461241.0467、225.0548、201.0541、197.0445、159.045910IsorhamnetinC16H12O730.612.8315.0519300.0275、283.0245、151.0048
3.2化合物的质谱裂解特征化合物1tR为8.97min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z289.0712 [M-H]-,其分子式为C15H14O6,分子离子峰失去CO2得到碎片离子m/z245.0826,碎片离子m/z245.0826分别失去C2H2O、C3H6O得到碎片离子m/z203.0715、187.0398。碎片离子m/z203.0715失去C2H2O得到碎片离子m/z161.0603,裂解规律与文献一致。因此,可以推测为儿茶素[5]。
化合物2tR为20.75min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z463.0681 [M-H]-,其分子式为C21H20O12,二级图谱与标准品一致,二级图谱碎片离子峰为m/z301.0351、300.0278、271.0246、255.0299、243.0294、178.9990、151.0046。根据二级碎片离子m/z301.0351、300.0278、272.0322、255.0290、243.0294、178.9990、151.0046推测为槲皮素母核,分子离子峰,m/z463.0681失去一分子葡萄糖得到m/z301.0351,而m/z301.0351强度高于m/z300.0278和碎片离子m/z271.0254、255.0299,可以推测糖连接在3位,见图2a。因此,推测此化合物为金丝桃苷[6]。
化合物3tR为20.86min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z477.0747[M-H]-,其分子式为C21H18O13,分子离子峰失去一分子葡萄糖醛酸得到碎片离子m/z301.0362,根据碎片离子m/z179.0344、151.0052、150.9874推测m/z301.0362为槲皮素母核。因此,推测化合物3为槲皮素-3-0葡萄糖醛酸,裂解规律与文献一致[6]。
化合物4tR为22.47 min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z431.0970 [M-H]-,其分子式为C21H20O10,分子离子峰失去C4H8O5得到碎片离子m/z311.0581,失去一分子葡萄糖得到碎片离子m/z269.0454。碎片离子m/z269.0454分别失去CO2和C3O2得到碎片离子m/z225.0572、200.0450,推测化合物4为芹菜素7-O-葡萄糖苷,裂解规律与文献一致[7]。
化合物5tR为26.57 min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z301.0363 [M-H]-,其分子式为C15H10O7,分子离子峰m/z301.0363 分别失去CO、C7H6O2得到碎片离子m/z273.0405、178.9982,碎片离子m/z178.9982失去CO得到碎片离子m/z151.0042,推测此化合物为槲皮素,裂解规律与文献一致[8]。
化合物6tR为27.75 min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z285.0399 [M-H]-,其分子式为C15H10O6,二级图谱与对照品一致,分子离子峰失去CO得到碎片离子m/z257.0562,碎片离子m/z257.0450失去CO得到碎片离子m/z229.0509。碎片离子m/z285.0399发生RDA裂解得到碎片离子m/z151.0051、133.0291,推测此化合物为木犀草素,见图2b,裂解规律与文献一致[9]。
化合物7tR为28.23min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z593.1304 [M-H]-,其分子式为C30H26O13,碎片离子峰为m/z447.0940、327.0516、307.0829、285.0415、284.0332、255.0304、227.0351、145.0296,分子离子脱去C9H6O2得到碎片离子447.0940,碎片离子m/z447.0940进一步脱去C6H10O5产生碎片离子m/z285.0415,推测中性丢失为葡糖糖基。由碎片离子m/z285.0415、284.0332、255.0304、227.0351可以推断为山奈酚母核。因此,推测此化合物为银锻苷[9]。

a 金丝桃苷

b 木犀草素

c芹菜素
化合物8tR为29.82min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z285.0399 [M-H]-,其分子式为C15H10O6,分子离子峰m/z285.0399分别失去CO、C4H4O3得到碎片离子m/z257.0450、187.0395,碎片离子m/z257.0450分别失去CO和HCOOH得到碎片离子m/z229.0501、211.0395,推测化合物8为山奈酚,裂解规律与文献一致[10]。
化合物9tR为30.31min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z269.0405[M-H]-,其分子式为C15H10O5,分子离子峰m/z269.0405分别失去CO、CO2、C3O2、C2O3得到碎片离子m/z241.0467、225.0548、201.0541、197.0445,碎片离子m/z201.0541失去C2H2O得到碎片离子m/z159.0459,见图2c,推测化合物9为芹菜素,裂解规律与文献一致[11]。
化合物10tR为30.61min,负离子模式下,高分辨ESI-MS准分子离子峰为m/z315.2549 [M-H]-,其分子式为C16H12O7,分子离子峰m/z315.2549失去CH3得到m/z300.0275,碎片离子m/z300.0275失去H2O得到碎片离子m/z283.0246,先失去C7H6O再失去CO得到碎片离子m/z151.0048,推测化合物10为异鼠李素,裂解规律与文献一致[12]。
4 讨论
藏药具有疗效明显、毒副作用小、资源丰富易得等优点,属我国较有影响、较为完整的民族药之一。而无尾果化学成分相关的报道仍属空白。
UHPLC-Q-TOF-MS/MS技术为化合物的鉴定提供了一种全新方法,与传统化学成分分离鉴别方法相比操作简便、快速、准确,已成为中药药效成分发现与鉴别的有力工具。本实验分析了无尾果甲醇提取物成分的质谱行为,鉴别了10种黄酮类化合物。并进一步发现以槲皮素为母核的化合物如槲皮素-3-0葡萄糖醛酸、金丝桃苷,其特征碎片离子为m/z301;芹菜素,其特征碎片离子为m/z269;木犀草素,其特征碎片离子为m/z285,为后续黄酮类化合物的鉴别提供了参考依据。
黄酮类化合物具有抗炎、镇痛、抗氧化、保肝、抗病毒等活性[13],如金丝桃苷具有抗炎镇痛的作用且通过抑制NF-κB的活化产生抗炎作用[14];木犀草素具有抗炎镇痛保护神经的作用,其能降低炎症因子转录调节因子的活性,减少促炎细胞因子和炎症介质的产生[15]。这表明本实验推断出的黄酮类化合物,在一定程度上阐明了无尾果的抗炎镇痛药效成分,为无尾果的药理活性乃至质量控制提供了初步物质依据。从总离子流图可以看出,仍有大量成分尚待进一步解析,说明无尾果可能还存在其它抗炎镇痛药效成分,相关工作正在进行之中。
[1]中国科学院西北高原生物研究所.藏药志[M].1991:350-351.
[2]Li S L,Song J Z,Qiao C F,et al.A novel strategy to rapidly explore potential chemical markers for the discrimination between raw and processed Radix Rehmanniae by UHPLC-TOFMS with multivariate statistical analysis.[J].Journal of Pharmaceutical & Biomedical Analysis,2010,51(4):812-23.
[3]Li Z,Song X,Fu Z,et al.Identification of the Major Constituents in Zhimu-Huangqi Herb-Pair Extract and Their Metabolites in Rats by LC-ESI-MS n[J].Chromatographia,2013,76(13):767-780.
[4]刘祥东,梁琼麟,罗国安,等.液质联用技术在医药领域中的应用[J].药物分析杂志,2005,25(1):110-116.
[5]刘国强,董 静,王 弘,等.4种儿茶素类化合物电喷雾质谱裂解规律的研究[J].高等学校化学学报,2009,30(8):1566-1570.
[6]张语迟,刘春明,刘志强,等.罗布白麻与罗布红麻的液相色谱-质谱联用分析[J].分析测试学报,2009,28(10):1148-1154.
[7]张维冰,王智聪,张凌怡.超高效液相色谱-二极管阵列检测-串联质谱法测定菊花中的10种咖啡酰基奎宁酸和22种黄酮类化合物[J].分析化学,2013,41(12):1851-1861.
[8]李宇航,戴海学,汪明明,等.槲皮素的电喷雾离子阱质谱分析[J].质谱学报,2009,30(6):374-378.
[9]李军茂,何明珍,欧阳辉,等.超高效液相色谱与飞行时间质谱联用快速鉴别木芙蓉叶的化学成分[J].中国药学杂志,2016,51(14):1162-1168.
[10]梁 艳,于世锋,陈卫军,等.山奈酚的电喷雾质谱裂解途径[J].应用化学,2009,26(10):1250-1252.
[11]丁健桦,王兴祥,张 慧,等.芹菜素的电喷雾萃取电离串联质谱[J].高等学校化学学报,2011,32(8):1714-1719.
[12]李 想.黄酮醇类化合物ESI-ITMS~n质谱裂解规律的量子化学研究[D].佳木斯大学,2015.
[13]阿布拉江·克依木.黄酮苷类天然产物的质谱分析方法研究[D].中国协和医科大学,2006.
[14]李锦松,陈剑鸿,孟民杰.金丝桃苷药理作用及其作用机制的研究进展[J].广东药学院学报,2015,31(2):269-272.
[15]王继双,何 焱,张文静,等.木犀草素的药理作用研究进展[J].生命科学,2013,25(6):560-565.
江西民族药现代科技与产业发展协同创新中心开放基金项目(No.JXXT201402021)
朱继孝,男,副教授,硕士研究生导师。研究方向:中药与民族药有效成分与作用机理。
▲通讯作者曾金祥,男,副教授,硕士研究生导师。研究方向:中药与民族药物质基础与质量标准。Email:zjinxiang@163.com
江西中医药大学中药资源与民族药研究中心(330004)

