磷和CO2浓度变化对苦草光合生理的影响
韩燕青刘 鑫胡维平张平究邓建才
(1. 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008; 2. 安徽师范大学国土资源与旅游学院, 芜湖 241003)
磷和CO2浓度变化对苦草光合生理的影响
韩燕青1,2刘 鑫1胡维平1张平究2邓建才1
(1. 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008; 2. 安徽师范大学国土资源与旅游学院, 芜湖 241003)
为了阐明CO2浓度和水环境要素变化对沉水植物生长的影响, 采用室外模拟的方法, 研究了不同磷和CO2浓度条件下苦草叶片(Vallisneria natans)光合生理特征。实验结果表明, 当水体磷浓度处于较高水平时,苦草叶片荧光参数Vj、Mo降低, 参数ABS/CSo、DIo/CSo、TRo/CSo、RC/CS、PET显著升高, 其他荧光参数则无显著变化; 高浓度的CO2在显著降低苦草叶片Vj、ABS/RC、DIo/RC、ABS/CSo、DIo/CSo的同时, 也显著提高了苦草叶片ψo、φEo、ETo/RC、PIABS、Fv/Fm、PTR、PET的参数值, 而对其他荧光参数无显著影响; 在磷与CO2交互作用方面, 磷与CO2在Vj、Mo、ψo、TRo/CSo、RC/CS和PET处存在显著的交互作用, 其他荧光参数不显著。可见, 磷或CO2浓度变化均能显著影响苦草叶片光合生理状态, 高浓度的CO2可有效改善苦草叶片PSⅡ反应中心光化学性能、电子传递能力及单位有活性反应中心能量的分配, 从而提高苦草叶片的光合能力;高浓度的磷可在一定程度上改善苦草叶片PSⅡ受、供体状态及电子传递性能。此外, 磷和CO2存在交互作用,协同影响苦草叶片的光合能力。
苦草; 磷; CO2; 光合生理
受化石燃料燃烧以及土地利用方式转变等因素影响, 大气CO2浓度已经从工业革命前的270 μmol/ mol升高至现在的390 μmol/mol, 预计到21世纪末将达到936 μmol/mol (IPCC, 2013)。由于大气-水体间CO2的交换服从开放体系的亨利定律, 大气CO2浓度的升高会造成水体中溶解性CO2浓度增加,含量升高, 总无机碳(DIC)增加[1—3]。在自然水体中, CO2的水气扩散速度一般小于水生植物所固定的CO2速度, 且不同生活型水生植物的碳利用能力亦存在较大的差异, 所以部分水生植物生长长期处于潜在的碳限制状态[4]。DIC作为水生植物光合作用的底物, 其组分的变化会对水生植物的光合作用产生直接影响, 肖月娥等[5]在对太湖2种大型沉水植物DIC利用效率的研究中发现菹草(Potamogeton crispus)和马来眼子菜(Potamogeton malaianus)均可利用水体中的和游离CO2, 且光合速率随着浓度增高而增高, 但马来眼子菜的光合速率高于菹草, 且对CO2的亲和力较大, 具有更好的生长优势, 这可能与马来眼子菜的碳酸酐酶活性较高, 催化与CO2之间的转化效率较高有关。刘露等[6]研究则发现大气CO2浓度升高可增加坛紫菜(Porphyra haitanensis)叶绿素a含量, 而一些相关研究则显示CO2升高会降低龙须菜(Gracilaria lemaneiformis)、菹草(Potamogeton crispus)、苦草(Vallisneria natans)等水生植物的叶绿素a含量[7—9];此外, 大量研究发现短期CO2浓度升高可增加植物的光合速率, 长期处理则可能出现光适应现象, 但对其适应机理没有定论[10,11]。
磷是植物生长发育的必要元素, 在光合作用中同化力的形成和Calvin循环中具有重要作用。缺磷会导致植物光合速率、最大荧光(Fm)、光化学效率(Fv/Fm)、电子传递速率(RET)等降低[12], 同时对同化力的形成、Calvin循环中酶的活性、RuBP的再生以及同化物的运输产生影响[13]。受施肥过度等农业非点源污染因素影响, 我国各湖泊水体磷浓度逐年升高, 最高可达1.04 mg/L[14]。水体磷浓度变化改变了水体营养条件, 引起湖泊水生态环境变化,从而对水生植物的生长发育产生影响。
苦草(Vallisneria natans)是最为常见的沉水植物之一, 广泛分布于我国江、河湖泊中, 对河湖水体污染物净化能力强, 是减缓水体富营养化进程的重要沉水植物[15,16]。本研究通过运用连续激发式荧光仪测定不同磷和CO2浓度条件下苦草叶片快速叶绿素荧光曲线, 运用JIP-test分析技术分析苦草叶片荧光参数变化特征, 研究在磷和CO2浓度双重因素影响下的苦草光合生理特征, 为探究全球环境变化背景下水生植物演化趋势提供科学依据。
1 材料与方法
1.1 材料
实验于2015年8月在中国科学院南京地理与湖泊研究所东山太湖湖泊生态系统研究站进行, 实验用苦草采自苏州东太湖湖区, 快速运回实验室后洗净苦草叶片表面的附着物, 用纯水预培养2d, 选择长势良好形态相近的苦草放于半封闭透明培养装置(r=20 cm, h=40 cm)中培养。培养水体采自东太湖区, 水质为中营养水平, 过滤去除杂质后加入半封闭透明培养装置中待用, 水位30 cm。实验苦草初始生物量为(2.22±0.30) g, 株高(21.59±2.90) cm,平均叶片数8片。
1.2 实验设计
实验设计方案如表 1, 共有4种处理, 每种处理3组重复, 每个重复3株苦草。磷浓度处理分为中营养和重度富营养2种, 由KH2PO4供给, 实验期间定期补充。CO2浓度处理分为现有大气CO2浓度和1000 μmol/mol, 现有大气浓度处理利用空气压缩机将新鲜空气从外部吸入, 经气体流量计控制气体流速1 L/min, 通过导气管直接导入半封闭透明培养装置靠近水面的水体处; 目标加富CO2浓度则通过导入高纯CO2和新鲜空气到CO2加富器中(CE-100-3,武汉瑞华仪器设备有限责任公司)获取, 控制气体流速1 L/min后经集气袋(50 L)充分混匀后通入培养装置靠近水面的水体处, CO2浓度变化幅度可控制在5%以内。实验期间不间断向半封闭透明培养装置供气, 半封闭透明培养装置顶部布有小孔, 可使培养装置中的空气处于不断置换状态, 保持空气新鲜。培养装置置于室外实验池内, 实验期间保证其他培养条件一致。

表 1 磷及CO2浓度处理方案Tab. 1 The strategy of phosphorus and CO2treatments
1.3 测定方法
水体指标测定 实验期间定期采集水样进行分析, 分别测定培养水体总磷、总氮、无机碳组分和叶绿素a含量, 其中总磷总氮测定采用过硫酸钾消解法[17], 送予中国科学院南京地理与湖泊研究所所级公共技术分析测试中心测定水体无机碳组分浓度, 测定仪器为连续流动分析仪—LYL, 叶绿素a测定采用热乙醇法[18]。
叶绿素荧光测定 经10d培养后, 对苦草叶片进行水底原位暗适应, 选取苦草第三片完全展开叶, 清除表面附着物, 夹上暗适应叶片夹(距离叶片顶端3 cm处), 30min后利用连续激发式荧光仪Handy PEA Senior (Hansatech Instruments, Norfol, UK)测定快速叶绿素荧光诱导动力学曲线, 测量叶绿素荧光时所使用的光化光和脉冲光的强度分别为180 和3000 μmol/(m2·s)。测定时, 仪器可自动记录从10μs到2s之间高分辨率间隔荧光信号, 并可自动导出相关荧光参数。本次用作实验分析的荧光参数主要有:照光2ms时有活性的反应中心的关闭程度(VJ)、QA被还原的最大速率(Mo)、电子传递到电子传递链下游的电子受体的概率(ψo)、反应中心吸收的光能用于电子传递的量子产额(φEo)、K相相对可变荧光(WK)、PSⅡ最大光化学效率(Fv/Fm)、光合性能指数(PIABS)、捕获光能性能(PTR)、传递电子性能(PET)以及光合机构的比活性,即活跃的单位反应中心(RC)或单位受光面积(CS)的各种量子效率(ABS/RC、TRo/RC、ETo/RC、DIo/RC、ABS/CSo、TRo/CSo、ETo/CSo、DIo/CSo等)以及单位面积上有活性的反应中心数量(RC/CS)。
实验所得原始数据采用Excel2003软件进行处理, 采用SPSS19.0统计软件进行单因素方差分析和双因素方差分析。
2 结果与分析
2.1 培养水体水质变化特征
由图 1可知, 低浓度磷培养水体中总磷浓度变化不明显, 在0—0.1 mg/L间变化, 处于稳定的低水平状态, 在高浓度磷条件下变化较为明显, 在第1和第6天2次添加外源磷情况下均随培养时间增加总磷浓度呈现下降趋势; 在总氮方面, 低浓度的磷处理条件下的水体总氮含量在实验期间大体上高于高浓度磷处理; 在无机碳组分方面, 高浓度CO2处理条件下的水体和含量均高于正常浓度CO2处理下的水体和含量; 实验中, 高浓度磷处理的水体中叶绿素a的浓度显著高于低浓度磷处理, 藻类在高浓度营养盐条件下生长旺盛。
2.2 磷和CO2浓度对苦草叶绿素荧光曲线的影响
通过对比发现(图 2), 高浓度的磷显著提高低浓度CO2条件下苦草叶片OJIP曲线各点荧光产额,但对高浓度CO2条件培养下的苦草叶片OJIP曲线各点荧光产额无显著影响; 高浓度的CO2一方面显著提高低浓度磷培养条件下苦草叶片OJIP曲线JIP段各点荧光产额, 另一方面降低了高浓度磷培养条件下的苦草叶片OJIP曲线各点荧光产额; 在所有处理中, 低浓度的磷和CO2条件下苦草叶片OJIP曲线各点荧光产额最低, 表明低浓度的磷和CO2降低了苦草叶片的荧光产额, 抑制了PSⅡ的光化学反应, 导致苦草叶片PSⅡ反应中心活性降低。
2.3 磷和CO2浓度对苦草叶片PSⅡ受、供体侧的影响
由图 3可知, 低浓度的磷和CO2显著提高了苦草叶片QA被还原的最大速率(Mo)、有活性的反应中心关闭程度(Vj)(P<0.05); 通过对比发现, 不同处理下的苦草叶片荧光参数Wk无明显差异(P>0.05),表明磷和CO2浓度变化均对苦草叶片PSⅡ反应中心供体侧放氧复合体(OEC)无明显影响, OEC处于稳定状态; 低浓度的磷和CO2显著降低电子传递到电子传递链下游的电子受体的概率(ψo) (P<0.05), 而高浓度的CO2可显著增加苦草叶片反应中心吸收的光能用于电子传递的量子产额(φEo) (P<0.05)。同时对荧光参数Vj、Mo、ψo、φEo进行双因素方差分析(表 2), 发现磷浓度变化对荧光参数Vj、Mo存在显著影响, CO2浓度则对Vj、ψo、 φEo影响显著, 且在Vj、Mo、ψo处与磷存在明显的交互作用。

图 1 不同处理组培养水体水质变化特征Fig. 1 The quality of cultivate water bodies under different treatments

图 2 不同处理组苦草叶片OJIP曲线
2.4 磷和CO2浓度对苦草叶片比活性的影响
表 3显示, 在单位有活性反映中心方面, 高浓度的CO2显著降低了单位有活性的反应中心吸收、耗散的能量(ABS/RC、DIo/RC)(P<0.05), 而显著提高了用于电子传递的能量(ETo/RC)(P<0.05), 此外, 单位反应中心捕获的能量(TRo/RC)在各处理间差异不显著(P>0.05)。双因素方差分析表明磷浓度对单位反应中心各种量子效率的影响不显著, 且与CO2无明显的交互作用; 在单位受光面积方面, 高浓度的磷和低浓度的CO2培养下的苦草叶片单位面积吸收、耗散、捕获的能量(ABS/CSo、DIo/CSo、TRo/CSo)均明显高于其他处理组(P<0.05)。不同处理单位面积用于电子传递的能量(ETo/CSo)差异不显著(P>0.05); 实验同时观察到在低浓度的磷和低浓度的CO2培养条件下的苦草叶片单位面积有活性的反应中心数量(RC/CS)最低, 且双因素方差分析表明CO2浓度变化对RC/CS无显著影响, 但磷浓度升高可显著提高单位面积有活性的反应中心数量。

图 3 不同处理对苦草叶片荧光参数Vj、Mo、ψo、φEo、Wk的影响

表 2 叶绿素荧光参数双因素方差分析Tab. 2 Double factor variance analysis of chlorophyll fluorescence parameters
2.5 磷和CO2浓度对苦草叶片Fv/Fm、PIABS、PTR和PET的影响
通过图 4对比发现, 处理组PLCL和PHCL的最大光化学效率(Fv/Fm)、光合性能指数(PIABS)和捕获光能性能(PTR)均明显低于PLCH和PHCH处理组(P<0.05); 电子传递性能(PET)则在CC处理条件下最低(P<0.05), 其他处理组相差不明显。结合双因素方差分析可知高浓度的CO2对苦草叶片的光合性能指数、最大光化学效率、捕光性能和传递电子性能均有明显的促进作用, 而磷浓度变化对Fv/Fm、PIABS和PTR无显著作用, 且与CO2无明显的交互作用, 但高浓度的磷可显著提高苦草叶片传递电子性能(表 2)。
3 讨论
实验表明水体磷浓度的增加在一定程度上改善了苦草叶片的光合能力, 但充足的氮磷营养条件也同时促进藻类的快速生长, 藻类大量繁殖加大了氮磷营养盐等资源的消耗, 和苦草竞争生存空间和资源, 对苦草的生存产生不利影响。而CO2浓度的升高可导致水体和浓度的升高, 改善苦草叶片光系统PSⅡ的状态, 进而提高苦草叶片光合能力。
3.1 磷和CO2浓度对苦草叶片PSⅡ受、供体侧的影响
高浓度的磷和CO2均可改善苦草叶片PSⅡ反应中心受、供体侧状态, 且两者之间存在明显的交互作用。高浓度的磷则可提高苦草叶片有活性的反应中心开放程度, 减少的积累, 保证PSⅡ反应中心处于有活性状态, 而有活性的光系统PSⅡ可通过电子传递和耦联的光合磷酸化促进同化力的形成, 进而推动碳同化反应, 提高苦草叶片光合能力。在低浓度的磷培养条件下, CO2浓度的升高会降低苦草叶片有活性的反应中心关闭程度(Vj), 反应中心吸收用于还原QA的光能减少, 更多的能量用于电子传递(φEo), 使得QA被还原的速率减慢(Mo),的积累相对降低, 而PSⅡ受体侧有更多的电子从进入下游电子传递链(ψo), 即PSⅡ受体侧电子传递能力相对增强, 电子传递能力的增强有利于植物捕获的光能在光合结构中的传递和转化, 促进光化学反应的进行; 在一些环境胁迫如高温、干旱、强光状态下, OJIP曲线会出现一个K相, 这与PSⅡ供体侧放氧复合体(OEC)失活有关, 常被用作OEC受伤害的标志, 并将此相的相对荧光值Wk的升高程度作为OEC被破坏的程度[19—22]。在实验中, 4种不同处理下的苦草叶片Wk无明显差异, 表明磷和CO2两种环境因子均对苦草叶片PSⅡ反应中心供体侧OEC无明显影响, OEC处于较为稳定状态。
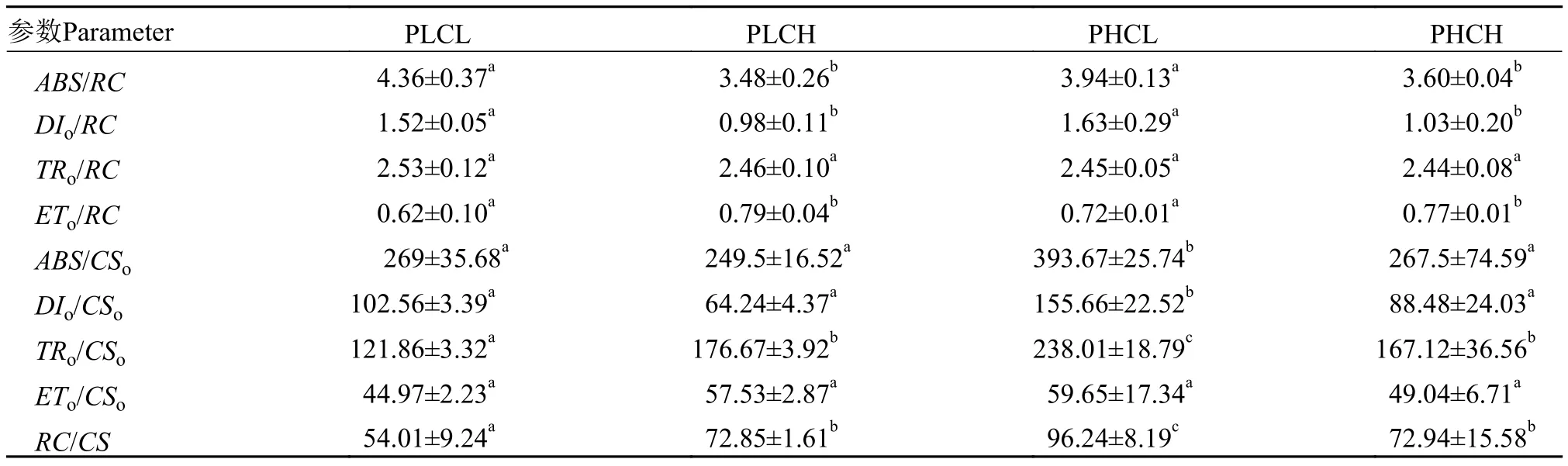
表 3 不同处理下苦草叶片比活性参数Tab. 3 The specific activity of V. natans under different treatments

图 4 不同处理对苦草叶片荧光参数Fv/Fm、PIABS、PTR、PET的影响Fig. 4 The effect on Fv/Fm, PIABS, PTRand PETin the leaves of V. natans with different treatments
3.2 磷和CO2浓度对苦草叶片比活性的影响
根据叶绿体能量流动模型, 植物叶片天线色素所吸收的光能主要有3种耗散形式, 小部分以热能和叶绿素荧光的形式耗散掉, 大部分则被反应中心(RC)捕获(TR), 在反应中心转化为还原能。将QA还原为,又被重新氧化, 从而产生电子传递(ET),把传递的电子用于固定CO2或用于其他途径[23]。本研究发现CO2浓度的升高均会降低苦草叶片单位有活性的反应中心吸收的能量(ABS/RC), 单位有活性反应中心用来热耗散的能量(DIo/RC)也同样降低, 最终单位反应中心用来电子传递的能量(ETo/RC)增加, 更多的能量可通过电子传递和光化学反应转化成与光合作用有关的化学能, 参与光合作用过程;在单位面积方面, 高浓度的磷提高了单位面积吸收和耗散的能量(ABS/CSo、DIo/CSo), 而高浓度的CO2则会降低单位面积吸收和耗散的能量(ABS/CSo、DIo/CSo), 导致在高浓度磷及CO2条件下苦草叶片单位面积光合效率无明显变化。
3.3 磷和CO2浓度对苦草叶片Fv/Fm、PIABS、PTR和PET的影响
Fv/Fm是PSⅡ的最大光化学效率, 在非胁迫条件下该参数的变化极小, 是反映在各种胁迫下植物光合作用光反应受抑制程度的关键指标[24,25]。实验发现, 水体磷变化则对苦草最大光化学效率无显著影响, 这与蔡炜等[26]研究发现水体中N、P营养盐质量浓度的高低对苦草叶片Fv/Fm影响不显著结果相一致。而高浓度的CO2明显提高了苦草叶片Fv/Fm, 表明苦草叶片最大光化学效率得到提高, PSⅡ潜在活性和光合作用原初反应增强。在实验中, 光合性能指数PIABS与Fv/Fm变化相同, 均随CO2浓度升高而表现增加趋势, 由于PIABS可以改写为PIABS=(RC/ABS)(PTR)(PET), 其中, RC/ABS是以叶绿素为基础的有活性的反应中心密度, PTR为捕获光能性能, PET为传递电子性能。因而, PIABS受到3个相互独立的因素共同制约, 更能敏感地反映出叶片光合效率的变化[27,28]。在本研究中, 水体磷含量变化则对苦草叶片的捕光性能无显著影响, 但高浓度的磷可提高苦草叶片的电子传递性能, 高浓度的CO2除了提高苦草叶片捕光性能, 也对低磷情况下的苦草叶片电子传递性能起着促进作用。
磷对植物的光合作用和碳水化合物的代谢具有调节作用, 充足的磷供给可通过促进卡尔文循环中酶的活性及RuBP的再生、同化力ATP和NADPH的形成以及同化物从叶片中输出等方面来提高植物光合速率[13]。CO2作为光合作用的底物, 其浓度的升高可改善CO2对Rubisco酶结合位点的竞争能力, 提高羧化效率, 减弱植物的光呼吸作用, 同时改善植物光系统结构如PSⅡ等的状态, 增强CO2同化速率, 进而提高植物的光合效率[29]。在对磷和CO2的交互作用研究中发现, 短期CO2浓度增加均可提高不同磷素处理下的三叶草(Trifolium pratense)固定CO2的能力, 而长时间CO2浓度增加对低磷条件下的三叶草固定CO2能力的提高作用显著小于对高磷条件下的三叶草的提高作用, 高浓度磷处理的三叶草仍表现出高浓度CO2对光合能力的促进作用[30]。对玉米、大豆的研究显示, CO2浓度升高对供磷水平下单、间作玉米大豆的株高、茎粗、叶面积及干物质积累量的增加量均大于缺磷处理, 供磷对CO2浓度升高所产生的正效应有促进作用[31]。在本研究中, 与前人碳、磷供应存在着相互促进作用的研究结果一致, 磷素及CO2浓度升高可在不同程度上改变苦草叶片光系统PSⅡ状态, 提高电子传递能力, 促进苦草光合作用。
环境中各种环境因素并不是孤立存在的, 它们相互联系, 相互影响。在实验中, 各处理组培养水体部分指标受磷和CO2浓度不同的影响亦发生不同程度变化, 如水体pH、叶绿素a、温度等, 而pH、水体叶绿素a及温度等都是影响水生植物生长发育的环境因素, 其差异性的存在会对苦草叶片光合生理特征产生影响。在实验中, 相比低浓度磷培养条件下, 在高浓度磷含量水体中叶绿素a含量较高, 藻类大量着生, 宋玉芝等[32]研究结果表明苦草附着藻类生物量随水体氮磷浓度的升高呈显著增加的趋势, 和本实验结果相一致。沉水植物和藻类之间存在着复杂的关系, 沉水植物可通过化感作用使得藻类体内活性氧自由基过量堆积和藻叶绿素含量下降, 藻类则能一方面通过遮光作用抑制沉水植物叶绿素a的合成, 另一方面通过化感作用和对可利用光合有效辐射及DIC的竞争优势影响沉水植物的光合作用[33—35]。苦草在不同环境条件下的生长变化特征及响应机理还有待开展深入研究。
4 结论
(1) 相比低浓度磷培养条件, 适度高浓度的磷可提高苦草叶片PSⅡ反应中心开放程度, 降低的积累, 增强苦草叶片电子传递性能, 改善苦草叶片光合能力。(2) CO2浓度对苦草叶片光和生理影响更为显著, 高浓度的CO2可改善苦草叶片PSⅡ受、供体状态, 促进苦草叶片PSⅡ光化学性能、电子传递能力及单位有活性的反应中心能量的高效分配, 提高苦草叶片的光合能力。(3) 磷和CO2浓度变化均对苦草叶片放氧复合体无显著影响, 但对苦草叶片PSⅡ反应中心开放程度、的积累和电子传递过程等影响显著并存在明显的交互作用。从短期来看, 在高浓度磷(0.5 mg/L)和高浓度CO2(1000 μmol/mol)培养下的苦草叶片具有更强的光合能力。
[1]Riebesell U. Effects of CO2enrichment on marine phytoplankton [J]. Journal of Oceanography, 2004, 60(4): 719—729
[2]Rost B, Riebesell U, Burkhardt S, et al. Carbon acquisition of bloom-forming marine phytoplankton [J]. Limnology and Oceanography, 2003, 48(1): 55—67
[3]Beardall J, Raven J A. The potential effects of global climate change on microalgal photosynthesis, growth and ecology [J]. Phycologia, 2004, 43(1): 26—40
[4]Thom R M. CO2-enrichment effects on eelgrass (Zostera marina, L.) and bull kelp (Nereocystis luetkeana, (mert.) P & R.) [J]. Water Air and Soil Pollution, 1996, (88): 383—391
[5]Xiao Y E, Chen K N, Dai X B, et al. Dissolved inorganic carbon uptake in two submerged macrophytes from Taihu Lake, China [J]. Journal of Plant Ecology, 2007, 31(3): 490—496 [肖月娥, 陈开宁, 戴新宾, 等. 太湖两种大型沉水植物无机碳利用效率差异及其机理. 植物生态学报, 2007, 31(3): 490—496]
[6]Liu L, Ding L L, Chen W Z, et al. The combined effects of increasing CO2concentrations and different temperatures on the growth and chlorophyll fluorescence in Porphyra haitanensis (Bangiales, Rhodophyta) [J]. Acta Ecologica Sinica, 2013, 33(13): 3916—3924 [刘露, 丁柳丽,陈伟洲, 等. 不同温度下CO2浓度增高对坛紫菜生长和叶绿素荧光特性的影响. 生态学报, 2013, 33(13): 3916—3924]
[7]Zheng W, Zhong Z H, Yang Z, et al. Effects of elevated CO2concentration on the photosynthetic physiological characteristics of Gracilaria lemaneiformis grown under different light levels [J]. Acta Ecologica Sinica, 2014, 34(24): 7293—7299 [郑伟, 钟志海, 杨梓, 等. 大气CO2增加对不同生长光强下龙须菜光合生理特性的影响. 生态学报, 2014, 34(24): 7293—7299]
[8]Xie Y H, Yu D, Geng X H. Effects of elevated CO2concentration on phenotypic, physiological and biochemical characteristics of submersed plant Potamogeton crispus leaf [J]. Acta Phytoecologica Sinica, 2003, 27(2): 218—222 [谢永宏, 于丹, 耿显华. CO2浓度升高对沉水植物菹草叶表型及生理生化特征的影响. 植物生态学报, 2003, 27(2): 218—222]
[9]Geng X H, Yu D, Huang Y M, et al. Growth and physiobioceemistry responses of Vallisnerla spiralis L. to CO2enrichment [J]. Acta Hydrobiologica Sinica, 2004, 28(3): 304—309 [耿显华, 于丹, 黄永明, 等. 高浓度CO2下苦草的生长和生理生化反应. 水生生物学报, 2004, 28(3): 304—309]
[10]Lu N, Hu W P, Deng J C, et al. Effects of elevated atmospheric CO2concentrations on growth of plants [J]. Chinese Journal of Soil Science, 2011, 42(2): 477—482 [路娜, 胡维平, 邓建才, 等. 大气CO2浓度升高对植物影响的研究进展. 土壤通报, 2011, 42(2): 477—482]
[11]Deng Y Y, Zou D H. Effects of elevated atmospheric CO2on photosynthesis of Gracilaria lemaneiformis and Ulva conglobata grown at low and high N supplies [J]. Chinese Journal of Ecology, 2014, 33(6): 1520—1527 [邓亚运,邹定辉. 大气CO2浓度升高对不同氮生长条件下的两种大型海藻光合作用的影响. 生态学杂志, 2014, 33(6): 1520—1527]
[12]Jacob J, Lawlor D W. In vivo, photosynthetic electron transport does not limit photosynthetic capacity in phosphate-deficient sunflower and maize leaves [J]. Plant Cell and Environment, 2006, 16(7): 785—795
[13]Yu H Q, Peng X X, Yan X L, et al. Effect of P deficiency on diurnal variation of photosynthesis in contrasting soybean genotypes [J]. Journal of Shenyang AgriculturalUniversity, 2005, 36(5): 519—522 [于海秋, 彭新湘, 严小龙, 等. 缺磷对不同磷效率基因型大豆光合日变化的影响. 沈阳农业大学学报, 2005, 36(5): 519—522]
[14]Cai L Y, Li Y, Zheng Z H. Temporal and spatial distribution of nitrogen and phosphorus of lake systems in China and their impact on eutrophication [J]. Earth and Environment, 2010, 38(2): 235—241 [蔡龙炎, 李颖, 郑子航.我国湖泊系统氮磷时空变化及对富营养化影响研究.地球与环境, 2010, 38(2): 235—241]
[15]Grise D, Titus J E, Wagner D J. Environmental pH influences growth and tissue chemistry of the submersed macrophyte Vallisneria americana [J]. Canadian Journal of Botany, 2011, 64(2): 306—310
[16]Cao D D, Wang D, Yang X, et al. Decomposition of two submerged macrophytes and their mixture: effect of sediment burial [J]. Acta Hydrobiologica Sinica, 2016, 40(2): 327—336 [曹丹丹, 王东, 杨雪, 等. 泥沙埋深对苦草和微齿眼子菜及两物种混合分解的影响. 水生生物学报, 2016, 40(2): 327—336]
[17]State Environmental Protection Administration, Editorial Board of Water and Wastewater Monitoring and Analysis Methods. Water and Wastewater Monitoring and Analysis Methods (Fourth edition) [M]. Beijing: China Environmental Science Press. 2002, 243—257 [国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法(第四版). 北京: 中国环境出版社. 2002, 243—257]
[18]Chen Y W, Chen K N, Hu Y H. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method [J]. Journal of Lake Sciences, 2006, 18(5): 550—552 [陈宇炜, 陈开宁,胡耀辉. 浮游植物叶绿素a测定的“热乙醇法”及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550—552]
[19]Zhang M, Wang H J, Yu C Q. The examination of high temperature stress of Ammopiptanthus mongolicus by chlorophyll fluorescence induction parameters [J]. Ecology and Environmental Sciences, 2009, 18(6): 2272—2277 [张谧, 王慧娟, 于长青. 超旱生植物沙冬青高温胁迫下的快速叶绿素荧光动力学特征. 生态环境学报, 2009, 18(6): 2272—2277]
[20]Geng L I, Gao H Y, Zhao B, et al. Effects of drought stress on activity of photosystems in leaves of maize at grain filling stage [J]. Acta Agronomica Sinica, 2009, 35(10): 1916—1922
[21]Jiang C D, Jiang G M, Wang X, et al. Enhanced photosystem 2 thermostability during leaf growth of Elm (Ulmus pumila) seedlings [J]. Photosynthetica, 2006, 44(3): 411—418
[22]Wen X, Qiu N, Lu Q, et al. Enhanced thermotolerance of photosystem II in salt-adapted plants of the halophyte, Artemisia anethifolia [J]. Planta, 2005, 220(3): 486—497
[23]Strasser B J, Strasser R J. Measuring fast fluorescence transients to address environmental questions: The JIP test [A]. In: Mathis P (Eds.), Photosynthesis: From Light to Biosphere [C]. the Netherlands: Kluwer Academic Publisher. 1995, 977—980
[24]Liu J S, Shi H, Li Y Y. Effects of Cd (2+) stress on photosynthesis and chlorophyll fluorescence characteristics of cucumber seedlings [J]. Research of Soil and Water Conservation, 2011, 18(5): 187—190 [刘劲松, 石辉, 李秧秧.镉胁迫对黄瓜幼苗光合和叶绿素荧光特性的影响. 水土保持研究, 2011, 18(5): 187—190]
[25]Zhang A L, Pan Y Z, Jiang B B, et al. Effects of hading on photosynthesis and chlorophyll fluorescence parameters in Lilium spp [J]. Journal of Southwest China Normal University, 2011, 6(5): 163—167 [张安林, 潘远智,姜贝贝, 等. 遮荫对香水百合光合特性及叶绿素荧光参数的影响. 西南师范大学学报(自然科学版), 2011, 6(5): 163—167]
[26]Cai W, Song Y Z. Effect of water nutrient concentration on photosynthetic fluorescence characteristics of Vallisneria natans [J]. Research of Environmental Sciences, 2009, 22(8): 907—912 [蔡炜, 宋玉芝. 水体营养盐质量浓度对苦草光合荧光特性的影响. 环境科学研究, 2009, 22(8): 907—912]
[27]Le B T, Shapcott A, Schmidt S, et al. The OJIP fast fluorescence rise characterizes Graptophyllum, species and their stress responses [J]. Photosynthesis Research, 2007, 94(2-3): 423—436
[28]Su S, Wan S M, Wan J X, et al. Effects of dehydration in the dark on functions of PSⅠ and PSⅡ in apricot (Prunus armeniaca L.‘JinTaiyang’) leaves [J]. Acta Horticulturae Sinica, 2008, 35(1): 1—6 [孙山, 王少敏, 王家喜,等. 黑暗中脱水对‘金太阳’杏离体叶片PSⅠ和PSⅡ功能的影响. 园艺学报, 2008, 35(1): 1—6]
[29]He P. Green house effect and plant photosynthesis: An analysis on the influences of CO2enrichment on photosynthetic mechanism in plants [J]. Journal of Central South Forestry University, 2001, 21(1): 1—4 [何平. 温室效应与植物光合作用: CO2浓度升高对植物光合机理影响的分析. 中南林学院学报, 2001, 21(1): 1—4]
[30]Duchein M, Bonicel A, Betsche T. Photosynthetic net CO2uptake and leaf phosphate concentrations in CO2enriched clover (Trifolium subterraneum L.) at three levels of phosphate nutrition [J]. Journal of Experimental Botany, 1993, 44(258): 17—22
[31]Zhang J T, Shen Y F, Li S Q. Growth effects of CO2concentration and phosphorus on maize and soybean underdifferent cropping patterns [J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(3): 577—584 [张瑾涛, 沈玉芳, 李世清. CO2浓度和磷对不同种植方式玉米大豆生长效应研究. 西北植物学报, 2013, 33(3): 577—584]
[32]Song Y Z, W Y J, W J Q, et al. Effects of nitrogen and phosphorus concentration on epiphytic algae living on two types of submerged plants [J]. Acta Scientiae Circumstantiae, 2016, 36(9): 3208—3212 [宋玉芝, 王宇佳, 王锦旗, 等. 水体氮磷浓度对两种沉水植物上附着藻类的影响. 环境科学学报, 2016, 36(9): 3208—3212]
[33]Chen W M, Zhang Q M, Dai S G. The mutual allelopathy of Vallisneria spiralis Linn. and Microcystis aeruginosa [J]. China Environmental Science, 2009, 29(2): 147—151 [陈卫民, 张清敏, 戴树桂. 苦草与铜绿微囊藻的相互化感作用. 中国环境科学, 2009, 29(2): 147—151]
[34]Sand-Jensen K, Borum J. Interactions among phytoplankton, periphyton, and macrophytes in temperate freshwaters and estuaries [J]. Aquatic Botany, 1991, 41(1—3): 137—175
[35]Sand-Jensen K, Borum J. Epiphyte shading and its effect on photosynthesis and diel metabolism of Lobelia dortmanna, L. during the spring bloom in a Danish lake [J]. Aquatic Botany, 1984, 20(1—2): 109—119
EFFECTS OF PHOSPHORUS AND CO2ON PHOTOSYNTHESIS PHYSIOLOGICAL OF VALLISNERIA NATANS
HAN Yan-Qing1,2, LIU Xin1, HU Wei-Ping1, ZHANG Ping-Jiu2and DENG Jian-Cai1
(1. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China; 2. The College of Territorial Resources and Tourism, Anhui Normal University, Wuhu 241003, China)
In order to evaluate the impact of changes in atmospheric and water environment on aquatic plants, we study the photosynthesis physiological of V. natans under different phosphorus and CO2. The results showed that the fluorescence Vj、Moof V. natans reduced when the concentration of phosphorus in the water was at a high level, but the ABS/CSo, DIo/CSo, TRo/CSo, RC/CS and PETincreased at the same time; high concentration of CO2significantly reduced Vj, ABS/RC, DIo/RC, ABS/CSoand DIo/CSoof V. natans, but improved the level of ψo, φEo, ETo/RC, PIABS, Fv/Fm, PTRand PET. There was a significant impact of phosphorus and CO2on Vj, Mo, ψo, TRo/CSoand RC/CS of V. natans. The change of phosphorus and CO2concentration could significantly affect the photosynthetic physiological of V. natans; high concentration of CO2can improve the performance of photosynthesis of V. natans leaves by promoting photochemical propertieselectron, transfer process and optimizing the distribution of energy among PSⅡ; while high concentration of phosphorus have significant promotion on the donor and acceptor of PSⅡ, and it also improved the electron transfer properties of V. natans. Moreover, there was an interaction of phosphorus and CO2on photosynthetic physiological of V. natans.
Vallisneria natans; Phosphorus; CO2; Photosynthesis physiological
Q178.1
A
1000-3207(2017)05-1097-09
10.7541/2017.137
2016-07-14;
2017-05-17
国家自然科学基金(41271213和41230853); 国家水体污染控制与治理科技重大专项(2014ZX07101-011); 中国科院重点部署项目(KZZD-EW-10)资助 [Supported by the National Natural Science Foundation of China (41271213, 41230853); State Water Pollution Control and Management Technology Major Projects (2014ZX07101-011); the Key Deployment Project of Chinese Academy of Sciences (KZZD-EW-10)]
韩燕青(1991—), 男, 江苏宿迁人; 硕士研究生; 主要研究方向为水生植物生态学。E-mail: 564795549@qq.com
邓建才, 副研究员; E-mail: jcdeng@niglas.ac.cn

