LED蓝光治疗创伤性感染伤口的疗效观察
罗 梅,王秀薇,胡 盼,向 勤,胡艳红
·经验交流·
LED蓝光治疗创伤性感染伤口的疗效观察
Effct of LED blue light in the treatment of traumatic wound infection
罗 梅,王秀薇,胡 盼,向 勤,胡艳红
研究LED蓝光治疗创伤性感染伤口的疗效。在常规清创换药治疗的基础上,采用蓝光照射治疗10d为1个疗程,照射1~2个疗程。照射1个疗程后,观察组转阴率明显升高,并随着干预时间的延长而增加,效果明显;伤口面积缩小,伤口愈合时间平均缩短6~7d,所有病例未出现伤口局部及全身的不良反应,值得推广。
创伤感染;伤口;LED蓝光;治疗
创伤是当今危害人类健康的重大疾患,在全球居第4位,创伤伤口感染是影响患者生存和生活质量的主要因素之一,但过度使用抗菌药物将增加内源性机会性感染的危险已成共识[1]。近年来,光动力治疗广泛应用于临床,有报道波长为405~470mm的蓝光具有广谱的抗菌作用,同时也能促进伤口愈合[2]。为此,大坪医院门诊伤口护理中心自2015年10月-2016年4月采用蓝光治疗创伤性感染伤口,效果满意。
临床资料
1 一般资料 入选患者41例(1例因治疗不足1周失访剔除),其中男性24例,女性16例;年龄25~64岁,平均45岁。伤口持续时间(从出现伤口到入选本研究的时间)25~56d,其中物理性创伤伤口28例(包括皮肤挫裂伤、烫伤和皮肤放射性损伤共24例,挤压伤1例和切割伤3例)称为A型,生物性创伤伤口12例(包括狗咬伤3例、蚊虫咬伤4例、猫咬伤2例、人咬伤3例) 称为B型, 伤口大小初诊时测量2.5cm×2.0cm~9.0cm×5.0cm。按首次换药的先后顺序编号后用电脑随机分为观察组和对照组,每组20例。两组患者的性别、年龄、伤口情况比较差异无统计学意义(P>0.05),具有可比性,见表1。
入选标准:按照创伤的定义[3]和创伤性伤口的分类[3]选择门诊伤口护理中心常见的物理性创伤伤口(如皮肤挫裂伤、机械切割伤口、挤压伤、烫伤、放射性损伤等),生物性伤口(动物或生物咬伤伤后),伤口深度至真皮层或以下,不及肌肉及骨骼、神经和肌腱组织,伤口面积≥2cm2,经细菌培养均存在不同程度感染,经常规清创、抗炎治疗3周以上未愈者,健康情况良好,无基础病。
排除标准:年龄<16岁或>75岁;严重的肝肾功能不全;有恶性肿瘤、免疫性疾病、糖尿病、低蛋白血症(血清白蛋白<30g/L);妊娠、哺乳期妇女,特异性感染伤口(结核、破伤风、真菌等)、动脉溃疡、不能按规定疗程接受治疗者。本研究获得医院伦理委员会授权批准,向患者解释研究目的取得同意并签署知情同意书。
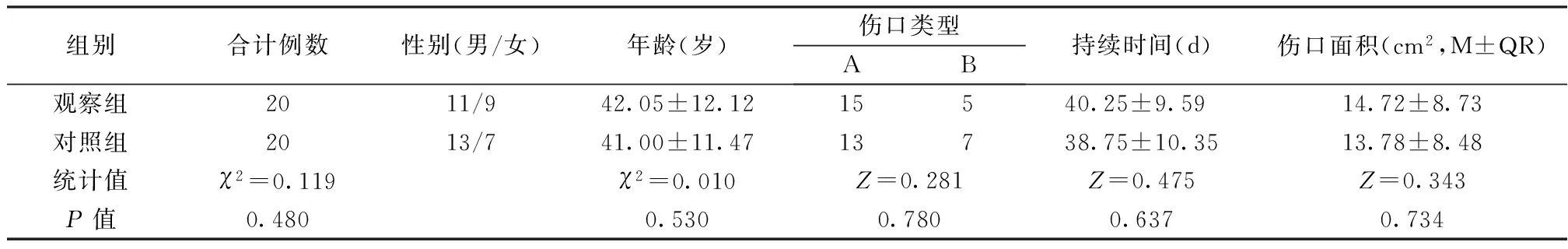
表1 两组患者的基本情况比较
2 伤口的局部治疗 伤口清创,剪去失活、坏死组织,生理盐水反复清洗伤口,并取伤口基底部组织做细菌培养;清创后伤口颜色为红色期予以照射干预。观察组采用蓝光治疗仪(型号GF-RB43-A,武汉光福生物医学工程有限公司生产) 照射伤口,蓝光波长465nm,光斑面积260cm2,照射时蓝光照射头与伤口垂直,距离10cm,照射时间20min,每日1次,光照中患者佩戴专门的护目镜。具体流程:安置舒适体位暴露伤口,揭开敷料即刻测量伤口面积与深度,生理盐水冲洗伤口,行伤口分泌物细菌培养,生理盐水再次冲洗伤口,干纱布拭干创面蓝光照射20min。移去光源, 根据伤口渗液量、组织颜色、气味和疼痛程度选择敷料,如伤口组织灰暗伴有大量渗液和异味,选用含银敷料抑制细菌生长和控制炎症反应;如伤口组织红润,渗液量少,无异味,则选用促进肉芽生长的敷料;设定10d为一疗程,照射1~2个疗程。对照组除不用蓝光照射外,换药方法同观察组直至伤口愈合。
3 观察指标
3.1 伤口分泌物细菌培养及鉴定 每组伤口在干预的第4、6、8、10天采用无菌技术用无菌旋涡式冲洗伤口或用无菌棉签清洗伤口后,去除表面腐肉或坏死组织,再用无菌棉签按“Z”字法从伤口一端至另一端均匀涂抹伤口基底渗液,进行细菌培养,依据分泌物细菌培养结果,比较两组患者治疗第4、6、8、10天的细菌转阴率。细菌转阴率=(初次细菌阳性例数-治疗后细菌阳性例数)/初次细菌阳性例数×100%。
3.2 伤口面积缩小率 每组伤口予干预的第4、6、8、10天采用直接测量技术测量伤口长和宽(cm)计算面积(cm2)和伤口面积缩小率。伤口面积缩小率=(初始面积-现有面积)/初始面积×100%。
3.3 伤口愈合时间 以伤口完全上皮组织覆盖,3%双氧水涂抹局部无氧化反应(阴性结果)为治愈标准,计算从入组第1天至伤口完全上皮化的时间。
3.4 不良反应 观察患者照射后局部皮肤有无瘙痒、皮疹、色素沉着等不适反应;眼睛是否干涩等不适现象。
4 统计学分析 采用SPSS 18.0统计软件进行分析,计量资料进行正态性检验和方差齐性检验,满足正态性者根据满足方差齐性与否使用独立样本t检验或t2检验,不满足正态性者使用秩和检验;计数资料及率的比较采用χ2检验,检验水准a=0.05。P<0.05为差异有统计学意义。
5 结果
5.1 两组伤口细菌转阴率比较 治疗前两组阳性率比较,差异无统计学意义(P>0.05);治疗第4、6、8、10天,两组转阴率比较差异明显,具有统计学意义(P<0.05),见表2。
5.2 两组患者各时间点创面面积缩小率比较 用创面面积缩小率来代替创面面积缩小情况,在第4、6、8、10天,两组创面面积缩小百分比差异有统计学意义(P<0.01),从表3可以看出,观察组伤口面积缩小率明显高于对照组(干预主效应P<0.01),表明LED蓝光照射观察组能有效促进创面缩小,随着时间的变化,组内面积缩小百分比率差异有统计学意义,干预因素和时间因素之间存在交互作用,见表3。
5.3 两组患者创面完全愈合时间比较 观察组患者创面完全愈合时间为(16.3±3.6)d,与对照组(23.5±4.05)d相比,差异有统计学意义(P<0.05)。
5.4 安全性评价 在干预期间,所有病例未出现伤口局部及全身的不良反应。
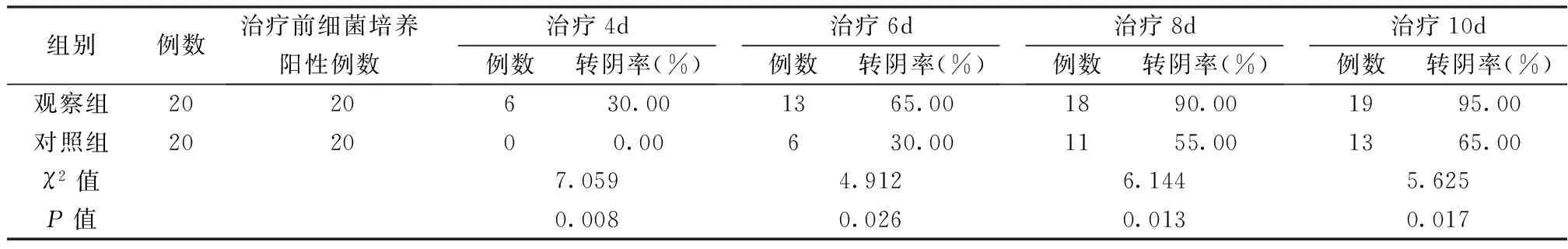
表2 两组伤口细菌转阴率比较
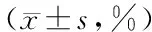
表3 两组患者各时间点创面面积缩小率比较
两组比较干预主效应F=77.788,P=0.000;时间主效应F=886.836,P=0.000;交互效应F=48.946,P=0.000;与对照组比较:aP<0.01
讨 论
创伤性感染伤口为难治性伤口,伤口细菌的定值和感染是影响伤口愈合的重要因素之一,由于抗生素的筛选作用,伤口多合并多重耐药菌感染,感染难以控制,愈合时间长,长期换药给患者带来身体和精神上的痛苦,如何有效干预是伤口处理中亟待解决的问题,寻找特定情景下的抗生素替代疗法具有重要意义。
LED蓝光是波长405~470nm的可见光,能直接将电能转化为光能的光源,蓝光杀菌机制与激活细菌内源生成的光敏卟啉有关[4]。 Hamblin等[5]用蓝光照射幽门螺旋杆菌的7个菌株,杀菌率为99.9%,蓝光还广泛应用于痤疮和新生儿黄疸的治疗。Maclean等[6]的研究发现蓝光能杀灭革兰氏阳性和革兰氏阴性菌。本研究对蓝光对细菌转阴率的影响进行了观察,研究结果显示,观察组用蓝光干预第4天,有6例转阴,转阴率为30.0%,而对照组转阴率为0,并随着干预时间的延长,蓝光对细菌生长的抑制作用逐渐增强,观察组转阴率明显升高,第10天达到95%,两组比较差异有统计学意义(P<0.05)。由此可见,蓝光可有效杀灭创伤性感染伤口细菌,且杀菌局限在细菌感染区域,不会影响其他的非感染部位。蓝光的辐射强度可以很好地调整和监控,相对于抗生素来说,有很好的安全性[7]。光抗菌机制有别于紫外线,对正常组织细胞几乎无毒性[8]。刘娜等[9]用蓝光照射对健康人体昼夜节律的影响,同时评价其安全性,发现蓝光对健康受试者生物节律的影响有效且安全。
蓝光照射可以促进伤口愈合[7]。万睿等[10]采用波长465nm的蓝光对11例MRAS(耐药金黄色葡萄糖球菌)感染的难愈性创面患者进行照射,结果11例患者创面均完全愈合。本研究采用随机对照的方法,观测蓝光对创伤性感染伤口的影响,结果显示,观察组在蓝光干预的不同时间段伤口面积缩小率明显高于对照组(干预主效应P<0.01),并随着治疗时间的延长,伤口面积缩小率明显增加,可推测与蓝光的杀菌与抑菌有关。两组愈合时间相比,观察组比对照组提前6~7d,伤口愈合速度较对照组明显加快(P<0.05),这与其他研究[11]结果相似,分析原因可能因为蓝光杀灭了伤口定植菌,伤口局部炎症反应减轻,白细胞及细菌对上皮细胞的破坏作用减少,间接促进了伤口愈合。
总之,LED蓝光治疗创伤性感染伤口是一种可行而有效的新方法,照射治疗安全、无毒副作用,且能减少抗生素使用,防止耐药菌产生,并能促进伤口愈合。但是,由于病种分布局限,样本偏少,对细菌学研究不够深入,未来需要扩大样本量进一步研究蓝光杀菌效果及促进伤口愈合的作用机制。
[1] Lazarus HM,Fox J,Lloyd JF,et al.A six-year descriptive study of hospital-associated infection in trauma patients:demographics,injury fetures,and infection pattems[J].Surg Infect,2007,8(4):463-473.
[2] Adamskaya N,Dungel P,Mittermayr R,et al.Light therapy by blue LED improves wound healing in an excision model in rats[J]. Injury,2011,42(9):917-921.
[3] 蒋琪霞,李晓华,彭青,等.三乙醇胺湿敷创伤性伤口的减痛效果研究[J].医学研究生学报,2012,25(1):64-66.
[4] Nitzan Y,Kauffman M.Endogenous porphyrin production in bacteria by aminolaevulinic acid and subsequent bacterial photoeradication[J].Lasers Med Sci,1999,14(4):269-277.
[5] Hamblin MR,Viveiro SJ,Yan GC,et al.Helicobacter pylori accumulates photoactive porphyrins and is killed by visible light[J].Antimicrob Agents Chemother,2005,49(7):2822-2877.
[6] Maclean M, MacGregor SJ,Anderaon JG,et al.Inactivation of bacterial pathogens following exposure to light form a 405-nanometer light-emitting diode array[J]. Appl Environ Microbiol,2009,75(7):1932-1937.
[7] Fuku TM,Yoshiok AM,Satomur AK,et al.Specific-wavelength visible light irradiation inhibits bacterial growth of porpbyromonas gingiralis[J].J Periodontal Res,2008,43(2):174-178.
[8] Dai T,Gupta A,Murray CK,et al.Blue light for infectious diseases: propionibacterium acnes,helicobactepylori,and beyond[J].Drug Resist Updat,2013,15(4):223-236.
[9] 刘娜,张楠,文冰亭,等.单色LED蓝光照射对健康人体昼夜节律的影响[J].中国组织工程研究与临床康复,2009,13(30):5923-5926.
[10] Dai T,Gupta A,Murrag CK,et al.Blue light for infectious diseases: propionibacteriuma,Helicobacterpylori,and beyond[J].Drug Resistance Updates,2012,15(4):223-236.
[11] 万睿,庞星原,欧阳山蓓,等.LED蓝光照射治疗MRSA感染创面的临床研究[J].中国美容医学,2014,23(7):554-555.
(本文编辑:郭 卫)
1009-4237(2017)09-0629-03
400042 重庆,第三军医大学大坪医院野战外科研究所门诊伤口护理中心
王秀薇:Email:papaioy@126.com
R 63
B
10.3969/j.issn.1009-4237.2017.08.022
2016-04-29;
2017-05-25)

