miR-133b介导食管鳞癌细胞的失巢凋亡
曾 薇,朱金峰,单 莉*
(新疆医科大学附属肿瘤医院1.肺内科一病区;2.胃肠外科,新疆 乌鲁木齐 830011)
·实验研究·
miR-133b介导食管鳞癌细胞的失巢凋亡
曾 薇1,朱金峰2,单 莉1*
(新疆医科大学附属肿瘤医院1.肺内科一病区;2.胃肠外科,新疆 乌鲁木齐 830011)
目的 研究探讨miR-133b在人食管鳞癌细胞失巢凋亡中的作用。方法 人食管鳞癌细胞KYSE150、KYSE450培养,细胞转染miR-133b mimic,细胞凋亡实验检测上述细胞转染miR-133b mimic对细胞失巢凋亡的影响。结果 人食管鳞癌细胞KYSE150、KYSE450转染miR-133b mimic,可显著上调细胞中miR-133b在转录水平的表达,并促进细胞失巢凋亡的发生。结论 人食管鳞癌细胞中过表达的miR-133b可以降低细胞失巢凋亡抵抗。
食管鳞癌;miR-133b;失巢凋亡
转移是食管鳞癌等大多数实体肿瘤引发死亡的首要原因,防止肿瘤细胞的转移、扩散是提高食管鳞癌患者生存率的一项重要手段目前研究发现,失巢凋亡(Anoikis)与肿瘤的转移和存活过程密切相关。失巢凋亡是一种细胞的程序性死亡,当细胞与邻近细胞或细胞外基质发生接触脱离时,通过线粒体或细胞表面死亡受体途径而诱导发生的[1]。目前研究发现miRNAs与肿瘤的失巢凋亡过程相关[2-3]。miRNAs是一类长度为18~25 nt的调控性的非编码单链小分子RNA[4],通过抑制靶mRNA翻译或诱导靶mRNA降解,参与肿瘤的发生、发展、侵袭、转移过程。Kano等研究发现,在食管鳞癌组织中miR-133b的表达下调,提示miR-133b可能作为抑癌基因,参与食管鳞癌的发生、发展过程。Fu等研究报道,在食管鳞癌组织中呈低表达的miR-133b与肿瘤的淋巴结转移、浸润深度呈负相关,并预测miR-133b可作为食管鳞癌治疗的潜在靶点。但是,目前对于miR-133b在食管鳞癌失巢凋亡的作用尚不完全清楚,本文将对此进行初步的研究、探讨。
1 材料与方法
1.1 材料
①细胞:人食管鳞癌细胞KYSE150、KYSE450均购自ATCC细胞库。②试剂:DMEM培养基、FBS、PBS、Trypsin Solution(美国Gibco公司),Lipofectamine 2000(美国Invitrogen公司),Annexin V-FITC/PI细胞凋亡检测试剂盒(美国ThermoFisher Scientific公司),miR-133bmimic、scramble(购自美国Life Technologie公司)。
1.2 方法
1.2.1 细胞培养
人食管鳞癌细胞KYSE150、KYSE450置于含100 U/ml青霉素和100 μg/ml链霉素的90%DMEM和10%胎牛血清中,在5% CO2、37℃、饱和湿度条件下培养。倒置显微镜下观察细胞生长情况,隔日更换培养液。当细胞生长达90%汇合时,用0.25%胰酶对细胞进行消化传代。
1.2.2 细胞转染
转染前一天,胰酶消化人食管鳞癌细胞KYSE150、KYSE450并计数,细胞铺板,待细胞融合至50%~80%时进行转染;使用250 μl无血清DMEM培养基稀释4.0 μg质粒;使用250 μl DMEM培养基稀释10 μl Lipofectamine 2000试剂;混合稀释的质粒与稀释的Lipofectamine 2000,在室温下孵育20 min;加入混合物,摇动培养板,轻轻混匀;在37℃,5%的CO2中培养4 h后更换培养基,继续培养48 h后,收集细胞进行检测。
1.2.3 miR-133b的表达检测
查找目的基因序列,设计引物(见表1);Trizol法提取细胞的总RNA;甲醛变性的琼脂糖凝胶电泳法检测总RNA的完整性;紫外分光光度计测定RNA的含量(A260值)和纯度(A260/A280比值);逆转录合成cDNA;以cDNA为模板,进行定量PCR;扩增结束后分析溶解曲线;扩增产物进行琼脂糖凝胶电泳分析特异性;每个样本中miRNA含量是指它与同标本中U6 snRNA的相对量,依据公式2-ΔCt计算得到。

表1 qRT-PCR实验引物序列
1.2.4 失巢凋亡的诱导
PolyHEMA以终浓度为20 mg/ml溶于95%的乙醇,65℃水浴至溶解;按lml孔铺好六孔板,晾干备用;将消化好的细胞置于铺有PolyHEMA的六孔板中进行悬浮培养,以模拟细胞脱离邻近细胞或细胞外基质的状态,诱导细胞发生失巢凋亡。
1.2.5 细胞失巢凋亡检测
人食管鳞癌细胞KYSE150、KYSE450转染miR-133b mimic、scramble 24 h后继续悬浮培养18 h;用不含EDTA的胰酶消化收集上述各组细胞;使用预冷1×PBS洗涤细胞;使用1×Binding Buffer悬浮细胞;加入Annexin V-FITC,避光室温孵育15 min;上机前进行PI标记,流式细胞仪检测各组细胞的凋亡情况。
1.3 统计学方法
采用SPSS 20.0统计软件进行统计学分析,计量资料以±s表示,各组间均数比较采用t检验或方差分析,检验水准α=0.05。以P<0.05为有统计学意义。
2 结 果
2.1 人食管鳞癌细胞中miR-133b的表达
人食管鳞癌细胞KYSE150、KYSE450分别转染miR-133b mimic、scramble作为实验组和对照组。人食管鳞癌细胞KYSE150,实验组中miR-133b mRNA相对表达量为1.77±0.07,对照组为0.86±0.06,两组比较P<0.01,见表2。人食管鳞癌细胞KYSE450,实验组中miR-133b mRNA相对表达量为1.77±0.05,对照组为0.83±0.05,两组比较P<0.01,见表2、表3。
表2 miR-133b在人食管鳞癌细胞KYSE150中的表达(±s)

表2 miR-133b在人食管鳞癌细胞KYSE150中的表达(±s)
2-ΔΔCT t P实验组 1.77±0.07 16.71 <0.01对照组 0.86±0.06
表3 miR-133b在人食管鳞癌细胞KYSE450中的表达(±s)

表3 miR-133b在人食管鳞癌细胞KYSE450中的表达(±s)
分组 2-ΔΔCTt P实验组 1.77±0.05 23.50 <0.01对照组 0.83±0.05
2.2 miR-133b促进食管鳞癌细胞失巢凋亡
人食管鳞癌细胞KYSE150、KYSE450转染miR-133b mimic、scramble 24 h后继续悬浮培养18 h,采用Annexin/PI双染法对细胞失巢凋亡进行检测。scramble/KYSE150悬浮组细胞失巢凋亡率为51.00±3.61,miR-133b mimic/KYSE150悬浮组细胞失巢凋亡率为61.67±1.53,两组比较P<0.01; scramble/KYSE450悬浮组细胞失巢凋亡率为50.67±3.21,miR-133b mimic/KYSE450悬浮组细胞失巢凋亡率为63.33±6.03,两组比较P<0.05;结果表明,上调miR-133b的表达能明显促进食管鳞癌细胞失巢凋亡的发生,见表4。
表4 miR-133b促进食管鳞癌细胞凋亡(±s)
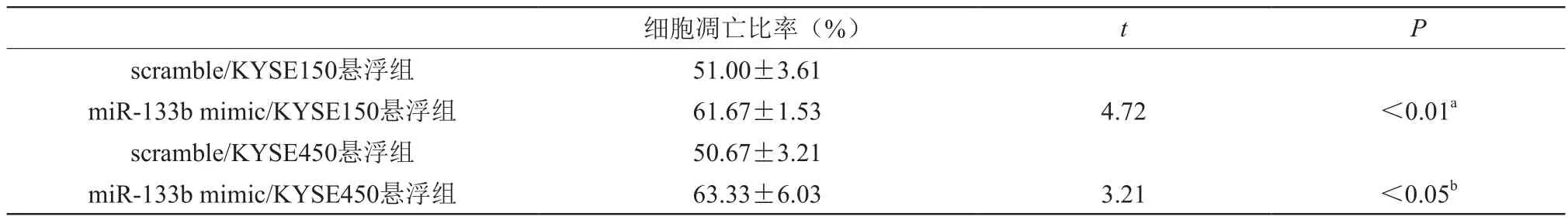
表4 miR-133b促进食管鳞癌细胞凋亡(±s)
注:a:scramble/KYSE150悬浮组vs miR-133b mimic/KYSE150悬浮组;b:scramble/KYSE450悬浮组 vs miR-133b mimic/KYSE450悬浮组
细胞凋亡比率(%) t P scramble/KYSE150悬浮组 51.00±3.61 miR-133b mimic/KYSE150悬浮组 61.67±1.53 4.72 <0.01ascramble/KYSE450悬浮组 50.67±3.21 miR-133b mimic/KYSE450悬浮组 63.33±6.03 3.21 <0.05b
3 讨 论
肿瘤转移是指肿瘤细胞从原发部位脱落,进入血液循环中并得以存活,形成循环肿瘤细胞(circulating tumor cells,CTCs),到达远处器官并不断增殖,最终形成转移灶。目前研究发现,肿瘤细胞脱离原发灶侵袭入血循环后产生抵抗失巢凋亡是其发生转移的关键步骤。失巢凋亡是指细胞脱离原来的生长部位,失去细胞与细胞,细胞与细胞外基质之间的黏附,从而发生的一种程序化死亡。正常细胞和大多数肿瘤细胞在脱离原发灶之后,由于丧失了周围细胞黏附和赖以生存的细胞基质都会发生失巢凋亡。然而,部分肿瘤细胞在脱离原发灶进入血液循环后,可以通过多种途径获得抵抗失巢凋亡的能力,肿瘤细胞才有机会与血管内皮进行黏附,从血管壁渗出并进入周围基质,最终在新的环境下形成转移灶。因此,对肿瘤细胞抗失巢调往的生物学机制进行研究,对于了解肿瘤转移过程至关重要。在本研究中,我们发现与转染scramble相比,人食管鳞癌细胞转染miR-133b mimics可以显著上调miR-133b在转录水平的表达。接着,我们通过在铺有PolyHEMA的六孔板中对细胞进行悬浮培养,来模拟食管鳞癌细胞与邻近细胞脱离的状态,诱导食管鳞癌细胞发生失巢凋亡,并采用Annexin/PI双染法对细胞的失巢凋亡进行检测。结果发现,与转染scramble相比,转染miR-133b mimic上调miR-133b的表达,可显著提高食管鳞癌细胞发生失巢凋亡的比率。提示在食管鳞癌中,过表达的miR-133b可以促进脱离邻近细胞或细胞外基质的食管鳞癌细胞发生失巢凋亡,减少食管鳞癌细胞的失巢凋亡抵抗,对肿瘤的转移起到负向调控的作用,提示miR-133b可能作为今后食管鳞癌的诊疗靶点之一。
[1] Grossmann J.Molecular mechanisms of detachmentinduced apoptosis—Anoikis[J].Apoptosis,2002,7(3):247-260.
[2] Liu Y,Zhang Y,Wu H,et al.miR-10a suppresses colorectal cancer metastasis by modulating the epithelial-to-mesenchymal transition and anoikis[J].Cell Death Dis,2017,8(4):e2739.
[3] Wei JL,Li YC,Ma ZL,et al.MiR-181a-5p promotes anoikis by suppressing autophagy during detachment induction in the mammary epithelial cell line MCF10A[J].Protein Cell,2016,7(4):305-9.
[4] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2),281-297.
本文编辑:吴 卫
R735.1
B
ISSN.2095-8242.2017.30.5743.02
新疆维吾尔自治区自然科学基金(项目编号:2015211C137)
单莉,E-mail:shanlinew319@163.com

