离子交换树脂提取纯化杆菌肽的工艺优化
冷 凤,张 炜,田 威,张雪霞*
(1.沈阳药科大学,辽宁 沈阳 110016;2.华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心 河北省工业微生物代谢工程技术研究中心,河北 石家庄 050015)
离子交换树脂提取纯化杆菌肽的工艺优化
冷 凤1,2,张 炜2,田 威1*,张雪霞2*
(1.沈阳药科大学,辽宁 沈阳 110016;2.华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心 河北省工业微生物代谢工程技术研究中心,河北 石家庄 050015)
首先比较了732、HZ016、D152、HD-2、D061、D001-CC、D296、D301等8种不同类型的离子交换树脂对发酵液中杆菌肽的吸附和解吸效果,选出适合提取纯化杆菌肽的树脂;然后以交换容量和洗脱收率为指标,对交换pH值、交换流速和洗脱条件进行优化。结果表明,大孔强酸型阳离子交换树脂D061对杆菌肽的纯化效果较好;最佳工艺条件为:交换pH值5.0~6.0,交换流速2.5 BV·h-1,先用0.5%氨水以流速0.5 BV·h-1洗脱2倍树脂体积,再用3.5%氨水洗脱3倍树脂体积,在此条件下,洗脱液中杆菌肽A含量可达66.2%,杆菌肽洗脱收率可达91%以上。所得洗脱液串联凝胶型001X4阳离子交换树脂柱进行脱盐处理,再经过脱色、萃取、结晶、干燥等精制步骤可得到生物效价高于74 U·mg-1的医药级杆菌肽原料药。该工艺简单可行,收率稳定,纯化效率高,为工业化生产杆菌肽奠定了理论基础。
发酵液;杆菌肽;离子交换树脂;提取纯化;工艺优化
杆菌肽(bacitracin),又名崔西杆菌素、枯草菌肽和亚枯草菌素,是一种多肽类抗生素。杆菌肽有多种异构体,包括杆菌肽A、A1、B1、B2、B3、C1、C2、C3、D、E、F、G等不同组分[1],其中杆菌肽A的生物活性最高。杆菌肽最初的产生菌为地衣芽孢杆菌(Bacillus licheniformis)[2],目前杆菌肽主要由特雷斯氏枯草杆菌(Bacillus subtilis)和地衣芽孢杆菌发酵产生。杆菌肽的抑菌作用较强,能够较好地抑制革兰氏阳性菌(G+)和革兰氏阴性菌(G-),如金黄色葡萄球菌、链球菌[3]。由于杆菌肽全身用药时具有肾毒性,在临床上应用受到限制,仅限于治疗由耐受青霉素的G+菌引起的耳、鼻、喉、眼、皮肤及口腔等局部感染[4]。美国药典对医药级杆菌肽各组分含量有严格的规定,其中杆菌肽A含量不低于40%,杆菌肽B1、B2、B3、A含量之和不低于70%,杆菌肽F含量不高于6%。国产品由于达不到国外药典标准,多用作动物饲料添加剂,大多应用于仔猪、生长猪、种猪、肉鸡、蛋鸡及鸭,在牛、羊等反刍动物以及火鸡、鸵鸟等特种动物上也可使用[5],在水产动物中也有良好的作用效果[6]。此外,杆菌肽还可用作生物表面活性剂、食品防腐剂及生物学的研究手段[7]。
国内关于杆菌肽在畜禽饲养方面应用的文献较多,但是关于提取工艺方面的报道很少。郭淑琴等[8]用离子交换法提取杆菌肽,所得产品生物效价仅为54U·mg-1。刘咏[9]用膜分离技术精制杆菌肽锌盐,所得产品生物活性也较低。国外对杆菌肽纯化工艺研究较多,有吸附法[10]、沉淀法[11]、离子交换法[12-13]和有机溶剂萃取法[14-15]等。这些方法大多存在所得产品生物效价低、总收率低、使用大量有毒试剂对环境造成污染等缺点。
作者比较了不同类型的离子交换树脂对发酵液中杆菌肽的吸附和解吸效果,筛选出适合提取纯化杆菌肽的树脂;并通过对交换条件和洗脱条件进行优化,确定最佳工艺条件,拟为工业化生产杆菌肽提供理论依据。
1 实验
1.1 材料、试剂与仪器
杆菌肽发酵液由华北制药集团研发中心发酵岗位提供。
苯乙烯系阳离子交换树脂732、HZ016,上海华震科技有限公司;大孔弱酸型阳离子交换树脂D152、HD-2,阴离子交换树脂D296、D301,天津波鸿树脂科技有限公司;大孔强酸型阳离子交换树脂D061、D001-CC,凝胶型阳离子交换树脂001X4,天津南开大学树脂厂;乙腈(色谱纯),美国Merck公司;杆菌肽标准品、去离子水,自制;其它试剂均为市售国产分析纯。
pH计,梅特勒-托利多公司;循环水式多用真空泵、SXJQ-1型机械搅拌仪,郑州长城科工贸有限公司;高效液相色谱仪,日本岛津公司;BS-30A型自动收集器,上海沪西分析仪器有限公司;恒温电磁搅拌器,上海雷磁创益仪器仪表有限公司。
1.2 色谱条件
色谱柱:Agilent C18(4.6 mm×250 mm,5 μm);流动相:A为0.05 mol·L-1KH2PO4和0.05 mol·L-1K2HPO4·3H2O的水溶液,B为80 mL乙腈和1 040 mL甲醇混合溶液,A∶B=40∶60(体积比);流速:1.2 mL·min-1;柱温:30 ℃;检测波长:杆菌肽A 254 nm,杆菌肽F 300 nm。
1.3 方法
1.3.1 发酵液的预处理
向杆菌肽发酵液中加入2%珍珠岩,搅拌10 min,真空抽滤,得杆菌肽滤液,采用HPLC法测定其效价,备用。
1.3.2 离子交换树脂的筛选
1.3.2.1 离子交换树脂的预处理与再生
新购树脂置于烧杯中,用乙醇浸泡12 h,用去离子水反复洗涤至上清液无色无异味。用4倍树脂体积的1 mol·L-1HCl溶液浸泡4 h,倾去上清酸液,用去离子水反复洗涤至中性;再用4倍树脂体积的1 mol·L-1NaOH溶液浸泡4 h,倾去上清碱液,用去离子水反复洗涤至中性,备用。离子交换树脂的物理参数见表1。
表1 离子交换树脂的物理参数

Tab.1 Physical parameters of ion exchange resins
1.3.2.2 树脂静态吸附率和解吸率的测定
取预处理好的8种湿树脂各10 mL置于250 mL三角瓶中,加入120 mL杆菌肽滤液于室温下电磁搅拌过夜,达到吸附平衡后采用HPLC法测定吸附残液效价,计算静态吸附率。将吸附饱和的树脂滤去残液,用去离子水洗涤后,分别加入3%氨水80 mL静置过夜,取上清液测定杆菌肽效价,并计算解吸率。
1.3.2.3 树脂D061和D001-CC的吸附动力学曲线
取处理好的湿树脂D061和D001-CC各10 mL置于500 mL三角瓶中,加入200 mL杆菌肽滤液于室温下电磁搅拌,每隔10 min取样一次,采用HPLC法测定吸附残液效价,计算吸附率,绘制2种树脂的吸附动力学曲线。
1.3.3 交换pH值的选择
pH值是影响离子交换平衡的一个重要因素。pH值会影响溶液中物质的带电性,也会影响离子交换树脂的交换容量。取7份杆菌肽滤液各200 mL,分别调节pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0。取7份处理好的湿树脂D061各10 mL,置于500 mL三角瓶中,分别加入不同pH值的杆菌肽滤液,室温下电磁搅拌进行交换,直至达到平衡,采用HPLC法测定吸附残液效价,计算树脂静态交换容量。
1.3.4 交换流速的选择
取5份处理好的湿树脂D061各100 mL,装5根相同的离子交换柱,柱子径高比为1∶6。调节杆菌肽滤液pH值为6.0,上样,分别控制流速为1.0 BV·h-1、1.5 BV·h-1、2.0 BV·h-1、2.5 BV·h-1、3.0 BV·h-1,当出口液杆菌肽浓度接近上样液浓度5%时停止上样,计算不同流速下树脂D061的动态交换容量。
1.3.5 洗脱液浓度的选择
调节杆菌肽滤液pH值为6.0,以最佳交换流速上5根D061树脂柱至平衡。用去离子水以2.0 BV·h-1流速洗2倍柱体积,洗去水溶性杂质和色素。分别配制浓度为0.5%、1.5%、2.5%、3.5%、4.5%氨水以0.5 BV·h-1流速洗脱树脂柱,柱底端串联凝胶型001X4阳离子交换树脂柱进行脱盐,采用HPLC法测定洗脱液中杆菌肽效价低于40 U·mL-1时停止洗脱。比较洗脱效果及洗脱收率。
1.3.6 洗脱流速的选择
调节杆菌肽滤液pH值为5.5,以最佳交换流速上4根D061树脂柱至平衡,用去离子水洗2倍柱体积,配制3.5%氨水,分别控制流速为0.25 BV·h-1、0.5 BV·h-1、1.0 BV·h-1、1.5 BV·h-1进行洗脱。用自动收集器收集洗脱液,每瓶25 mL,采用HPLC法测定洗脱液中杆菌肽效价。
2 结果与讨论
2.1 离子交换树脂的筛选结果
2.1.1 树脂静态吸附率和解吸率测定结果(图1)
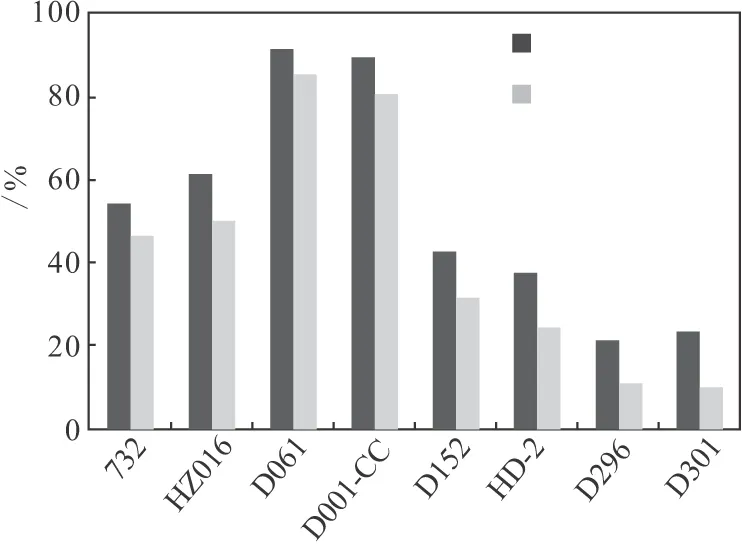
图1 树脂对杆菌肽的静态吸附率和解吸率
由图1可知,各种类型的离子交换树脂对杆菌肽的吸附能力和解吸能力大小顺序为D061>D001-CC>HZ016>732>D152>HD-2>D301>D296。树脂D061和D001-CC的静态吸附率和解吸率都较高,原因是二者都为强酸型阳离子交换树脂,杆菌肽易与树脂上阳离子进行交换,其次二者都有大孔吸附性,杆菌肽较易进入树脂内部发生交换。因此,初步选择D061和D001-CC从吸附动力学角度做进一步的比较。
2.1.2 树脂D061和D001-CC的吸附动力学曲线(图2)
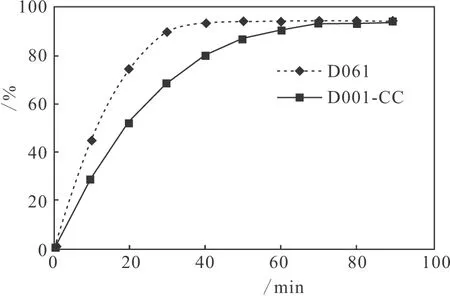
图2 树脂D061和D001-CC的吸附动力学曲线
由图2可知,D061和D001-CC的吸附率相差不大,但是D061的吸附速度比D001-CC快;而且从图1可知D061的解吸率比D001-CC要略高一些,因此选择树脂D061提纯发酵液中的杆菌肽。
2.2 交换pH值的确定
树脂D061对不同pH值杆菌肽滤液的静态交换容量见图3。
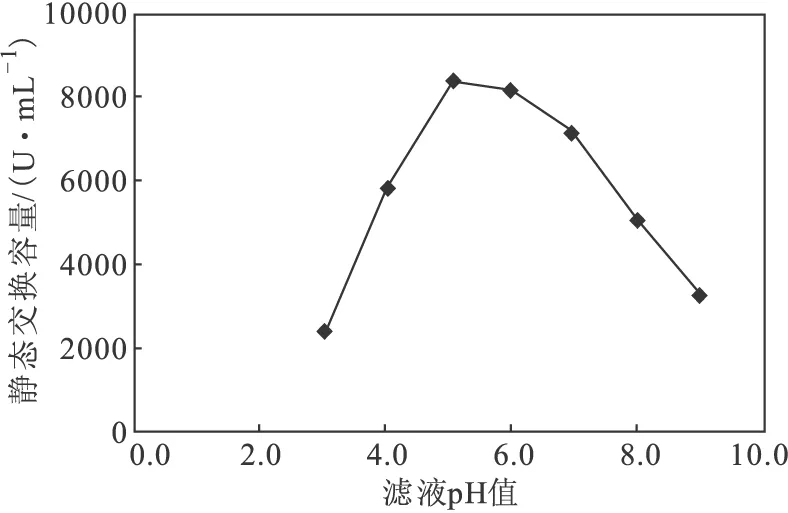
图3 树脂D061对不同pH值滤液的静态交换容量
由图3可知,杆菌肽滤液pH值在5.0~6.0之间时,树脂D061的静态交换容量较高。因此,确定最佳交换pH值为5.0~6.0。
2.3 交换流速的确定
交换流速对树脂D061动态交换容量的影响见图4。

图4 交换流速对树脂D061动态交换容量的影响
由图4可知,对树脂D061而言,交换流速不超过2.5 BV·h-1时,交换流速对动态交换容量的影响不大;流速过快(3.0 BV·h-1),动态交换容量明显降低。综合考虑,确定最佳交换流速为2.5 BV·h-1。
2.4 洗脱液浓度的确定
由于D061是大孔强酸型阳离子交换树脂,交换条件偏弱酸性,宜选用弱碱性的氨水作为洗脱剂[16]。不同浓度氨水的洗脱情况见表2。
由表2可知,1.5%、2.5%氨水对树脂D061的洗脱收率低,拖尾严重;而4.5%氨水浓度过高,会破坏原料,收率也较低;当氨水浓度为3.5%时,不仅解吸集中,洗脱收率还较高。另外发现,0.5%氨水虽然没有解吸能力,但是可以洗下一些杂质和色素。因此,确定解吸流程为:先用0.5%氨水洗脱2倍树脂体积,再用3.5%氨水洗脱3倍树脂体积。
表2 不同浓度氨水的洗脱情况

Tab.2 Elution conditions by different concentrations of ammonia
2.5 洗脱流速的确定
洗脱流速对效价影响见图5,洗脱流速对杆菌肽A含量和洗脱收率的影响见表3。

图5 洗脱流速对效价的影响

表3 洗脱流速对杆菌肽A含量及洗脱收率的影响
由图5可知,洗脱流速慢,洗脱收率高,杆菌肽浓度集中;随着洗脱流速的加快,杆菌肽浓度不集中,出现拖尾现象。流速为0.25 BV·h-1时洗脱收率最高,解吸也最集中,但是由于流速较慢,洗下的杂质较多,HPLC图谱上显示主峰纯度并不好,其纯化效果较流速0.5 BV·h-1要低。综合考虑,确定最佳洗脱流速为0.5 BV·h-1。
2.6 树脂D061提取纯化杆菌肽的验证实验
按照实验筛选出的优化条件进行3批50 L发酵罐的小试实验,以验证工艺的可行性和稳定性。用2.5 L D061树脂柱从发酵液中提取纯化杆菌肽,调节杆菌肽滤液pH值为6.0,以流速2.5 BV·h-1上样;用5 L去离子水洗涤树脂柱,用0.5%氨水以洗脱流速0.5 BV·h-1洗脱2倍树脂体积,用3.5%氨水洗脱3倍树脂体积;洗脱液串联凝胶型001X4阳离子交换树脂柱进行脱盐,再经过脱色、萃取、结晶、干燥等后续精制步骤,得到杆菌肽原料药粉末,测定其生物效价。计算洗脱收率和提取总收率,结果见表4。
表4 小试工艺验证实验结果(n=3)

Tab.4 Verification experiment results of lab scale process(n=3)
由表4可知,采用树脂D061提取纯化杆菌肽,在最佳工艺条件下,洗脱收率可达91%以上,所得终产品生物效价超过74 U·mg-1,提取总收率超过60%。
3 结论
采用大孔强酸型阳离子交换树脂D061提取纯化杆菌肽发酵液,确定最佳交换条件为:杆菌肽滤液pH值5.0~6.0,流速2.5 BV·h-1;最佳洗脱条件为:先用0.5%氨水以流速0.5 BV·h-1洗脱2倍树脂体积,再用3.5%氨水洗脱3倍树脂体积。HPLC检测结果显示,面积归一化法计算洗脱液中主峰杆菌肽A的含量可达66.2%,达到纯化目的,洗脱收率可达91%以上,所得终产品的生物效价超过74 U·mg-1,物料体积缩小5~7倍,大大节省后续精制步骤中有机溶剂的使用量,为杆菌肽的精制打下基础,也为工业化生产医药级杆菌肽原料药提供理论依据。
[1] 周岩民,王龙昌.杆菌肽产品在动物饲料中的应用研究进展[J].饲料工业,2012,33(18):1-5.
[2] 胡立勇,宋友礼.杆菌肽的研究[J].国外药学抗生素分册,1988,9(1):55-64.
[3] 贺文庆.亚甲基水杨酸杆菌肽预混剂对鸭的促生长、靶动物安全性和残留消除研究[D].扬州:扬州大学,2014.
[4] 张小兵,闫静辉,李玉静.杆菌肽(锌)及其应用进展[J].畜牧与饲料科学,2009,30(6):170-172.
[5] 邱楚武.杆菌肽锌在饲料中的应用[J].饲料博览,2001(5):37-38.
[6] 张建刚,邓波波,朱建平,等.杆菌肽锌在动物生产中的应用[J].江西饲料,2011(6):31-33.
[7] 高艳秀.杆菌肽PBCA纳米粒滴眼剂的研制[D].延吉:延边大学,2012.
[8] 郭淑琴,魏景新.树脂吸附法提取杆菌肽的研究[J].沈阳化工,1985(1):3-8.
[9] 刘咏.抗生素杆菌肽锌脱色提纯工艺研究[D].天津:天津大学,2005.
[10] GOORLEY J T.Purification of bacitracin:US 2457887[P].1947-01-04.
[11] BATHORY J,ERY NEE N M,GEREI L,et al.Process for the recovery of zinc bacitracin free from zinc hydroxide:US 3937694[P].1976-02-10.
[12] WILLIAM B,HODDS G.Improvements in or relating to the production of bacitracin:GB 782999[P].1957-09-18.
[13] LOUIS C,CACHRANE T J.Recovery and concentration of bacitracin:US 2915432[P].1959-12-01.
[14] JOHNSON B A,ELENEY F L.Process for producing bacitracin:US 2498165[P].1950-02-21.
[15] SENKUS M,MARKUNAS P C.Recovery of bacitracin:US 2609324[P].1949-10-12.
[16] 顾觉奋.离子交换与吸附树脂在制药工业上的应用[M].北京:中国医药科技出版社,2008:101-102.
Optimization in Extraction and Purification of Bacitracin by Ionic Exchange Resin
LENG Feng1,2,ZHANG Wei2,TIAN Wei1*,ZHANG Xue-xia2*
(1.ShenyangPharmaceuticalUniversity,Shenyang110016,China;2.NewDrugResearch&DevelopmentCompanyofNCPC,NationalEngineeringResearchCenterofMicrobialMedicine,HebeiIndustryMicrobialMetabolicEngineering&TechnologyResearchCenter,Shijiazhuang050015,China)
Wefirstlycomparedtheadsorptionanddesorptionefficienciesofeightkindsofionicexchangeresins,namely732,HZ016,D152,HD-2,D061,D001-CC,D296,andD301onbacitracininfermentationbroth,andselectedthesuitableresinforextractionandpurificationofbacitracin.Then,weoptimizedexchangepHvalue,exchangeflowrate,andelutionconditionsbyusingexchangecapacityandelutionyieldasindexes.ResultsshowedthatmacroporousstrongacidcationexchangeresinD061wasthebestonetoextractandpurifybacitracin.Theoptimalprocessconditionswereasfollows:exchangepHvaluewas5.0~6.0,exchangeflowratewas2.5BV·h-1,eluting2timesoftheresinvolumewith0.5%ammoniawithflowrateof0.5BV·h-1firstly,theneluting3timesoftheresinvolumewith3.5%ammonia.Underaboveconditions,thecontentofbacitracinAineluentreached66.2%,andelutionyieldreachedover91%.Afterdesalinationbygeltypecationexchangeresin001X4,andfollowingpurificationstepssuchasdecolorization,extraction,crystallization,anddrying,weobtainedpharmaceuticalgradebacitracinwiththetiterof74U·mg-1.Theprocessiseasyandfeasiblewithstableyieldandhighpurificationefficiency,whichlaysatheoreticalfoundationforindustrialproductionofbacitracin.
fermentationbroth;bacitracin;ionicexchangeresin;extractionandpurification;processoptimization
河北省科技条件建设项目(169676404G)
2017-04-25
冷凤(1981-),女,黑龙江海林人,工程师,研究方向:微生物来源药物的分离、纯化、结晶,E-mail:214824557@qq.com;通讯作者:田威,副教授,E-mail:tianweiww@sina.com;张雪霞,教授级高级工程师,E-mail:zhangxuexiazxx@163.com。
10.3969/j.issn.1672-5425.2017.08.013
TQ028
A
1672-5425(2017)08-0063-05
冷凤,张炜,田威,等.离子交换树脂提取纯化杆菌肽的工艺优化[J].化学与生物工程,2017,34(8):63-67.

