肝癌人源肿瘤异种移植模型构建及初步应用
黄 昊,李宝亮,杨星九,李梦媛,朱瑞敏,胡娟娟,韦荣飞,李克娟, 蒋 力,高 苒*
研究报告
肝癌人源肿瘤异种移植模型构建及初步应用
黄 昊1#,李宝亮2#,杨星九1,李梦媛1,朱瑞敏1,胡娟娟1,韦荣飞1,李克娟1, 蒋 力2*,高 苒1*
人源肿瘤组织异种移植模型(patient-derived xenograft models,PDX)是指将病人的新鲜肿瘤组织或肿瘤细胞通过原位或异位等方式移植到免疫缺陷小鼠体内,依靠小鼠提供的环境生长的一种异种移植模型[1]。这种模型保留了原代肿瘤的微环境和组织病理学及遗传学特征,对于筛选抗癌药物以及预测患者疗效、毒副作用、吸收程度等具有重要意义[2]。此外,PDX模型可以保留原代病人肿瘤的特性,可以作为活体肿瘤用于保存和传代,为肿瘤学研究提供非常宝贵的研究标本。
肝癌是我国高发的,危害极大的恶性肿瘤,发病率和死亡率排名分别位居第三和第二位[3]。虽然近些年治疗手段的不断进步,但肝癌患者的总体生存率依然不高,原因在于肝癌患者早期诊断发现困难,多数患者在就诊时已为晚期,失去手术的机会,即使行手术治疗,术后复发率较高,且缺乏有效的复发治疗手段。因此,寻找对晚期肝癌和复发性肝癌有效的治疗手段,对延长肝癌患者的生存具有重要意义。
索拉非尼是一种新型多靶点抗肿瘤药物,可通过阻断由RAF/MEK/ERK介导的细胞信号传导通路而直接抑制肿瘤细胞的增殖,还可通过抑制VEGF和血小板衍生生长因子(PDGF)受体而阻断肿瘤新生血管的形成,间接地抑制肿瘤细胞的生长,具有双重的抗肿瘤作用[4]。索拉非尼作为肝癌中唯一被证实可用的分子靶向药,但其有效率仍不及50%,一半的患者对索拉非尼不敏感导致整体疗效欠佳,并且承受药物不良反应及巨大的经济负担[5, 6]。肝癌PDX模型保持了来源肿瘤的生物学特性,给筛选索拉非尼耐药病例提供较为合适的动物模型,为肝癌的精准治疗提供临床前研究平台。
1 材料和方法
1.1 实验动物及标本
5周龄SPF级雄性NCG小鼠60只,体重22 g,用于构建PDX模型,购自南京大学-南京生物医药研究院[SCXK(苏)2015-0001];5周龄SPF级雄性BALB/C裸鼠15只,体重16 g,用于PDX模型的药效评价,购自北京华阜康生物科技股份有限公司[SCXK(京)2014-0009],NCG小鼠和BALB/C裸鼠均饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2015-0035]。所有肝癌肿瘤标本来自首都医科大学附属北京地坛医院,所有动物实验通过了中国医学科学院医学实验动物研究所伦理委员会的批准[GR16002]。
药敏评价患者病例资料:患者男,44岁,主因“发现HbsAg(+)13年,发现肝占位性病变12 d。”由门诊以“原发性肝癌”于2016年7月收入院。2003年发现HbsAg(+),有肝功能异常,间断给予保肝治疗。2013年进展到肝硬化阶段,2015年11月腹部MR未见明确占位改变,2016年7月腹部MR提示肝右叶下段占位性病变,2.5 cm,T1呈低信号,T2呈高信号,腹部增强CT提示肝右叶下段见不规则低密度影,边界不清,增强扫描动脉期未见明显异常强化,门脉期呈低密度影,延迟期病变体积减小,考虑为原发性肝癌可能性大,入院后完善检查评估,并于2016年7月行肝右叶部分切除术、胆囊切除术及PDX模型制作,术后病理回报:肝细胞癌,中-低分化,部分细胞呈胆管细胞样分化,慢性胆囊炎。恢复顺利出院,2016年8月开始持续口服索拉非尼,每次0.4 g(2×0.2 g),每日两次,温开水吞服。2017年1月和2月分别发现肝S7段占位及肝右叶占位,分别给予肝癌射频消融术及肝癌TACE(transcatheter arterial chemoembolization)术,介入后复查PET-CT发现腹腔淋巴结转移,索拉非尼疗效评价结果为疾病进展(progressive disease, PD)。
1.2 主要试剂
RPMI-1640培养基、胎牛血清购自美国Gibco公司;戊巴比妥钠购自美国Sigma公司;5-氟尿嘧啶0.25 g/10 mL购自天津金耀氨基酸有限公司;甲磺酸索拉非尼片(简称索拉非尼)购自德国拜耳公司;肿瘤组织解离试剂盒(130-095-929)购自德国美天旎生物技术有限公司。
1.3 实验方法
1.3.1 人肝癌PDX模型的建立方法
临床肝癌患者手术切除组织标本离体后立即放入含20%胎牛血清的4℃培养基中,2 h内转移至动物房生物安全柜内,取部分组织10%中性甲醛溶液固定,剩余部分切成2 mm×2 mm×2 mm小块。NCG小鼠腹腔注射戊巴比妥钠溶液,麻醉剂量为60 mg/kg,腹股沟处备皮,碘伏消毒,开3 mm左右切口,套管针皮下接种移植,手术切口使用5-0可吸收线缝合,小鼠保温苏醒后放入笼内。每周观察小鼠皮下移植瘤的生长情况,首次生长的肿瘤为P1代。待肿瘤直径达1 cm时,进行组织传代,脱臼处死小鼠,剥离肿瘤组织,采用皮下移植方法进行传代,步骤如前。皮下传代至第三代时,取部分肿瘤组织中性甲醛固定,HE染色与患者肿瘤组织比较,冻存部分P3代肿瘤备用,包括组织块和组织悬液。
1.3.2 PDX模型生长曲线
皮下接种移植的肿瘤,每周定期测量肿瘤最长瘤径(a)和最短瘤径(b),计算肿瘤体积,肿瘤体积(V)=1/2×a×b2,绘制肿瘤生长曲线。待肿瘤长径达1 cm进行传代。
1.3.3 肝癌PDX模型肿瘤组织单细胞悬液制备及造模
P3代PDX肿瘤组织长径达1 cm时,剥离肿瘤组织,按肿瘤组织解离试剂盒操作流程,获得肿瘤单细胞悬液,活细胞计数后调整细胞浓度为2×107个细胞每毫升,皮下接种100 μL,制作肝癌模型。
1.3.4 动物分组、给药及观察指标
动物分组:肝癌模型建立后一周,将小鼠按瘤体体积大小随机分为对照组、5-氟尿嘧啶组和索拉非尼组,每组5只。
给药方式:5-氟尿嘧啶组:尾侧静脉注射,25 mg/kg,隔日一次,连续治疗两周;索拉非尼组:灌胃,30 mg/kg,每日一次,连续治疗两周,对照组:不用药物干预。
观察指标:隔日观察肿瘤体积及小鼠体重变化,绘制生长曲线。药物干预治疗4周后,脱臼处死小鼠,剥离肿瘤组织称重,统计瘤重及抑制率(inhibition rate,IR)。抑制率=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100%。
1.4 统计学方法

2 结果
2.1 肝癌PDX模型的建立
本研究共移植2016年7月至2017年2月的18例临床肝癌组织标本,其中有6例标本(编号为LC-3,LC-7,LC-8,LC-9,LC-13和LC14)成瘤,P1代成瘤时间平均97 d(50~155 d),P1代成瘤的病例信息如表1所示。P1代肿瘤直径达1 cm时,进行组织传代,NCG小鼠皮下移植直至P3代。
2.2 PDX肿瘤组织与患者肿瘤组织病理形态比较
将肝癌患者肿瘤组织及成瘤后PDX模型肿瘤组织使用10%中性甲醛固定、石蜡包埋、组织切片后进行HE染色,光镜下观察肿瘤组织的结构特征,结果如图1,PDX模型肿瘤较好的保持了原发肿瘤的结构特征,二者具有较好的相似性。
2.3 PDX模型肿瘤生长曲线
各代肿瘤组织接种NCG小鼠皮下后,每周监测计算肿瘤体积,随着时间的延长,肿瘤体积增大,其生长特性符合肿瘤增殖的生物学特性。图2选用的是LC-3肝癌PDX模型P1,P2和P3的两个肿瘤的生长曲线(图2A,2B和2C),随着代次的增加,PDX成瘤时间随之减少(图2D)。
2.4 LC-3肝癌PDX模型的药效学评价
我们对LC-3肝癌PDX模型进行药效学评价,临床使用索拉非尼同步治疗患者,定期复查患者情况,LC-3患者术后6个月出现复发,且伴腹腔淋巴结转移,索拉非尼疗效评定为疾病进展(PD),与PDX模型的药效学评价结果相似。治疗组在给药两周后开始出现抑制现象(图3A);在治疗过程中,小鼠体重变化无明显差别(图3B);实验结束时,索拉非尼组抑瘤率约29.6%,但瘤重比较差异无统计学意义,阳性对照组5-氟尿嘧啶抑瘤率达63.7%,瘤重差异有显著性(P< 0.01)(图3C、3D)。PDX模型体内实验结果与临床治疗结果相同,索拉非尼对LC-3患者的疗效不佳,即LC-3患者对索拉非尼存在先天耐药,其药敏实验结果能够反应体内原代肿瘤的药敏疗效,对于筛选抗癌药物以及预测患者疗效等具有重要意义。
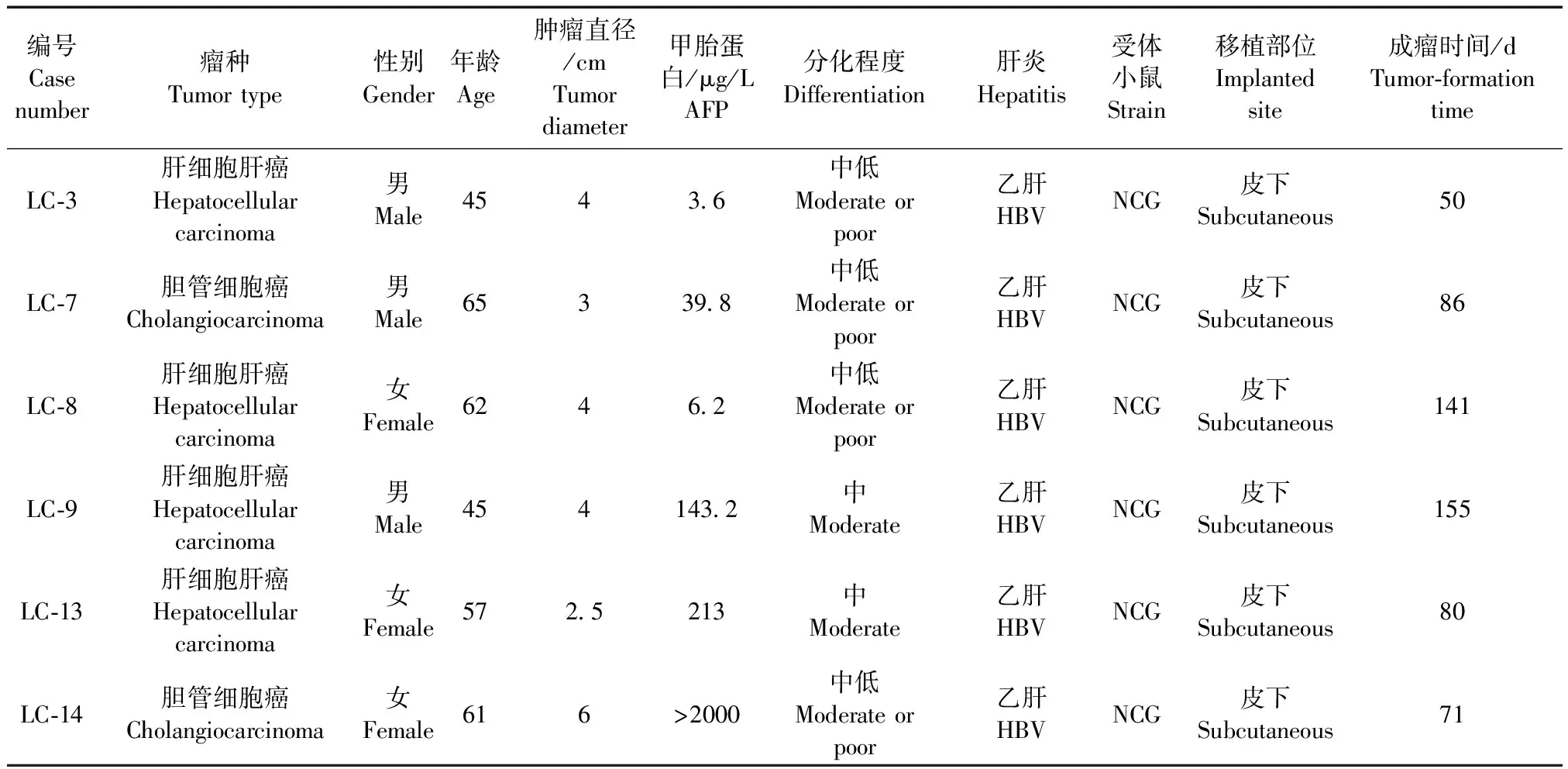
表1 肝癌相关PDX模型的病例信息
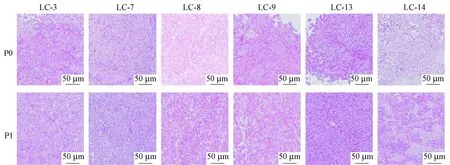
注:P0表示原代肿瘤组织;P1表示第一代PDX组织。图1 肝癌PDX肿瘤组织于患者肿瘤组织HE染色Note. P0, the primary tumor tissue;P1, the first generation of PDX tissues.Fig.1 Histology of PDX tumor tissues and human tumor tissues. HE staining
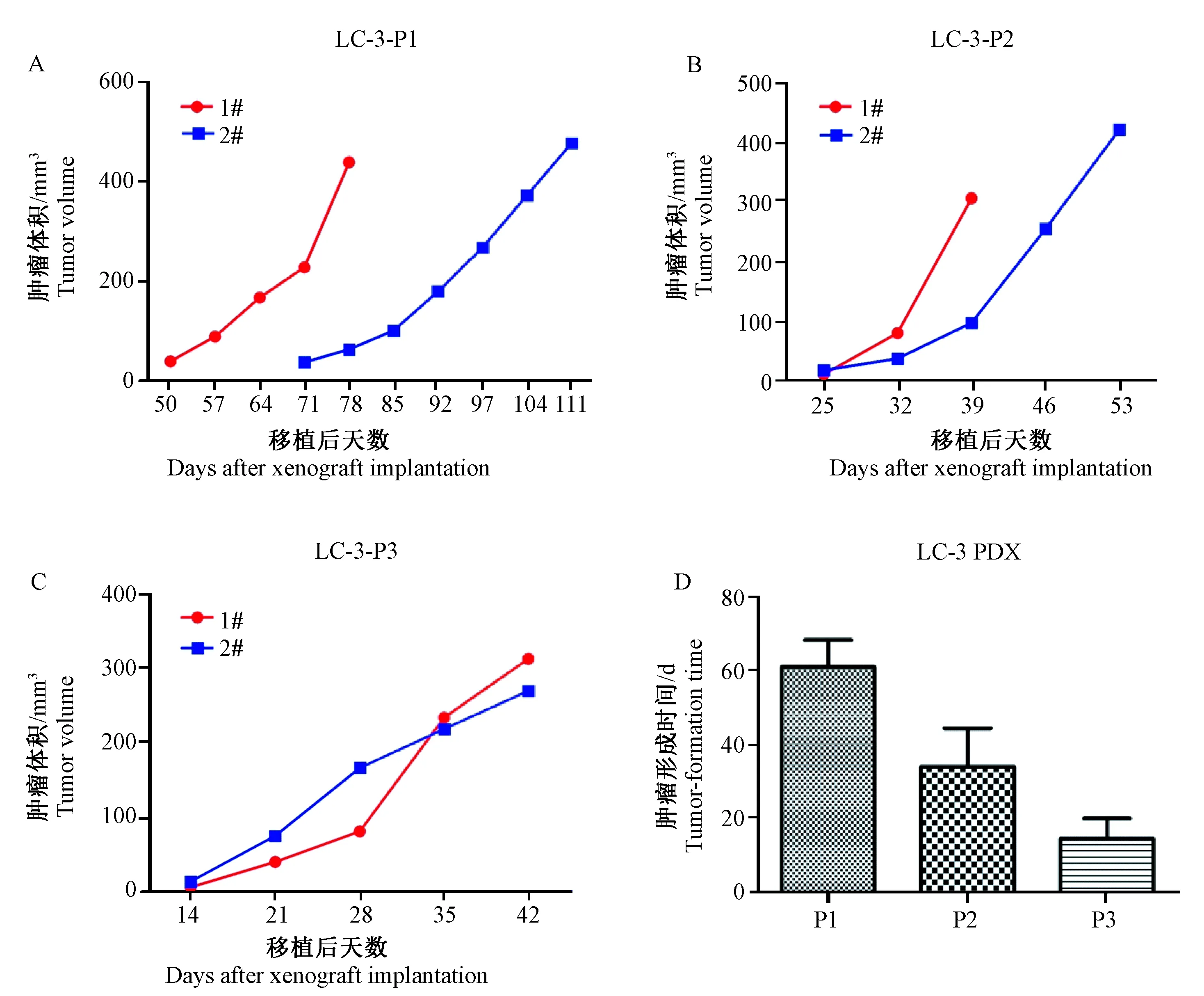
注:(A)P1代肿瘤生长曲线;(B)P2代肿瘤生长曲线;(C)P3代肿瘤生长曲线;(D)不同代次成瘤时间柱状图;1#、2#分别代表各代生长的两个肿瘤。图2 LC-3肝癌PDX模型的生长特点Note. (A) The growth curve of P1 tumor; (B) The growth curve of P2 tumor; (C) The growth curve of P3 tumor; (D) The histogram of tumor formation time in different generation; 1# and 2# represent two tumors of each generation.Fig.2 Growth characteristics of the LC-3 PDX model
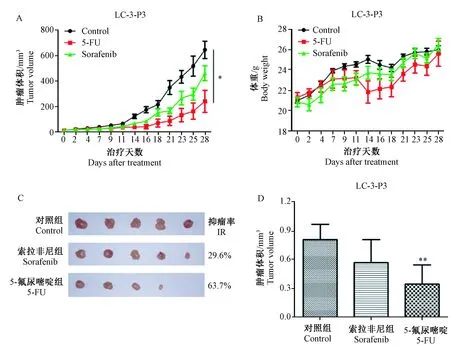
注:(A)肿瘤体积生长曲线图;(B)小鼠体重变化图;(C)剥离肿瘤大小比较图;(D)肿瘤重量量化图;与对照组比较,*P< 0.05,**P< 0.01。图3 LC-3肝癌PDX模型的药效学评价Note. (A) Tumor volume growth curve; (B) Mouse body weight curve; (C) Peeled tumor size comparison chart; (D) Tumor weight quantification diagram; Compared with the control group,*P < 0.05,**P< 0.01.Fig.3 Pharmacodynamic evaluation of the LC-3 PDX model
3 讨论
肝癌是我国常见的恶性肿瘤之一,虽然由于血清甲胎蛋白的临床应用和各种影像学技术的进步,使肝癌能够在无症状和体征的亚临床期做出诊断,加之外科手术技术的成熟,以及各种局部治疗等非手术治疗方法的发展,使肝癌的预后较过去有了明显提高,但是整体生存期依然有限[7, 8],因此,研究开发疗效好,毒副作用小及不易产生耐受性的新的治疗方案,对延长肝癌患者生存有重要意义。
分子靶向药在肿瘤治疗中的应用越来越多,索拉菲尼也被证实在肝癌中有效,提示分子靶向药物可能是治疗肝癌的新方法。但是目前进入肝癌临床试验的靶向药物中,除了索拉菲尼以外,其余全部被证实在总体人群中无效。即使是索拉菲尼,在临床应用中同样有约50%的患者无效,但是我们无法在用药之前判断索拉菲尼的疗效。索拉菲尼作为唯一应用于肝癌临床治疗的靶向药物,约一半患者则对索拉菲尼不敏感,使得索拉菲尼的整体疗效欠佳,并使得一半患者承受药物不良反应带来的痛苦和巨大的经济负担。而在索拉菲尼耐药研究中,受限于体内外肿瘤模型的限制,使得索拉菲尼耐药机制和标志物仍不清楚。因此,肝癌缺乏有效的分子靶向药物和用来指导靶向药物治疗的生物标志物或者分子分型。
PDX模型是目前被认为最接近临床患者的药物筛选模型。一般PDX模型构建选用高度免疫缺陷的小鼠,以排除机体免疫反应,此外PDX模型根据移植部位主要分为皮下移植、肾包膜下移植和原位移植三种,但模型构建的成功率会随着组织移植部位、鼠种等不同而差异较大[9-11]。肝癌PDX模型和其对临床患者肿瘤的代表性报道相对较少,其应用价值值得探讨,因此本研究通过皮下接种方式共移植18例临床肝癌组织标本,其中有6例成瘤,成瘤率为33.3%,P1代成瘤时间平均97 d,随着代次的增加,PDX成瘤时间随之减少。PDX模型肿瘤在传代过程中较好的保持了原发肿瘤的组织形态及结构特征,且移植肿瘤在体内的生长特性符合肿瘤增殖的生物学特性。
PDX模型构建的成功率与肿瘤类型、肿瘤的恶性程度、组织中肿瘤细胞比例、组织离体时间、受体鼠、操作技术、移植部位、饲养环境等多种因素相关[2]。本项目中肝癌PDX模型构建成功率为33.3%,其低成功率可能与肝癌的组织类型或组织中的癌细胞比例相关,我们在相同条件下进行的结直肠癌PDX模型的构建成功率可达90%以上,据文献报道结直肠癌(64%~89%)与胰腺癌(62%)均具有较高的移植率,但乳腺癌(13%~27%)则相对较低[12];另外,低成功率可能与移植部位有关,原位或肾包膜移植可能会提高成功率。
虽然PDX模型能够模拟原发肿瘤的组织病理学、基因组结构以及药敏反应,但PDX模型依然不能完全模拟原发肿瘤的体内微环境。PDX模型肿瘤的克隆型分布与原发肿瘤不同,基因突变频率表明克隆选择在初期移植过程中比传代步骤中发生的更加频繁,且克隆选择在同一类型肿瘤不同样本中仍然不同[13]。作为克隆选择的结果,PDX肿瘤中更具有侵略性的肿瘤克隆成为主导,基因组和转录组数据结果表明PDX模型肿瘤与转移及复发病灶更为相似,与原发灶肿瘤差别较大[14]。因此,PDX模型的应用更适用一线治疗失败、肿瘤复发或转移的患者。
本研究中我们对一例肝癌患者进行了前瞻性研究,患者手术切除肿瘤的同时制作PDX模型,患者术后接受索拉非尼单药治疗,定期复查,患者术后6个月出现复发,且伴腹腔淋巴结转移,索拉非尼疗效评定为疾病进展,与建成的PDX模型的药效学评价结果相似,提示其对索拉非尼存在先天耐受,从而导致索拉非尼的疗效不佳。肝癌PDX模型是目前为止最为接近临床研究的相关肿瘤模型,这种模拟人肿瘤特异性的模型对肿瘤临床前评估、治疗和预后具有重要的转化意义,有望为肿瘤患者个体化治疗带来新突破。
[1] Kopetz S, Lemos R,Powis G. The promise of patient-derived xenografts: the best laid plans of mice and men [J]. Clin Cancer Res, 2012, 18(19):5160-5162.
[2] 李克娟,黄昊,高苒. 人源肿瘤异种移植模型在精准肿瘤医学中的研究进展 [J]. 中国比较医学杂志,2017,27(1):91-98.
[3] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2):115-132.
[4] Rini BI. Sorafenib [J]. Expert Opin Pharmacother, 2006, 7(4):453-461.
[5] Ben Mousa A. Sorafenib in the treatment of advanced hepatocellular carcinoma [J]. Saudi J Gastroenterol, 2008, 14(1):40-42.[6] Spangenberg HC, Thimme R,Blum HE. Targeted therapy for hepatocellular carcinoma [J]. Nat Rev Gastroenterol Hepatol, 2009, 6(7):423-432.
[7] Bruix J,Llovet JM. Major achievements in hepatocellular carcinoma [J]. Lancet, 2009, 373(9664):614-616.
[8] Desai JR, Ochoa S, Prins PA, et al. Systemic therapy for advanced hepatocellular carcinoma: an update [J]. J Gastrointest Oncol, 2017, 8(2):243-255.[9] Jin K, Teng L, Shen Y, et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review [J]. Clin Transl Oncol, 2010, 12(7):473-480.
[10] Lee CH, Xue H, Sutcliffe M, et al. Establishment of subrenal capsule xenografts of primary human ovarian tumors in SCID mice: potential models [J]. Gynecol Oncol, 2005, 96(1):48-55.
[11] Huynh H, Ong R,Soo KC. Foretinib demonstrates anti-tumor activity and improves overall survival in preclinical models of hepatocellular carcinoma [J]. Angiogenesis, 2012, 15(1):59-70.
[12] Williams SA, Anderson WC, Santaguida MT, et al. Patient-derived xenografts, the cancer stem cell paradigm, and cancer pathobiology in the 21st century [J]. Lab Invest, 2013, 93(9):970-982.
[13] Eirew P, Steif A, Khattra J, et al. Dynamics of genomic clones in breast cancer patient xenografts at single-cell resolution [J]. Nature, 2015, 518(7539):422-426.
[14] Rosfjord E, Lucas J, Li G, et al. Advances in patient-derived tumor xenografts: from target identification to predicting clinical response rates in oncology [J]. Biochem Pharmacol, 2014, 91(2):135-143.
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021; 2.首都医科大学附属北京地坛医院,北京 100015)
目的 建立肝癌人源肿瘤异种移植(patient-derived xenografts,PDX)模型,探讨其在肝癌精准医疗中的作用。方法 取临床肝癌新鲜手术切除标本,NCG小鼠皮下接种肿瘤组织建立PDX模型,HE染色比较移植肿瘤组织与患者肿瘤组织形态结构的一致性。将成功传至第三代的PDX模型制备肿瘤细胞悬液,BALB/c裸鼠皮下接种制作肝癌移植瘤模型15只,成瘤后随机分为5-氟尿嘧啶(5-fluorouracil,5-FU)组、索拉非尼(sorafenib)组和阴性对照组,每组5只。定期监测各组荷瘤小鼠肿瘤体积和重量,根据瘤重计算抑瘤率,评估疗效。结果 本研究共建成肝癌PDX模型6例,成功率为33.3%(6/18),模型较好的保持了原发肿瘤的特征。1例PDX模型中,5-FU与索拉非尼组肿瘤抑瘤率分别为63.7%和29.6%,5-FU组抑瘤率比较差异有显著性(P< 0.05),索拉非尼组抑瘤率比较差异无统计学意义,与临床结果相符。结论 肝癌PDX模型保持了患者肿瘤组织的组织形态,可以适用于肝癌患者的精准医疗。
人源性肿瘤异种移植模型;肝癌;精准医疗
Establishment and application of a patient derived xenograft mouse model of liver cancer
HUANG Hao1#, LI Bao-liang2#, YANG Xing-jiu1, LI Meng-yuan1, ZHU Rui-min1, HU Juan-juan1, WEI Rong-fei1, LI Ke-juan1, Jiang Li2*, GAO Ran1*
(1.Institute of Medical Laboratory Animal Science, Chinese Academy of Medical Sciences & Comparative Medicine Center, Peking Union Medical College, Beijing 100021, China; 2.Beijing Ditan Hospital, Capital Medical University, Beijing 100015)
Objective To establish a patient-derived xenografts (PDX) mouse model of liver cancer (LC) and to explore its role in precision medicine. Methods PDX model was established by subcutaneous implantation of tumor tissues in NCG mice. The morphological structure of tumor tissue was exaimed using HE staining. Fifteen BALB/c nude mice were subcutaneously inoculated with tumor cell suspension from the PDX models. The xenograft mice were randomly divided into 5-fluorouracil (5-FU) group, sorafenib group and negative control group. The tumor volume and body weight of the tumor-bearing mice were measured regularly, the tumor inhibition rate was calculated and the curative effect was evaluated. Results The success rate was 33.3% (6/18) in the establishment of liver cancer PDX mouse model, and the model well retained the characteristics of the primary tumor. In one case of PDX mouse model, the tumor inhibition rates of 5-FU and sorafenib group were 63.7% and 29.6%, with a statistically significant differece between them (P< 0.05), and there was no significant difference between the sorafenib group and negative control group, consistent with clinical observation. Conclusions The PDX mouse model of liver cancer can maintain the histological structure of primary tumor, and can be applied to precision medicine for patients with liver cancer.
Patient derived xenograft, PDX; Mouse model; Liver cancer; Precision medicine
中国医学科学院医学与健康科技创新工程经费资助(2016-I2M-3-019);中央级公益性科研院所基本科研业务费(2016ZX310032);协和青年科研基金资助(3332016078)。
黄昊(1986-),男,助理研究员,研究方向:肿瘤动物模型的创制及应用。E-mail: huanghao@cnilas.org;李宝亮(1981-),男,主治医师,研究方向:消化道肿瘤综合治疗。E-mail: lblzgz@vip.qq.com。# 共同第一作者。
高苒(1980-),女,副研究员,研究方向:肿瘤学、免疫学。E-mail: gaoran26@hotmail.com;蒋力(1967-),男,主任医师,研究方向:肝胆外科及肿瘤外科诊治。E-mail: movdush@139.com
R-33
A
1671-7856(2017) 08-0060-06
10.3969.j.issn.1671-7856. 2017.08.012
2017-05-22

