运动对糖尿病大鼠胰岛的影响及其机制探讨
龚 云,张 鑫
专题研究
运动对糖尿病大鼠胰岛的影响及其机制探讨
龚 云1*,张 鑫2
胰岛素抵抗和β细胞分泌缺陷是2型糖尿病发病机制的两个主要环节[1-3],二者关系错综复杂,有学者认为,没有胰岛β细胞功能的缺陷,就没有糖尿病的发生[4]。有研究表明:糖尿病患者存在着进行性的胰岛β细胞功能恶化和胰岛萎缩现象,但这种现象在疾病发展的早期阶段是可逆的[5]。Qian的研究[6]显示,胰岛β细胞功能受损可能是糖耐量异常和空腹血糖异常进展为糖尿病的主要原因。现已知,长期体育锻炼能改善胰岛素敏感性、降低餐后和空腹血糖水平[7]。这种敏感性的改变,主要通过增加骨骼肌对葡萄糖摄取的“外周效应”来实现。国内有研究显示:糖尿病大鼠行8周游泳运动可显著改善血清胰岛素水平、降低血糖并提高胰腺胰岛素含量及促使胰岛形态恢复[8]。但未对胰岛β细胞形态结构及其生理学机制做深入研究,本研究通过8周跑台运动,期望观测其对2型糖尿病大鼠胰岛及β细胞形态结构和功能的影响,并以“双门控制模型”[9,10]为立论基础分析其变化机制,旨在其发病机理的“中心效应”方面积累有益的实验室资料。
1 材料和方法
1.1 实验动物
SPF级雄性Wistar大鼠30只,8周龄,体重185~220 g,购自甘肃中医药大学实验动物中心[SCXK(甘)2011-0001][SYXK(甘)2011-0002],国家标准啮齿类动物饲料喂养、自由饮食。动物室温度23℃~25℃,相对湿度40%~60%,自然光照,饲养室、用具每周进行紫外灯照射消毒一次。并按实验动物使用的3R原则给予人道的关怀。
1.2 实验方法
1.2.1 建模及分组
所有大鼠进行适应性喂养1周(自由进食、饮水)后,随机选取10只作为对照组(C组,正常饲料喂养、正常饮水)。其余大鼠给予高脂、高糖饲料(10%蔗糖、10%猪油、5%胆固醇)喂养,期间正常饮水,第30天(前1 d禁食12~16 h,不禁水)按50 mg/kg[11]体重逐只腹腔注射STZ(用1%柠檬酸钠缓冲液溶解STZ,30 min内注射完毕)。48 h后连续3 d同一时间剪尾取血测空腹血糖,血糖≥16.7 mmol/L[11]即为建模成功,期间死亡1只,剔除5只。对照组大鼠注射等体积柠檬酸盐缓冲液。再将建模成功大鼠分为两组:糖尿病对照组(DMC,7只),糖尿病运动组(DM exercice, DME, 7只)。
1.2.2 动物运动方案
C组、DMC组大鼠不运动,笼内自由生活取食。DME组大鼠先进行3 d适应性跑台运动,强度由15 m/min(15 min,坡度为0°)开始,逐渐增加到20 m/min (30 min,坡度为0°);后连续进行8周跑台运动(30 min,强度20 m/min)[12],每天运动一次,逢周日休息1 d。实验期间,大鼠均自由取食和饮水,并观察饮食和精神状态。
1.2.3 指标测试
在实验前、后清晨空腹状态下,逐只准确测量各组大鼠体重。待实验结束时,将各组大鼠逐一腹腔注射0.4%戊巴比妥钠麻醉,先腹主动脉取血测试血糖、血清胰岛素含量;后置于冰盘上迅速剖腹取出胰腺组织,用预冷的0.9%的生理盐水冲洗,剪取胰头(胰腺前三分之一)置10%福尔马林浸泡过夜,每组随机选取5块行常规石蜡包埋并切片,隔2选1行HE染色及制片,每组制片20张。将胰腺后三分之二组织均浆待用。
1.2.4 组织匀浆
先用锋利剪刀剪碎各组胰腺组织,加入匀浆液后在电动均浆机中匀浆30 s、间隔30 s,重复3次,后将匀浆液(冰冷的生理盐水,0.9%氯化钠)置入离心机(4℃、3500 rpm)离心10 min取上清液备用,用于测试组织胰岛素含量、葡萄糖激酶(GK)及微量总ATP酶活性。
1.2.5 胰腺Ins含量、GK及微量总ATP酶活性测试
两种酶活性检测试剂盒购自上海研辉生物科技有限公司,通过双抗体一步夹心法酶联免疫吸附试验(ELISA),严格按照试剂盒操作步骤,分别在636 nm和450 nm下读取OD值,带入各自回归方程求得样品浓度,再乘以稀释倍数得样品实际浓度。
1.2.6 切片观测
随机选取各组HE染色切片10张,用Motic数码显微镜(BA400/450)观察胰岛及β细胞形态结构,每张切片再随机选取三个视野在100及400倍下分别拍照,并运用Motic Images Advanced 3.1图像处理软件在100倍视野下对胰岛行周长和面积测量,并由此计算形状因子。
1.3 统计学方法

2 结果
2.1 建模前、后及实验末各组大鼠体重、血糖变化
与建模前相比,注射STZ大鼠几乎都出现了“三多”现象。对糖尿病患者而言,随疾病发展可出现进行性体重下降的变化。建模前、后及实验末各组大鼠体重变化见图1;而实时检测血糖可及时了解机体糖代谢状况及糖尿病的发展转归。实验前、后各组大鼠血糖变化情况见图2。

图1 建模前、后及实验末大鼠体重变化Fig.1 Changes of body weight of rats during the experiment
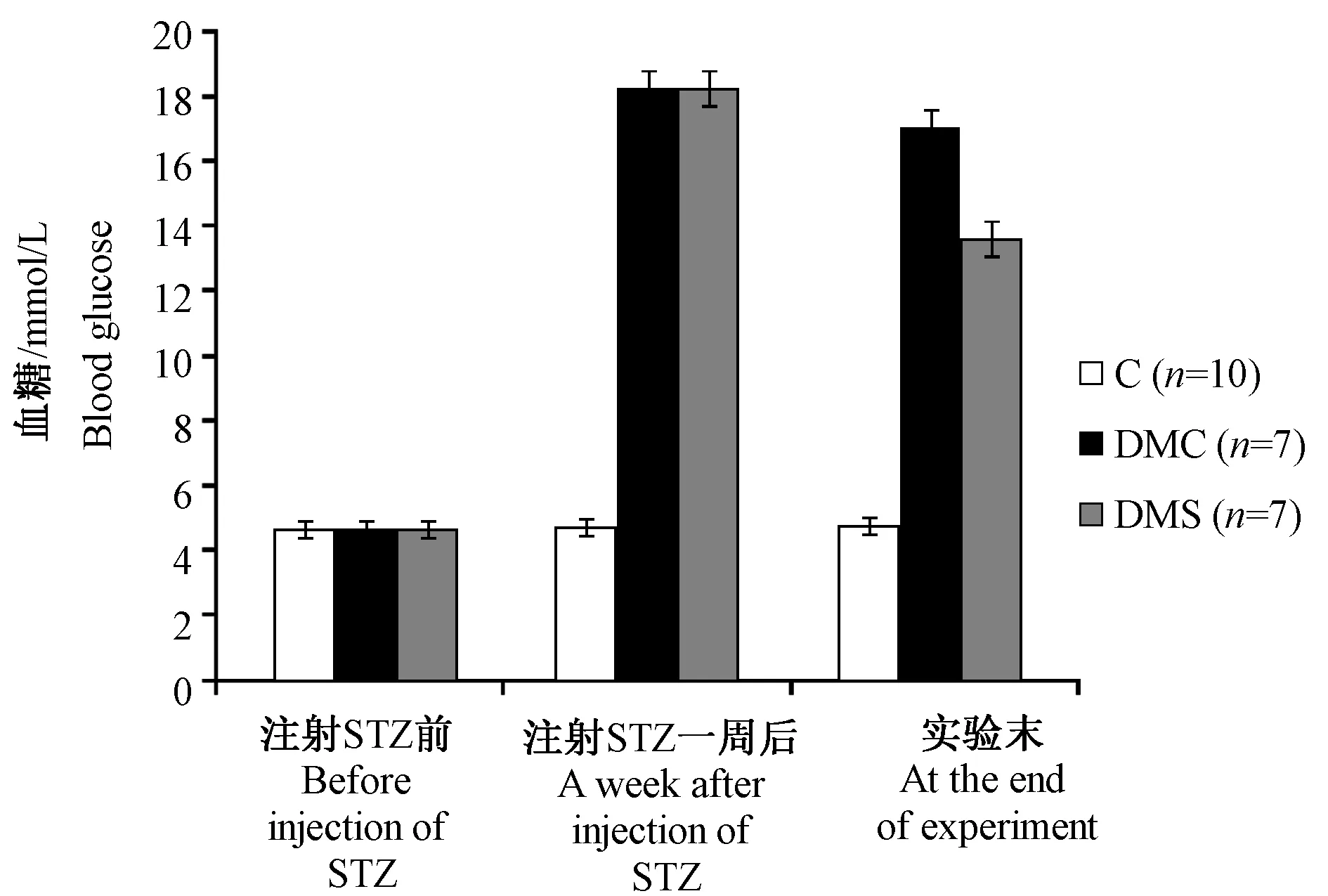
图2 注射STZ前、后及实验末大鼠血糖变化Fig.2 Changes of blood glucose levels of the rats during the experiment
由图1、图2可见,高糖、高脂饲料喂养的大鼠体重显著高于正常饲料喂养的C组大鼠体重;注射STZ1周后,DM大鼠体重较C组大鼠体重显著下降;而血糖比注射前及C组大鼠血糖极显著增高;8周跑台运动结束时,C组大鼠体重极显著(P< 0.01)高于实验前及实验末DMC、DME组大鼠;此时DME组大鼠体重也显著(P< 0.05)高于DMC组大鼠,提示中等强度有氧运动在一定程度上有延缓体重持续下降的作用;DME组大鼠血糖尽管仍比C组大鼠血糖极显著增高,但与DMC、注射STZ一周后DM组大鼠相比,有显著下降趋势。说明中等强度有氧运动有阻抗糖尿病病情持续发展的作用。
2.2 实验末各组大鼠胰腺、血清胰岛素检测及HOMA推算
胰岛素是体内唯一的降糖激素。本实验运用胰岛素试剂盒(购自上海研辉生物科技有限公司)测试实验末各组大鼠胰腺及血清胰岛素含量(兰州军区总医院安宁分院核医学科测试),并基于空腹血糖和空腹胰岛素值计算胰岛素敏感性指数[13]:HOMA=空腹胰岛素(μU/mL)×空腹血糖(mmol/L)/22.5。测试结果见表1。
由上表可见,经过8周跑台运动,DME组大鼠胰腺及血清胰岛素浓度比DMC组显著升高(P< 0.05),但仍比C组大鼠极显著降低(P< 0.01);另外,经推算胰岛素敏感性指数(HOMA)可知, DME组大鼠的HOMA比C组大鼠显著增高(P< 0.05)。2.3 实验末各组大鼠胰腺部分酶活性测定
胰岛β细胞分泌胰岛素受营养状况、神经递质及激素等多重因素的精确调控。本实验用试剂盒检测葡萄糖激酶(GK, 购于上海研辉生物科技有限公司)及超微量总ATP酶(试剂盒购于南京建成生物科技有限公司)活性,结果见表2。
由上表可见,与C组大鼠相比,用STZ建模后,DMC组大鼠葡萄糖激酶及超微量总ATP酶活性均极显著下降;但经8周跑台运动后,尽管这两种酶活性仍比C组大鼠显著降低,而比DMC组大鼠却显著升高(P< 0.05)。
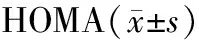
表1 实验末各组大鼠胰腺、血清胰岛素含量及
注:与C组比较,★P< 0.01,●P< 0.05;与DMC组比较,▲P< 0.05。
Note.Compared with the group C,★P< 0.01,●P< 0.05;Compared with the DMC group,▲P< 0.05.
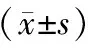
表2 实验末各组大鼠胰腺葡萄糖激酶(GK)及ATP合成酶水平
注:与C组比较,★P< 0.01,●P< 0.05;与DMC组比较,▲P< 0.05。
Note.Compared with the group C,★P< 0.01,●P< 0.05;Compared with the DMC group,▲P< 0.05.

表3 各组大鼠胰岛周长、面积及形状因子推算结果
注:与C组、DME组比较,★P< 0.05,▲P< 0.01;(n)测试胰岛数目。
Note.Compared with the group C and DME group,★P< 0.05,▲P< 0.01;(n)The number of tested islets.
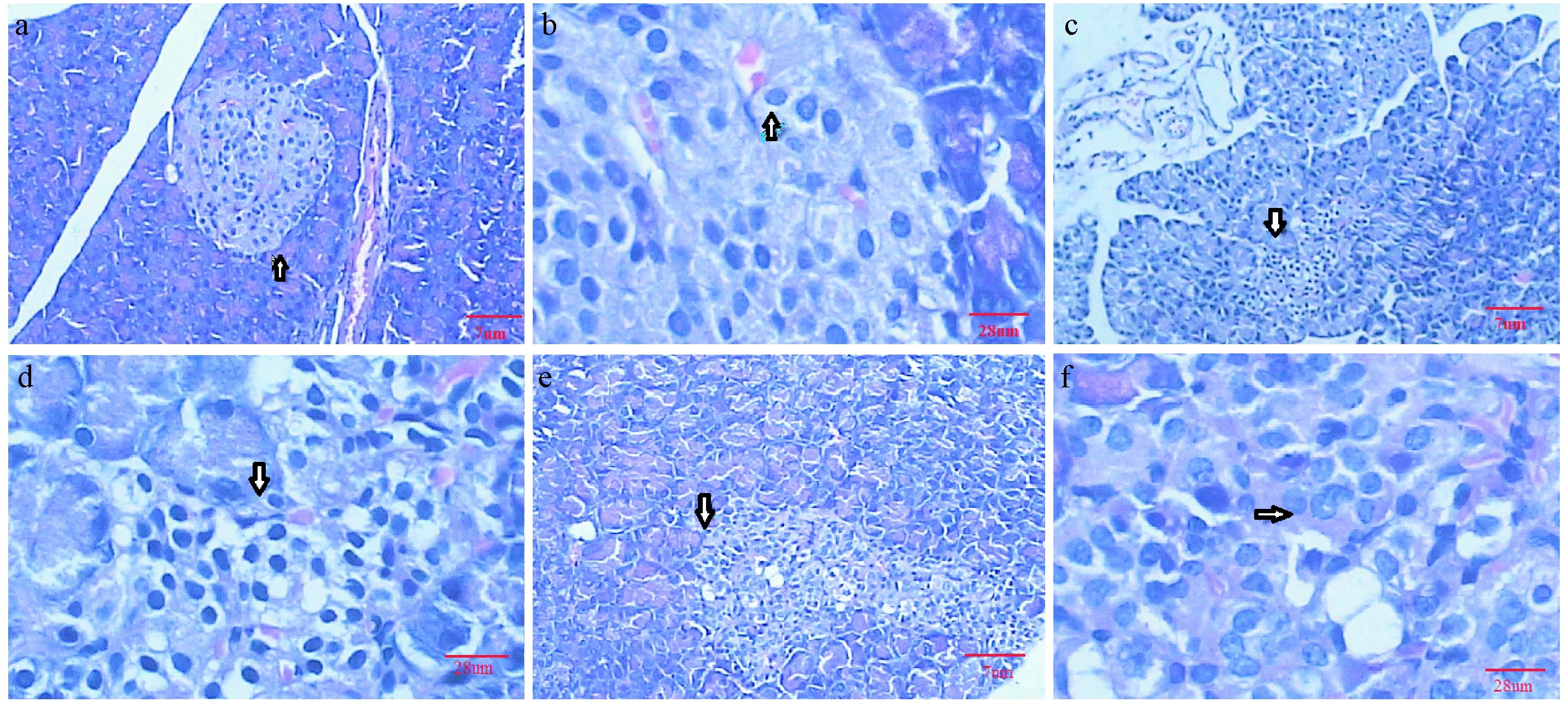
注:(a)C组(×100);(b)C组(×400);(c)DMC组(×100);(d)DMC组(×400);(e)DME组(×100);(f)DME组(×400)。图3 各组大鼠胰腺HE染色切片Note. a, A rat of group C; b, A rat of group C; c, A rat of group DMC; d, A rat of group DMC; e, A rat of group DME; f, A rat of group DME.Fig.3 Histological images of pacreatic islets of the rats. HE staining
2.4 实验末各组大鼠胰岛及β细胞形态结构观测
本实验用Motic数码显微镜(BA400/450)观察了各组大鼠胰岛及β细胞形态结构(图3)。结果显示,正常对照组(C)大鼠的胰腺组织结构、内分泌部的胰岛以及外分泌部的腺泡清晰可见,胰岛细胞之间排列紧密,结缔组织少(图3-a、b)。糖尿病对照组(DMC组)大鼠胰岛萎缩、包膜不完整、细胞数量减少、部分胰岛细胞坏死或肥大、胰岛细胞间排列较松散、β细胞空泡增多、细胞核固缩(图3-c、d),外分泌细胞深入胰岛内。糖尿病运动组(DME)大鼠的胰岛组织已得到初步的修复,结缔组织增生、β细胞空泡及肥大数量明显减少,细胞核固缩不明显(图3-e、f),胰岛细胞之间紧密程度加强,显示较DMC组大鼠胰岛形态显著改善。在100倍视野下,应用Motic Images Advanced 3.1图像处理软件,先设定像素宽×高=570×380后,再对胰岛周长和面积进行多点测量,并由此计算出胰岛的形状因子(形状因子为胰岛周长与面积的比值,用于反应胰岛形状的变化)[14]。具体结果见表3。
由上表可见,DMC组大鼠周长较C组、DME组大鼠显著减小(P< 0.05),形状因子显著增大(P<0.05);而面积比C组、DME组大鼠极显著减小(P< 0.01)。
3 讨论
常用的糖尿病动物模型有实验性和自发性两类[15],实验性糖尿病动物模型应用比较广泛,其中链脲佐菌素对机体组织毒性相对较小,动物存活率高、造模长期稳定性好,是目前国内外使用较多的制备糖尿病动物模型的方法[16]。本研究先用高脂、高糖饲料喂养大鼠30 d,后一次性腹腔注射小剂量STZ(50 mg/kg,1%柠檬酸钠缓冲液)建造T2DM大鼠模型。从体重看,注射STZ前DM较C组大鼠显著增加,注射后显著下降,通过行为观察发现多食、多饮、多尿现象(“三多一少”),且血糖测试结果大于16.7 mL/L,表明我们建造的T2DM大鼠模型是成功的。这与国内、外通用的大鼠2型糖尿病模型建立方法基本一致。因预先高脂、高糖饲料喂养可使大鼠体重较快增加,并引发胰岛素抵抗现象,还可出现高胰岛素血症和高血糖症,与人类T2DM发病过程和疾病进程非常接近,从而可在较短时期内建造T2DM大鼠模型。
胰岛素抵抗和β细胞分泌功能缺陷是2型糖尿病发病机制中的两个重要环节[1-3]。有流行病学研究[17]显示:如果具有补偿胰岛素抵抗的胰岛素分泌能力,单纯的胰岛素抵抗不会形成2型糖尿病。结合临床病理解剖观察,普遍认为胰岛β细胞分泌功能缺陷在2型糖尿病发病过程中扮演了非常重要的角色。本研究显示:DMC组大鼠胰岛明显萎缩、包膜不完整,β细胞空泡较多、胞核固缩明显(图3-c、d),但颗粒晕轮尚在。DME组大鼠胰岛明显增大,上述病理症状明显改善,与所测周长、面积及形状因子数据相吻合,并与吴亚文等[8]研究结果基本相同。说明有氧运动能显著改善2型糖尿病大鼠胰岛及β细胞结构,依据结构决定功能认知,结构的改变必然会影响其功能变化。
胰岛素是体内唯一的降糖激素,也是促合成激素,可抑制肝糖原降解和糖异生,从而有效控制血糖水平,使之保持稳态。β细胞以脉冲方式分泌胰岛素,其分泌过程主要受制于葡萄糖的触发途径和扩增途径,并受到营养物质、神经递质和激素等多重因素的精确调控。在β细胞内,葡萄糖激酶(glucokinase,GK)催化葡萄糖生成葡萄糖6磷酸,后主要经糖酵解通路并辅助三羧酸循环氧化生成ATP,这在整个胰岛素分泌调控中起关键作用[18]。GK的动力学特点为Km值约为6~10 mmol/L,其产物葡萄糖6磷酸无抑制作用,因而使其成为合适的葡萄糖感受器,根据机体需要控制葡萄糖代谢刺激胰岛素分泌[19]。可见,葡萄糖激酶(GK)是β细胞内葡萄糖氧化过程的第一限速酶,被称为“前门”。现认为ATP合成酶是胰岛β细胞分泌胰岛素的又一关键限速酶,又被称为“后门”。而且,这两个关键代谢酶表达的上调显著提高大鼠胰岛及β细胞系的ATP含量与葡萄糖反应性胰岛素分泌量达300%以上[9、10]。
长期暴露于高糖、高脂及炎症细胞因子环境会损伤β细胞胰岛素分泌功能, 并随时间推移逐渐诱导细胞凋亡,并最终引发2型糖尿病。本研究结果显示,经过8周有氧跑台运动,糖尿病运动组大鼠血糖显著下降,而胰腺及血清胰岛素含量、GK及ATP合成酶活性显著高于糖尿病对照组大鼠。这样的结果再一次佐证葡萄糖在胰岛素分泌中的反馈调节作用不容小觑。血糖的下降首先归因于胰岛素的分泌量增多,这种分泌量的增多,依据“双门控制模型”理论,首先得益于“前门”-GK活性的增高,其次得益于“后门”ATP合成酶活性的增高,由此促使β细胞分泌较多的胰岛素。从本研究胰岛素敏感性指标HOMA的推算结果看,8周有氧跑台运动使之显著增高,这或许提示有氧运动又可使外周组织(骨骼肌、脂肪组织等)强化葡萄糖的转运利用,从而又会引发血糖进一步下降。二者效应叠加,最终出现显著的血糖下降现象。这与国内谷成英等[20]的研究结果基本一致。现有研究认为,运动对胰岛素敏感性的改善作用和运动对胰岛功能的保护作用存在因果关系,运动通过改善外周胰岛素抵抗而降低胰岛β细胞的葡萄糖负荷,继而改善胰岛及β细胞的形态结构表征。
[1] Kahn S, Hull R, Utzschneider K. Mechanisms linking obesity to insulin resistance and to type 2 diabetes[J]. Nature,2006,444(7121):840-846.
[2] Ferrannini E, Gastaldelli A, Miayzaki Y, et al. Predominant role of reduced beta-cell sensitivity to glucose over insulin resistance in impaired glucose tolerance[J]. Diabetologia 2003,46(9):1211-1219
[3] Bergman R. Banting Lecture 2006: Orchestration of glucose homeostasis: from a small acorn to the California Oak[J]. Diabetes,2007,56(6):1489-1501.
[4] Seino S, Shibasaki T, Minami K. Dynamics of insulin secretion and the clinical implications for obesity and diabetes[J]. J Clin Invest,2011,121(6): 2118-2125.
[5] Wajchenberg BL.Beta-cell failure in diabetes and preservation by clinical treatment[J].Endocr Rev,2007,28(2):187-218.
[6] Qian L, Xu L, Wang X, et al. Early insulin secretion failure leads to diabetes in Chinese subjects with impaired glucose regulation[J].Diabetes Metab Res Rev,2009,25(2):144-149.
[7] Maiorana A, O′Driscoll G, Goodman C, et al. Combined aerobic and resistance exercise improves glycemic control and fitness in type 2 diabetes[J]. Diabetes Res Clin Pract,2002,56:115-123.
[8] 吴亚文,江钟立,李红卫,等. 运动训练对糖尿病大鼠胰岛形态和β细胞功能的影响[J].中国康复医学杂志,2009,24(6):518-522.
[9] Yang J, Wong RK, Park M, et al. Leucine regulation of glucokinase and ATP synthase sensitizes glucose-induced insulin secretion in pancreatic beta-cells[J].Diabetes,2006,55(1):193-201.
[10] Yang J, Wong RK, Park M, et al. Leucine culture reveals that ATP synthase function as a fuel sensor in pancreatic beta-cells[J].J Biol Chem,2004, 279(52):53915-53923.
[11] Matteucci E,Giampietro O.Proposal open for discussion: defining agreed diagnostic procedures in experimental diabetes research[J].J Ethnopharmacol,2008,115(2):163-172.
[12] 赵杰修,田野,曹建民,等.跑台运动和营养补充对大鼠骨骼肌能量代谢酶的影响[J].体育科学,2007,27(1):68-71.
[13] Eisenmann JC, DuBose KD, Donnelly JE. Fatness, fitness, and insulin sensitivity among 7- to 9-year-old children[J].Obesity(Silver Spring),2007,15(8):2135-2144.
[14] 崔亚南,张桂珍,薄立华.体视学定量分析技术在病理学应用研究中的优化设计[J].中国体视学与图像分析,2002,7(3):185-190.
[15] Rees DA, Alcolado JC. Animal models of diabetes mellitus[J].Diabet Med,2005,22(4):359-370.
[16] Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J]. Physiol Res,2001,50(6):537-546.
[17] Sunmin P, Sang MH, Ji EL, et al. Exercise improves glucose homeostasis that has been impaired by a high-fat diet by potentiating pancreatic β-cell function and mass through IRS2 in diabetic rats[J].J Appl Physiol,2007,103(5):1764-1771.
[18] Meglasson MD, Burch PT, Berner DK, et al. Chromatographic resolution and kinetic characterization of glucokinase from islets of Langerhans[J].Proc Natl Acad Sci,1983,80:85-90.
[19] Matschinsky FM. A lesson in metabolic regulation inspired by the glucokinase glucose sensor paradigm[J].Diabetes,1996,45(2):223-241.
[20] 谷成英,袁莉,唐兆生,等.运动对2型糖尿病大鼠胰岛细胞形态与功能的影响[J].中华物理医学与康复杂志,2005,27(3):145-148.
专家问答
问:小动物活体成像中,如何比较准确地定量或半定量?肿瘤单位面积的荧光强度值如何计算?
答:活体光学成像在实际执行时可能会有一些困难,比如定量的问题,目前活体光学成像用的是绝对定量的方法,有一个特定的单位,即每一个扫描弧度在单位面积单位时间所得到的光子量。目前几乎所有期刊都采用这个定量方法。另外就是二维和三维的问题,二维定量是没有问题的,但目前很少使用三维定量,最重要的原因是基于活体光学成像的物理原理,所得到的影像和图像都是二维的,三维都是通过软件模拟得到的虚拟图像,因此得出来的体积不是很精确,得到的并不是扫描样品的真正结果。
(感谢第四军医大学 师长宏 教授和冷泉港生物科技股份有限公司分子影像部门副总经理 王志宇 先生的解答)
(1.西北师范大学体育学院,兰州 730070; 2.济南市皇亭竞技体育学校,济南 250011)
目的 探讨有氧运动对2型糖尿病大鼠胰岛及β细胞的影响及其机制。方法Wistar大鼠30只,随机选取10只为C组,其余20只用链脲佐菌素(streptozotocin, STZ)配合高脂高糖饲料喂养建造2型糖尿病大鼠模型,留其成功的15只再分两组,一组为DMC组(n=7);另组为DME组(n=7,实验结束时死亡1只)。DME组大鼠以每天20 m/min强度跑台运动30 min,每6 d休息1 d,共持续8周,其余大鼠笼内自由活动。实验结束时,腹主动脉取血测血糖、血清Ins含量,并推算HOMA;切取胰腺前三分之一行石蜡切片、HE染色,在数码显微镜下观察胰岛形态及β细胞结构并拍照;在100倍视野下,运用Motic Images Advanced 3.1图像处理软件测量胰岛周长和面积,并由此计算出SF;将剩余胰腺匀浆后测其Ins含量、GK及微量总ATP酶活性。结果 DME组大鼠胰岛周长和面积均较DMC组大鼠显著增加(P< 0.05),但仍低于C组大鼠,SF显著增高;β细胞肥大及空泡、胞核固缩等现象较DMC组大鼠显著改善;DME组大鼠血糖、Ins含量、胰腺GK及微量总ATP酶活性均显著高于DMC组大鼠(P< 0.05);SF及HOMA也有显著变化。结论 有氧运动可降低2型糖尿病大鼠的血糖浓度、改善胰岛以及胰岛β细胞形态结构,归因于胰腺组织GK、ATP合成酶活性及胰岛素敏感性的提高。
有氧运动;2型糖尿病;胰岛β细胞;结构及功能;机制;大鼠
Effect of aerobic exercise on pancreatic islets and exploration of their mechanism in type 2 diabetic rats
GONG Yun1*, ZHANG Xin2
(1.College of Physical Education, northwest Normal University, Lanzhou 730070, China; 2. Competitive Sports School of Huang Ting, Jinan 250011)
Objective To explore the effect and mechanism of aerobic exercise on islet β-cells in type 2 diabetic rats. Methods Thirty healthy SPF 8-week old Wistar rats were randomly divided into control group (C,n=10), diabetic control groups (DMC) and diabetic exercise (DME) groups, 10 rats in each group, among which 7 successful rat models were used in the experiment. The diabetic rat model was established by high fat and sugar diet and i.p. injection of streptozotocin in a dose of 50 mg/kg. The rats of group DME were forced to perform 20 m/min running for 30 min, once a day, 6 days in a week, for 8 weeks. Other rats were allowed free movement. At the end of experiment, serum glucose and insulin were measured and homeostasis model assessment (HOMA) was calculated, and pancreatic tissue samples were collected for histopathological examination. The morphology and structure of pancreatic islets were observed under a digital microscope, the perimeter and area of islets were analyzed by image analysis, and shape factor of islets was calculated. The insulin content, glucokinase and ultramicro-ATPase activity in the pancreatic homogenate were determined. Results In the DME group, the perimeter and area of islets were significantly higher than the DMC group (P< 0.05), but still lower than the control group. The shape factor was significantly increased, the cell hypertrophy, vacuolization and nuclear pyknosis were markedly alleviated than those in the DMC group, the insulin content, glucokinase and the trace total ATP activity in the DME group were significantly higher than those in the DMC group (P<0.05), and the SF and HOMA were significantly changed. Conclusions Aerobic exercise can reduce the blood glucose level, improve the morphology of islets and β-cells in the type 2 diabetic rats. It may be due to increase of the activity of glucose kinase and ATP-synthase, and increased insulin sensitivity in the pancreas.
Aerobic exercise; Type 2 diabetes; Pancreatic islets β-cells; Structure and function Mechanism; Rats
西北师范大学青年教师科研能力提升计划项目(SKQNGG-13018);西北师范大学2017研究生培养与教学改革项目(2017-11014)。
龚云(1970-),男,副教授,硕士研究生导师,主要研究方向:糖尿病运动疗法及其机制研究。E-mail: gongyun@nwnu.edu.cn
R-33
A
1671-7856(2017) 08-0022-06
10.3969.j.issn.1671-7856. 2017.08.005
2016-12-08

