参芍口服液调控TLR4/MyD88通路改善糖尿病大鼠心肌炎症损伤
张红利,贾春新,李海鸥,周洪霞,张春来
专题研究
参芍口服液调控TLR4/MyD88通路改善糖尿病大鼠心肌炎症损伤
张红利1,贾春新1,李海鸥1,周洪霞1,张春来2*
糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病主要的心血管并发症之一,是糖尿病患者高心力衰竭发生率和死亡率的主要病因[1]。目前,DCM的发病机制及诊治方面的研究尚有许多未知领域和难点。近年研究认为,DCM是心肌在长期高血糖状态下发生的一种慢性炎症性疾病[2]。研究报道,糖尿病患者的血清和糖尿病动物模型的心肌组织中,多种炎症因子的表达水平显著升高[3],因此,DCM早期进行抗炎治疗是防治DCM的一个新靶点。TLR4作为炎症反应的重要受体,是免疫防御系统中的重要一员,是免疫反应与慢性炎症的桥梁[4]。既往有研究证实,TLR4参与了许多炎症性疾病的发生与发展,包括肾小球肾炎、神经炎症、炎症性肠病等。但TLR4是否介导了DCM早期炎症损伤的发生发展尚未有研究报道。
参芍口服液是在补阳还五汤的基础上研制的速效、高效中药制剂。课题组前期研究表明,参芍口服液可改善动脉粥样硬化、减轻炎症反应、抗心肌缺血等[5,6],但其作用于DCM发挥抗炎作用的确切机制并不明确。本实验通过建立2型糖尿病心肌病大鼠模型,观察参芍口服液对DCM大鼠心肌早期炎症损伤的影响,以期为DCM的防治提供新的方向。
1 材料和方法
1.1 实验动物
50只SPF级8周龄雄性Wistar大鼠,体重120~160 g,购自华北理工大学动物中心[SCXK(京)2015-0038]。动物饲养于华北理工大学动物中心[SYXK(冀)2015-0038]屏蔽环境下,环境温度:(22±2)℃,相对湿度:50%~60%,光照:12 h/12 h明暗交替,噪音<50 db;自由饮食水,并在试验过程中按实验动物使用的“3R”原则给以人道主义关怀,适应性饲养1周后进行正式实验。
1.2 主要试剂与仪器
高脂饲料(普通饲料78.8%,胆固醇1%,牛胆盐0.2%,蛋黄粉10%,猪油10%)购自华北理工大学动物中心;链脲佐菌素购自Sigma公司;参芍口服液(丹参250 g,黄芪250 g,赤芍药150 g,当归150 g,川芎75 g,桃仁125 g,红花75 g,水蛭187.5 g,地龙250 g,清半夏125 g)由河北省唐山市工人医院制剂室提供;TLR4 antibody、NF-κB P65 antibody购自Abcom公司;MyD88 antibody购自Santa Cruz公司。
血糖测量仪及试纸(美国强生公司);Medlab生物信号采集处理系统;组织包埋机(德国莱卡公司,型号EG1150H);组织切片机(德国莱卡公司,型号RM2245);显微镜(日本奥林巴斯公司,型号BX53);超薄切片机(德国莱卡公司,型号UC-6);透射电子显微镜(日本日立公司,型号H7650),全自动生化分析仪(日本日立公司,型号7600-110)。
1.3 实验方法
1.3.1 实验动物分组与处理
50只Wistar大鼠随机分为对照组20只和实验组30只,对照组全程给予普通饲料,实验组全程给予高脂饲料。实验组大鼠按70 mg/kg一次性快速腹腔注射链脲佐菌素(溶于0.1 mmol/L柠檬酸缓冲液,pH 4.5),正常对照组按体重腹腔注射等量柠檬酸缓冲液。注射后3 d、7 d分别测空腹血糖(fasting blood glucose,FBG),两次FBG≥16.7 mmol/L为糖尿病大鼠入选标准。1周后将对照组随机分为空白组(control group,生理盐水8 mL/d),正常干预组组(Con+HS group,参芍口服液8 mL/d);实验组随机分为模型组(DCM group,生理盐水8 mL/d),低剂量组(DCM+LS group,参芍口服液4 mL/d),高剂量组(DCM+HS group,参芍口服液8 mL/d),每组各10只(实验中若出现死鼠,则予补充该组大鼠)。药物剂量依据预实验及既往文献确定。持续灌胃干预6周,直至实验结束(共12周)。
1.3.2 左心室插管测定心功能
给药结束后(第12周末),大鼠禁食12 h,测血糖,称重,按照50 mg/kg注射2%戊巴比妥钠溶液麻醉,仰位固定,颈正中切口,气管插管,心前区去毛,暴露心脏,将单压力导管插入左心室,连接Medlab生物信号记录仪记录左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压力(left ventricular end diatolic pressure,LVEDP)、左心室最大收缩/舒张速率(maximum rate of myocardial contraction and maximum rate of myocardial diastole,±dp/dtmax)。
1.3.3 测定大鼠动脉血中CK、LDH、hsCRP含量
腹主动脉取血,将抽取的动脉血迅速注入含有酶抑制剂的抗凝管中,摇匀,12 000 r/min,4℃离心15 min,分离血浆,-80℃冰箱保存,全自动生化分析仪测定血浆CK、LDH、hsCRP水平。
1.3.4 HE染色及透射电镜观察大鼠心肌病理改变
动物处死后,进行组织取材,一部分用生理盐水洗去血液后浸于4%多聚甲醛中固定,后进行脱水、透明、包埋、切片,HE染色,光镜下观察心肌细胞形态;一部分修剪成米粒大小,浸于2.5%戊二醛溶液中,送至华北理工大学电镜中心检测,观察心肌细胞超微结构,每张切片观察10个视野。
1.3.5 免疫组织化学法检测TLR4、MyD88、NF-κB P65表达
取心肌组织石蜡切片,进行脱蜡、修复、封闭后加入一抗TLR4 antibody、MyD88 antibody、NF-κB P65 antibody(均为1∶100),4℃过夜;加二抗,DAB 显色,封片,在同一条件下光镜观察并照相,随机选择10 个视野,采用Image Pro 6.0图像分析系统测定样本的累积光密度值(intergrated optical density,IOD)。
1.4 统计学方法
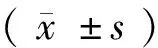
2 结果
2.1 各组大鼠的一般情况
实验过程中Con组及Con+HS组大鼠精神状态良好,反应灵敏。DCM组大鼠则出现多饮、多食、多尿及消瘦的症状,精神低靡,反应迟钝,易激惹,毛发杂乱、污秽。Con+LS组及Con+HS组大鼠精神状态则较模型组改善。
实验结束时,DCM组大鼠血糖较Con组明显升高,差异有显著性(P< 0.05)。Con+LS组及Con+HS组血糖水平仍高于Con组(P< 0.05)且与DCM组相比差异无显著性(P> 0.05),参芍口服液干预的正常大鼠血糖水平与Con组相当(P> 0.05),表明参芍口服液不具有明显的降糖作用。
DCM组大鼠体重明显低于Con组,心体比则高于Con组(P< 0.05)。Con+LS组及Con+HS组体重、心体比较DCM组略有改善,但与Con组相比仍明显异常(P< 0.05)且与DCM组比差异无显著性(P> 0.05)。参芍口服液干预对正常大鼠体重、心体比无影响(P> 0.05),见表1。
2.2 参芍口服液对DCM大鼠模型心功能的影响
与Con组比较,DCM组大鼠左心室收缩压(LVSP)、左心室舒张末期压力(LVEDP)及左心室最大收缩/舒张速率(±dp/dtmax)绝对值下降(P< 0.05)。Con+LS组及Con+HS组LVSP、LVEDP、±dp/dtmax 绝对值则较DCM组升高(P< 0.05)。而参芍口服液对正常大鼠心功能差异无显著性(P> 0.05),见表2。
2.3 各组大鼠血浆心肌酶、hsCRP的变化及相关性
与CON组相比,DCM组血浆CK、LDH、hsCRP含量明显升高(P< 0.05),Con+LS组及Con+HS组则较DCM组降低(P< 0.05),且hsCRP与CK、LDH呈正相关(r=0.753,r=0.819,P< 0.05),见表3。
2.4 参芍口服液对DCM大鼠模型病理改变的影响
HE:Con组大鼠心肌纤维排列整齐、紧密,胞核均一,边界清晰;DCM组大鼠心肌纤维断裂、肿胀,排列紊乱、疏松,胞核不均,边界不清晰,可见局灶性坏死;Con+LS组及Con+HS组大鼠上述病理改变在一定程度上有所改善,且参芍口服液对正常大鼠无影响,见图1。

表1 各组大鼠的一般情况
注:与空白组相比,*P< 0.05。
Note.Compared with the control group,*P< 0.05.
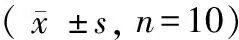
表2 参芍口服液对各组大鼠心功能的影响
注:与空白组相比,*P< 0.05;与模型组相比,#P< 0.05。
Note. Compared with the control group,*P< 0.05;Compared with the diabetic cardiomyopathy group,#P< 0.05.

表3 参芍口服液对各组大鼠心肌酶、hsCRP的影响
注:与空白组相比,*P< 0.05;与模型组相比,#P< 0.05。
Note. Compared with the control group,*P< 0.05;Compared with the diabetic cardiomyopathy group,#P< 0.05.
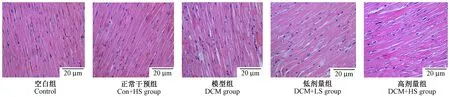
图1 各组大鼠心肌组织HE染色(×400)Fig.1 Myocardial changes of the rat heart in the 5 groups. HE staining
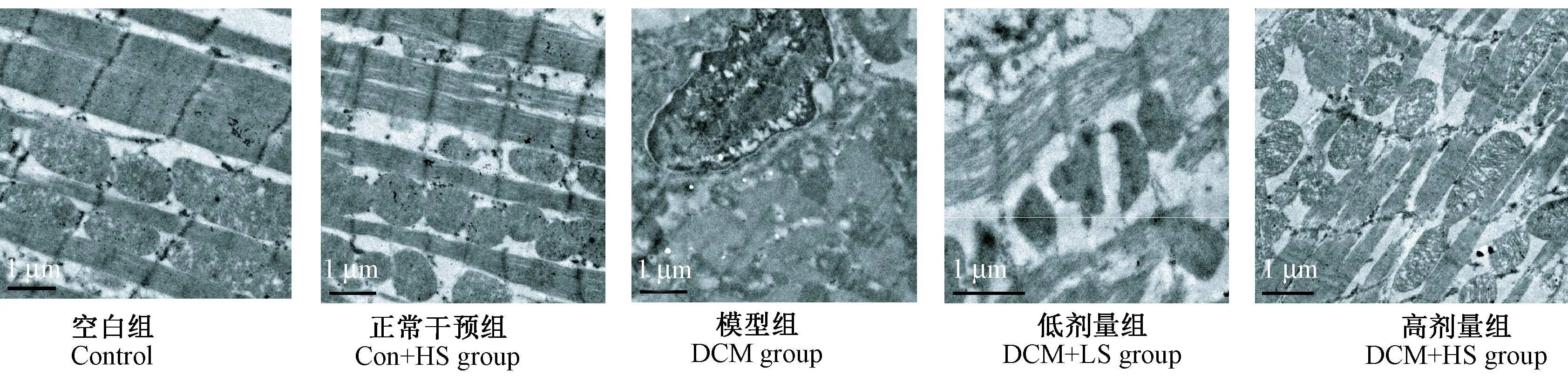
图2 各组大鼠心肌组织透射电镜观察(×8000)Fig.2 Electronmicrographs of rat cardiomyocytes in the 5 groups
电镜:Con组心肌纤维排列整齐,含有大量肌丝,肌小节Z线清晰可见,胞质中含有丰富的线粒体,呈圆形或椭圆形,嵴完整且排列有序;DCM组肌原纤维片状坏死、溶解,胞核固缩、坏死,线粒体肿胀、变性溶解,嵴断裂,形成空泡区;参芍口服液干预各组心肌病变减轻,且Con+HS组较Con+LS组改善明显,见图2。
2.5 参芍口服液对DCM大鼠心肌TLR4、MyD88、NF-κB p65表达的影响
TLR4、MyD88、NF-κB p65阳性表达信号为黄色至棕黄色颗粒,在DCM组中心肌细胞胞质中可见大量棕黄色颗粒,其累积光密度(IOD)较Con组显著升高(P< 0.05)。经参芍口服液干预后,TLR4、MyD88、NF-κB p65表达减少,且Con+HS组下降较Con+LS组更为显著。参芍口服液干预的正常大鼠心肌组织中MyD88、NF-κB p65表达较正常大鼠下降,但其累积光密度差异无显著性(P> 0.05),见图3~6。

图3 TLR4在各组中的表达(×400)Fig.3 Expression of TLR4 in rat cardiomyocytes in the 5 groups

图4 MyD88在各组中的表达(×400)Fig.4 Expression of MyD88 in rat cardiomyocytes in the 5 groups
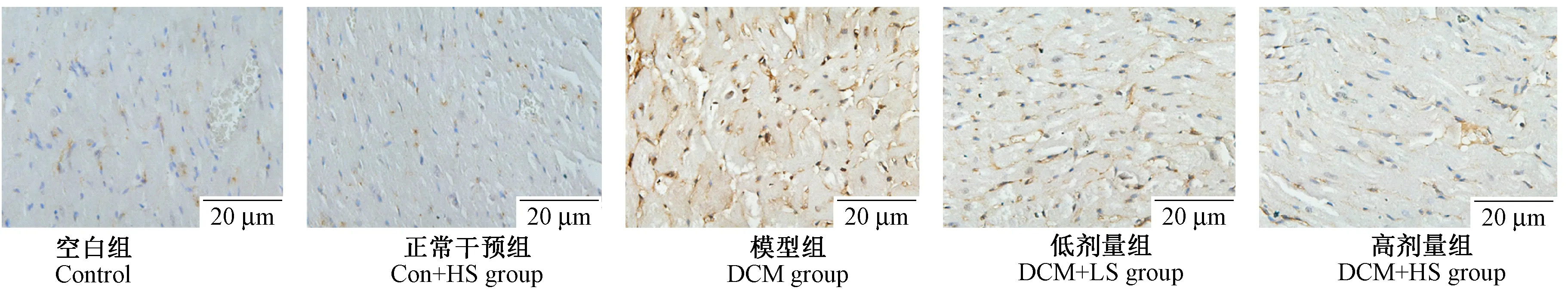
图5 NF-κB p65在各组中的表达(×400)Fig.5 Expression of NF-κB p65 in rat cardiomyocytes in the 5 groups

注:与空白组相比,*P < 0.05;与模型组相比,#P < 0.05;与参芍口服液低剂量组相比,△P< 0.05。图6 TLR4、MyD88、NF-κB p65在各组表达的累积光密度值Note. Compared with the control group,*P < 0.05;Compared with the diabetic cardiomyopathy group,#P < 0.05;Compared with the control+low dose Shenshao decoction group,△P < 0.05.Fig.6 Intergrated optical density of TLR4,MyD88,NF-κB in myocardium of rats in the 5 groups
3 讨论
研究发现,免疫炎症参与糖尿病心肌病早期病理过程,是DCM发生发展的重要病因之一[7,8]。Toll样受体是作为先天免疫系统重要的一员,已证实在动脉粥样硬化、病毒性心肌炎、扩张型心肌病,心脏移植排斥反应和脓毒症所致的左心室功能障碍中可发挥重要作用[9]。TLR4是Toll样受体家族中介导炎症反应的主要受体之一[10],张雨薇等[11]通过实验证明沉默TLR4基因可减轻STZ糖尿病小鼠的心肌损伤;他汀类药物可通过抑制TLR4信号通路,阻断炎症介质和细胞因子释放,发挥对糖尿病大鼠心肌的保护作用[12]。李跃华等[13]发现MyD88依赖性NF-κB信号途径在心肌肥大过程中发挥重要作用。故推测TLR4/MyD88通路可能在DCM早期炎症损伤中也发挥重要作用。机体在长期高糖条件下产生AGEs、FFA等物质作为内源性配体激活TLR4,TLR4活化后其TIR结构域发生构象变化,可与MyD88的TIR结构域结合[14],最终使NF-κB/I-κB三聚体中的I-κB磷酸化而失活,NF-κBp65解离发生核移位、活化进入细胞核内,促进相关基因转录[15],导致下游炎症因子如IL-6、TNF等表达增强,产生炎症级联反应,最终导致心肌损伤。本实验中,DCM组hsCRP明显升高,且与心肌酶水平呈正相关,提示糖尿病心肌损害与炎症反应存在联系。免疫组织化学结果进一步显示,DCM组大鼠的心肌组织中NF-κB随着TLR4和MyD88的表达提高而上调,与预期结果一致,提示TLR4-NF-κB炎性信号通路参与了DCN早期炎症损伤的发生与发展,且其信号转导可能是通过MyD88依赖性途径进行的。
参芍口服液以活血化瘀为治疗原则, 兼以补气通络,可以增加外周血流量,抑制炎症、保护血管内皮等[16]。薛忠文等[17]证实参芍口服液可降低动脉粥样硬化大鼠主动脉IL-1β,IL-17A,IL-23的表达水平,通过抑制大鼠炎性反应减轻主动脉粥样斑块的进展。并有研究证实,参芍口服液可降低心肌梗死[18]及冠状动脉粥样硬化[5]大鼠外周血VCAM-1的表达。实验中参芍口服液干预后糖尿病大鼠炎性标志物hsCRP与炎症因子IL-6含量降低,且TLR4、MyD88、NF-κB的表达较模型组明显下调,提示参芍口服液可能通过抑制TLR4炎症反应通路减轻了糖尿病大鼠心肌组织炎症反应的程度,近而发现糖尿病大鼠的心肌病理损伤减轻,表现为心肌细胞排列整齐、紧密,断裂、肿胀减少,透射电镜可见心肌纤维呈束状排列,坏死及溶解区少见,可见Z线;同时糖尿病大鼠的心功能也得到改善,因此得出参芍口服液可能通过抑制TLR4/MyD88介导的下游炎症因子的表达,对DCM大鼠心肌炎症损伤及功能起保护作用这一结论。
本实验证实在糖尿病心肌病大鼠模型中,TLR4/MyD88依赖性信号通路高表达,并推测参芍口服液可能是通过抑制该通路来抑制NF-κB表达,继而抑制免疫炎症的级联反应,提示参芍口服液可能通过抑制糖尿病大鼠心肌炎症反应从而达到保护心脏结构及功能的作用,但其具体机制尚需进一步研究与证实。本实验为参芍口服液治疗糖尿病心肌病的作用机制提供了新的方向,同时也提出了对TLR4/MyD88依赖性信号通路进行干预可能成为治疗糖尿病心肌病的新靶点。
[1] Isfort M, Stevens SC, Schaffer S, et al. Metabolic dysfunction in diabetic cardiomyopathy[J]. Heart Fail Rev, 2014, 19(1):35-48.
[2] Drimal J, Knezl V, Navarova J, et al. Role of inflammatory cytokines and chemoattractants in the rat model of streptozotocin-induced diabetic heart failure[J]. Endocr Regul, 2008, 42(4):129-135.
[3] Van Linthout S, Riad A, Dhayat N, et al. Anti-inflammatory effects of atorvastatin improve left ventricular function in experimental diabetic cardiomyopathy[J]. Diabetologia, 2007, 50(9):1977-1986.
[4] Takeuchi O,Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6):805-820.[5] 薛忠文, 董天崴, 张琦,等. 参芍口服液对冠状动脉粥样硬化大鼠主动脉IL-8、VCAM-1、ICAM-1表达的影响[J]. 中成药, 2012, 34(11):2077-2081.
[6] 张琦, 刘晓堃, 李映雪,等. 参芍口服液对冠状动脉介入治疗术后再狭窄的影响[J]. 中国动脉粥样硬化杂志, 2013, 21(10): 903-906.
[7] Westermann D, Van Linthout S, Dhayat S, et al. Cardioprotective and anti-inflammatory effects of interleukin converting enzyme inhibition in experimental daibetic cardiomyopathy[J]. Diabetes, 2007, 56(7):1834-1841.[8] Westermann D, Van Linthout S, Dhayat S, et al. Tumor necrosis factor-alpha antagonism protects from myocardial inflammation and fibrosis in experimental diabetic cardiomyopathy[J]. Basic Res Cardiol, 2007, 102(6):500-507.
[9] Vallejo JG. Role of Toll-like receptors in cardiovascular diseases[J]. Clin Sci, 2011, 121(1):1-10.
[10] Akira S, Taked.Toll-like receptor signalling[J]. Nat Rev Immunol, 2004, 4(7):499-500.[11] 张雨薇,马建,郑秀芬,等.沉默TLR4基因对STZ糖尿病小鼠心肌损伤的影响[C].中华医学会第十次全国内分泌学学术会议论文汇编,2011.
[12] 吕莎莎,刘宽芝.辛伐他汀降低2型糖尿病大鼠心肌TOLL样受体4表达[J].中国循环杂志,2014,29(1):64-67.
[13] 李跃华, 哈团柱, 陈琪,等. MyD88依赖性核因子-κB在心肌肥大发生过程中的作用[J]. 中华医学杂志, 2005, 85(4):267-272.
[14] Kaisho T, Akira S. Toll-like receptor function and signaling.[J]. J Allergy Clin Immunol, 2006, 117(5):979-987.
[15] Kawai T, Akira S. Signaling to NF-κB by Toll-like receptors[J]. Trends Mol Med, 2007, 13(11):460-469.
[16] 陈晨,刘倩,高华. 活血化瘀药药理作用研究进展[J]. 中国药事, 2011, 25(6):603-605.
[17] Xue ZW, Shang XM, Lv SS, et al. Effects of Shenshao decoction on the inflammatory response in the aorta of a rat atherosclerotic model[J]. Chin J Integr Med, 2013, 19(5):347-352.
[18] 张春来, 尚小明, 许丹,等. 心肌梗死大鼠外周血中血管内皮因子水平与参芍宽心合剂的干预作用[J]. 中国组织工程研究与临床康复, 2007, 11(45):9039-9042.
(1.华北理工大学/河北省慢性疾病重点实验室/唐山市慢性病临床基础研究重点实验室,河北 唐山 063000; 2.唐山市工人医院,河北 唐山 063000)
目的 探讨参芍口服液在糖尿病心肌病(diabetic cardiomyopathy,DCM)大鼠结构功能损伤中的作用及其可能机制。方法 一次性腹腔注射大剂量链脲佐菌素诱导糖尿病大鼠模型。测定血浆心肌酶(CK、LDH)、超敏C反应蛋白(hsCRP)的变化,左心室插管测定大鼠心功能,苏木素-伊红染色、透射电镜观察大鼠心肌病理改变,免疫组织化学法检测Toll样受体4(TLR4)、髓样分化蛋白(MyD88)及核因子κB P65(NF-κB P65)表达。结果 治疗6周后,DCM大鼠左心室舒张和收缩功能明显改善;心肌纤维及线粒体肿胀、断裂、坏死减少,结构紧密,排列整齐;CK、LDH、hsCRP含量降低(P< 0.05),且hsCPR与CK、LDH呈正相关(r=0.753,r=0.819,P< 0.05);TLR4、MyD88、NF-κB P65表达明显下调(P< 0.05)。而参芍口服液干预的正常大鼠上述指标无明显改变(P> 0.05)。结论 参芍口服液可减轻糖尿病心肌病大鼠心肌损伤,改善心脏舒张和收缩功能,其机制可能与抑制TLR4/MyD88信号通路诱导的炎症反应有关。
参芍口服液;糖尿病心肌病;心功能;TLR4/MyD88;炎症
Shenshao decoction improves myocardial inflammatory injury in diabetic rats by regulation of TLR4/MyD88 pathway
ZHANG Hong-li1, JIA Chun-xin1, LI Hai-ou1, ZHOU Hong-xia1, ZHANG Chun-lai2*
(1.North China University of Science and Technology/Hebei Key Laboratory for Chronic Diseases/Tangshan Key Laboratory for Preclinical and Basic Research on Chronic Diseases,Tangshan 063000,China; 2.Tangshan Worker’s Hospital, Tangshan 063000)
Objective To investigate the improving effects of Shenshao decoction on myocardial structure and function in diabetic cardiomyopathy,and its effect on expression of TLR4/MyD88-dependent pathway signal in diabetic cardiomyopathy. Methods Diabetes mellitus was induced in 8-week-old male Wistar rats by a single intraperitoneal injection of streptozotocin. The changes of plasma myocardial enzyme (CK, LDH) and high sensitive C reactive protein (hsCRP) were measured. Cardiac function was measured by left ventricular intubation. Hematoxylin and eosin staining and electron microscopy were used to observe the changes of myocardial morphology and ultrastructure in rats. Expression of Toll-like receptor 4(TLR4), myeloid differentiation protein 88(MyD88), and nuclear factor-κB P65(NF-κB P65) were tested by immunohistochemistry. Results After 6 weeks of treatment, the left ventricular diastolic and systolic functions were obviously improved;the degrees of myocardial fibers and mitochondrial damage were obviously relieved;the content of CK, LDH and hsCRP decreased (P< 0.05), and hsCPR was positively correlated with CK and LDH (r=0.823,r=0.819,P< 0.05).The expressions of TLR4, MyD88, NF-κB P65 were significantly decreased (P< 0.05).There was no significant difference in the above mentioned indicators between the control group and control+Shenshao decoction group (P> 0.05). Conclusions Shenshao decoction can reduce the myocardial injury in diabetic cardiomyopathy and improve cardiac diastolic and systolic functions.The mechanism may be related to attenuated inflammation by TLR4/MyD88 dependent signaling pathway.
Shenshao decoction; Diabetic cardiomyopathy; Cardiac function; TLR4/MyD88; Inflammation; Rats
张红利(1989-),女,硕士研究生。E-mail: hongli2618@sina.com
张春来,教授,硕士研究生导师。E-mail: 120zcl@sina.com
R-33
A
1671-7856(2017) 08-0028-06
10.3969.j.issn.1671-7856. 2017.08.006
2017-02-08

