实验动物四种病原体多重PCR方法的建立与应用
祝岩波,徐增年,魏世锦,郑 龙,尤红煜,孟钰榕,刘福英,梁晓亮,王俊霞*
技术方法
实验动物四种病原体多重PCR方法的建立与应用
祝岩波1,徐增年1,魏世锦2,郑 龙1,尤红煜1,孟钰榕1,刘福英1,梁晓亮3,王俊霞1*
多杀巴氏杆菌(Pasteurellamultocida)、支气管鲍特杆菌(Bordetellabronchiseptica)、支原体(Mycoplasmapneumoniae)和肺炎克雷伯杆菌(Klebsiellapneumoniae)是实验动物的常见病原微生物,能引起许多哺乳动物呼吸系统的隐性感染甚至死亡[1]。近几年实验动物质量监测结果显示,以上四种病原微生物阳性时有发生[2-4]。目前我国实验动物微生物等级及监测标准为多杀巴氏杆菌(GB/T 14926.5-2001),支气管鲍特杆菌(GB/T 14926.6-2001),支原体(GB/T 14926.8-2001),肺炎克雷伯杆菌(GB/T 14926.13-2001)。上述四种病原微生物采用的检测方法是传统的分离培养和生化鉴定方法,此种方法费时费力,而且实验人员需要具备较高的专业素质,因此急需建立一种更为简便,快速的检测方法。目前分子生物学方法对于细菌、病毒的检测已得到广泛应用,四种病原微生物的单一PCR方法已有报道,但同时检测四种病原微生物的方法尚未建立[6,8-15],本研究建立了能够同时检测上述四种病原微生物的多重PCR方法并且完成初步应用,为其快速检测和诊断提供实验依据。
1 材料和方法
1.1 实验材料
1.1.1 菌株
本实验所用肺支原体(NCTC10540)由中国食品药品检定研究院惠赠,多杀巴氏杆菌(K8123)购自温州康泰生物科技有限公司,支气管鲍特杆菌(CGMCC1.2418)购自中国微生物菌种保藏中心,肺炎克雷伯杆菌(CMCC46117)购自广东省微生物菌种保藏中心。金黄色葡萄球菌(ATCC6538)由石家庄市疾控中心惠赠。乙型溶血性链球菌(CMCCB32210)、乙型副伤寒沙门氏菌(CMCCB50094)、大肠埃希菌(CMCC44102)、肺炎链球菌(CMCCB31001)购自北京北纳创联生物技术研究院。
1.1.2 动物样本
随机抽检河北省实验动物中心和山西省实验动物中心45只清洁级实验动物的气管及分泌物和鼻棉拭子,其中包含20只小鼠,5只大鼠,10只兔,5只豚鼠,5只地鼠,动物购买后于开放环境中饲养数日。
1.1.3 引物
根据多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌的特异性区域设计相应引物,引物基因、引物序列、产物长度和文献出处见表1。引物由生工生物工程(上海)股份有限公司合成。
1.2 主要试剂与仪器
DHL琼脂平皿,血琼脂平皿,支原体培养基,均购自北京三药科技开发公司;细菌基因组DNA提取试剂盒购自天根生物有限公司;细菌生化鉴定管购自杭州天和微生物试剂有限公司;Mix购自康为世纪;Tris购自Solarbio公司;DNA Ladder购自南京诺唯赞生物科技有限公司;琼脂糖Agarose购自BIOWEST公司;核酸染料ExRed购自北京庄盟国际生物基因科技有限公司;支原体ELISA检测试剂盒购自苏州西山生物技术有限公司。
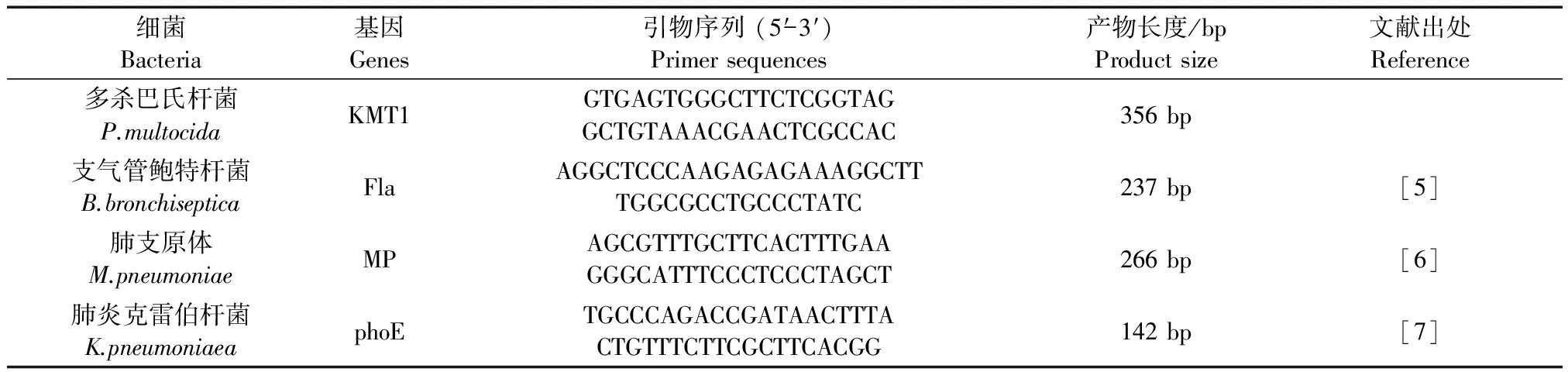
表 1 引物序列
再鑫仪器有限公司生物安全柜;上海跃进医疗器械厂PYX-DHS隔水式电热恒温培养箱;NanoDrop 基因公司ND-1000 Spectrophotometer;美国UVPGDS-8000凝胶成像系统;北京君意东方电泳设备有限公司JY600E电泳仪;美国GeneAmp 9700PCR;德国 Heraeus高速冷冻离心机;无锡县电化教具厂JLQ-S1菌落计数器。
1.3 实验方法
1.3.1 细菌DNA的提取
多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌四株标准菌株复苏培养后,用天根细菌基因组DNA提取试剂盒按照使用说明提取基因组DNA。经紫外分光光度计检测,测取各菌株的浓度,并将各菌株浓度稀释为10 ng/μL。
1.3.2 气管分泌物和鼻棉拭子DNA的提取
将动物气管浸泡在酵母浸出液中,或将鼻棉拭子泡在酵母浸出液中震荡,其余按天根细菌基因组DNA提取试剂盒使用说明提取基因组DNA。
1.3.3 PCR反应体系和反应条件
PCR反应体系为50 μL,包括:Mix 25 μL,引物浓度分别为多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌0.2 μmol/L,DNA各10 ng。反应条件为94℃ 5 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,共30 个循环; 72℃ 7 min。PCR产物在2.5% 琼脂糖凝胶中,120 V 电泳30 min。
1.3.4 特异性检测
用所建立的多重PCR体系分别扩增金黄色葡萄球菌、乙型溶血性链球菌、乙型副伤寒沙门氏菌、大肠埃希菌、肺炎链球菌分离株来检测所建方法的特异性。
1.3.5 敏感性检测
将四种病原体的DNA按1:10的比例进行稀释,稀释后浓度分别为10 ng/μL,1 ng/μL,100 pg/μL,10 pg/μL,1 pg/μL,100 fg/μL,同时设置阴性空白对照,检验多重PCR的敏感性。
1.3.6 应用
用四种病原体多重PCR方法检测5种人工感染样本和45例实验动物气管及分泌物和鼻棉拭子。
1.3.7 血清学方法
根据肺支原体ELISA检测试剂盒操作检测肺支原体的感染情况。
1.3.8 传统培养方法
取气管分泌物和鼻咽棉拭子分别涂在血平皿培养36~48 h和DHL琼脂平皿18~24 h,根据国家标准多杀巴氏杆菌(GB/T 14926.5-2001),支气管鲍特杆菌(GB/T 14926.6-2001),肺炎克雷伯杆菌(GB/T 14926.13-2001)鉴定三种病原体的感染情况。
2 结果
2.1 特异性
用建立的多重PCR方法扩增金黄色葡萄球菌、乙型溶血性链球菌、乙型副伤寒沙门氏菌、大肠埃希菌、肺炎链球菌,结果显示仅第一管扩增目的条带,无其他阳性产物(见图1)。
2.2 敏感性
四种病原微生物多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌多重PCR敏感性实验结果显示,肺炎克雷伯杆菌DNA最低检测质量均为10 pg,其他三种DNA最低检测质量均为1 pg,见图2。四种病原微生物单重PCR的敏感性结果显示肺炎克雷伯杆菌DNA最低检测质量均为10 pg,其他三种DNA最低检测质量均为1 pg,见图3。

注:(M)100 bp DNA Ladder;(1)阳性对照;(2)金黄色葡萄球菌;(3)乙型溶血性链球菌;(4)乙型副伤寒沙门氏菌;(5)大肠埃希菌;(6)肺炎链球菌。图1 多重PCR特异性Note.(M)100 bp DNA Ladder;(1)Positive control;(2)Staphylococcus aureus;(3)β-hemolytic streptococcus;(4)Salmonella paratyphi;(5)Escherichia coli;(6)Streptococcus pneumoniae.Fig.1 Specificity of the multiplex PCR assay
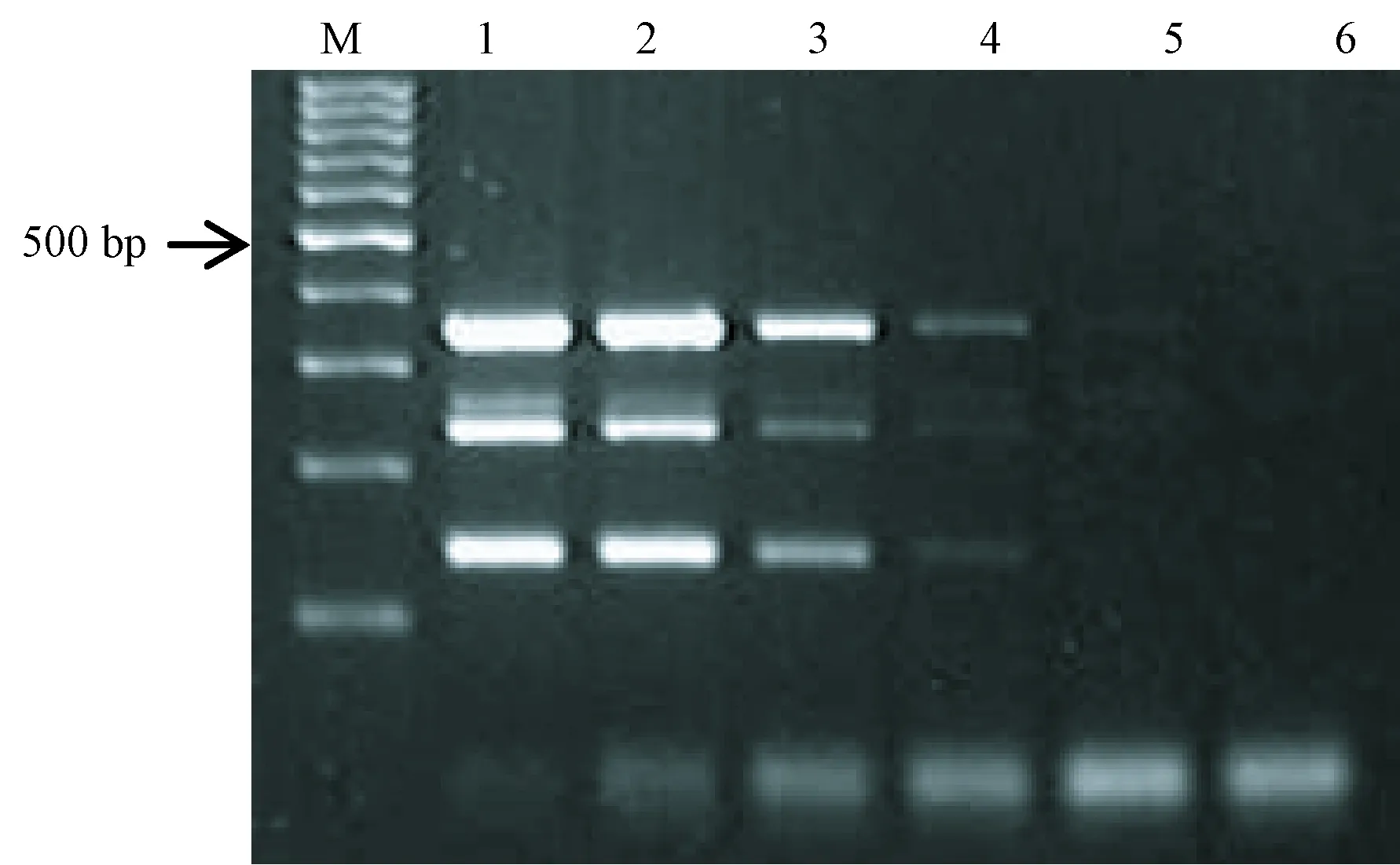
注:(M)100 bp DNA ladder;(1~6)质量分别为10 ng、1 ng、100 pg、10 pg、1 pg、100 fg。图2 多重PCR敏感性Note.(M)100 bp DNA ladder;(1~6)The quantity was of 10 ng,1 ng,100 pg,10 pg,1 pg, and 100 fg, respectively.Fig.2 Sensitivity of the multiplex PCR assay

注:(M)100 bp DNA ladder;(1~6)质量分别为10 ng、1 ng、100pg、10 pg、1 pg、100 fg;(A)支气管鲍特杆菌;(B)支原体;(C)多杀巴氏杆菌;(D)肺炎克雷伯杆菌。图3 单重PCR敏感性Note.(M)100 bp DNA ladder;(1~6)The quantity was 10 ng,1 ng,100 pg,10 pg,1 pg, and 100 fg,respectively;(A)Bordetella bronchiseptica;(B)Mycoplasma pneumoniae;(C)Pasteurella multocida;(D)Klebsiella pneumoniae.Fig.3 Sensitivity of the single PCR assay
2.3 应用
使用多重PCR方法对人工感染的气管及分泌物DNA样本进行扩增,结果显示与预期结果一致,并无非特异性产物扩增(见图4);用多重PCR体系对收集的45份动物气管及分泌物和鼻棉拭子DNA检测,结果显示9只小鼠同时扩增出多杀巴氏杆菌和肺支原体阳性的目的条带,1只小鼠和5只兔扩增出多杀巴氏杆菌阳性的目的条带(见图5)。
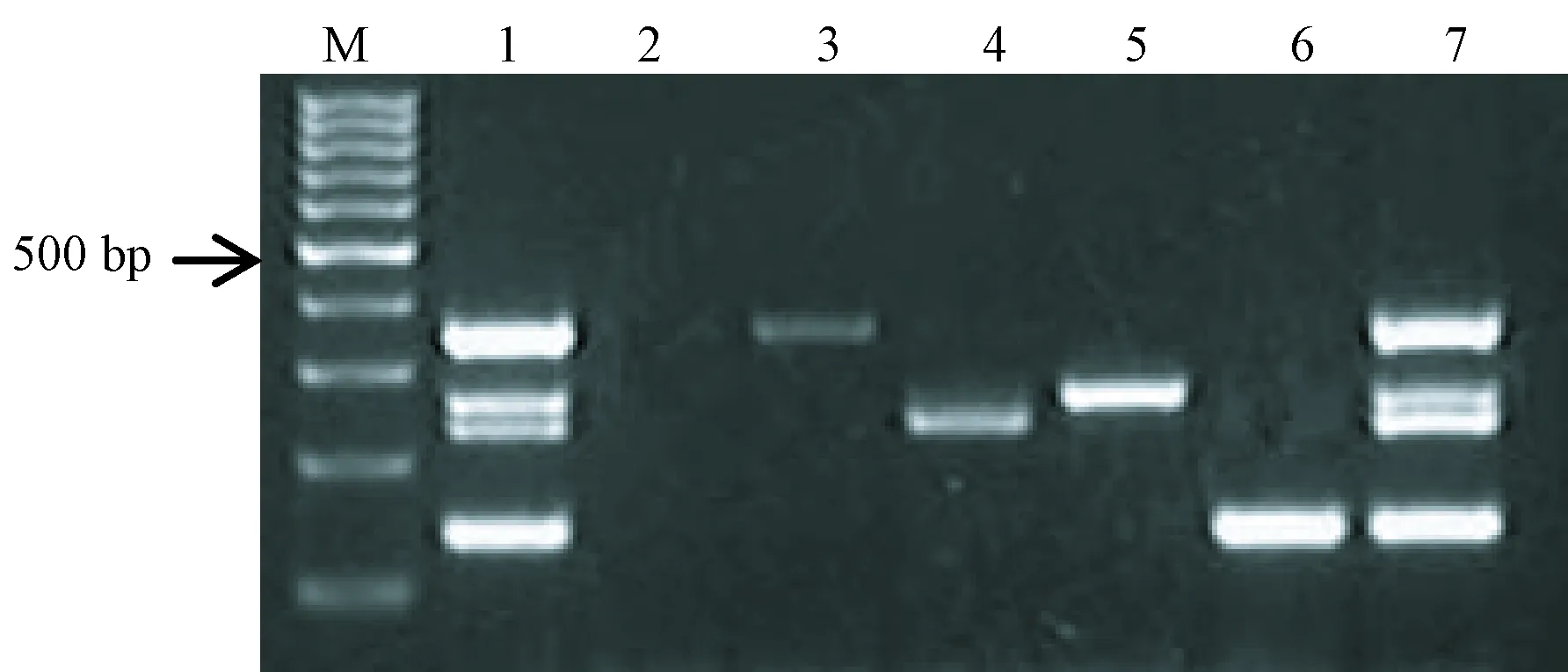
注:(M)100 bp DNA ladder;(1)阳性对照;(2)阴性对照;(3)加多杀巴氏杆菌;(4)加支气管鲍特杆菌;(5)加支原体;(6)加肺炎克雷伯杆菌;(7)加多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌。图4 多重PCR的人工感染标本检测结果Note.(M)100 bp DNA ladder;(1)Positive control;(2)Negative control;(3)Pasteurella multocida;(4)Bordetella bronchiseptica;(5)Mycoplasma pneumoniae;(6)Klebsiella pneumoniae;(7)The four bacteria.Fig.4 Results of the multiplex PCR detection of artificial positive samples
3 讨论
多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌属我国实验动物必须排除的病原微生物。目前我国以上四种病原微生物的检测仍采用国家标准推荐的传统的分离培养方法和生化鉴定。该方法经典、准确,但操作繁琐,费时,实验条件限定和检测人员的主观判定使得该方法各检测室之间易出现结果的差异。因此急需建立一种快速、准确的新检测方法。
本研究在参考前人单重PCR研究的基础上[5-7],参照GenBank中多杀巴氏杆菌(KMT1)、支气管鲍特杆菌(Fla)、支原体(16S rRNA)和肺炎克雷伯杆菌(phoE)的基因序列,在其高度保守区设计一对特异性引物,建立多重PCR体系。通过对金黄色葡萄球菌、乙型溶血性链球菌、乙型副伤寒沙门氏菌、大肠埃希菌、肺炎链球菌的扩增表明,本实验建立的PCR检测方法特异性强;敏感性实验中肺炎克雷伯杆菌DNA最低检测质量均为10 pg,其他三种DNA最低检测质量均为1 pg,多重PCR与单重PCR的敏感性结果一致,结果表明该多重PCR方法具有很高的敏感性,多重PCR不会影响其单重的敏感性。
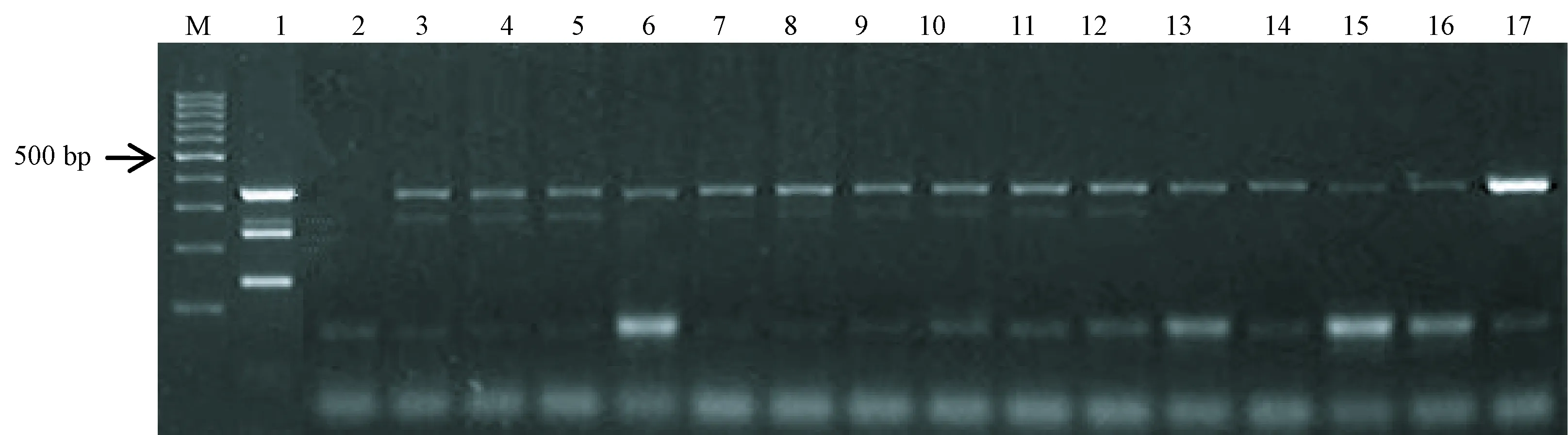
注:(M)100 bp DNA ladder;(1)阳性对照;(2)阴性对照;(3~12)小鼠气管分泌物和鼻棉拭子样本;(13~17)兔气管分泌物和鼻棉拭子样本。图5 多重PCR气管及分泌物样本检测结果Note.(M)100 bp DNA ladder;(1)Positive control;(2)Negative control;(3~12)Tracheal secretion and cotton swab samples of mice;(13~17)Tracheal secretion and cotton swab samples of rabbits.Fig.5 Results of the multiplex PCR detection of tracheal secretion and cotton swab samples
考虑到样本DNA提取物可能影响多重PCR反应特异性,本研究将多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌分别混入到动物气管及分泌物中,提取总DNA,多重PCR方法扩增结果与预期结果一致,能够准确的检测掺入的病原微生物,甚至是四种全部,并且没有非特异性扩增。为了验证本方法在实际实验动物病原菌检测中的应用性,收集河北省实验动物中心和山西省实验动物中心20只小鼠,5只大鼠,10只兔,5只豚鼠,5只地鼠,共45只实验动物的气管及分泌物和鼻棉拭子,提取总DNA,使用多重PCR方法检测四种病原微生物,同时根据国家标准的传统方法和血清学方法做对比,结果显示45份样本中显示9只小鼠同时扩增出多杀巴氏杆菌和肺支原体阳性的目的条带, 1只小鼠和5只兔扩增出多杀巴氏杆菌阳性的目的条带,但传统方法和血清学方法并未检测出阳性结果,45份样本中多重PCR方法优于传统和血清学方法,初步验证本方法的可行性。本文建立的多重PCR方法旨在呼吸系统疾病的检测,便于对实验动物进行长期的微生物监测,达到质量控制标准。该多重PCR方法适用于实验动物的微生物学检测,可初步应用于无创呼吸系统疾病、垫料、常规的病原检测和笼具环境的检测。鼻棉拭子取材简便,利于实验动物微生物学检测的大面积的筛查。下面的工作,将进一步扩大检测样本量验证本方法的准确性和实用性。本方法有良好的重复性,操作简单、快速,成本较低,可以在实验动物微生物检测中进一步应用。
[1] 田克恭,贺争鸣,刘群,等.实验动物疫病学[M].北京,中国农业出版社,2015.
[2] 王保宁,宁磊.兰州地区实验动物肺支原体感染调查和分离鉴定[J].中国实验动物学报,2001,9(4):239-241.
[3] 魏杰,林建伟,付瑞,等. 2009—2013 年北京地区实验动物质量抽检结果分析[J].实验动物科学,2014,31(2):1-6.
[4] 葛文平,张旭,高翔,等. 我国商业化SPF 级小鼠病原体污染分析[J].中国比较医学杂志,2012,22(3):65-68.
[5] Hozbor D, Fouque F, Guiso N.Detection of Bordetella bronchiseptica by the polymerase chain reaction[J].Res Microbiol,1999,150(5):333-341.[6] Ferreira JB, Yamaguti M, Marques LM,et al.Detection of Mycoplasma pulmonis in laboratory rats and technicians[J].Zoonoses Public Health,2008,55(5): 229-234.
[7] 井发红,慕玉东,辛娜,等.实时荧光定量PCR检测血流感染常见病原菌的临床应用[J].山西医科大学学报,2015,46(11):1126-1129.
[8] Hozbor D, Fouque F, Guiso N.Detection of Bordetella bronchiseptica by the polymerase chain reaction[J]. Res. Microbiol, 1999,150 (5):333-341. [9] Townsend KM, Frost AJ, Lee CW,et al. Development of PCR assays for species- and type-specific identification of Pasteurella multocida isolates[J]. J Clin Microbiol,1998,36(4):1096-1100.
[10] Miflin JK, Blackall PJ. Development of a 23S rRNA-based PCR assay for the identification of Pasteurella multocida[J]. Lett Appl Microbiol,2001, 33(3):216-221.
[11] Zigangirova NA, Popova OV, Solovjeva CV,et al. Development of a PCR-based method for diagnosing Mycoplasma pneumoniae infections[J]. Lett Appl Microbiol,1993, 16(2):106-109.
[12] Shivachandra SB, Kumar AA, Gautam R,et al. PCR assay for rapid detection of Pasteurella multocida serogroup A in morbid tissue materials from chickens with fowl cholera[J]. Vet J,2004,168 (3):349-352.
[13] Coutinho TA, Bernardi ML, de Itapema Cardoso MR,et al. Performance of transport and selective media for swine Bordetella Bronchiseptica recovery and it comparison to polymerase chain reaction detection[J].Braz J Microbiol,2009,40(3): 470-479.
[14] Buck GE, O’Hara LC, Summersgill JT. Rapid, sensitive detection of Mycoplasma pneumoniae in simulated clinical specimens by DNA amplification[J]. J Clin Microbiol, 1992, 30(12):3280-3283.[15] Neuberger A, Oren I, Sprecher H. Clinical impact of a PCR assay for rapid identification of Klebsiella pneumoniae in blood cultures[J]. J Clin Microbiol,2008,46(1):377-379.
(1.河北省实验动物重点实验室,河北医科大学实验动物学部,石家庄 050000; 2.柏乡县中心医院, 石家庄 050000; 3.河北医科大学第四医院,石家庄 050000)
目的 建立快速检测多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌4种实验动物病原体的多重PCR方法。方法 根据GenBank基因设计出特异性引物;经过多重PCR的优化,特异性和敏感性的检测,建立多重PCR体系。应用该PCR体系检测人工感染样本和实验动物的气管分泌物,并与传统方法做对比。结果 多重PCR扩增出多杀巴氏杆菌(356 bp)、支气管鲍特杆菌(237 bp)、支原体(266 bp)和肺炎克雷伯杆菌(142 bp)的目的条带。肺炎克雷伯杆菌敏感性为10 pg,多杀巴氏杆菌、支气管鲍特杆菌、支原体敏感性为1 pg,特异性检测未从其他病原菌中检测出目的条带。应用建立的多重PCR体系检测人工感染样本的不同组合,45只实验动物气管检测出15只多杀巴氏杆菌阳性,9只肺支原体阳性,但传统培养方法和血清学方法未检测出阳性标本。结论 本文建立的多重PCR方法操作简单、快速、特异性强、灵敏度高,能够实现对多杀巴氏杆菌、支气管鲍特杆菌、支原体和肺炎克雷伯杆菌4种实验动物病原体的快速检测。
多杀巴氏杆菌;支气管鲍特杆菌;支原体;肺炎克雷伯杆菌;多重PCR
Establishment and application of a multiplex PCR assay for four pathogens in laboratory animals
ZHU Yan-bo1, XU Zeng-nian1, WEI Shi-jin2, ZHENG Long1, YOU Hong-yu1, MENG Yu-rong1, LIU Fu-ying1, LIANG Xiao-liang3, WANG Jun-xia1*
(1.Key Laboratory of Laboratory Animals, Hebei province, Department of Laboratory Animals, Hebei Medical University, Shijiazhuang 050000, China; 2. Baixiang County Central Hospital, Shijiazhuang 050000; 3.Fourth Hospital of Hebei Medical University,Shijiazhuang 050000)
Objective The aim of this study is to establish a multiplex polymerase chain raction (PCR) to identify of four kinds of laboratory animal pathogens:Pasteurellamultocida,Bordetellabronchiseptica,MycoplasmapneumoniaeandKlebsiellapneumoniae. Methods Specific primers were designed based on GenBank data. The multiplex PCR system was established through optimization of multiple PCR and detection of its specificity and sensitivity. This technique was used to test artificially infected samples and tracheal secretions of experimental animals (rat, mouse, guinea pig, rabbit, hamster), and comparing the detection results by this method and traditional detection test. Results Target bands ofPasteurellamultocida(356 bp),Bordetellabronchiseptica(237 bp),Mycoplasmapneumoniae(266 bp), andKlebsiellapneumoniae(142 bp) were obtained, with a detection sensitivity ofKlebsiellapneumoniaeof 10 pg, and that of Pasteurella multocida, Bordetella bronchiseptica and Mycoplasma pneumoniae of 1 pg by this newly developed multiplex PCR assay. No target bands were observed from the non-specific pathogens of artificially infected samples. The tracheal secretions taken from 45 experimental animals (mice and rabbits) were tested with this new PCR assay, among which 15 cases ofKlebsiellapneumoniaand 9 cases ofPasteurellamultocidawere detected as positive, while all the results of traditional method and serological test were negative. Conclusions A simple, rapid, specific and highly sensitive multiplex PCR system has been successfully established.It is valuable for detection ofPasteurellamultocida,Bordetellabronchiseptica,Mycoplasmapneumoniae,andKlebsiellapneumoniaein laboratory animals.
Pasteurellamultocida;Bordetellabronchiseptica;Mycoplasmapneumoniae;Klebsiellapneumonia; Multiplex PCR
国家科技支撑计划(2015BAI07B02-05)。
祝岩波(1990-),女,硕士研究生,专业:动物学。E-mail:787211186@qq.com
王俊霞(1962-),女,教授,研究方向:从事微生物检验。E-mail:13333011022@163.com
R-33
A
1671-7856(2017) 08-0080-05
10.3969.j.issn.1671-7856. 2017.08.016
2016-11-28

