PON1基因多态性与血小板再活化与支架内血栓的相关性研究
刘珂崎,于风旭,闫继强
PON1基因多态性与血小板再活化与支架内血栓的相关性研究
刘珂崎1,于风旭2,闫继强1
目的 探讨影响冠状动脉介入术(PCI)预后的危险因素,分析接受PCI患者血清对氧磷酯酶1(PON1)基因多态性、术后血小板再活化与PCI术后主要心血管事件和支架内血栓的相关性。方法筛选2015年1月~12月期间就诊雅安市人民医院PCI患者362例,检测PCI后测血小板聚集率(PAR),通过受试者工作曲线预测术后主要心血管事件(MACE)发生的最佳 PAR值。将所有受试者分成术后血小板再活化(HPPR)组(PAR≥44.5%,即HPPR组)(n=180)和对照组 (PAR<44.5%)(n=182),检测通过聚合酶链反应-限制性片段长度多态性技术实现,记录患者CYP2C19基因681(G/A)位点的基因型和等位基因,以及患者CYP2C19(681G/A)基因型、等位基因分布情况,统计分析住院期间与术后6个月患者MACE的发生情况。结果 HPPR组三个基因多态性位点(-108C/T,-126G/C及-162G/A)分别为63.9%、25.0%和23.9%显著高于对照组的25.6%、44.0%和12.1%,差异有统计学意义(P<0.05)。携带 -108C/T 基因型是PCI治疗后MACE和术后支架内血栓发生的独立预测因子,OR(95%CI)值为3.647(1.633~6.275),P=0.016。结论 携带 -108C/T 基因型与 HPPR是 PCI治疗后MACE和支架内血栓发生的独立预测因子。
冠状动脉介入术;基因多态性;血小板聚集率;术后血小板再活化;术后主要心血管事件
R816.2
A
1674-4055(2017)08-0941-03
目前经皮冠状动脉介入术(PCI)是冠心病血运重建的最适方法[1],抗血小板治疗易引发PCI术后患者的出血风险。血清对氧磷酯酶1(PON1)由人体肝脏合成,参与肝内物质水解反应,PON1启动子的基因多态性能够会影响氯吡格雷药效,影响抗血小板的效果[2-4]。目前有效药物治疗方案[5]为:在长期服用阿司匹林的基础上,联用氯吡格雷至少12个月;对于非急性冠脉综合症植入非药物涂层支架的患者,持续服用氯吡格雷1~12个月,从而预防主要缺血事件及血栓栓塞性事件的发生。本研究用PCR-RFLP基因分析法检测患者PON1基因启动子的多态性,探讨影响PCI预后的临床危险因素,并分析PCI术后支架内血栓的发生与PON1基因启动子间的关联。
1 资料与方法
1.1 临床资料 选取2015年1月~12月于雅安市人民医院接受PCI术治疗患者362例,包括不稳定型心绞痛(UAP)172例 、非ST段抬高型心肌梗死(NSTEMI)190例。UAP和NSTEMI受试者均符合中华医学会《UAP和 NSTEMI诊断与治疗指南》。入选标准:受试者均使用阿司匹林与氯吡格雷治疗[6];受试者签署知情同意书。排除标准:受试者术前已应用血小板膜糖蛋白Ⅱb/Ⅲa受体抑制剂(GPI);糖尿病患者;需急诊PCI治疗的急性ST段抬高型心肌梗死患者;同时患有严重肝、肾功能障碍者;抗血小板治疗禁忌者。
1.2 设计和分组 受试者进行PCI术24 h后测定患者血小板聚集率(PAR),通过受试者工作曲线(ROC曲线)预测术后主要心血管事件(MACE)发生的最佳 PAR值。根据每位患者最佳PAR值的差别,将所有受试者分成两组,即术后血小板再活化(HPPR)组(n=180):PAR≥44.5%和对照组(n=182):PAR<44.5%。
1.3 方法 检测通过聚合酶链反应-限制性片段长度多态性技术实现,记录每位患者CYP2C19基因681(G/A)位点的基因型和等位基因及分布情况,统计分析住院期间与术后6个月随访期间患者MACE和支架血栓的发生情况。聚合酶链反应-限制性片段长度多态性技术的仪器、试剂和步骤:⑴使用的仪器:PTC2150型PCR仪(MJRESEARCH INC公司,美国);JM2250型电泳仪(捷迈公司,大连) ;9700PCR仪(Applied Bi-osystems公司)。⑵使用的试剂:Taq DNA聚合酶、10* PCR mix,DNA分子量标准物(天恩泽公司,北京);全血基因组DNA提取试剂盒(天恩泽公司,北京) ;Bam HⅠ、Sma Ⅰ限制性内切酶及其缓冲液(天恩泽公司,北京) ;PON1基因启动子的引物合成(捷瑞公司,上海)。⑶检验步骤和方法:①基因组DNA的提取:抽取静脉血2 ml,通过Gentra Puregene Blood Kit(QIAGEN,上海)根据说明书提取基因组DNA,若其A260/A280大于1.8则符合要求。②基因分型:检测PON1启动子区位点(-108C/T,-126G/C以及-162G/A)。在普通PCR仪(Eppendorf公司,美国)使用Go Taq Green Master(Promega公司,美国)扩增PCR。上游引物5'-AGTGAGGAGGACGAAGG-3',下游引物5'-TTACAGTTGGAAGGAGCA-3'。
1.4 统计学分析 选用SPSS 21.0软件(美国IBM公司),计量资料采用均数±标准差(x±s)表示,多组间比较采用t检验,组间两两比较采用LSD-t检验;计数资料采用百分率(%)表示,组间比较采用χ2分析,将CYP2C19 681A基因作为自变量进行多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料比较 将PAR≥44.5%定义为PCI后血小板再活化,即HPPR组(其PAR≥44.5%)180例,其中男性88例,女性92例,年龄(60.69±6.57)岁;对照组(PAR<44.5%)182例,其中男性92例,女性90例,年龄(60.43 ±5.49)岁;对比两组患者年龄、性别、平均血压、体质指数、肾小球滤过率等基本资料方面差异无统计学意义(P>0.05),见表1。
2.2 两种基因型分布情况比较 HPPR组三个基因多态性位点(-108C/T,-126G/C及-162G/A)分别为63.9%、25.0%和23.9%高于对照组的25.6%、44.0%和12.1%,差异有统计学意义(P<0.05),见表2。
2.3 多因素Logistic回归分析 将CYP2C19 681A 基因为自变量行多因素Logistic回归分析HPPR基因多态性等因变量与应变量的关系。结果显示,携带-108C/T基因型是PCI治疗后MACE和术后支架内血栓发生的独立预测因子,OR(95%CI)值为3.647(1.633~6.275),P=0.016,见表3。
3 讨论
目前,急性冠脉综合征(ACS)的发病率愈来愈高[7],伴随介入疗法技术的进步,接受PCI治疗的冠脉病变也愈加复杂。由于具有满意的抗血小板作用,氯吡格雷已成为指南推荐的患者标准治疗方案药物之一。然而,术前规范使用氯吡格雷抗血小板治疗的患者PCI术后仍会出现HPPR现象,即始终有部分患者对氯吡格雷规范治疗存在不同程度的低反应性。PCI术后患者若出现较严重的HPPR现象,则易发生术后MACE事件[8-10]。这种现象称为氯吡格雷低抵抗现象。
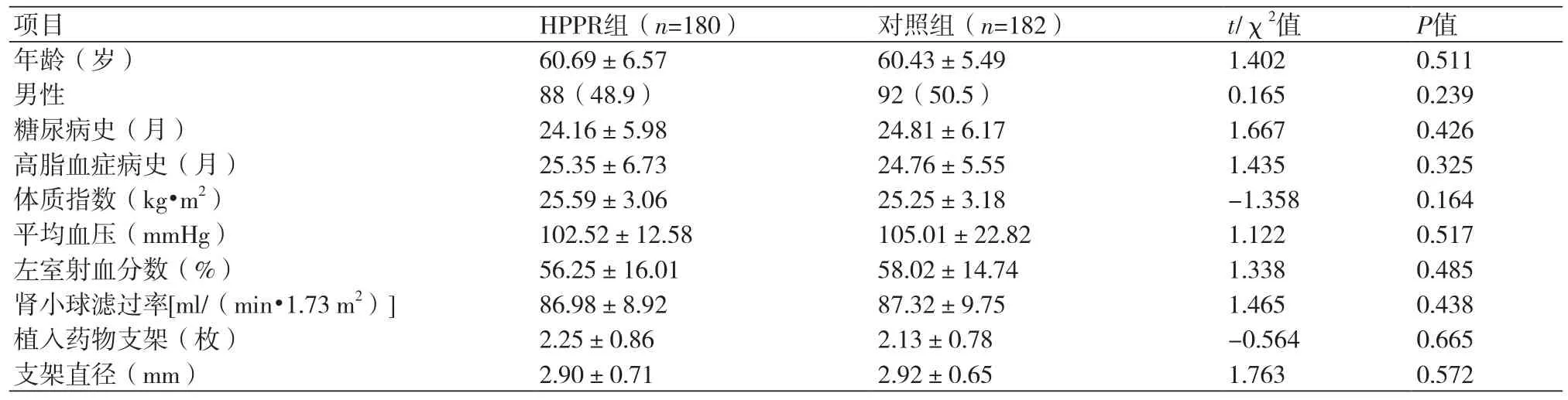
表1 两组患者基本资料比较(n,%)
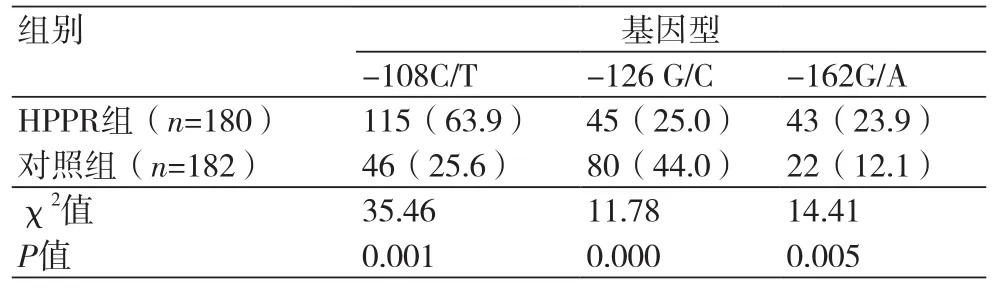
表2 两种基因型分布情况比较[n(%)]
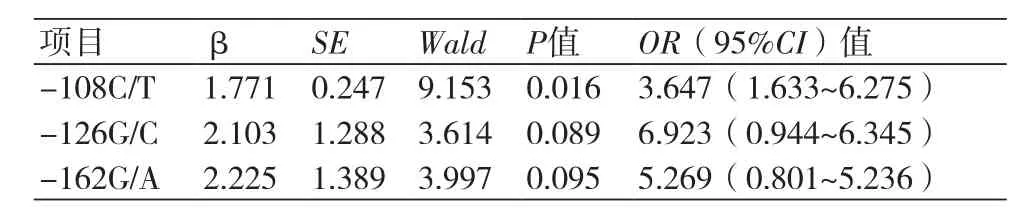
表3 CYP2C19 681A 基因与术后MACE的多因素Logistic回归分析结果
如果抗血小板方案对ACS患者药理作用不满意,则PCI术后出现MACE事件的可能性将剧增,给ACS患者带来严重后果。故而,针对ACS 患者,特别是接受PCI治疗的患者,抗血小板方案变得更为关键。因此,预估实施PCI疗法后是否会发生HPPR成为临床研究者关注的焦点内容。
个体对氯吡格雷反应性低的根本原因是患者个体的遗传特性[11]。氯吡格雷本身是一种无活性的前体药物,需通过降解后才能为活性代谢物(即氯吡格雷的硫醇衍生物),才能发挥抗血小板的药理作用。PON1基因的转录激活区域富含 “GGCGGG”片段,其转录因子Sp1与其结合后激活基因开始转录[12]。该转录激活区-108C/T能够通过影响PON1基因的转录激活区和Sp1的结合,进一步影响相关基因的表达量[13-15]。因此,该突变及邻近位点的突变能够通过影响 PON1基因表达量,进而影响氯吡格雷的活化,最终干预氯吡格雷的抗血小板的药理效应[16,17]。
本研究检测通过聚合酶链反应-限制性片段长度多态性技术实现,记录每例患者CYP2C19基因681(G/A)位点的基因型和等位基因及分布情况,统计分析住院期间与术后6个月随访时患者MACE的发生情况,发现HPPR组三个基因多态性位点(-108C/T,-126G/C及-162G/A)显著高于对照组。结果表明携带-108C/T基因型是PCI术后MACE和支架内血栓发生的独立预测因子。试验证实,ACS患者接受PCI后,若出现HPPR现象,则该患者对抗血小板的药物反应性低,很大程度上增大了PCI术后发生支架内血栓和心脏意外事件的几率。本研究还表明,HPPR组三个基因多态性位点(-108C/T,-126G/C及-162G/A)显著高于对照组。而且,采用多因素Logistic回归分析受试者是否携带-108C/T基因型证实,携带-108C/T基因型是PCI治疗后 MACE 和支架内血栓发生的独立预测因子。
[1] 鲍东来,黄伟剑,单培仁. 血浆CysC及BNP水平对冠心病患者经皮冠状动脉介入术预后的评估价值[J]. 中国老年学杂志,2015, 35(16): 4516-18.
[2] 韩运峰,冯艳萍,张树林. 氯毗格雷抵抗的药物基因组学研究进展[J]. 中国分子心脏病学杂志,2010,10(4):249-53.
[3] 康彦红,劳海燕,陈秀云,等. PON1基因启动子多态性及非遗传因素对PCI术后抗血小板治疗临床效应的影响[J]. 中国药理学通报,2012,28(12):1682-6.
[4] 赵亚子,许杜娟,李骏. 中国冠心病患者PON1 Q192R基因多态性对氯吡格雷临床疗效影响的Meta分析[J]. 中国临床药理学与治疗学,2016,21(9):1018-23.
[5] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 非ST段抬高急性冠状动脉综合征诊断和治疗指南[J]. 中华心血管病杂志,2012,40(5):353-67.
[6] 易光兆,罗素新,文俊杰,等. sTWEAK,hsCRP在急性冠脉综合征的表达及临床意义[J]. 重庆医科大学学报,2014,39(1):64-8.
[7] 李翔东,刘晓堃. 不同剂量阿托伐他汀对急性冠脉综合征高敏C-反应蛋白的影响[J]. 世界最新医学信息文摘,2015,15(75):58-60.
[8] 冷文修,范利. 氯吡格雷治疗后血小板高反应性研究现状[J]. 中华老年心脑血管病杂志,2013,15(5):701-6.
[9] 刘震,李韶南,罗义. 细胞色素P450 2C19基因多态性与急性冠脉综合征患者PCI治疗后血小板再活化及预后的关系[J]. 岭南心血管病杂志,2015,21(1):32-6.
[10] Liu XL,Wang ZJ,Yang QL,et al. Impact of CYPZC19 polymorphism and smoking on response to clopidogrel in patients with stable coronary artery disease[J]. ChinMedJ,2010,123(22):3178-83.
[11] 丁肖梁,缪丽燕. 脑梗死患者P2Y12与CYP2C19基因突变的临床学特征及其与氯吡格雷动态抵抗的相关性[J]. 中风与神经疾病杂志,2014,31(10):871-5.
[12] 雷晓辉,翟娅婧,贺海蓉,等. ABCB1、CYP3A5和PON1基因多态性对氯吡格雷临床疗效的影响[J]. 西安交通大学学报(医学版),2016,37(5):726-33.
[13] Souza-Nogueira A,Camargo AE,Remondi FA,et al. Paraoxonase 1 (PON1) Q192R genotypes and their interaction with smoking strongly increase atherogenicity and the Framingham risk score[J]. Arch Endocrinol Metab,2016,60(5):426-35.
[14] García-González I,Mendoza-Alcocer R,Pérez-Mendoza GJ,et al. Distribution of genetic variants of oxidative stress metabolism genes:Paraoxonase 1 (PON1) and Glutathione S-transferase (GSTM1/GSTT1) in a population from Southeastern Mexico[J]. Ann Hum Biol,2016, 43(6):554-62.
[15] Turgut Cosan D,Colak E,Saydam F,et al. Association of paraoxonase 1 (PON1) gene polymorphisms and concentration with essential hypertension[J]. Clin Exp Hypertens,2016,38(7): 602-7.
[16] Wójcicka G,Jamroz-Wisniewska A,Czechowska G,et al. The paraoxonase 1 (PON1), platelet-activating factor acetylohydrolase (PAF-AH) and dimethylarginine dimethylaminohydrolase (DDAH) activity in the metformin treated normal and diabetic rats[J]. Eur J Pharmacol,2016,789(10):187-94.
[17] Rizzi F,Conti C,Dogliotti E,et al. Interaction between polyphenols intake and PON1 gene variants on markers of cardiovascular disease: a nutrigenetic observational study[J]. J Transl Med, 2016,14(1):186.
本文编辑:陈亚磊
Correlation among PON1 gene polymorphism, platelet reactivation and in-stent thrombosis
Liu Keqi*, Yu Fengxu, Yan Jiqiang.
*Department of Cardiothoracic Surgery, People's Hospital of Ya'an City, Ya'an 625000, China.
Corresponding author: Yu Fengxu, E-mail: 896221780@qq.com
Objective To investigate the risk factors influencing the prognosis of percutaneous coronary intervention (PCI), and analyze the correlation among the gene polymorphism of serum paraoxonase (PON1), posttreatment platelet reactivation (HPPR), postoperative major adverse cardiovascular events (MACE) and in-stent thrombosis in patients undergone PCI. Methods The patients undergone PCI (n=362) were chosen from the People’s Hospital of Ya’an City from Jan. 2015 to Dec. 2015. The platelet aggregation rate (PAR) was detected after PCI in all patients. The best PAR value of incidence of postoperative major adverse cardiovascular events (MACE) was predicted by using receiver operating curve (ROC). All patients were divided into HPPR group (PAR≥44.5%, n=180) and control group (PAR<44.5%, n=182) after PAR detection by using polymerase chain reactionrestriction fragment length polymorphism (PCR-RFLP). The genotypes and alleles of CYP2C19 gene at 681 (G/A) loci and their distribution were recorded in each patient. The incidence of MACE was statistically analyzed in all patients during hospitalization and 6 months after PCI. Results The incidence of MACE and in-stent thrombosis was 63.9% at -108C/T locus, 25.0% at -126G/C locus and 23.9% at -162G/A locus in HPPR group, which were all significantly higher than those in control group (25.6%, 44.0% and 12.1%, P<0.05). The genotype of -108C/T was an independent predictive factor for incidence of MACE and in-stent thrombosis (OR=3.647, 95%CI: 1.633-6.275, P=0.016). Conclusion The genotype of -108C/T and HPPR are independent predictive factors for incidence of MACE and in-stent thrombosis.
Percutaneous coronary intervention; Polymorphism; Platelet aggregation rate; Post-treatment platelet reactivation; Postoperative major adverse cardiovascular events
四川省科技厅资助项目(2011JY0065)
1625000 雅安,雅安市人民医院心胸外科;2646000泸州,西南医科大学附属医院心外科
于风旭,E-mail:896221780@qq.com
10.3969/j.issn.1674-4055.2017.08.12

