急性肾出血个体化介入栓塞治疗的临床疗效观察
毛学群, 谭中宝
(江苏大学附属医院介入放射科, 江苏 镇江 212000)
急性肾出血个体化介入栓塞治疗的临床疗效观察
毛学群, 谭中宝*
(江苏大学附属医院介入放射科, 江苏 镇江 212000)
目的:探讨根据肾出血患者肾动脉造影表现选择个体化栓塞方案进行止血的疗效。方法:18例肾破裂出血患者,行DSA造影明确出血部位、程度以及责任血管管径,依据造影表现个体化选择不同的栓塞方案:单一栓塞剂栓塞和多种栓塞剂联合栓塞(栓塞剂:明胶海绵颗粒(700~1000um)、PVA(500-700um)、弹簧圈等)。术后随访观察临床疗效、并发症等情况。结果:18例患者技术成功率为100%,17例患者一次栓塞成功,临床成功率94.4%,1例患者术后2d出血复发再次栓塞成功止血,1例患者两天后死于全身多脏器衰竭。对存活17例患者随访3~36个月,除1例患者一年后复查有镜下血尿外,其他患者生存期间均未再次出现肾破裂出血情况。所有患者术后未出现肾功能降低情况。结论:经导管选择性肾动脉栓塞治疗各种原因引起的肾出血是安全有效的方法。个体化栓塞方法可提高临床成功率和对肾功能的最大程度的保护。
急性肾出血; 动脉栓塞; 个体化治疗
肾出血是临床常见急症,治疗方法主要是内科保守治疗、外科手术治疗以及肾动脉选择性栓塞治疗,对于反复出血患者内科保守治疗效疗往往不佳,外科手术治疗创伤较大,而且有些患者术后仍有反复出血的可能。经导管栓塞治疗肾动脉出血,由于创伤小、止血效果好、最大限度保护肾功能,逐渐得到泌尿外科医师的认可,易被患者所接受[1~3]。本文分析总结我科从2010年1月至2017年02月间,根据肾出血病因、DSA血管造影表现,个体化选择肾动脉栓塞材料,对18例患者27根异常血管进行了选择性栓塞治疗,获得满意效果,报告如下:
1 资料与方法
1.1 一般资料:本组患者男11例,女7例,年龄24~65岁,平均43.5岁。病程1d至3年。其中肾结石行经皮肾穿刺激光碎石术(PCNL)7例,肾移植术后1例,肾挫裂伤3例,肾脏肿瘤部分切除术后1例,多囊肾破裂1例,动静脉畸形5例。临床表现主要为:肉眼血尿、腰背部疼痛、贫血等,其中2例患者出现出血性休克。所有患者术前均进一步行CT检查明确出血原因和部位:5例动静脉畸形患者术前CT增强扫描表现为局部畸形血管团;7例肾结石患者术前CT平扫诊断明确;多囊肾破裂出血CT扫描提示肾周血肿;移植肾CT增强提示患侧肾无强化;肾挫裂伤3例CT扫描提示肾裂伤、肾周血肿;肾肿瘤术后CT提示肾局部动脉瘤形成。18例患者行膀胱镜检查见不同程度患侧肾输尿管开口出血及膀胱内血凝块;所有患者在行肾动脉栓塞治疗前已行内科保守治疗,血尿未见缓解,失血症状无明显好转。
1.2 方法:造影评估:采用Seldinger技术经股动脉穿刺插管,先引入“猪尾”导管行腹主动脉造影,明确患侧肾动脉的开口,再用5F Cobra导管以3~4mL/s总量9~15mL行患侧肾动脉造影,明确责任血管具体部位、范围、大小、供血动脉及引流静脉情况。栓塞方案:依据造影确定测量责任血管并进行测量,根据责任血管粗细选择不同的栓塞方法:动脉主干栓塞、外周栓塞、毛细血管栓塞。①肾动脉主干:弹簧圈联合明胶海绵颗粒、PVA等。②肾段动脉:弹簧圈联合明胶海绵颗粒、PVA等。③肾叶间动脉:采用明胶海绵颗粒和或PVA颗粒。
1.3 疗效评价:技术成功率:术前血管造影剂外溢经栓塞后无造影剂外溢表现。临床成功率:术后5d未再次出现活动性肾出血[1]。
2 结 果
2.1 个体化栓塞方法:①肾动脉主干栓塞:本组中2例慢性肾功能衰竭血透患者,患侧肾无功能,要求肾动脉主干栓塞,血管造影提示1例患者出血量大,肾动脉主干较纤细,约2mm,有造影剂外渗,予明胶海绵颗粒(1*1*1mm)结合聚乙烯醇(PVA 500~700um)栓塞,1例患者予弹簧圈(4*40mm)栓塞。②段动脉及叶间动脉栓塞:本组中3例患者供血动脉(叶间动脉)直径小于2mm先天性AVM,予单纯性明胶海绵颗粒(1*1*1mm)栓塞;2例患者供血动脉(段动脉)直径大于等于2mm先天性AVM,予明胶海绵颗粒(1*1*1mm)结合弹簧圈(3*40mm)栓塞。7例患者因PCNL术后出血,血管造影提示7例均有动静脉瘘表现,其中4例有造影剂外渗见(图A1、A2图C1、C2),对6例患者微弹簧圈(3*40mm)栓塞近端的段动脉,1例患者因动静脉瘘小,直径小于1mm,予明胶海绵颗粒(1*1*1mm)结合聚乙烯醇(PVA 500~700um)栓塞。1例左肾肿瘤切除术后第2天出现肾出血,血管造影提示供血动脉(叶间动脉)直径约2mm,经肾动脉予弹簧圈(2*40mm)两枚、(4*140mm)一枚栓塞治疗。3例患者因肾挫裂伤引起肾出血,血管造影表现为叶间动脉(直径小于2mm)处造影剂外渗,未见明显动脉静瘘见(图B1、B2),3例患者均采用明胶海绵颗粒(1*1*1mm)栓塞。每次栓塞治疗后退出微导管,等待5~10min后,经Cobra导管再次对患侧肾动脉造影,如无异常血管出现或无造影剂外渗,拔除导管。
2.2 临床疗效:本组对18例患者27根异常血管选择插管技术成功率为100%。8例患者异常血管直径小于2mm予明胶海绵颗粒或明胶海绵颗粒结合聚乙烯醇(PVA)栓塞,其中有1例患者出现术前有明显休克症状,采用明胶海绵结合PVA栓塞后出血复发(图C1),后选用一枚弹簧圈栓塞后出血停止(图C2),1d后再次出血,血管造影提示血管明显扩张,加用明胶海绵栓塞后出血停止见(图C3、C4)。1例肾挫裂伤患者2d后出现多脏器衰竭死亡,对于10例异常血管直径大于等于2mm的患者予明胶海绵颗粒联合弹簧圈栓塞。17例患者术后1~3d肉眼血尿消失,有6例患者术后出现栓塞后综合征,主要表现为肾区疼痛不适、发热、恶心,对症处理后好转。对17例患者随访3~36个月,均无肉眼血尿,无腰背部疼痛不适,有1例患者一年后复查有镜下血尿,除2例肾衰、1例死亡患者外,其它15例患者术前、术后肾功能均正常。
(图A1)表现为PCNL术后,出现肾段动脉动静脉瘘及造影剂外渗,(图A2)表现为肾段动脉经弹簧圈栓塞后动静脉瘘消失,出血停止;(图B1)表现为肾挫伤后肾叶间动脉损伤,有造影剂外渗,(图B2)经明胶海绵颗粒栓塞后,造影剂外渗消失;(图C1)表现为PCNL术后,出现肾段动脉动静脉瘘,(图C2)表现为肾段动脉经弹簧圈栓塞后动静脉瘘消失,出血停止;(图C3)1d后肾段动脉动静脉瘘再次出现,伴有血尿,(图C4)加用明胶海绵栓塞后动静脉瘘消失,血尿停止。
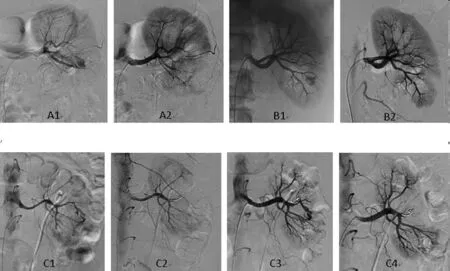
图1
3 讨 论
临床上引起血尿的原因众多,其中常见的有肾挫伤、肾动静脉畸形、良恶性肿瘤、肾结石或碎石术后等。肾出血的治疗原则是彻底止血、最大程度保留肾组织。传统的治疗方法是对于少量肾出血者,可先通过内科手段保守治疗,对于出血量大,生命体征不稳定,内科保守治疗效果不佳者,则大多采用外科手术探查,但因为出血原因不明,手术中创伤大,恢复慢,为止血而行全肾切除更为患者不能接受。1973年Bookstein[4]首先报道了肾动脉栓塞治疗急性肾出血,此后肾动脉栓塞治疗各种原因引起的内科治疗无效的肾出血在临床得到广泛应用,特别是近年来,随着影像设备以及介入材料的不断更新改进,肾出血介入治疗效果明显[5]。本组病例均为内科治疗失败的肾出血患者,对17例患者随访3~36个月,均无肉眼血尿,无腰背部疼痛不适,15例患者术后肾功能均正常。但经肾动脉栓塞治疗后部分病例短期内仍有复发,分析其原因可能是:①肾动脉造影不全面,血管造影对于诊断肾出血极为重要,可以明确肾出血的部位、范围及性质,为进一步的肾动脉栓塞治疗提供有力的影像学支持,肾动脉一般为单个血管,在第1、2腰椎之间,肠系膜上动脉下(1~2cm)发出,肾动脉的变异较为常见,如肾门动脉、肾门外动脉、上极动脉、下极动脉等,在行肾动脉造影前先行腹主动脉、髂动脉造影,本组病例中有1例肾移植患者右肾动脉供血来源于右髂总动脉。②没有正确选择合理的栓塞材料,栓塞剂的合理选择及应用是介入治疗的关键[6]。临床上一般认为出血量少,病变范围小,出血血管直径细可用明胶海绵颗粒或PVA栓塞,出血血管粗大或肾动脉主干栓塞可用弹簧圈,但没有量化,栓塞材料选择不当可造成栓塞不彻底而复发,过度栓塞引起异位栓塞或增加患者经济负担,本组病例栓塞治疗中,对出血血管、动静脉畸形的供血动脉或动静脉瘘血管直径小于2mm予明胶海绵颗粒或明胶海绵颗粒结合聚乙烯醇(PVA)栓塞,7例患者栓塞后疗效显著,1例患者出现复发,再次造影提示被栓塞血管有扩张,对异常血管直径大于等于2mm予弹簧圈或弹簧圈结合明胶海绵颗粒,10例患者栓塞后疗效显著,未出现复发。③没有即时扩容纠正休克,患者大出血后出现休克,肾动脉会出现痉挛,根据血管直径选择栓塞材料有可引起复发。本组病例中有一例患者术前明显休克,经多次栓塞后仍有出血,分析考虑为病人经抗休克治疗后有肾动脉扩张,导致出血复发。所以对于术前有明显出血性休克肾动脉痉孪患者应充分扩容再选择栓塞剂。另外在栓塞中要考虑栓塞剂的夯实作用,栓塞后5~10min再次造影,了解栓塞情况。
肾动脉栓塞治疗后部分患者可出现腰背不适、发热、恶心呕吐等栓塞后综合症状,本组中有33.3%(6/18)出现,经对症处理后好转,不需要作特殊处理。
总之,通过全面的血管造影、合理选择应用栓塞材料以及超选择性肾动脉栓塞治疗肾出血是一种止血快、安全、有效、并发症少的治疗方法,制定好个体化的肾动脉栓塞方案,可最大限度的提高一次性治疗肾出血的成功率。
[1] Wang HL, Xu CY, Wang HH, et al. Emergency transcatheter arterial embolization for acute renal hemorrhage[J].Medicine, 2015, 94(42):e1667.
[2] Keeling AN, McGrath FP, Thornton J, et al. Emergency percutaneous transcatheter embolisation of acute arterial haemorrhage[J].Ir Med Sci 2010, 179(3):385~391.
[3] Sam K, Gahide G, Soulez G, et al. Percutaneous embolization of iatrogenic arterial kidney injuries: safety, efficacy, and impact on blood pressure and renal function[J].Vasc Interv Radiol 2011, 22(11):1563~1568.
[4] Bookstein J J, Ernst C B. Vasodilatory and vasoconstrictive pharmacoangiographic manipulation of renal collateral flow[J].Radiology, 1973, 108(108):55~59.
[5] Loffroy R, Rao P, Kwak B K, et al. Transcatheter arterial embolization in patients with kidney diseases: an overview of the technical aspects and clinical indications[J].Korean Journal of Radiology, 2010, 11(3):257.
[6] 代向党,王赢,程喆,等.超选择肾动脉栓塞治疗外伤性肾出血的临床应用[J].中国临床解剖学杂志,2009,27(5):616~618.
Clinical Observation of Individualized InterventionalEmbolization for treatment of Acute Renal Hemorrhage
MAOXuequn,TANZhongbao,DIZhenhai,etal
(TheAffiliatedHospitalofJiangsuUniversity,JiangsuZhenjiang212001,China)
Objective:To discuss the clinical efficacy of individualized renal arterial embolization in the treatment of renal hemorrhage based on renal arteriography. Methods: Renal arteriography was performed on 18 patients with renal hemorrhage to determine the origin, diameter of the bleeding vascular and its position. Individualized renal arterial embolization was performed based on the result of renal arteriography: using single material or with multiple materials (Gelatin sponge particles embolization (700~1000 um), PVA (500-700-um), coils). The effects, complications and bleeding recurrence after renal arterial embolization were evaluated. Results: Technical success rate was 100% in 18 cases. Clinical success was achieved in 17 cases. The recurrence of renal bleeding after renal arterial embolization in one case and the patient was underwent successfully a second renal arterial embolization. One patient died because of MODS. During the followed up, one patient appeared microscopic haematuria in one year after embolization. The other patients did not appear again renal rupture bleeding during followed up. Postoperative renal function reducing did not happen in all of the patients. Conclusions: Renal arterial embolization is an effective method in the treatment of renal hemorrhage. Individualized renal arterial embolization can improve the clinical success rate of renal hemorrhage and the greatest degree of protection of renal function.
Acute renal hemorrhage; Renal arterial embolization; Individualized treatment
1006-6233(2017)08-1292-03
A
10.3969/j.issn.1006-6233.2017.08.017
*【通讯作者】谭中宝, 狄镇海, 张 建, 邹容, 王庆庆

