ABO血型不合肾移植的现状及研究进展
张子健,胡小鹏(首都医科大学附属北京朝阳医院,北京 100020)
肾移植是治疗终末期肾病最有效的方法。供体来源严重短缺是限制器官移植发展的一大瓶颈。积极开展器官捐献和亲属活体肾移植,是解决供肾短缺的重要途径[1-2]。随着围术期和术后管理方案的不断进步,肾移植逐渐突破了人类白细胞抗原(human leucocyte antigen, HLA)配型和ABO血型的限制[3]。据统计,潜在亲属活体肾移植中,约30%供体与受体存在ABO血型不合[4],因此,开展ABO血型不相容肾移植(ABO incompatible kidney transplantation, ABOi-KT)已成为增加亲属活体肾移植数量的重要途径。ABOi-KT最重要的步骤是降低受体血清抗ABO抗体滴度,常用的办法是血浆置换、免疫吸附、脾切除、输注供体血小板等[5]。从20世纪90年代中期开始,全球许多移植中心先后建立了成熟的ABOi-KT免疫抑制方案。本文总结了ABOi-KT最新的免疫机制、抗体清除技术、免疫抑制方案、围术期管理及现状。
1 目前的临床现状
Alexandre等[6]采用脾切除和血浆置换的方法成功完成了全球首例ABOi-KT,此后随着免疫抑制治疗的进步,ABOi-KT的器官存活时间不断延长。特别是近年来他克莫司、吗替麦考酚类和利妥昔单抗的广泛应用,ABOi-KT的器官存活时间与ABOc-KT无显著差异[7]。日本自1989年至今共完成了约2 000例ABOi-KT,也是当今世界上完成ABOi-KT例数最多的国家。由于新型免疫抑制剂的应用,ABOi-KT的移植肾5年存活率呈阶梯式上升,1989-1994年、1995-2000年、2001-2006年分别为68%、76%、90%[8]。2002-2008年,应用利妥昔单抗后,移植肾5年存活率达到了100%,同期ABO血型相容肾移植(ABO compatible kidney transplantation, ABOc-KT)和脾切除ABOi-KT 为 88.4% 和 90.3%[9]。 移植肾9年的存活率甚至达到83%[10]。目前日本ABOi-KT约占活体肾移植数量的30%[11]。在美国,1995-2009年来自280个移植中心的738例ABOi-KT患者中,移植物1、3、5和10年存活率分别为94.1%、89.6%、82.6%和72.9%(同期ABOc-KT为97.1%、93.6%、89%和76.4%),ABOi-KT的1年存活率略低于ABOc-KT而10年存活率无明显差异[12]。Opelz等[13]对2005-2012年101个移植中心1 420例ABOi-KT的研究表明,ABOi-KT的移植物3年存活率与ABOc-KT差异无统计学意义(89.9%比90.1%)。
2 ABO血型系统
图1 经典的血型相合和血型不合移植
1900年,研究人员首次发现不同患者血清和洗涤红细胞混合,会发生有规律的红细胞凝集反应,以此提出ABO血型系统及相应的抗ABO抗体理论,并根据A、B抗原将血型分为A、B、AB、O 4种类型[14-15]。这一基础理论定义了ABO相合、不合的移植方案。不发生受体抗ABO抗体与供体ABO抗原反应,即为ABO相合(图1)。造成ABO不合的主要因素是受体抗ABO抗体中的抗A1亚型或抗B型与供体器官细胞表面的A、B抗原结合。研究认为,A2亚型在红细胞和其他组织细胞表达很弱,因此,仅出现A2亚型不相合的供受体,可视为ABO相合,无需接受额外的免疫脱敏治疗[16],当供体为A2型时,使移植前受体的抗A抗体滴度≤1:8,可改善患者的长期预后[17]。
抗ABO抗体测定方法:随着检验技术的发展,已出现多种定量测定抗ABO抗体的检验学方法。传统的血凝法存在稀释比例的误差、反应时间、温度等诸多易对结果产生不良影响的因素,部分移植中心采用了更加可靠、重复性好、成本也更高的流式微球分析技术[18]。不同的移植中心均根据各自采用的检测方法制定不同的参考范围。
3 围术期方案
ABOi-KT的术前免疫脱敏方案主要包括抗ABO抗体清除、降低B淋巴细胞免疫应答以及围术期免疫抑制治疗。在日本、美国、欧洲的部分移植中心,均有成熟的免疫抑制方案(图2)。这些方案主要的不同在于抗体清除方案、利妥昔单抗的剂量、诱导与持续免疫抑制方案[19-21]。这些常见的免疫脱敏方案存在的争议包括:① 测定以及清除抗ABO抗体的最佳方案(包括测定、清除方法、目标值和术后的长期监测方案)。② 静脉注射免疫球蛋白(intravenous immuoglobulin,IVIG)的作用和必要性。③ 利妥昔单抗最佳的使用时间、剂量及常规使用的必要性。④ 免疫适应现象的机制和作用。制定ABOi-KT的免疫抑制方案主要原则是:① 在术前清除受体预存抗体。② 术后维持免疫抑制治疗并持续监测抗体,防止抗体滴度升高[22]。
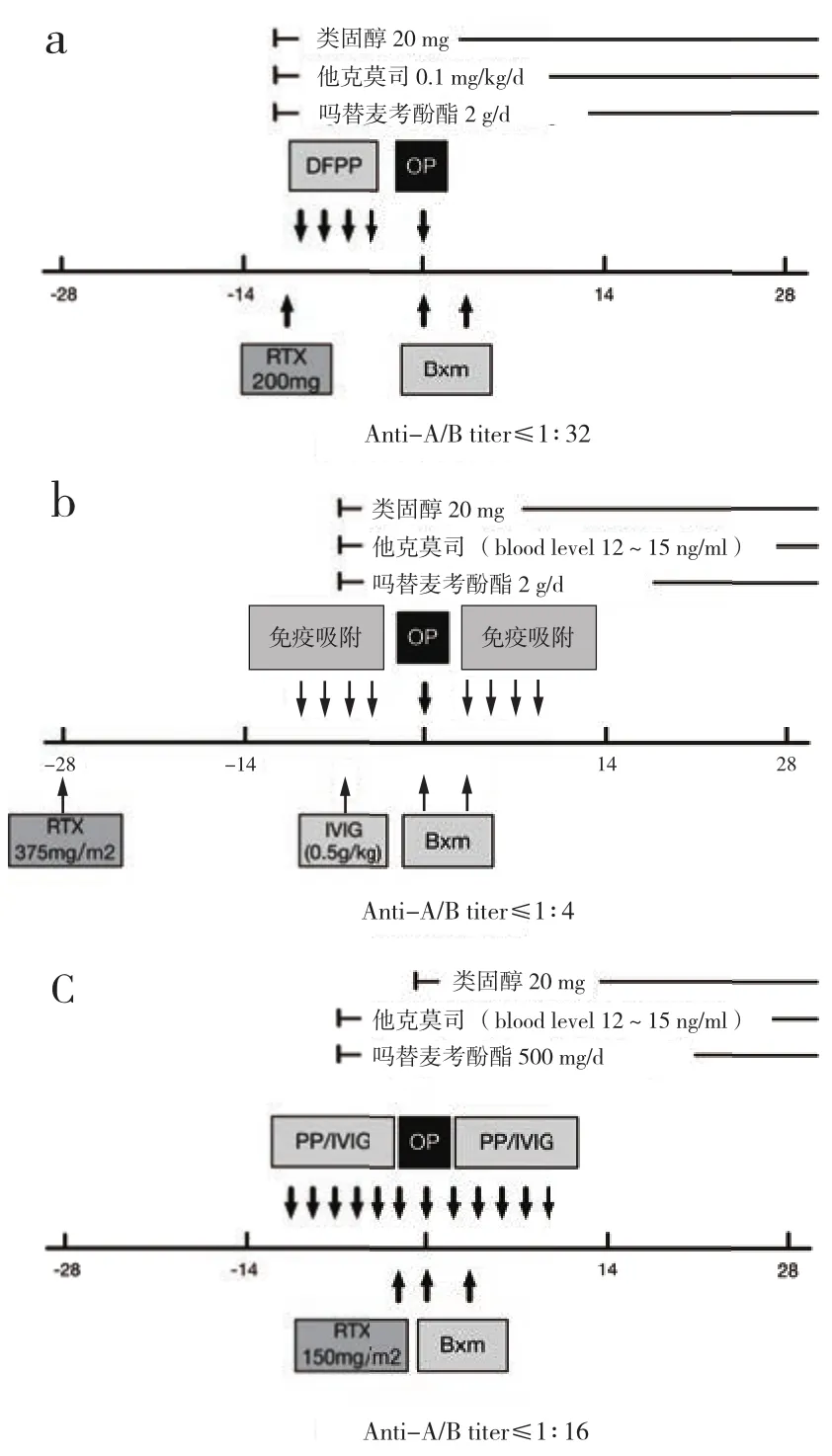
图2 多个移植中心的围术期免疫抑制方案 (a)东京女子医科大学(b)弗莱堡大学医院(c)约翰霍普金斯医院。Bxm: 巴利昔单抗;DFPP: 双重滤过血浆置换;IVIG:静脉注射免疫球蛋白;OP:手术;PP:血浆置换;RTX:利妥昔单抗
3.1 抗体清除:日本目前是传统血浆置换(plasma exchange, PE)与双重滤过血浆置换(double filtration plasmaphersis, DFPP)两种方法共存[23],而在美国,则主要采用传统血浆置换[21,23]。PE利用白蛋白或新鲜冰冻血浆替代并清除血浆中的大部分蛋白。其在清除免疫球蛋白的同时也清除了大量凝血因子,因此,会大幅度增加出血和感染风险。为了减少不良反应,大多数移植中心均在移植前即刻进行PE[24]。DFPP会对滤过后的血浆进行二次重滤过,选择性滤除免疫球蛋白的同时重新回输其余成分。因此,DFPP对血液动力学影响较小且滤过效率高,一次约可清除60%~ 70%的抗体(PE仅可清除40%~50%),重新回输凝血因子和白蛋白,患者较少出现并发症[25]。
以瑞典卡罗林斯卡大学医院为代表的欧洲采用包被A或B抗原的特异性吸附柱进行免疫吸附清除抗ABO抗体,期间其他免疫球蛋白及凝血因子损失较少,出血和感染风险较小[26]。特异性吸附柱一次性使用,其优点是吸附效果可靠,缺点是成本较高。非特异性吸附柱可多次使用,但存在IgM抗体吸附不完全的缺陷,对于抗体滴度较高的患者,无法降至安全水平[27]。因此,一些移植中心采用非特异性吸附与PE联合的方法清除抗体[27]。这种方法相对于仅使用非特异性吸附柱可以显著提高IgM抗体清除率,在降低治疗成本的同时保证清除效果。目前尚缺乏大样本量研究评价术前免疫吸附对术后的长期效果,故大多数移植中心主张在术后定期复查抗体滴度,按需采取相应措施[28]。
术后规律性抗体清除可用于在术后复查中抗体滴度升高和脱敏前抗体滴度较高的患者[23]。一些学者认为,脱敏前抗体滴度较高者在术后出现抗体介导排斥反应(antibody-mediated rejection, AMR)的可能性较高,应常规进行抗体清除[29],也有学者认为仅在术后复查中抗体滴度升高(>1:64)时进行抗体清除不会增加排斥风险[28]。
3.2 IVIG:IVIG是纯化自人血浆的效应免疫调节剂。IVIG的恒定段可与巨噬细胞、B细胞的Fc段受体结合,抑制细胞分化和T细胞激活; IVIG的可变段可阻断自身抗体与特异性受体结合[30],广泛应用于预防和治疗AMR。IVIG的使用分为高剂量(1~2 g/kg)和低剂量(100 mg/kg)。高剂量IVIG常用于ABOi-KT、群体反应性抗体(panel reactive antibody,PRA)阳性或DSA阳性患者的移植前脱敏治疗;近年来越来越多的文献报道低剂量IVIG在ABOi-KT中的成功应用,在保证脱敏效果的同时减少不良反应[31]。研究表明,IVIG可诱导抗炎细胞因子表达,在体外交叉配型试验中起到封闭抗体的作用,在体内输注后可立即减少抗HLA抗体表达,减少排斥反应的发生[32]。
3.3 B细胞清除:B细胞清除可减少抗ABO抗体产生,避免发生AMR。在早期脱敏方案中,脾切除术是B细胞清除的唯一方法。但脾切除术会导致免疫系统永久受损,增加感染风险。
自从ABOi-KT成功应用利妥昔单抗以来,利妥昔单抗以不良反应少、长效清除B细胞的特点逐渐取代脾切除术[33]。利妥昔单抗是人/鼠嵌合抗CD20单克隆抗体,可充分清除骨髓、脾和淋巴结中的CD20阳性B细胞。Sawada等[33]在东京女子大学发表了第一例利妥昔单抗用于ABOi-KT的病案报道。 然而利妥昔单抗使用剂量仍存在较多争议。传统认为使用标准剂量375 mg/m2是安全、有效的[34]。近年来,已有部分移植中心证实,低剂量利妥昔单抗方案 (200 mg)也能充分清除B细胞[35],且可将术后感染发病率从标准剂量的38.2%降低至26.3%[36]。但现在仍缺乏比较不同剂量利妥昔单抗在ABOi-KT中作用和不良反应的前瞻性临床研究。
最近许多报道开始质疑B细胞清除对于预防AMR的必要性,认为不常规使用利妥昔单抗不增加AMR的发生率[12],同时可以避免感染等不良反应,因此一些移植中心开始停止在ABOi-KT患者中常规使用利妥昔单抗[37-38]。然而有研究表明,使用利妥昔单抗可减少慢性AMR,有助于改善患者预后[39]。
4 免疫适应
免疫适应是ABOi-KT术后在不发生AMR的情况下,也会出现抗ABO抗体升高和C4d沉积的现象[40]。临床资料表明,ABOi-KT术后不久抗ABO抗体即可恢复至足以发生AMR的水平,肾活检病理显示ABO抗原持续存在[41-42]。然而,在移植后的最初2周中,免疫系统将发生适应性变化,使上述现象不发展为移植物损伤,机制可能与抗凋亡基因如 HO-1, A20, bcl-2, bcl-xL以及补体调节蛋白如CD45, CD55, CD59, Erk-1/2 的表达相关[10]。保护性细胞表面分子转录抑制因子核转录因子-κB(nuclear factor-κB, NF-κB)的出现可能有助于预防T细胞反应和补体膜攻击复合物的生成,同时补体蛋白水平也会上调[33]。目前免疫适应的确切机制尚不明确。
5 C4d阳性与其他组织学研究
C4复合物是补体激活经典途径和凝集素途径的重要部分,是在细胞膜表面招募C3复合体的必要步骤[43]。C4d是C4裂解出C4b后保留在细胞膜表面共价结合的部分,是抗体依赖性补体激活的稳定标志[44]。与ABOc-KT相比,C4d可出现在管周毛细血管网中,但此时并未出现AMR征象[45]。电镜检查显示,C4d阳性的ABOi-KT与C4d阴性的ABOc-KT在急、慢性肾小球、肾小管周围毛细血管内皮细胞和基底膜损伤中,并无明显差异[46]。有16%~57%的ABOi-KT受体在术后1小时内即开始出现管周毛细血管网C4d沉积,而高达70%~95%的受体在术后1周内出现C4d沉积[45]。现认为单独出现的C4d沉积不是移植肾功能受损的标志,仅当C4d沉积和间质炎症同时出现时,才强烈提示出现进展中的慢性移植物失功[47]。
C3是补体激活经典途径和旁路途径的重要部分。裂解产物C3d通过CD21增强B细胞的作用,从而增强体液免疫应答[48]。C3是ABOi-KT中各种补体激活途径的共同组分和标志。有研究表明C3d阳性与ABOi-KT中AMR相关,提出C3d可以作为移植排斥的病理学标记物[49]。
6 小 结
ABOi-KT是目前解决供肾短缺的有效方法,各移植中心为建立标准化的ABOi-KT方案、提高移植物存活时间已经做出了很多努力。然而现在仍存在一些尚未解决的问题,如高初始ABO抗体滴度受体的术前脱敏方案、常规进行B细胞清除的必要性、应用最小化免疫抑制治疗方案以减少不良反应等,需进一步的研究解决。尽管如此,ABOi-KT依然是一种安全、有效、预后良好的治疗终末期肾病的方法。

