3D 打印多孔钛材料修复兔股骨髁骨缺损的实验研究
邓 威, 郑 欣, 谌业帅, 芮 敏, 王 帆, 李 赛, 郭吉强, 刘 洪, 郭开今
(徐州医科大学附属医院骨科, 徐州 221000; 2. 徐州市第一人民医院影像科, 徐州 221000)
3D 打印多孔钛材料修复兔股骨髁骨缺损的实验研究
邓 威1, 郑 欣1, 谌业帅1, 芮 敏1, 王 帆2, 李 赛2, 郭吉强1, 刘 洪2, 郭开今1
(徐州医科大学附属医院骨科, 徐州 221000; 2. 徐州市第一人民医院影像科, 徐州 221000)
目的 研究3D打印的多孔钛材料对骨缺损的修复能力和成骨性能。方法 选取20只6月龄新西兰白兔, 在其股骨髁上制备直径6 mm, 深10 mm的临界性骨缺损。实验组将多孔钛材料迅速注入骨缺损区。对侧生理盐水冲洗, 不植任何材料, 作为对照组。术后3 d、4周、8周、12周通过X线及CT观察骨缺损处生长变化,术后12周处死所有新西兰白兔,通过大体观察、X线、CT、Micro-CT及组织学观察骨缺损处的修复情况。结果 实验组与对照组一般情况良好,术后12周取出标本清理周围软组织,实验组缺损部位被新生骨填充; 对照组见缺损处骨质凹陷; 影像学观察,实验组植入物区域与周围界限模糊不清; 对照组未见明显新生骨阴影; Micro-CT观察,术后12周实验组植入物区域空隙内长入新生骨组织,植入物附近可见骨小梁长入; 对照组缺损区未见明显的骨长入; 硬组织切片观察,实验组植入材料与成骨细胞结合,可见成熟的哈佛氏系统散在分布于新生骨内; 对照组骨缺损区被大量纤维组织填充。IPP5.1计算新生骨与缺损区面积比,差异有统计学意义。结论 多孔钛材料可以促进骨组织的生长愈合,新生骨组织可以长入并充满孔隙,是一种很有应用前景的组织工程修复材料。
兔; 股骨髁; 骨缺损; 多孔钛; 3D 打印
由高能创伤、感染、骨肿瘤或先天性畸形切除引起的大段骨缺损, 至今仍是骨科临床医生面临的难题之一[1]。目前较为常用方法有自体骨移植或同种异体骨移植, 但这两种方法都存在一定局限性[2]。自体骨移植需要增加额外的手术,创伤大,取骨处往往会伴有神经损伤、骨折、感染等相关并发症[3]; 同种异体骨移植有诱发免疫反应、与宿主骨整合、重塑缓慢、传播疾病等风险[4]。多孔钛支架材料因其多孔结构与自然骨相接近,利于新生骨组织的长入而成为潜在的骨替代材料,为治疗骨缺损提供了一种新的方式[5]。作者利用激光立体成形技术对钛粉进行加工,制备出多孔钛材料,采用动物实验的方法,验证该材料修复兔股骨髁骨缺损的能力,为下一步临床应用提供实验依据。
1 材料与方法
1.1 实验动物、材料及相关仪器
选取6月龄普通级新西兰白兔20只,雌雄不限,体质量为2.8~3.2 kg,由徐州医科大学实验动物中心提供[SCXK(苏)2014-0009]。实验过程中对动物的处置参照科技部《关于善待实验动物的指导性意见》。多孔钛材料(创生医疗器械有限公司,中国); 手术器械,电钻及带刻度6 mm关节镜钻头(Smith & Nephew公司, 美国); DR设备(Philips公司,荷兰); CT(Siemens公司, 德国); 光学显微镜(Olympus公司, 日本); Micro-CT(SkyScan1176公司,美国);硬组织切片机(EXAKT公司, 德国)。
1.2 实验操作
多孔钛材料经高压蒸汽灭菌备用。以氯胺酮加氟哌利多肌肉注射麻醉,地西泮耳缘静脉注射维持麻醉效果,麻醉生效后将兔仰卧位固定于动物实验台上,经过消毒铺巾,在股骨外髁中点处做长约2 cm的纵形切口,依次切开并分离皮肤、皮下组织、肌肉及骨膜,暴露股骨外侧髁。用带刻度直径6 mm关节镜钻头在股骨髁中心距远端关节面4 mm处钻出直径6 mm、深10 mm的骨缺损空腔(图1)。随机选择一侧股骨外髁,植入多孔钛材料,对侧股骨外髁缺损不植任何材料,生理盐水冲洗,作为对照组。逐层关闭切口,伤口辅料包扎。术后所有兔单笼饲养,连续3 d给予青霉素80万U肌肉注射。
1.3 观测指标
1.3.1 大体观察 观察术前及术后兔的饮食、活动、伤口愈合情况。术后12周处死实验动物, 取出标本, 观察植入材料有无漏出, 尽量多地去除周围软组织,肉眼大体观察骨缺损区的修复及植入材料有无降解及多孔钛材料与宿主骨之间的愈合情况。1.3.2 影像学观察 X线观察术前兔股骨髁有无畸形并与术后对照,术后3d、4周、8周、12周观察骨缺损植入材料有无移位、脱出,以及愈合和修复的情况。并做常规CT,三维重建及最大骨密度成像(MIP)。

图1 实验兔股骨髁缺损造模
1.3.3 Micro-CT观察 术后12周选用SkyScan1176 Micro-CT,空间分辨率: 9 μm,18 μm; X-射线源:密封X-射线电子管 20~90 kV; 光斑尺寸: <5 μm; 功率: 25 W; 样品扫描尺寸:在最高分辨率的情况下, 直径为68 mm,最大扫描长度为200mm; 用Overlay叠加的方法通过不同颜色复合显示各个标本植入物区域内的新生骨。
1.3.4 组织学观察 制作股骨髁硬组织切片, HE染色, 光学显微镜下观察新骨形成情况进行形态学分析,并应用IPP5.1图像分析软件(美国Media Cybernetics公司)计算出新骨生成面积百分比(新生骨面积/骨缺损面积×100%)。1.4 统计学处理
应用SPSS19.0统计学软件,实验数据计量资料用x-± s表示。P<0.05为差异有统计学意义。
2 结果
2.1 大体观察
植入材料后兔的一般情况良好,术后手术侧兔下肢有不同程度肿胀,术后5 d时肿胀消失,切口愈合良好,无感染迹象,实验过程中无兔死亡,活动及进食正常。术后12周处死实验兔,取出标本清理周围软组织,可见实验侧骨缺损部位被新生骨组织填充,新生骨覆盖材料,骨缺损边界模糊不清,与周围骨组织无明显差别;对照组仍可见骨缺损处仍较周围骨质略凹陷,被纤维包膜覆盖,未修复(图2)。
2.2 X线及CT观察
2.2.1 X线观察 术后3 d,术后4周、8周两组于骨缺损处及周围有不同程度的骨膜反应,均见少量骨痂形成。术后12周2组均见骨痂形成,实验组骨缺损植入物区域密度较宿主骨高,骨痂形成较多,与周围骨之间的界限模糊不清,材料表面的腔隙已被充填。对照组骨缺损区域密度较低,与周围骨界限清晰可见,缺损区呈完全低密度透光影,可见低密度缺损区及点状新生骨阴影(图3)。
2.2.2 CT观察 术后3 d,通过CT三维成像及最大密度投影(MIP)技术,可见骨缺损,植入物位置良好,排列整齐; 术后4周,可见骨缺损区域有纤维组织长入; 术后8周两组标本均可见不同程度的骨膜反应在骨缺损区及植入材料周围,并可见少量骨痂形成; 到术后12周,取出标本行CT检查。两组均见骨痂形成,实验组多孔钛植入区域密度较周围宿主骨高并骨痂形成较多,并与周围骨之间的界限模糊不清,多孔区域已被充填。对照组骨缺损区域密度较低,与周围骨界限清晰可见,缺损区呈完全低密度透光影,可见低密度缺损区及点状新生骨阴影(图4)。
2.3 Micro-CT
术后12周可见实验组植入物区域空隙内长入新生骨组织,与周围宿主骨连接处有成片或者成网状骨小梁生长, 新生骨与多孔材料结合紧密(图5)。
2.4 组织学观察

图2 兔股骨髁缺损标本
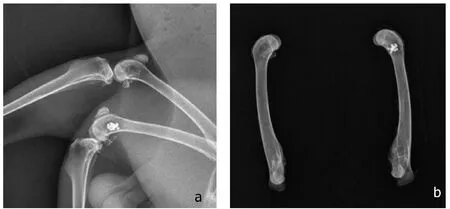
图3 兔股骨髁缺损术后X线观察

图4 兔股骨髁缺损术后CT观察

图5 兔股骨髁缺损术后Micro-CT观察
术后12周,实验组植入材料与周围骨组织紧密结合,未见明显炎性细胞浸润,无纤维组织间隔,植入材料区域无明显的骨吸收及骨溶解,材料与成骨细胞结合,新的骨小梁结构形成并与多孔钛紧密结合,可见成熟的哈弗氏系统散在分布于新生骨内,新生骨小梁结构通过多孔钛周边部向骨缺生骨与骨缺损面积比为0.1721±0.046 5; 对照组为0.0291±0.0421(P<0.01)。损中心区长入,植入材料被新生骨包饶,多孔钛材料空隙内均可见新生骨长入; 对照组在骨缺损区边缘可见无序的新生骨形成,数量较少,骨缺损区被大量的纤维组织填充(图6)。
实验组和对照组各选取5个切片, 通过IPP5.1图像分析软件计算新骨生成面积百分比=新生骨面积/骨缺损面积×100%。实验组和对照组在光学显微镜10×视野下随机选取5个视野,计算出新

图6 兔股骨髁组织切片观察
3 讨论
骨缺损是严重危害人类健康的常见骨科疾病,造成骨缺损的原因很多,创伤、感染、肿瘤切除等较为常见,由于骨质的缺失,骨组织无法修复再生。骨缺损的治疗是骨科最为困难的部分之一,目前主要为植骨,包括自体植骨或同种异体骨移植为主,且自体骨移植被公认为骨缺损修复的“金标准”。但采骨量有限,术后供区疼痛等制约了自体骨移植的应用,异体骨移植虽然克服了自体骨的一些缺点,却有引发免疫排斥反应、传播疾病的危险[6,7]。多孔材料利于成骨细胞和血管的长入和骨生成、骨诱导和骨传导,而成为近年来研究的热点[8]。近年来,新兴的组织工程人工骨技术给骨缺损治疗带来了希望。
多孔钛材料是一种优良的生物医用材料,与人体骨骼密度和较为接近,具备良好的可加工性,以及很好地环境适应性[9]。表面多孔结构,有利于骨组织的长入,改善植入体和骨组织的相容性,同时能促进纤连蛋白和玻连蛋白在材料表面及内部的沉积[10]。
基于3D打印的多孔钛材料因其多孔特性而成为骨替代物,其一,多孔结构利于成骨细胞的粘附、分化和生长,新生骨组织长入孔隙,加强了多孔钛材料与宿主骨的连接,达到生物固定的作用;其二,多孔钛的密度、强度和弹性模量能通过改变其孔隙度来调整,进而到达与宿主骨相匹配的力学相容性,避免植入体内发生骨变形、坏死和发生新骨畸变等;另外,开放的多孔结构利于血液和养料在植入物内的传输,促进组织的再生和重建,加快修复进程。有学者[11]研究表明,多孔材料相互连通的孔隙能给血管提供长入空间,为组织提供营养,促进新生骨的长入。
本实验所采用的3D打印多孔钛材料, 通过常规CT, Micro-CT观察, 多孔钛材料的外形符合骨缺损部位的大小和形态; 通过硬组织切片HE染色证实多孔钛材料能很好的修复骨缺损区域。多孔钛材料内部为相互连通的多孔开放系统,可以促进毛细血管向内生长, 提供细胞所需的充足的营养和氧分[12]。
有学者[13,14]认为 多孔钛材料的孔径150~600 μm都能让骨组织长入。研究[15,16]表明,40%孔隙率连通性差的多孔钛合金植入体内其钙磷含量低于孔隙率70%为连通性好的植入体,间接表明了连通的孔隙结构对体液转运的促进作用。本实验所采用的多孔钛材料的孔径范围是145~253 μm,空隙互相贯通,术后12周通过常规CT, Micro-CT, 硬组织切片组织学观察,植入材料的孔隙内均已长入并充满成熟的骨组织,骨缺损修复完整,植入物与周围骨组织形成连续的骨性结合,说明本实验所采用的多孔材料选择恰当,适合成骨细胞长入,达到了骨缺损修复的实验预期。
实验表明, 多孔钛材料表面及孔隙内大量新生骨组织生成及长入, 材料的多孔性更加利于成骨的早期贴附、增殖, 有利于骨缺损的修复。3D打印的多孔钛材料在动物实验中表现出良好的生物相容性,植入物周围骨组织修复愈合良好, 植入物与骨界面形成骨结合, 新生骨组织长入并充满材料的多孔结构。
[1] Yuan J, Cui L, Zhang WJ, et al. Repair of canine mandibular bone defects with bone marrow stromal cells and porous βtricalcium phosphate[J]. Biomaterials, 2007, 28(6):1005-1013.
[2] Komaki H, Tanaka T, Chazono M, et al. Repair of segmental bone defects in rabbit tibiae using a complex of betatricalcium phosphate, type I collagen, and fibroblast growth factor-2[J]Biomaterials, 2006, 27(29):5118-5126.
[3] Samartzis D, Shen FH, Goldberg EJ, et al. Is autograft the gol standard in achieving radiographic fusion in one-level ante rior cervical discectomy and fusion with rigid anterior plat fixation [J]. Spine(Phila Pa 1976), 2005, 30(15):1756-1761
[4] Ding H, Mao Y, Yu B, et al. The use of morselized allograft without impaction and cemented cage support in acetabula revision surgery: a 4- to 9-year follow-up[J]. J Orthopaedi Surg Res, 2015, 10(1):77.
[5] Laurencin C, Khan Y, El-Amin SF. Bone graft substitutes[J]Expert Rev Med Dev, 2006, 3(1):49-57.
[6] Olender E, Brubaker S, Uhrynowska-Tyszkiewicz I, et al Autologous osteoblast transplantation, an innovative metho of bone defect treatment: role of a tissue and cell bank in th process[J]. Transplant Proc, 2014, 46(8):2867-2872.
[7] Faldini C, Traina F, Perna F, et al. Surgical treatment of asepti forearm nonunion with plate and opposite bone graft strut Autograft or allograft [J]. Int Orthop, 2015, 39(7):1343-1349
[8] Bucholz RW. Nonallografi osteoconductive bone graf substitutes[J]. Clin Orthop Relat Res, 2002(395):44-52.
[9] Kenneth Ward W. A review of the foreign-body response t subcutaneously-implanted devices:the role of macrophage and cytokines in biofouling and fibrosis[J]. J Diabetes Sc Technol, 2008, 2(5):768-777.
[10] Besong AA, Hailey JL, Ingham E, et al. A study of th combined effects of shelf ageing following irradiation in ai and counterface roughness on the wear of UHMWPE[J]Biomed Mater Eng, 1997, 7(1):59-65.
[11] Al-Malaika S. Vitamin E: an effective biological antioxidant fo polymer stabilisation[J]. Polymers Polymer Composites 2000, 8(8):537-542.
[12] Drosse I, Volkmer E, Capanna R, et al. Tissue engineering fo bone defect healing:An update on a multi-component approac[J]. Injury, 2008, 39(Suppl 2):S9-S20
[13] Wolfarth D, Ducheyne P. Effect of a change in interfacia geometry on the fatigue strength of porous-coated Ti-6Al 4V[J]. J Biomed Mater Res A, 1994, 28(4):417-425.
[14] Gibson LJ, Ashby MF. Cellular solids: structure and propertie[M]. Cambridge: Cambridge University Press, 1999.
[15] Daugaard H, Elmengaard B, Bechtold JE, et al. Bone growt enhancement in vivo on press-fit titanium alloy implants wit acid etched microtexture[J]. J Biomed Matser Res A,2008 87(2):434-440.
[16] Shim J, Nakamura H, Ogawa T, et al. An understanding of th mechanism that promotes adhesion between roughene titanium implants and mineralized tissue[J]. J Biomech Eng 2009, 131(5):054503.
An Experimental Study on Repairing Femoral Condyle Defect by Printing Porous Titanium with 3D Technology in Rabbits
DENG Wei1, ZHENG Xin1, SHEN Ye-shuai1, RUI Min1, WANG Fan2,LI Sai2, GUO Ji-qiang1, LIU Hong2, GUO Kai-jin1
(1. Department of Orthopaedics, Affiliated Hospital of Xuzhou Medical University, XuZhou 221000, China;2. Imaging Department of Xuzhou No.1 People’s Hospital, XuZhou 221000, China)
Objective To investigate the ability of the 3D printed porous titanium material for bone defect repairing and bone formation. Methods The critical bone defect models (6 mm in depth and 10 mm in diameter) were made of 20 six-month-old New Zealand white rabbits’ femoral condyle. One of the porous titanium material was swiftly implanted into the bone defect area (experimental group, n=20),with the opposite side as control group (also the blank group, n=20), washed with saline and sutured without any implants. The samples were harvested and observed by X-ray and CT examinations at 3 days and 4, 8, 12 weeks after the operation to assess bone growth in the bone defect area. At 12 weeks after the operation, all rabbits were euthanized and evaluate the bone defect repair through X-ray, CT,histology and Micro-CT. Results Both the experimental group and control group recovered with good condition. At 12 weeks after the operation, we can see that the bone defect area was filled with new bone in the experimental group after removing the soft tissue surrounding the bone defect area; In contrast,the bone defect in control group was seen hollow and covered with fibrous capsule. According to the radiological observation, the demarcation line between the defect area and the surrounding area was obscure in the experimental group; the bone defect area in control group saw an entire translucency with no obvious shadow reflecting the new-borne bone. The Micro-CT observations proved fresh bone tissue formed in the plantation area at 12 weeks after the operation, and the surrounding area could see bone trabecula grown, In comparison, there was no obvious bone formed in the defect area of control group,which was filled by fiber tissue and relatively less bone trabecula and new-borne bone tissue. The results of un-decalcificated bones slicing showed the implanted material appeared combined with osteoblast,and the mature harversian system was seen distributed within the new-borne bone; for control group, a small amount of unordered bone formed in the defect area, filled with a lot of fiber texture. The area ratio of new-borne bone and the defect area was calculated via the IPP5.1 software, producing differences that have statistical significance. Conclusion A series of experiments prove that the porous titanium material has high biosecurity and ability to promote bone growth and healing. The new-borne bone tissue can grow and fill the lacuna, thereby effectively repairing bone defect. In short, the 3D printed porous titanium is a kind of promising repairing material in the tissue engineering field.
Rabbits; Femoral condyle; Bone defect; Porous titanium; 3D printing
R683.4 Q95-33
A
1674-5817(2017)04-0266-07
10.3969/j.issn.1674-5817.2017.04.002
2017-02-23
江苏省卫生计生委面上科研课题(H201528); 江苏省级重点研发专项资金项目(BE2015627); 第59批中国博士后科学基金面上项目(2016M591929); 徐州市科技社会发展项目(KC15SH067)共同资助
邓 威(1986-), 男, 医学硕士, 研究方向: 运动创伤与关节镜。E-mail:dengwei0223@163.com
郭开今, E-mail: xzgkj@sina.com

