Irx5a 基因过表达对斑马鱼胚胎早期造血的影响
金 璐, 李 燕, 李志操, 吴西军, 周艳华, 何志旭, 舒莉萍,3,4
(贵州医科大学 1. 组织工程和干细胞实验中心; 2. 儿童医学中心;3. 基础医学院免疫学教研室; 4. 实验动物中心, 贵阳550004)
·第十六届中国西部实验动物管理与学术研讨会论文专题
Irx5a 基因过表达对斑马鱼胚胎早期造血的影响
金 璐1,2, 李 燕2, 李志操1,2, 吴西军1, 周艳华1, 何志旭1,2, 舒莉萍1,3,4
(贵州医科大学 1. 组织工程和干细胞实验中心; 2. 儿童医学中心;3. 基础医学院免疫学教研室; 4. 实验动物中心, 贵阳550004)
目的 探讨易洛魁族同源盒5a(Irx5a)基因对斑马鱼胚胎早期造血相关转录调控因子的影响。方法 于斑马鱼胚胎1细胞受精卵期,显微注射Irx5a-EGFP mRNA斑马鱼胚胎作为实验组、显微注射增强型绿色荧光蛋白(EGFP) mRNA斑马鱼胚胎作为实验对照组、野生型斑马鱼作为空白对照组,应用qPCR检测相关造血转录调控因子在斑马鱼胚胎受精后9 h (9 hpf)、12 h、18 h、24 h和30 h时相的表达水平。结果 实时荧光定量PCR结果表明, 在原始造血转录因子lmo2、scl中, 实验组从9 hpf~24 hpf较另外两组间明显减低; 在定向造血转录因子中,c-myb实验组从12 hpf~24 hpf较另外两组间明显减低,runx1实验组从9 hpf~30 hpf较另外两组间明显减低; 髓系造血转录因子pu.1和红系造血转录调控因子gata-1实验组从9 hpf~30 hpf较另外两组间明显减低,且差异有统计学意义。结论 Irx5a基因在斑马鱼原始造血、成体造血、红系造血、髓系造血的重要转录调控因子中发挥着抑制作用。
斑马鱼; 5a(Irx5a); 造血转录调控因子
造血干细胞(hematopoietic stem cells,HSCs)属多能干细胞,是存在于造血组织中的一群原始造血细胞,具有高度的自我更新、多向分化以及损伤后修复的能力,HSC的自我更新是由促进生长的正调控信号和导致凋亡的负调控信号之间的平衡来实现调控的。HSC以一个细胞分裂成两个细胞时,其中一个细胞仍然保持干细胞的一切生物特性,而另一个细胞则进一步分化成为各类成熟血细胞[1]。造血干细胞在发育过程中的不同阶段,其各系中有特异的造血转录调控因子,如原始造血相关因子lmo2和scl; 定向造血相关因子c-myb和runx1; 红系造血相关因子gata-1; 髓系造血相关因子pu.1等[2]。
易洛魁族同源盒(iroquois homebox, Irx)基因最早在果蝇的神经系统中被发现[3,4],该基因编码一个含高度保守同源盒序列的三氨基酸环延伸(thre amino acid, TALE)超家族蛋白。在哺乳动物中由A、B两个基因簇组成的6个Irx基因,IrxA位于13号染色体,含有Irx1、Irx2和Irx4,IrxB位于8号染色体,含有Irx3、Irx5和Irx6。在斑马鱼中含有11个Irx基因4个基因簇,IrxAa (Irx1a, 2a 4a), IrxAb(Irx1b, 4b), IrxBa(Irx3a, 5a, 6a), and IrxB(Irx3b, 5b),另外还有Irx7,其中的Irx5a与高等的脊椎动物IrxB基因簇有着类似的功能[5-7]。例如在小鼠中IrxB基因的缺失可以引起肾母细胞瘤肿瘤细胞分化而导致肾母细胞瘤,在人类前列腺癌细胞中Irx5基因的下调可使细胞周期停止,凋亡细胞增加[8,9]。故本研究以Irx5a为研究对象,探讨其对早期造血发育中相关转录调控因子的影响。
1 材料与方法
1.1 实验动物
实验所需野生型斑马鱼Tüebingen由本实验室繁殖培育, 养殖条件: 28±2 ℃,用带有过滤系统的循环水系统进行养殖,光照12 h/d。予丰年虫早晚各喂食1次,雌雄鱼分缸饲养,待斑马鱼发育至性成熟,按雌雄1∶2的比例配对,在次日0.5h后收集胚胎,对受精卵进行清洗后,移入斑马鱼受精卵培养用水(egg water)中并置于28 ℃生化培养箱培养。根据斑马鱼生长发育图谱以了解斑马鱼胚胎发育不同时相。
1.2 主要试剂及仪器
Trizol reagent (Ambion 15596026),iQTM SYBR®Green super(Bio-Rad 1708882AP),First strand cDNA synthesis(Fermentas MBIK1612),KOD plus(Toyobo Kod-201),无水乙醇(分析纯,中国上海振兴化工一厂),氯仿(分析纯,中国汕头市西陇化工厂),德国Eppendorf AG22331梯度PCR仪,德国Eppendorf低温离心机,美国紫外分光光度仪(UV1700), 美国凝胶成像系统(Bio-Rad), 美国Bio-Rad CFX96 Real-Time PCR仪,上海生化培养箱(LRH系列,一恒科技有限公司),中国北京爱生科技斑马鱼循环养殖系统。
1.3 Irx5a过表达模型的建立
将Irx5a-增强型绿色荧光蛋白(EGFP)正义mRNA经显微注射导入1~2细胞期的野生型斑马鱼Tüebingen胚胎中作为实验组; 将EGFP正义mRNA经显微注射导入1~2细胞期的野生型斑马鱼Tüebingen胚胎中作为实验对照组; 未进行任何处理的野生型斑马鱼作为空白对照组。注射后的胚胎均置于28.5 ℃恒温培养箱中,定期更换培养液并挑出死胚胎,防止影响其他胚胎的发育。经显微注射后的胚胎在体视镜下观察胚胎发育时相,选取所需时相,并于荧光显微镜下筛选具有特异性绿色荧光蛋白表达的胚胎,按照斑马鱼形态发育图谱辨认其发育过程,并收集实验所需的时相。
1.4 提取斑马鱼胚胎RNA及制备cDNA
分别收集三个实验组受精后不同时相(9 h、12 h、18 h、24 h、30 h)的胚胎, 每个时相20枚放于无酶Epp管中, PBS清洗一次后加150 μL Trizol液于室温放置5 min, 每1 mL Trizol液加入200 μL氯仿剧烈振荡15 s并室温放置2~3 min, 12 000 g离心15 min (4 ℃), 将上清(约60%)转移至新的无酶Epp管中, 加入等体积的异丙醇上下颠倒10次并静置冰上10 min, 12 000×g再次离心15 min (4 ℃), 弃上清可见白色沉淀附于管壁, 加入1 mL的体积分数75%乙醇-DEPC-treated water洗涤沉淀并7 500 g×5 min (4 ℃)后弃上清, 室温放置5~10 min使乙醇挥发后每管加入10 μL无酶水溶解RNA并用紫外分光光度计检测其纯度。最后将上述所得的RNA进行逆转录,从而得到斑马鱼不同时相的cDNA, 在-20℃中保存。
1.5 引物设计及合成
从GenBank中获取下表斑马鱼基因的cDNA序列,应用Primer Express软件,根据SYBR Green染料法的引物设计原则,在各自保守区域设计特异性引物,以β-actin和GAPDH作为内参基因。造血转录调控因子: 原始造血lmo2、scl,成体造血c-myb、runx1,红系造血gata-1,髓系造血pu.1作为目的基因,引物序列(表1),引物由上海捷瑞生物工程有限公司合成。
1.6 实时荧光定量PCR
在上述所得cDNA中分别加入SYBR和各转录因子引物, 95 ℃预变性3 min, 95℃变性10s, 55.8 ℃退火/延伸30 s, 39个循环。溶解曲线: 每5 s升高0.5 ℃,从55 ℃到95 ℃。以GAPDH、β-actin作为内参基因,对lmo2、scl、C-myb、Runx1、Gata-1、Pu.1进行相对定量分析。利用Bio-Rad CFX manager 2.0软件分析相对表达值,用内参基因做标准,进行分析比较,最后通过SPSS16.0进行统计学分析, P<0.05为差异有统计学意义。
2 结果
斑马鱼GAPDH、β-actin、lmo2、scl、C-myb、Runx1、Gata-1、Pu.1基因的溶解曲线均为单峰曲线,说明所扩增的目的基因引物设计良好,在使用所选择的最适温度时,无非特异性产物生成; 并且扩增曲线光滑、连续,多次重复,结果较好。
2.1 Imo2在不同组各时相中的变化
受精后9 h~24 h(9 hpf~24 hpf )中实验组较另外两组的相对表达量均下降,lmo2在实验组9 hpf有少量表达,12 hpf表达量最高,随着时相的增加逐渐下降,30 hpf后基本无表达(P<0.05,表2)。
2.2 Scl在不同组各时相中的变化
9 hpf~24 hpf 中实验组较另外两组的相对表达量均下降,scl在实验组9 hpf已有所表达,12hpf表达量最高,随着时相的增加逐渐下降,30 hpf后基本无表达(P<0.05,表3)。
2.3 C-myb在不同组各时相中的变化
12 hpf~24 hpf 中实验组较另外两组的相对表达量均下降,c-myb在实验组9 hpf少量表达,以后逐渐增加,18 hpf表达量最高,随着时相的增加逐渐下降(P<0.05,表4)。

表 1 实时荧光定量PCR引物序列和产物长度Table 1 The sequences of primers and products length of qPCR

表 2 lmo2在Irx5a基因mRNA的相对表达量 (n=3)Table 2 Expression of lmo2 in the mRNA of Irx5a (n=3)
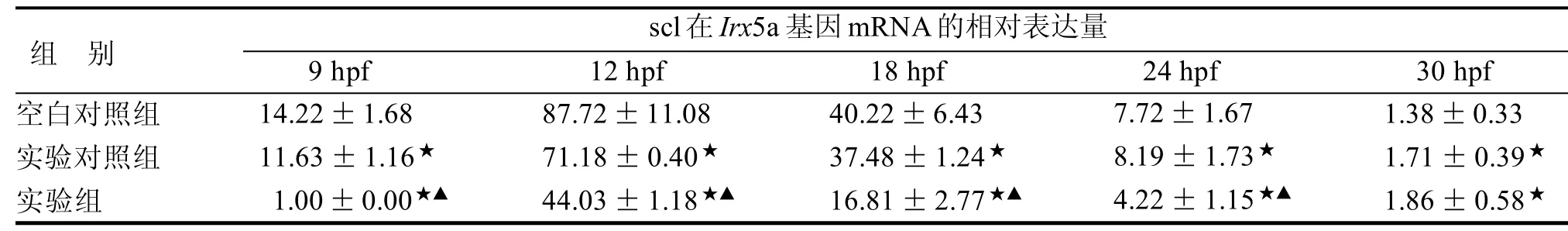
表 3 scl在Irx5a基因mRNA的相对表达量 (n=3)Table 3 Expression of scl in the mRNA of Irx5a (n=3)

表 4 c-myb在Irx5a基因mRNA的相对表达量 (n=3)Table 4 Expression of c-myb in the mRNA of Irx5a (n=3)
2.4 Runx1在不同组各时相中的变化
9 hpf~30 hpf 中实验组较另外两组的相对表达量均下降, runx1在实验组9 hpf少量表达,在9 hpf已有所表达,12 hpf表达量最高,随着时相的增加逐渐下降,30 hpf后基本无表达(P<0.05, 表5)。
2.5 Gata-1在不同组各时相中的变化
9 hpf~30 hpf 中实验组较另外两组的相对表达量均下降,gata-1在mRNA实验组9 hpf少量表达,18 hpf表达量最高,随着时相的增加逐渐下降,30hpf后明显减少(P<0.05,表6)。

表 5 runx1在Irx5a基因mRNA的相对表达量 (n=3)Table 5 Expression of runx1 in the mRNA of Irx5a (n=3)

表 6 gata-1在Irx5a基因mRNA的相对表达量 (n=3)Table 6 Expression of gata-1 in the mRNA of Irx5a (n=3)
2.6 Pu.1在不同组各时相中的变化
9 hpf~30 hpf 中实验组较另外两组的相对表达量均下降,pu.1在实验组9 hpf已有所表达,12 hpf表达量最高,随着时相的增加逐渐下降,30 hpf后表达量明显下降(P<0.05,表7)。因组序列已全部被测出,其中有80多个与哺乳动物造血相关的基因,如scl、lmo2、gata-l和c-myb等[10]。斑马鱼的造血发育与人类有着许多相似之处,造血发育同样具有原始造血(primitive hematopoiesis)和定向造血(definitive hematopoiesis),

表 7 pu.1在Irx5a基因mRNA的相对表达量 (n=3)Table 7 Expression of pu.1 in the mRNA of Irx5a (n=3)
3 讨论
斑马鱼作为一种新兴的动物模型是研究基因功能的有效载体,相比较于其他模式生物,其优势在于其生殖周期短、生殖能力强、高产卵量、体积小、发育快且胚胎透明,经济适用等优点,并且斑马鱼基因与人类基因保守度约85%。斑马鱼基这两个造血峰存在于所有脊椎动物,包括斑马鱼。不同的是斑马鱼的原始造血存在于两个区域,第一个区域分为两部分即前部侧板中胚层(anterior lateral mesoderm,ALM)和后部侧板中胚层(posterior lateral mesoderm,PLM),它是某些髓系前体细胞及早期巨噬细胞起源的区域,叫作侧板中胚层。第二个区域称为中间细胞群(intermediate cell mass,ICM),位于脊索和躯干中胚层之间,相当于哺乳动物卵黄囊,原始造血过程中的造血干细胞来自于ICM区[10,11]。在人类中Irx5基因定位于第16号染色体,而在斑马鱼中则有两个子基因,其中Irx5a位于第7号染色体,Irx5b位于第25号染色体[12]。
本研究通过观察实验组,实验对照组和空白对照组中各个造血相关转录调控因子的变化来探讨Irx5a对斑马鱼早期造血的影响。对于原始造血发育的转录因子主要有lmo2、scl、gata2、fli1a等。lmo2是具有LIM结构域的转录因子,在斑马鱼中lmo2在10~11 hpf表达于ALM和PLM区,然后在ICM区域有所表达。Scl对于原始和定向造血及血管生成均发挥着关键作用,与急性淋巴细胞白血病有着密切的关系[13-15]。从实验结果中可以看出,原始造血lmo2和scl在过表达Irx5a 时对造血发育发挥着抑制作用。定向造血发育中发挥着重要作用的转录因子主要有c-myb、runxl、cbfβ等,c-myb为myb原癌基因家族最早被鉴定成员之一,主要表达于不成熟血细胞,随着血细胞不断成熟分化而表达下降。runxl是runt家族成员之一, runt家族在多个发育过程中均发挥重要作用, 包括神经发育、造血发育、骨发育及细胞分裂等, runxl在原始造血的成熟和定向造血的发育中均发挥着作用。从实验结果中可以看出, c-myb和runxl均在过表达Irx5a基因时对造血发育发挥抑制作用[16,17]。gata-l通过与结合多个转录因子来产生效应, 在斑马鱼ICM区原始红细胞和髓细胞间的平衡主要是通过gata-l和pu.1来调控的, gata-l的正常功能是部分限制细胞中pu.1的表达, 所以, gata-l不仅是促进红系发育而且抑制髓细胞的表达[18]。实验结果中可以证明gata-l和pu.1在红系和髓系造血中发挥着相互抑制的作用。
综上所述,过表达Irx5a基因可以下调造血转录调控因子,即Irx5a基因在斑马鱼原始造血、成体造血、红系造血和髓系造血的重要转录调控因子中发挥着抑制作用的。
[1] Huang X, Cho S, Spangrude GJ. Hematopoietic stem cells:generation and self-renewal[J]. Cell Death Differ, 2007, 14(11):1851-1859.
[2] de Jong JL, Zon LI. Use of the zebrafish system to study primitive and definitive hematopoiesis[J]. Annu Rev Genet,2005, 39:481-501.
[3] Cavodeassi F, Modolell J, Gomez-Skarmeta JL. The Iroquoi family of genes: from body building to neural patterning[J]Development, 2001, 128(15):2847-2855.
[4] Diez del Corral R, Aroca P, Gómez-Skarmeta JL, et al. Th Iroquois homeodomain proteins are required to specify bod wall identity in Drosophila[J]. Genes Dev, 1999, 13(13)1754-1761.
[5] Dildrop R, Ruther U. Organization of Iroquois genes in fis[J]. Dev Genes Evol, 2004, 214(6):267-276.
[6] Gómez-Skarmeta JL, Modolell J. Iroquois genes: genomi organization and function in vertebrate neural developmen[J]. Curr Opin Genet Dev, 2002, 12(4):403-408.
[7] Lecaudey V, Anselme I, Dildrop R, et al. Expression of th zebrafish Iroquois genes during early nervous system forma tion and patterning[J]. J Comp Neurol, 2005, 492(3):289 302.
[8] Mengelbier LH, Karlsson J, Lindgren D, et al. Deletions of 16 in Wilms tumors localize to blastemal-anaplastic cells an are associated with reduced expression of the IRXB rena tubulogenesis gene cluster[J]. Am J Pathol, 2010, 177(5)2609-2621.
[9] Myrthue A, Rademacher BL, Pittsenbarger J, et al. Th iroquois homeobox gene 5 is regulated by 1,25 dihydroxyvitamin D3 in human prostate cancer and regu lates apoptosis and the cell cycle in LNCaP prostate cance cells[J]. Clin Cancer Res, 2008, 14(11):3562-3570.
[10] Jing L, Zon LI. Zebrafish as a model for normal and malignan hematopoiesis[J]. Dis Model Mech, 2011, 4(4):433-438.
[11] Chen AT, Zon LI. Zebrafish blood stem cells[J]. J Cel Biochem, 2009, 108(1): 35-42.
[12] Kerner P, Ikmi A, Coen D, et al. Evolutionary history of th iroquois/Irx genes in metazoans[J]. BMC Evol Biol, 2009, 9 74.
[13] Davidson AJ, Zon LI. The 'definitive' (and 'primitive') guid to zebrafish hematopoiesis[J]. Oncogene, 2004, 23(43): 7233 7246.
[14] Hsia N, Zon LI. Transcriptional regulation of hematopoieti stem cell development in zebrafish[J]. Exp Hematol, 2005, 3(9):1007-1014.
[15] Paik EJ, Zon LI. Hematopoietic development in the zebrafis[J]. Int J Dev Biol, 2010, 54(6-7):1127-1137.
[16] Gering M, Patient R. Hedgehog signaling is required for adul blood stem cell formation in zebrafish embryos[J]. Dev Cell 2005, 8(3):389-400.
[17] Jin H, Xu J, Wen Z. Migratory path of definitive hematopoi etic stem/progenitor cells during zebrafish development[J]Blood, 2007, 109(12):5208-5214.
[18] Rhodes J, Hagen A, Hsu K, et al. Interplay of pu.1 and gata determines myelo-erythroid progenitor cell fate in zebrafis[J]. Dev Cell, 2005, 8(1):97-108.
Effects of Irx5a Gene Overexpression on Early Hematopoietic in Zebrafish Embryos
JIN Lu1,2, LI Yan2, LI Zhi-cao1,2, WU Xi-jun1, ZHOU Yan-hua1, HE Zhi-xu1,2, SHU Li-ping1,3,4
(1. Tissue Engineering and Stem Cell Research Center, 2. Deptartment of Pediatrics,3. Department of Immunology, 4. Laboratory Animal Center,Guizhou Medical University, Guiyang 550004, China)
Objective To investigate the expression and influence of early hematopoietic related genes in zebrafish embryos. Method The single-cell-stage zebrafish embryos were micro-injected with iroquois homebox 5a-enhanced green fluorescent protein (Irx5a-EGFP) mRNA as experimental group, EGFP mRNA as experimental control group, wild type zebrafish as blank control group. Comparised the hematopoietic transcript factor genes with three groups by quantificational reverse transcription-PCR (qPCR). Such as primitive hematopoiesis scl and lmo2, definitive hematopoiesis c-myb and runx1,erythroid hematopoiesis gata-1, myeloid hematopoiesis pu.1. The zebrafish embryos’ time point are 9 h、12 h、18 h、24 h、30 h post fertilization (pf). Results From the real-time fluorescence quantitative PCR can be seen in the original hematopoietic transcription factor lmo2 and scl, the experimental group from 9 hpf to 24 hpf significantly lower than the other two groups. In the targeted hematopoietic transcription factor, c-myb experimental group from 12 hpf to 24 hpf significantly lower than the other two groups, runx1 experimental group from 9 hpf to 30 hpf significantly lower than the other two groups. Myeloid hematopoietic transcription factor pu.1 and erythroid hematopoietic transcription factor gata-1, the experimental group from 9 hpf to 30 hpf were significantly lower than the other two groups. The differences were statistically significant. Conclusion Irx5a gene plays an inhibitory role in the transcriptional regulators of primitive hematopoiesis, adult hematopoiesis, erythroid hematopoiesis and myeloid hematopoiesis in the zebrafish.
Zebrafish; Iroquois homebox 5a(Irx5a); Hematopoietic transcription factor
Q95-33
A
1674-5817(2017)04-0309-06
10.3969/j.issn.1674-5817.2017.04.011
2017-05-30
国家自然科学基金(31460312)
金 璐(1991-), 女, 临床医学硕士研究生, 贵州医科大学组织工程和干细胞实验中心,E-mail: 326687520@qq.com
舒莉萍, 教授。E-mail: gyslp-456@163.com
何志旭, 教授。 E-mail: hzx@gmc.edu.cn

