人胃癌细胞系的建立及其评价
葛晓梅, 张一心, 谢付波, 刘继斌, 杨 磊, 渠颖颖,顾 莹,5, 李学廷, 杨伟敏, 刘喜朋, 周 禾,5, 强福林
(1. 上海睿智化学研究有限公司, 上海 201203; 2.上海交通大学, 上海 200240;3. 南通市肿瘤医院, 南通 226361; 4. 药物转化工程技术研究中心, 上海 201203;5. 开拓者医学研究(上海)有限公司, 上海 201203)
·论 著·
人胃癌细胞系的建立及其评价
葛晓梅1,2, 张一心3, 谢付波1,4, 刘继斌3, 杨 磊3, 渠颖颖1,顾 莹1,5, 李学廷1, 杨伟敏1, 刘喜朋2, 周 禾1,4,5, 强福林3
(1. 上海睿智化学研究有限公司, 上海 201203; 2.上海交通大学, 上海 200240;3. 南通市肿瘤医院, 南通 226361; 4. 药物转化工程技术研究中心, 上海 201203;5. 开拓者医学研究(上海)有限公司, 上海 201203)
目的 利用已建立的胃癌人源化异种移植瘤 (Patient-derived xenograft, PDX) 模型建立胃癌细胞系,并对建立的胃癌细胞系进行生物学特性评价。方法 选择12例生长状态良好的胃癌PDX模型,待小鼠移植瘤体积生长至500~900 mm3时,取出肿瘤组织进行癌细胞的原代培养建立细胞系,通过细胞形态学观察、染色体分析、短片段重复序列(STR)分析、免疫组织化学染色、体外药敏及体内成瘤实验对其生物学特性进行分析鉴定,并在此基础上利用建立成功的胃癌细胞系进行化疗药物药效学评价。结果 12例PDX模型中共成功建立6例胃癌细胞系,细胞系可稳定多次传代。选择其中2例胃癌细胞系(GAXC031和GAXC066)进行生物学特性鉴定。遗传学结果证实,这2例细胞系来自亲本PDX模型,符合恶性胃癌的遗传学特征,在裸小鼠体内具有致瘤性。由细胞系建立的移植瘤模型在保留主要临床生物学特征的前提下,具有成瘤率高,潜伏期短,生长均一性好等特点。体外和体内药敏实验结果均表明,GAXC031对5-氟尿嘧啶有一定的敏感性[体外半抑制浓度(IC50)为0.265 μmol/L, 体内肿瘤生长抑制率(TGI)为30%~50%], 而GAXC066不敏感(体外 IC50为>200 μmol/L, 体内 TGI<0); 2 例细胞系对顺铂的敏感性均较强(TGI>60%)。结论 成功建立了6例人源胃癌细胞系。对GAXC031和GAXC066细胞系全面的分析和鉴定显示,细胞系与亲本PDX模型高度相关。细胞系体内外药敏实验结果显示,对同一个化疗药物,其体内与体外数据间存在很高的一致性。这些细胞系及相关模型可用于抗癌药物的研发和肿瘤基础研究。
人源化异种移植瘤(PDX); 胃癌; 细胞系; 生物学特性; 药效学实验
胃癌是全球发病率最高的癌症之一,在恶性肿瘤的死亡病因中高居第2位, 仅次于肺癌[1,2]。近年来,虽然胃癌的全球发病率有所下降,但相比于西方国家,亚洲的发病率仍然很高[3-5]。中国是胃癌发病率最高的国家之一,胃癌的新发病例已占全球的40%以上[6]。据全国肿瘤登记中心统计显示无论城乡,胃癌的发病率和死亡率都居高不下[7]
目前胃癌的治疗模式已经从单一的手术治疗进入综合治疗加规范化手术的新治疗模式,其中辅助化疗作为综合治疗方法之一,已得到越来越多的关注[2,8]。尽管对于早期胃癌患者而言, 施行手术治疗可使其5年生存率达到90%以上, 但遗憾的是早期胃癌的诊断率却不足10%[9,10]; 而进展期胃癌由于其手术切除率比较低,联合应用综合治疗后虽然可明显提高其5年生存率, 但患者的预后仍然比较差[11]胃癌临床化疗往往会面临以下问题: 首先,常用的化疗方案缺乏客观指标反应药物的抗癌敏感性[12]; 其次,耐药现象的发生仍然是胃癌化疗中存在的最大问题[13,14]。尽管人们已经在抗癌药物的筛选及克服化疗药物耐药性方面做了很多的研究,但至今这些问题还未得到根本解决。鉴于此,建立与临床肿瘤病理表现相同的胃癌细胞系,可为临床前药物的筛选和临床耐药现象的研究提供重要的实验材料。
由于直接运用临床肿瘤组织建立肿瘤细胞系成功率比较低, 因此, 通过运用临床肿瘤标本先建立动物肿瘤模型,进而通过原代培养建立人源肿瘤细胞系更具有可行性,同时也接近于肿瘤的临床生物学特性, 对药物的耐药性及敏感性具有良好的预测性,而且也有效地弥补了人源化肿瘤异种移植模型用时长、通量低、均一性差、难以进行机理研究等弱点。另外利用这些细胞系还可建立体内移植瘤模型, 进而可以获得体外、体内两个相关联的药物筛选平台。因此, 本研究选择12例生长状态良好的胃癌患者原代肿瘤异种移植(PDX)模型, 通过原代培养,建立了人胃癌细胞系, 对其生物特性进行分析鉴定,并利用所建立的细胞系进行体内体外药效学评价。
1 材料与方法
1.1 实验动物
雌性BALB/c裸小鼠共110只,5~6周龄,体质量16~19 g,购自北京维通利华实验动物有限公司 [SCXK(京)2012-0001], 饲养于上海睿智化学研究有限公司SPF动物实验设施[SYXK (沪) 2012-0030],适应一周后开始实验。
1.2 主要试剂和药物
HBSS缓冲液、RPMI-1640培养液、胎牛血清购自美国Invitrogen公司; DNA提取试剂盒购自美国Axygen公司; anti-CEA、anti-Cytokeratin、anti-Vimentin、anti-CA19-9购自美国Santa Cruz公司;anti-HER-2购自美国Cell Signaling公司; DAB试剂盒购自福州迈新生物技术开发有限公司; CellTiter Glo试剂盒购自美国Promega公司; 基质胶Matrigel购自美国BD公司; 秋水仙素、5-氟尿嘧啶(货号47576)、奥沙利铂(货号09512)、伊立替康(货号I1406)购自美国Sigma公司; 顺铂购自江苏豪森药业股份有限公司(国药准字H20040813); 多西紫杉醇购自美国Fluka公司(货号 01885)。
1.3 肿瘤组织来源
本研究中所有胃癌肿瘤组织均从上海睿智化学研究有限公司成功建立的PDX获得[15]。肿瘤组织最初的获取和相关处理通过上海睿智化学研究有限公司伦理委员会的审核。
1.4 细胞原代培养
从胃癌PDX模型库中选择12例生长状态较好的模型, 待裸小鼠体内移植瘤体积增长至500~900 mm3时, 对荷瘤鼠施行安死术。在无菌条件下,取出肿瘤组织后去除黏膜组织及血管,将肿瘤组织切成小块,用肿瘤细胞消化液重悬, 并置于37 ℃摇床上消化2~4 h, 70 μm滤膜过滤, 红细胞裂解液裂解红细胞,淋巴细胞分离液(Histopaque)纯化肿瘤细胞后,向培养瓶内加入含有5%胎牛血清, 100 U/mL青霉素G,100 μg/mL硫酸链霉素和0.25 μg/mL两性霉素B的RPMI-1640培养基,在37 ℃、体积分数5% CO2恒温培养箱中静置培养。当细胞铺满培养瓶底约70%时,传代细胞同时利用成纤维细胞与肿瘤细胞贴壁速率不同对细胞进行纯化,如此反复进行直至将成纤维细胞去除。培养过程中避免肿瘤细胞间的交叉污染。
1.5 细胞形态学观察
将生长状态良好的细胞置于倒置显微镜下观察细胞生长状态,有无污染情况, 并进行显微摄影。
1.6 染色体数目鉴定
将纯化后的细胞分别置于37 ℃、体积分数5%CO2条件下培养12 h后, 加入0.4 μg/mL秋水仙素,再继续培养10 h。采集分裂中期的细胞, 向细胞中加入0.075 mol/L的KCl低渗溶液, 37 ℃孵育20~30 min,离心弃上清液,用新鲜配制的固定液(甲醇∶乙酸=3:1)固定30 min,离心后用PBS重悬细胞,将细胞悬液滴于预冷的载玻片上,用Giemsa染色液染色10min,清水冲洗,晾干,封片,在显微镜下计数染色体数目。
1.7 短片段重复序列(STR)鉴定
分别收集新鲜培养的细胞, 用试剂盒提取细胞基因组DNA, 用5'端荧光标记的引物进行PCR扩增,对所得产物进行测序, 分析包括Amelogenin, THO1,TPOX, D13S317, vWA, D16S539, D5S818, CSF1PO以及D7S820等各个STR位点的序列重复数。
1.8 组织来源鉴定
将培养的细胞分别接种在盖玻片上进行培养,等细胞伸展后, 用质量分数4%甲醛固定过夜后,将固定液吸弃, 并使用PBS进行漂洗。透化处理细胞膜后加入封闭液封闭30 min, 然后加入适量一抗(anti-CEA, anti-Cytokeratin, anti-Vimentin, anti-CA19-9,anti-HER-2)4℃孵育过夜, 加入二抗室温孵育30 min后, 进行DAB染色。封片后使用ScanScope(Aperio)切片扫描系统进行扫描。
1.9 体外细胞毒性实验
体外测定胃癌临床常用的化疗药物: 5-氟尿嘧啶、顺铂、奥沙利铂、多西紫杉醇和依立替康对细胞的抗增殖作用。分别将受试细胞以3000个/孔的密度接种在96孔板中, 加入不同浓度梯度的药物, 各药物终浓度梯度分别为: 5-氟尿嘧啶(200.00 μmol/L、50.00μmol/L、12.50μmol/L、3.13μmol/L、0.78μmol/L、0.20 μmol/L); 顺铂(200.00 μmol/L、50.00 μmol/L、12.50 μmol/L、3.13 μmol/L、0.78 μmol/L、0.20 μmol/L);奥沙利铂(100.00 μmol/L、25.00 μmol/L、8.33 μmol/L、2.78 μmol/L、0.93 μmol/L、0.31 μmol/L); 多西紫杉醇(4.00 μmol/L、0.80 μmol/L、0.16 μmol/L、0.03μmol/L、0.01 μmol/L、0.001 μmol/L); 依立替康(200.00 μmol/L、66.67μmol/L、22.22μmol/L、7.41μmol/L、2.47μmol/L、0.82 μmol/L), 每个浓度设立三个复孔, 培养72 h后,用CellTiter Glo试剂盒测定细胞活力,利用XLFit软件计算半数抑制浓度(IC50)。
1.10 体内生长曲线及组织学观察
分别收集细胞并制成悬液, 双侧皮下接种至5只裸小鼠, 接种的细胞量视细胞生长速率而定。接种后注意观察肿瘤的生长情况,每周对小鼠体质量进行称量。待肿瘤生长至可测量时, 使用游标卡尺每周定期测量肿瘤的长(a)与宽(b)。待实验结束时,用过量的CO2麻醉荷瘤小鼠并施行安死术,将肿瘤剥离, 先大体观察剥离的肿瘤, 使用质量分数4%中性甲醛固定液固定肿瘤组织, 然后进行石蜡包埋、切片及HE染色,并在光学显微镜下进行观察。
1.11 体内药效实验
体外收集对数期细胞, 各接种至50只裸小鼠单侧皮下。待肿瘤长至合适体积(100~300 mm3)时,挑选肿瘤形状比较规则且体积比较接近的小鼠进行随机分组,每组小鼠8~10只,腹腔给药,共3组: 对照组; 5-氟尿嘧啶组,25 mg/kg连续给药5 d后停药2 d; 顺铂组,5 mg/kg每周给药一次。分组当日开始给药,给药前称量并记录小鼠体质量,共给药2周。给药后每周定期测量小鼠肿瘤体积。
1.12 数据分析
小鼠肿瘤体积(TV)计算公式为: TV=1/2ab(a、b分别为肿瘤长径和短径), 根据所得数值来绘制肿瘤生长曲线。针对每一例人胃癌细胞系体内移植瘤模型, 使用肿瘤生长抑制率(TGI)作为药效实验评价指标, 计算公式为: TGI%=[1-(Ti-T0)/(Vi-V0)]×100, (Ti: 给药组当日测量的TV; T0: 给药组分组时的TV; Vi: 对照组当日测量的 TV; V0: 对照组分组时的TV)。实验结果以x- ± s表示, 并使用GraphPad Prism 5.0软件进行统计学分析, 两组内数据的比较采用Two-way ANOVA检验, P<0.05为差异有统计学意义
2 结果
2.1 建立的人胃癌细胞系相关信息
12例人胃癌PDX模型共成功建立6例细胞系(表1),这些细胞系性状都比较稳定,能在体外长期生长和稳定传代。
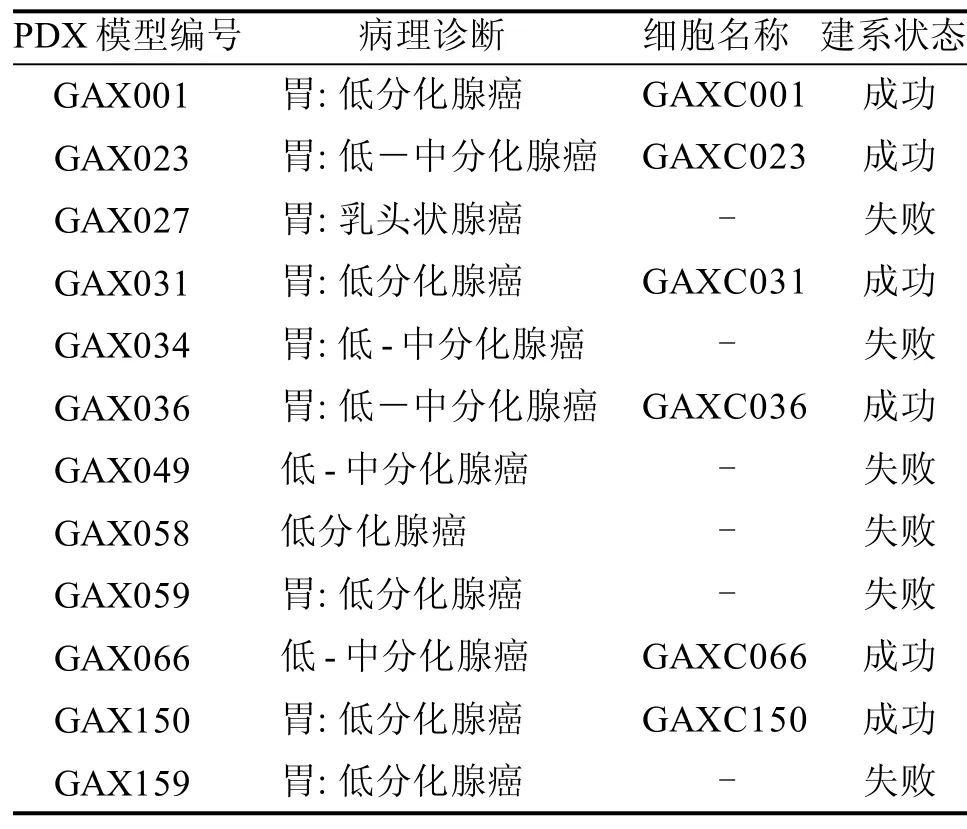
表1 12例胃癌PDX模型相关信息Table 1 The information of 12 gastric cancer PDX models
2.2 胃癌细胞系呈恶性生长
以细胞系GAXC031和GAXC066为例,显微镜下可见体外生长的GAXC031细胞呈恶性生长有重叠生长,贴壁生长部分呈扁平状,无明显接触抑制;体外生长的GAXC066主体细胞呈大柳叶形,无明显接触抑制特性(图1)。
2.3 染色体畸变严重

图1 倒置显微镜下人胃癌细胞系的细胞形态 (100×)Figure 1 Cell morphological observation of human gastric cancer cell lines under Inverted microscope (100×)

图2 细胞系GAXC031和GAXC066染色体分析结果 (1000×)Figure 2 Chromosome analysis of GAXC031 and GAXC066 cell line (1000×)
细胞系GAXC031和GAXC066在经过连续传代后,染色体仍保持人源性肿瘤细胞染色体的特征,表现为多倍体。GAXC031染色体总数为79±3, 占71.29%, 表现为高异倍性; GAXC066染色体总数为51±2, 占80.89%, 表现为超二倍体。二者均存在多数中央及亚中央着丝粒染色体, 且染色体数目和结构畸变严重, 符合人恶性肿瘤的遗传学特征(图2)。
2.4 STR具有细胞系特异性
对细胞系GAXC031和GAXC066的Amelogenin,THO1, TPOX, D13S317, vWA, D16S539,D5S818,CSF1PO以及D7S820等各个STR位点的序列重复数进行分析,其中STR位点的拷贝数如表2所示,并与其亲本PDX组织的STR结果进行比对分析。由表可见, 这2例细胞系的各个位点数目与其亲本PDX组织的基本保持一致, GAXC031与GAX031仅在vWA存在细微差异(GAXC031的序列重复数为16, 而GAX031为16和17), 而GAXC066与GAX066也仅在D13S317存在稍许不同(GAXC066的序列重复数为10, 而GAX066为7和10)。据此可以判定这2例细胞系来自其相应的亲本PDX肿瘤。上述序列和ATCC, DSMZ等细胞库的数据进行查询比对,未返回相同的遗传图谱。由此可以证明细胞系的独一无二性,且在原代培养过程中未发生和其他细胞的交叉污染。
2.5 免疫组织化学染色表现为胃腺癌
细胞系GAXC031和GAXC066免疫组织化学染色结果相似。以GAXC066为例,结果如图3所示,其中Vimentin为强阳性;Cytokeratin为强阳性,CA19-9为阳性,提示其肿瘤类型与腺癌相关;CEA为强阳性,提示该细胞系恶性程度较高;HER-2表达常见于腺癌而少见于鳞癌,表达为弱阳性。结合其来源组织的临床信息和病理诊断结果,判断该细胞来源于胃腺癌。
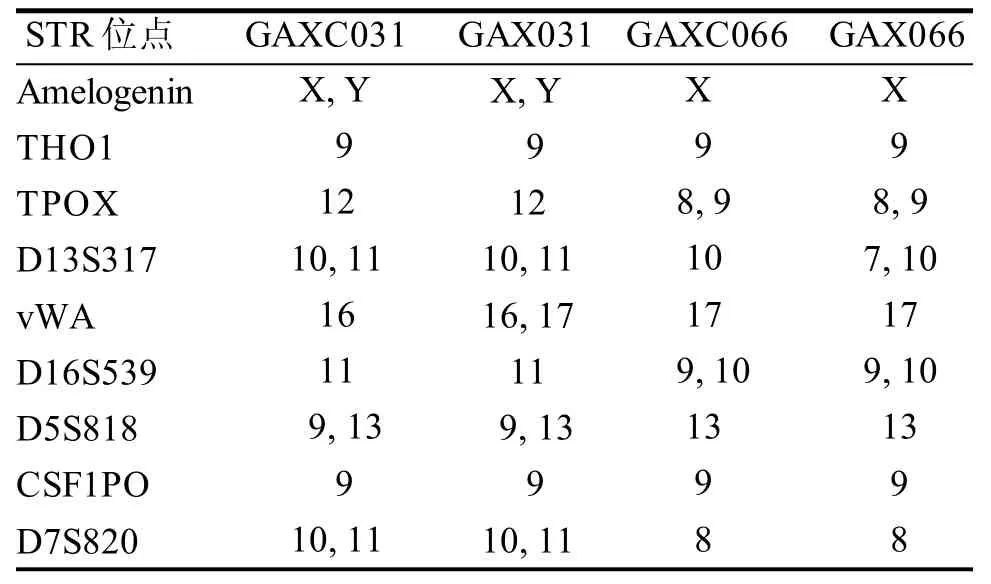
表 2 细胞系GAXC031和GAXC066的STR 位点拷贝数Table 2 Copies of STR for GAXC031 and GAXC066 cell line
2.6 各化疗药物对细胞系GAXC031和GAXC066的药物敏感性
各化疗药物对细胞系GAXC031和GAXC066的IC50值如表3所示, 生长抑制曲线如图4所示。对5-氟尿嘧啶而言, GAXC031对其敏感性较强, 而GAXC066的敏感性则比较弱; 细胞GAXC031和GAXC066对顺铂敏感; GAXC031对奥沙利铂的敏感性明显大于GAXC066; 伊立替康对这2例细胞的生长抑制作用相当, IC50均在 25~40 μmol/L; 而化疗药物多西紫杉醇对这2例细胞的敏感性较强,IC50值均比较低。
2.7 胃癌细胞系具有强致瘤性
细胞系GAXC031和GAXC066接种到小鼠皮下1周后开始生长,成瘤率均高达90%以上。肿瘤潜伏期(肿瘤体积达到100~300 mm3所需要的时间较亲本PDX模型缩短2~3周。细胞系的成瘤率和生长均一性相对其亲本PDX模型(成瘤率60%左右都有所提高。
HE染色结果显示,细胞系移植瘤的组织形态均高度接近其来源组织瘤块,且病理诊断结果均为低分化胃腺癌, 以GAXC066为例, 结果如图5所示
2.8 体内成瘤组织对5-氟尿嘧啶和顺铂的敏感性
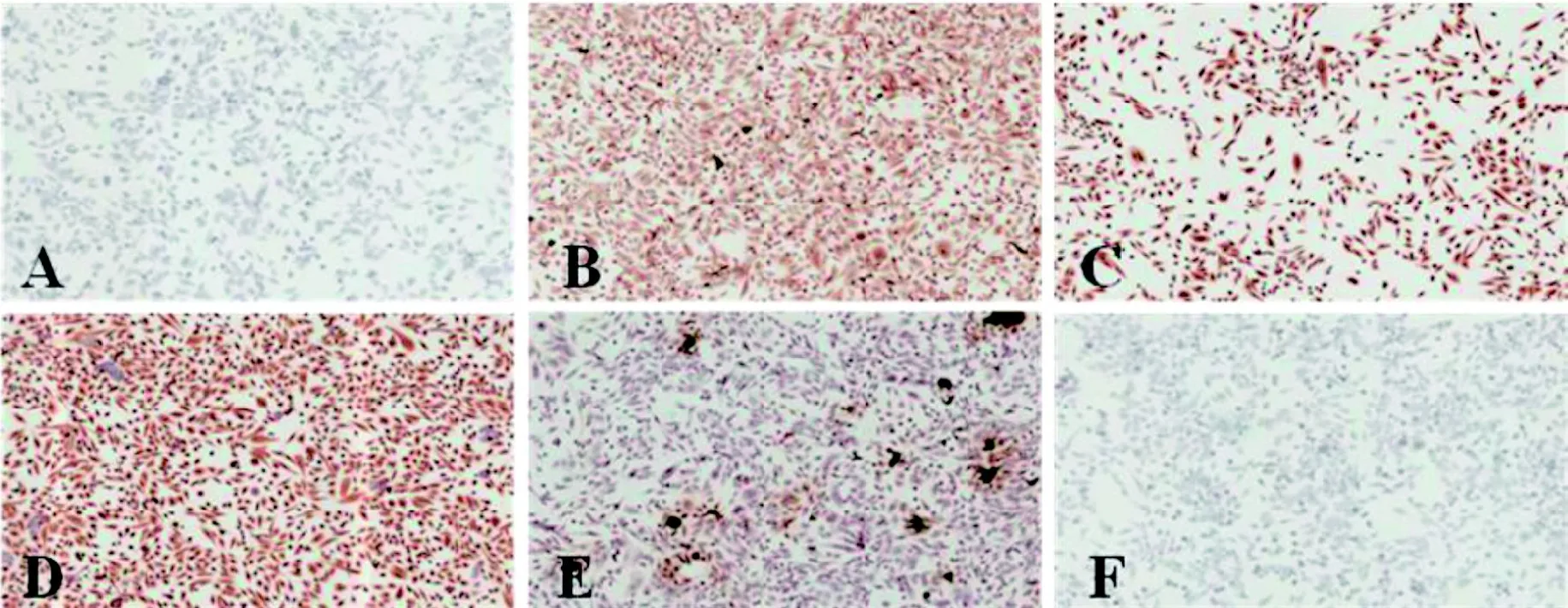
图3 细胞系GAXC066免疫组织化学染色结果 (200×)Figure 3 Immunohistochemical analysis of GAXC066 cell line (200×)

表 3 各化疗药物对细胞系GAXC031和GAXC066的IC50Table 3 IC50 of chemotherapy drugs on GAXC031 and GAXC066 cell line μmol/L
经过13~14 d给药后,给药组与对照组相比5-氟尿嘧啶对GAXC031肿瘤的生长具有一定的抑制作用, 而顺铂对其具有较强的抑制作用(P<0.05)并且这2个化疗药物在GAXC031与GAX031中的敏感性保持一致,具有高度相关性; 顺铂对GAXC066具有较强的敏感性(P<0.05),而5-氟尿嘧啶对其不敏感(P>0.1),与GAX066体内药效实验具有一定的相似性,但并没有表现出完全的一致性(图6),可能与亲本GAX066模型具有更高的异质性有关。

图4 各化疗药物对细胞系GAXC031和GAXC066的生长抑制曲线Figure 4 The growth inhibition of chemotherapy drugs on GAXC031 and GAXC066 cell line

图5 GAXC066移植瘤的组织形态观察Figure 5 Observation on histomorphology of GAX066 xenograft tumor
3 讨论
我国胃癌发病率比较高, 其病因尚不完全清楚,其高发区主要集中在西北及沿海的各省市,如甘肃省、上海市和江苏省等地[17]。本研究在建立细胞系时所使用的肿瘤模型均来源于江苏省南通市肿瘤医院的临床肿瘤标本[15], 这为研究具有区域特异性胃癌的发生与发展及治疗提供了理想的体外研究模型,而且选取的12例胃癌PDX模型均为腺癌, 这与中国人群中胃癌患者的病理分布情况也是相符合的[16]。
本研究所建立的细胞系GAXC031和GAXC066性状均比较稳定, 可以稳定多次传代, 具有成瘤性强、潜伏期短、均一性较好等优点。在遗传学和病理学方面高度接近原肿瘤组织,很好保持了肿瘤的临床生物学特性,这对于抗癌药物的疗效具有很好预测性,同时由于肿瘤来源于中国人群,比较符合中国人的遗传特征,因此,这些新建立的细胞系对研发适合中国人的抗胃癌新药具有十分重要的理论和临床意义,是胃癌研究理想的实验材料。

图6 体内5-氟尿嘧啶和顺铂对成瘤组织的生长抑制作用Figure 6 In vivo tumor growth inhibitions of 5-Fu and Cisplatin on gastric cancer xenograft models
针对化疗药物5-氟尿嘧啶和顺铂而言,细胞系GAXC031和GAXC066体内与体外药物敏感性相似,这说明体内与体外数据间存在较高的相关性。体外药敏实验表明,GAXC031和GAXC066对5-氟尿嘧啶的敏感性差异较大,在体内药效实验中对肿瘤生长的抑制效果也具有明显的差异性;而在体外药敏实验中对顺铂的敏感性无明显差异,在体内药效实验中对顺铂的反应性也区别不大。通过体内药效实验相比,GAXC031与GAX031对5-氟尿嘧啶和顺铂的反应性具有高度的相关性,对于化疗药物的初步筛选具有很大的意义。
由于在胃癌治疗过程中,铂类联合氟尿嘧啶类化疗一直是一线且唯一的临床推荐方案,所以取得合适的研究材料以加深对5-氟尿嘧啶和顺铂耐药机制的了解,有助于解决胃癌化疗中耐药现象产生的问题,进而大大提高胃癌的化疗效果,对胃癌的临床治疗具有非常重要的意义。对于细胞系GAXC066而言,在体内与体外实验中对5-氟尿嘧啶均表现出显著的耐药性。已有文献[18-20]指出5-氟尿嘧啶的治疗效果与其代谢分解相关的靶向酶胸苷酸合成酶 (thymidylate synthase, TS)和二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD) 呈负相关,其耐药的发生可能是与此类酶的表达以及基因多态性有关。但是到目前为止,5-氟尿嘧啶耐药的确切分子机制还不十分明确。因此,细胞系GAXC066非常适用于研究5-氟尿嘧啶的耐药机制,本研究中所建立的人胃癌细胞系对于有效指导临床研究也具有重要作用。
传统的肿瘤细胞系及移植瘤模型在药物研发中被广泛用于药物筛选。但由于长期体外培养,传统细胞系逐渐丧失了很多疾病特征,药效与临床存在很大的差异, 极大影响了药物研发进程。2016年初美国国家癌症研究所(NCI)宣布,于2016年春季末正式废弃已经被世界各地的研究人员使用了长达25年之久的NCI-60细胞系,取而代之的是PDX模型及相关原代细胞系[21]。PDX模型是将患者肿瘤组织块接种到免疫缺陷小鼠中,与传统细胞系建立的动物模型相比,减少了体外培养步骤,保持临床肿瘤的形态和分子学特征,因而用该模型做的药效结果更具有临床预测性。同时PDX模型接近于肿瘤的临床生物学特性,对药物的耐药性及敏感性具有良好的预测性,是辅助精准化医疗的有效工具之一。但PDX模型用时长、通量低、均一性差、难以进行大规模的药物筛选和机理研究。从PDX模型建立肿瘤原代细胞系,保持了PDX模型的基因和区域特性,同时可以像传统的细胞系一样在体外传代扩增,在很大程度上克服了PDX模型的缺陷。另外利用这些细胞系还可建立体内移植瘤模型,可以获得体外、体内两个相关联的药物筛选平台。本研究通过PDX模型肿瘤细胞原代培养,成功建立了人胃癌细胞系,对其生物特性进行分析鉴定,证实这些细胞系及移植瘤模型与亲本PDX模型相关性极好, 可以作为PDX模型的补充。但必须指出,从PDX模型建立的肿瘤原代细胞系与PDX模型相比异质性降低,所以药物敏感性上与PDX模型可能存在不同。本研究中5-氟尿嘧啶在GAX066 PDX模型有一定疗效,但对GAXC066细胞及移植瘤模型几乎没有任何疗效。提示PDX模型来源的肿瘤细胞系不能完全替代PDX模型,需要和PDX模型结合使用。
综上所述, 本研究成功建立了PDX模型来源的胃癌细胞系,基本保持了PDX模型的特性,为胃癌的相关基础研究和药物研发提供了更多的工具。
[1] Cidon EU, Centeno RG, Lagarto EG, et al. HER-2 evaluation in a specific gastric cancer population with the highest rate of mortality in Spain[J]. J Oncol, 2011:391564[Epub 2011 Oct 27].
[2] Ye H, Jing YF, Shu DX. Can the incidence of gastric cancer be reduced in the new century[J]. J Digest Dis, 2013, 14(1):11-15.
[3] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[4] He YT, Hou J, Chen ZF, et al. Trends in incidence of esophageal and gastric cardia cancer in high-risk areas in China[J]. Eur J Cancer Prev, 2008, 17(2):71-76.
[5] Jin H, Pinheiro PS, Callahan KE, et al. Examining the gastric cancer survival gap between Asians and whites in the United States[J]. Gastric Cancer, 2016 [Epub ahead of print].
[6] 刘天艺, 焦宇飞. 胃黏膜活检标本中上皮内瘤变及早期癌的病理诊断[J]. 中华病理学杂志, 2014, 43(9):644-646.
[7] 王江红, 项颖. 早期胃癌的筛查现状及诊断进展[J]. 重庆医学, 2009, 38(20):2634-2636.
[8] Dan Liu, Ming Lu, Jian Li, et al. The patterns and timing of recurrence after curative resection for gastric cancer in China[J]. World J Surg Oncol, 2016, 14(1), 305.
[9] Binn M, Ruskonéfourmestraux A, Lepage E, et al. Surgical resection plus chemotherapy versus chemotherapy alone:comparison of two strategies to treat diffuse large B-cell gastric lymphoma[J]. Ann Oncol, 2003, 14(12):1751-1757.
[10] Moelans CB, Milne AN, Morsink FH, et al. Low frequency of HER2 amplification and overexpression in early onset gastric cancer[J]. Cell Oncol (Dordr), 2011, 34(2):89-95.
[11] Liu KH, Hung CY, Lu CH, et al. Survival outcomes of geriatric patients with clinically resectable gastric cancer: to operate or not[J]. J Surg Res, 2016, 206(2):481-489.
[12] Thiel A. Targeted therapy in gastric cancer[J]. APMIS, 2015,123(5):365-372.
[13] Li C, Zou J, Zheng G, et al. MiR-30a Decreases Multidrug Resistance (MDR) of Gastric Cancer Cells[J]. Med Sci Monit,2016, 22:4509-4515.
[14] Tang QF, Sun J, Yu H, et al. The Zuo Jin Wan formula induces mitochondrial apoptosis of cisplatin-resistant gastric cancer cells via Cofilin-1[J]. Evid Based Complement Alternat Med, 2017, 2017(1):8203189.
[15] 许春花, 杨磊, 汤旭蓁,等. 人源性胃癌移植瘤模型的初步建立及其评价[J]. 实验动物与比较医学, 2014, 34(4): 259-265.
[16] 崔晋峰, 赵晨燕, 曹立勇,等. 食管胃交界腺癌和远端胃癌KLF4SP1及CyclinD1表达的对比研究[J]. 中国肿瘤临床,2014, 41(2):108-112.
[17] 李平. 浅谈胃癌的中医药治疗[J]. 中医药临床杂志, 2011,23(3):207-208.
[18] Terashima M, Irinoda T, Fujiwara H, et al. Roles of thymidylate synthase and dihydropyrimidine dehydrogenase in tumor progression and sensitivity to 5-fluorouracil in human gastric cancer[J]. Anticancer Res, 2002, 22(2A):761-768.
[19] Qin B, Tanaka R, Shibata Y, et al. In-vitro schedule-dependent interaction between oxaliplatin and 5-fluorouracil in human gastric cancer cell lines[J]. Anticancer Drugs, 2006,17(4):445-453.
[20] Zhang X Q, Zhang H M, Sun X E, et al. Inhibitory effects and mechanism of 5-fluorouracil combined with celecoxib on human gastric cancer xenografts in nude mice[J]. Exp Ther Med, 2015, 9(1):105-111.
[21] Chabner BA. NCI-60 Cell Line Screening: A Radical Departure in its Time[J]. J Natl Cancer Inst, 2016, 108(5).
Establishment and Characterization of Patient Derived Gastric Cancer Cell Lines
GE Xiao-mei1,2, ZHANG Yi-xin3, XIE Fu-bo1,4, LIU Ji-bin3, YANG Lei3, QU Ying-ying1,GU Ying1,5, Li Xue-ting1, YANG Wei-min1, LIU Xi-peng2, ZHOU He1,4,5, QIANG Fu-lin3
(1. Shanghai ChemPartner Co., Ltd, Shanghai 201203, China;2. Shanghai Jiao Tong University, Shanghai 200240, China;3. Nantong Tumor Hospital, Nantong 226361, China;4. Engineering Research Center for Pharmaceutical Translation, Shanghai 201203, China;5. Clinical Explorer (Shanghai) Co., Ltd, Shanghai 201203, China)
Objective To establish and characterize primary gastric cancer cell lines derived from gastric cancer patient-derived xenograft (PDX) models. Methods Tumors from 12 stable gastric cancer PDX models were selected to establish primary tumor cell lines when the tumor volume reached 500~900 mm3. The established cell lines were characterized by cell morphology, chromosome, STR and immunohistochemical analyses, in vivo tumorigenicity, as well as drug sensitivity in vitro and in vivo.Results Six primary gastric tumor cell lines were successfully established. GAXC031 and GAXC066 were selected and characterized thoroughly. STR analysis confirmed that these 2 cell lines were consistent with their parental PDX models. These 2 cell lines presented the morphological, histological and genomic characteristics of malignant gastric cancer cells. They generated xenograft readily in nude mice and these tumors maintained histology characteristics of the parental PDX tumors. Moreover, compared to the parental PDX models, these 2 cell lines initiated xenografts with higher take rate, shorter incubation period, and better uniformity in tumor growth. In vitro and in vivo drug sensitivity test showed that GAXC031 was more sensitive to 5-fluorouracil than that of GAXC066, while both cell lines were sensitive to cisplatin. Conclusions Six patient derived gastric cell lines were successfully established from PDX models in this study. Deep characterization showed that these cell lines maintained many characteristics of the original PDX models with improved take rate, latent period and uniformity,therefore represent useful tools in basic research and drug screening.
Patient-derived xenograft (PDX); Gastric cancer; Cell lines; Biological characteristics;Drug efficacy study
Q95-33
A
1674-5817(2017)04-0257-09
10.3969/j.issn.1674-5817.2017.04.001
2017-01-25
科技部国家科技支撑计划项目(2015BAH24F00)
葛晓梅(1989-), 女, 硕士, 研究方向: 肿瘤药理。
E-mail: xmge@chempartner.cn
共同第一作者: 张一心(1956-), 男, 博士, 研究方向: 肿瘤学。E-mail: drzhangyx@163.com
周 禾, 女, E-mail: zhhe@chempartner.cn
共同通讯作者: 强福林, 男。E-mail: tian2008@163.com

