不同生境下Epichlo⊇gansuensis对醉马草根际土壤丛枝菌根真菌的影响
钟 睿,周晓蓉,张稚钦,夏 超,李娜娜,张兴旭
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
不同生境下Epichlo⊇gansuensis对醉马草根际土壤丛枝菌根真菌的影响
钟 睿,周晓蓉,张稚钦,夏 超,李娜娜,张兴旭
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
本研究通过根系染色和根际土壤丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)孢子形态学鉴定分析了榆中栽培(内生真菌感染,endophyte-infected,E+;无内生真菌感染,endophyte-free,E-)和野生条件下醉马草(Achnatheruminebrians)根系丛枝菌根侵染率、根际土壤中孢子密度以及AMF的多样性。结果表明,栽培条件AMF侵染率显著高于野生条件(P<0.05)。栽培条件下,甘肃内生真菌(Epichlo⊇gansuensis)对醉马草AMF侵染率具有显著促进作用(P<0.05);栽培条件下土壤孢子密度显著低于野生条件(P<0.05),栽培条件下内生真菌对醉马草根及土壤孢子密度具有显著促进作用(P<0.05)。栽培条件下共发现3属9种,其中E+根际土壤中球囊霉属(Glomus)6种和无梗囊霉属(Gigaspora)1种,E-根际土壤中球囊霉属(Glomus)3种,其中无梗囊霉属(Gigaspora)1种和盾巨孢囊霉属(Scutellospora)1种;在野生条件下共发现AMF 2属9种,其中球囊霉属8种和巨孢囊霉属1种,两种生长条件下球囊霉属所占比例均最大。野生条件下,AMF群落组成丰富度显著高于栽培条件(P<0.05);栽培条件下,内生真菌对AMF群落组成丰富度无显著影响(P>0.05)。以上结果表明,内生真菌和生长条件对AMF侵染以及AMF多样性有显著影响。
丛枝菌根真菌;多样性;内生真菌;生长条件;菌根侵染率;土壤孢子密度
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是自然界中普遍存在的一类真菌,可与80%的陆生高等植物形成共生关系,目前有关AMF的研究主要集中在AMF可以提高植物对土壤矿质营养元素的吸收和累积,促进植物的抗旱、抗涝、抗盐、抗病和耐受重金属胁迫等方面[1-2]。
禾草-内生真菌指能在禾草组织内(叶鞘、种子等组织)度过大部分或者整个生命周期,而不让禾草显示任何外部症状的真菌[3]。根据目前已有的报道,在许多冷季型禾草上发现了Epichlo⊇ 属内生真菌,关于禾草-内生真菌共生体的探索多集中于黑麦草属(Lolium)和羊茅属(Festuca)的禾草上[4-9]。已有研究表明,内生真菌可以提高宿主植物抗生物胁迫[4-6]和耐非生物胁迫[7-9]的能力,内生真菌能够产生生物碱,导致家畜中毒,造成畜牧业减产[10]。
醉马草(Achnatheruminebrians)为禾本科芨芨草属的多年生草本植物,是我国西北地区天然草原较为常见的常年烈性毒草之一,主要分布在环境恶劣的地区(干旱、盐碱等生境),例如甘肃、内蒙古、新疆等省(区)[11]。我国学者分别于2004和2015年将分离于甘肃醉马草和新疆醉马草的内生真菌命名为甘肃内生真菌(Epichlo⊇gansuensis)[12]和醉马草内生真菌(Epichlo⊇inebrians)[13]。近年来,关于醉马草的研究表明,内生真菌产生的有毒生物碱是造成家畜中毒的主要原因[14];同时,内生真菌的存在,提高了醉马草植株对低温[15]、干旱[16]、病害[17-18]、虫害[19]和重金属[20]等生物和非生物胁迫的耐受能力。
禾草内生真菌和土壤中的AMF可以相互影响,禾草可以同时与内生真菌和菌根真菌形成共生体,其中,关于内生真菌对植物根系真菌影响的研究主要集中在内生真菌对丛枝菌根侵染的影响[21]。目前,关于禾草-内生真菌-菌根真菌三者互作关系的研究主要集中在高羊茅(Schedonorusphoenix)[22-23]、羽茅(A.sibiricum)[24]、多年生黑麦草(Loliumperenne)[25]、多花黑麦草(L.multiflorum)[26]、雀麦(Bromussetifolius)[27]、Elymushystrix[28]、羊草(Leymuschinensis)[29]和野大麦(Hordeumbrevisubulatum)[30]等禾草。研究发现,内生真菌的存在降低了菌根侵染率[21-26,28-30],但也有研究认为,内生真菌的存在对AMF侵染有促进或者无作用[26-27]。丛枝菌根真菌在植物提高抗逆性扮演着重要的角色,菌根真菌的存在可扩大宿主植物根系对土壤养分的吸收范围[1-2],促进植物生长。多年来,Epichlo⊇ 属内生真菌研究也围绕因其对宿主植物生长及抗逆性的增益效果而展开[4-9],但两种共生真菌对宿主植物生长促进作用及自身之间的互作关系仍不明了。本研究选取醉马草为研究材料开展生长条件和内生真菌对醉马草根系菌根侵染、根际土壤孢子密度以及多样性的研究,以期初步探明宿主植物地上部分内生真菌的侵染对其根系菌根侵染率及丰富度的影响,为将来进一步探究两种共生菌在促进宿主植物生长过程中各自的作用及分工奠定基础。
1 材料与方法
1.1 试验地概况与根系土壤取样
本研究在兰州大学草地农业科技学院榆中试验站(104°39′ E,35°89′ N,海拔1 653 m)开展,选取不同生长环境的醉马草为研究对象,包括栽培条件下带菌(endophyte-infented,E+)、不带菌(endophyte-free,E-)醉马草和野生环境醉马草。栽培醉马草小区共64个,E+/E-各32个小区,每个小区面积3.65 m×1.30 m,建植于2011年,小区定期除杂草浇水;野生醉马草小区为相同时间在试验地附近醉马草分布区域范围内划分的4个小区(10 m×100 m),无任何田间管理措施。参照Li等[12,16]的方法,通过苯胺蓝染色镜检确定醉马草植株的带菌情况,在确定E+和E-后,各随机选取4个小区,野生小区带菌率为100%,在选定的12个小区内采用五点取样法收集少许根样以及根际土壤,最终获得12份混合根样和12份混合土样,用冰盒于低温下带回实验室,其中根样用于菌根侵染率测定,土样用于AMF孢子筛选鉴定。
1.2 菌根侵染率的测定
菌根真菌的侵染率测定参照Mcgongile等[31]的方法,将醉马草根用清水洗净后剪成约1 cm浸入10%的KOH中(60 ℃水浴锅处理90 min),后用2%的HCl酸化5~10 min,用0.05%的台盼蓝(Trypan Blue)染色(60 ℃水浴锅处理30 min),计算侵染率用方格交叉法[31],将已剪碎的根段置于带有5 mm×5 mm方格的培养皿中,在体视镜下检查与网格线相交的地方是否有菌根侵染,然后计算侵染根断与统计的所有根段的比例(即菌根侵染率)。
1.3 土壤孢子密度以及孢子形态鉴定
土壤样品中的AM孢子采用湿筛倾注-蔗糖离心法[32]分离土壤样品中的AMF孢子,称取20 g风干土样于500 mL烧杯中,加500 mL 清水充分搅拌,浸泡30 min 后,用双层土壤筛过滤(上筛 900 μm,下筛38 μm),然后用清水冲洗38 μm 筛出物于50 mL离心管中,在3 000 r·min-1下离心5 min,下部沉淀物加30 mL 50%的蔗糖溶液3 000 r·min-1离心1 min,马上过38 μm 筛,用蒸馏水冲洗干净后收集孢子于培养皿中在体视镜下观察并计数。孢子密度以20 g土壤中所含的孢子数计算。先在体视镜下察看AMF孢子的具体形态(颜色、大小、连孢菌丝的特征、孢子果形态等);然后用吸管将孢子吸出置于载玻片上,加水作浮载剂,封片后在显微镜下继续观察记录孢子的颜色、连孢菌丝的特征,测定孢子的大小。压碎孢子后再观察内含物的性质、孢壁层次及各层颜色,测定各层孢壁的厚度等。鉴定中辅助使用 Melzer’s试剂,观察孢子的特异性反应,对有代表性或特异性特征随时进行拍照。综合以上观察结果,根据国际网站(http://www.amf-phylogeny.com)的分类描述,并参阅有关鉴定材料和近年来发表的新种进行种属的检索和鉴定。
1.4 指标计算
AMF种丰富度(species richness)[32]常用于衡量一个生境中物种数目的多寡,本研究所指的AMF种丰富度指的是20 g醉马草根际土壤样本中的AM真菌种数。
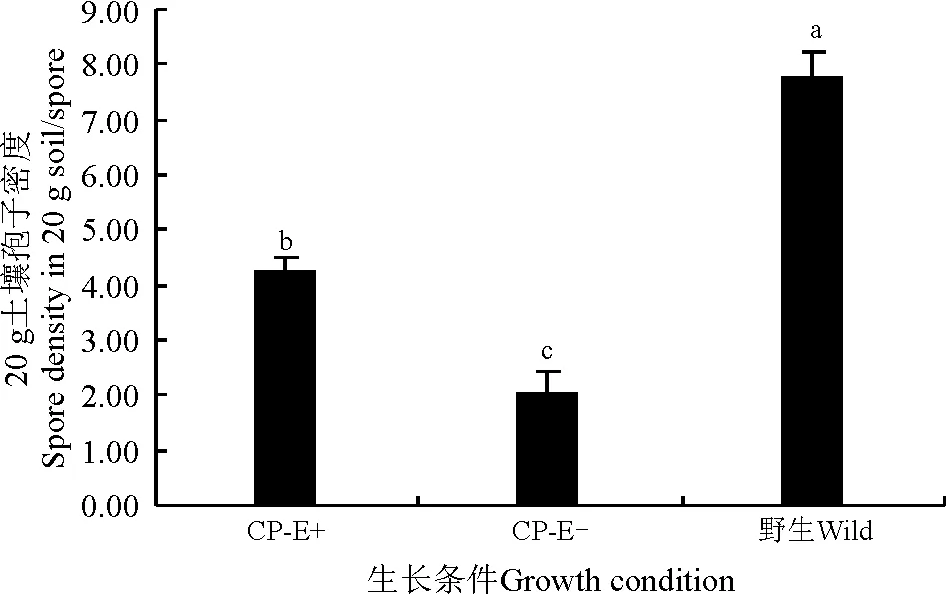
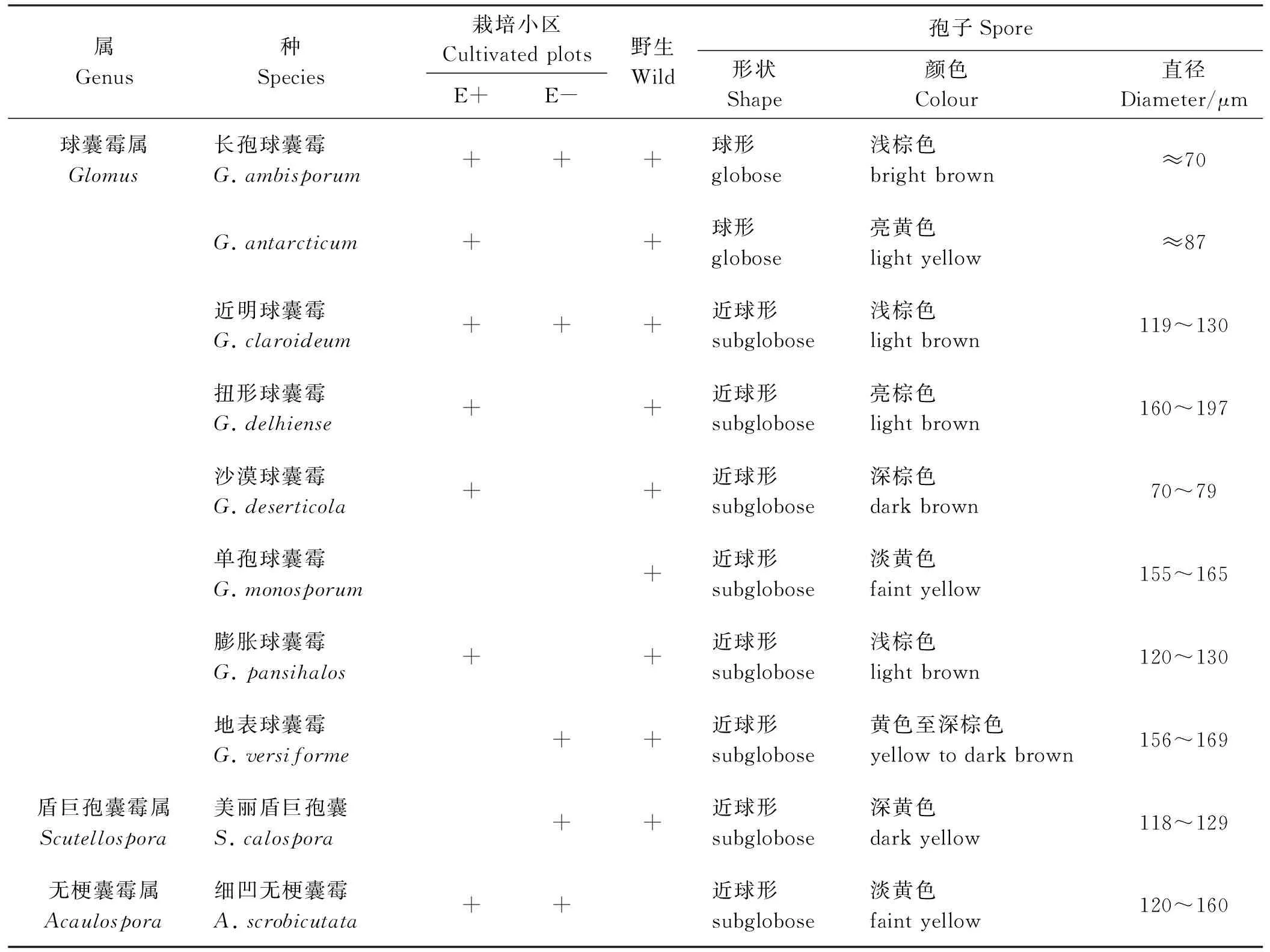
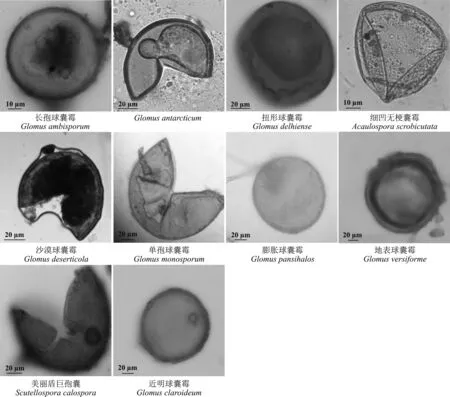
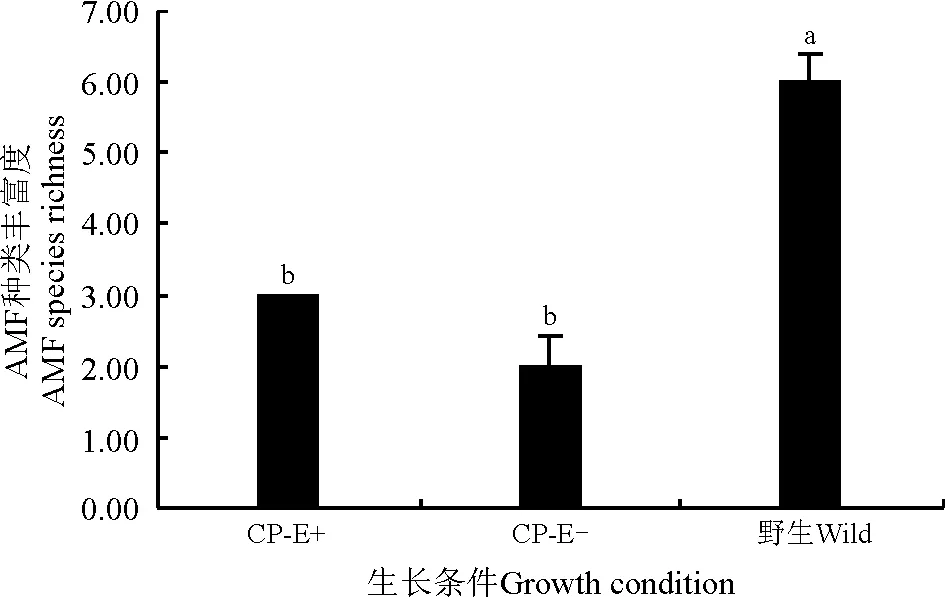
AMF频度(frequency,F)[32],指某一个物种在样本总体中的出现的频率,即某种AMF出现次数/土壤总AMF数×100%。以属的频度作为划分优势种的标准,F>50%为优势种,30% 1.5 统计分析 试验数据采用Microsoft Excel 2013录入并作图。醉马草菌根侵染率、土壤孢子密度结果均采用平均值±标准误表示。采用SPSS 17.0 (Ver. 17.0,SPSS Inc.,Chicago,IL,USA)统计分析软件对菌根侵染率进行单因素方差分析,Duncan法进行多重比较,显著性水平P=0.05。 2.1 内生真菌对醉马草菌根侵染率的影响 栽培条件下醉马草植株菌根侵染率显著高于野生植株 (P<0.05) (图1);大田栽培条件下,E+植株根系侵染率显著高于E-植株(P<0.05)(图1)。 2.2 内生真菌对土壤AMF孢子密度的影响 野生条件的醉马草植株根际土壤AMF孢子密度显著高于大田栽培醉马草植株根际土壤(P<0.05);大田栽培条件下,E+植株根际土壤AMF孢子密度显著高于E-(P<0.05) (图2)。 图1 不同生长条件下醉马草根系的菌根侵染率Fig. 1 Mycorrhizal colonization rate of drunken horse grass under different growth conditions 注:不同小写字母表示不同生长条件之间差异显著(P<0.05);CP-E+,栽培条件下有内生真菌感染的醉马草,CP-E-,栽培条件下无内生真菌感染的醉马草。下同。 Note: Different lowercase letters indicate significant difference among different growth conditions at the 0.05 level; CP-E+, endophyte-infected drunken horse grass grown in cultivated plots, CP-E-, endophyte-free drunken horse grass grown in cultivated plots; similarly for the following figures. 图2 不同生长条件下醉马草根际土壤中的孢子密度Fig. 2 Soil spore density per 20 g rhizosphere soil of drunken horse grass under different growth conditions 2.3 根际土壤中的AMF孢子种类 对上述孢子进行形态学鉴定,共发现3属10种AMF(表1、图3),栽培条件醉马草根际土壤中发现3属9种AMF孢子,野生条件下的醉马草根际土壤中发现2属9种AMF孢子,其中长孢球囊霉(G.ambisporum)和近明球囊霉(G.claroideum)在3种土壤样本中均检测到,细凹无梗囊霉(A.scrobicutata)仅在栽培条件下存在,在野生土壤中未发现该类孢子;单孢球囊霉(G.monosporum)仅在野生条件下存在(表1)。在栽培条件下的9种AMF孢子中,扭形球囊霉(G.delhiense)、G.antarcticum、沙漠球囊霉(G.deserticola)、膨胀球囊霉(G.pansihalos)仅在E+醉马草根际土壤中检测到;地表球囊霉(G.versiforme)和美丽盾巨孢囊(S.calospora)仅在E-醉马草根际土壤中检测到;长孢球囊霉(G.ambisporum)和细凹无梗囊霉(A.scrobicutata)为E+和E-所共有的丛枝菌根真菌(表1)。 2.4 AMF的丰富度 野生条件的醉马草植株根际土壤AMF种类丰富度显著高于栽培醉马草植株根际土壤AMF种类丰富度(P<0.05);大田栽培条件下,E+和E-醉马草根际土壤AMF种类丰富度无显著差异(P>0.05) (图4)。 2.5 不同生长条件下AMF的频度分级类 在不同生境条件下,球囊霉属为优势种,无梗囊霉属是仅在栽培条件下存在的少见种,而在野生条件下不存在;盾巨孢囊霉属仅在E-和野生条件醉马草根际土壤中发现,在E-醉马草根际土壤中是少见种,但是在野生条件醉马草根际土壤中是罕见种(表2)。 表1 不同生长条件下醉马草根际土壤AMF种类及形态描述Table 1 AMF species and morphology in rhizosphere soil of drunken horse grass under different growth conditions 注:+,发现该物种。E+,有内生真菌感染; E-, 无内生真菌感染, YS, 野生醉马草。下同。 Note: +, this AMF species is found in soil. E+, endophyte-infected; E-, endophyte-free; YS, wild; similarly for the following tables. 图3 本研究分离的3属10种AM真菌孢子形态图Fig. 3 Ten AMF species from three genera isolated in the present study 图4 不同生长条件醉马草根际土壤AMF种类丰富度Fig. 4 AMF species richness in drunken horse grass under different growth conditions 注:****,优势种;***,常见种; **,少见种; *,稀有种;-,没有发现该种。 Note: A, dominant AMF species; B, common AMF species; C, unusual AMF species D, rare AMF species; -, AMF species not be found. 本研究通过根系染色和土壤AMF孢子的形态学鉴定方法研究了醉马草根系与AMF形成共生结构,同时也发现内生真菌和生境条件对AMF与醉马草根系侵染率以及土壤AMF孢子密度以及丰富度存在影响。 3.1 内生真菌对菌根侵染率的影响 禾草可以同时与内生真菌和丛枝菌根真菌形成共生关系,关于内生真菌对菌根侵染的影响早在1992年Chu-Chou等[23]就已经开展了相关工作,到目前为止国内外大多数研究发现内生真菌对丛枝菌根真菌的侵染有抑制作用[31-26,28-30],如内生真菌的存在降低了高羊茅根部的丛枝菌根真菌(未明确AMF的种类)的侵染率[22];降低了羽茅根部幼套球囊霉(G.etunicatum)的侵染率,而对摩西球囊霉(G.mosseae)对根系的侵染无影响[24];降低了摩西球囊霉和根内球囊霉(G.intraradices)对黑麦草根部的侵染率[26];对野大麦球囊霉属菌根侵染率具有较强的抑制作用[30];在一定浓度带菌雀麦植株的根系分泌物浸提液作用下内生真菌可以增加菌根真菌菌丝长度[27];内生真菌会降低披碱草(E.hystrix)近明球囊霉的侵染率,但提高摩西球囊霉的侵染率[28],本研究得到类似结果,发现内生真菌能促进醉马草根系菌根侵染率。 3.2 内生真菌对土壤AMF孢子的影响 关于内生真菌对土壤微生物研究较少,黄玺等[33]探讨了醉马草内生真菌共生体对土壤微生物和养分的影响,发现醉马草根际土壤中真菌和细菌的数量均高于其伴生种硬质早熟禾(Poasphondylodes)和针茅(Stipacapillata)根际土壤中的细菌和真菌。而关于内生真菌对根际孢子的研究少之又少,Zhou等[24]研究发现,内生真菌对羽茅根际摩西球囊霉孢子具有显著的抑制作用,本研究结果与之相反。在E+醉马草根际土壤共发现2属7种AMF孢子,在E-醉马草根际土壤共发现3属5种AMF孢子,扭形球囊霉、沙漠球囊霉、G.antarcticum和膨胀球囊霉仅在E+根际土壤中存在,说明内生真菌对这4种AMF孢子具有促进作用;地表球囊霉和美丽盾巨孢囊霉仅在E-根际土壤中存在,说明内生真菌对这两种AMF孢子具有抑制作用。 3.3 生长条件对土壤AMF孢子的影响 本研究表明,生长条件不同,AMF的群落结构也不同;栽培条件较野生条件会降低AMF真菌的丰富度,这与大多数研究结果一致[32,34]。单孢球囊霉仅在野生条件下存在,导致这种结果发生的原因主要是土地管理破坏了AMF的菌丝体、导致土壤养分的变化等[35-36];细凹无梗囊霉仅在栽培条件下存在,主要是因为土地管理方式改变了土壤的理化性质,创造了适宜细凹无梗囊霉孢子繁殖体生存的土壤环境,充分说明生长条件能够影响土壤AMF群落。部分研究发现,不同草地植被类型寄主植物根围土壤AM真菌多样性存在差异,不同植物侵染率不同,同时部分植物不形成菌根结构[37-38],本研究中野生区醉马草物种较为丰富,而栽培区由于除草导致群落单一,栽培区和野生区植被的差异也是造成不同生长条件下醉马草根际土壤孢子密度及种类存在差异的原因。 本研究表明,内生真菌和生长条件均能影响醉马草根际土壤AMF孢子密度集群落组成,为内生真菌和生长条件对禾草根系以及根际土壤微生物多样性的研究提供了理论依据。后续将继续通过分子方法对醉马草根系以及土壤AMF真菌的种类进行鉴定,以及量化内生真菌-菌根真菌之间的互作。 References: [1] Johnson N C.Resource stoichiometry elucidates the structure and function of arbuscular mycorrhizas across scales.New Phytilogist,2010,185(3):631-647. [2] van der Heijden M G A,Martin F M,Selosse M A,Sanders I R.Mycorrhizal ecology and evolution:The past,the present,and the future.New Phytilogist,2015,205(4):1406-1423. [3] 南志标,李春杰.禾草-内生真菌共生体在草地农业系统中的作用.生态学报,2004,24(3):605-616. Nan Z B,Li C J.Roles of the grass-Neotyphodiumassociation in pastoral agriculture systems.Acta Ecologica Sinica,2004,24(3):605-616.(in Chinese) [4] Pennell C G L,Popay A J,Rolston M P,Townsend R J,Lloyd-West C M,Card S D.Avanex unique endophyte technology reduced insect food source at airports.Environmental Entomology,2016,45(1):101-108. [5] Ma M Z,Christensen M J,Nan Z B.Effects of the endophyteEpichlo⊇festucaevar.loliiof perennial ryegrass (Loliumperenne) on indicators of oxidative stress from pathogenic fungi during seed germination and seedling growth.European Journal of Plant Pathology,2015,141(3):571-583. [6] Susi H,Laine A.The effectiveness and costs of pathogen resistance strategies in a perennial plant.Journal of Ecology,2016,103(2):303-315. [7] Hahn H,McManus M T,Warnstorff K,Monahan B J,Young C A,Davies E,Tapper B A,Scott B.Neotyphodiumfungal endophytes confer physiological protection to perennial ryegrass (LoliumperenneL.) subjected to a water deficit.Environmental and Experimental Botany,2008,63(1-3):183-199. [8] Hamilton C E,Bauerle T L.A new currency for mutualism? Fungal endophytes alter antioxidant activity in hosts responding to drought.Fungal Diversity,2012,54(1):39-49. [9] Kannadan S,Rudgers J A.Endophyte symbiosis benefits a rare grass under low water availability.Functional Ecology,2008,22(4):706-713. [10] Schardl C L,Young C A,Faulkner J R,Florea S.Pan J.Chemotypic diversity ofEpichlo⊇,fungal symbionts of grasses.Fungal Ecology,2012,5(3):331-344. [11] 史志诚.中国草地重要有毒植物.北京:世界图书出版公司,1997:166-176. Shi Z C.Important Poisonous Plants of China Grassland.Beijing:China Agricultural Press,1997:166-176.(in Chinese) [12] Li C J,Nan Z B.A newNeotyphodiumspecies symbiotic with drunken horse grass (Achnatheruminebrians) in China.Mycotaxon,2004,90(1):141-147. [13] Chen L,Li X Z,Li C J,Swoboda G A,Young C A,Sugawara K,Leuchtmann A,Schardl C L.Two distinctEpichlo⊇ species symbiotic withAchnatheruminebrians,drunken horse grass.Mycologia,2015,107:863-873. [14] Schardl C L,Young C A,Faulkner J R,Florea S,Pan J.Chemotypic diversity of epichloae,fungal symbionts of grasses.Fungal Ecology,2012,5:331-344. [15] Chen N,He R L,Chai Q,Li C J,Nan Z B.Transcriptomic analyses giving insights into molecular regulation mechanisms involved in cold tolerance byEpichlo⊇endophytein seed germination ofAchnatheruminebrians.Plant Growth Regulation,2016,80(3):367-375. [16] Li C J,Li F,Gou X Y,Nan Z B. Effects of abiotic stressesonAchnatheruminebriansby symbiotic endophyte ofNeotyphodiumgansuense.In:Multifunctional Grasslands in Changing World.Guangzhou:Guangdong People’s Publishing House,2008:819. [17] Xia C,Zhang X X,Christensen M J,Nan Z B,Li C J.Epichlo⊇ endophyte affects the ability of powdery mildew (Blumeriagraminis) to colonise drunken horse grass (Achnatheruminebrians).Fungal Ecology,2015,22:26-34. [18] Xia C,Li N N,Zhang X X,Feng Y,Christensen M J,Nan Z B.AnEpichlo⊇ endophyte improves photosynthetic ability and dry matter production of its hostAchnatheruminebriansinfected byBlumeriagraminisunder various soil water conditions.Fungal Ecology,2016,16:26-33. [19] Zhang X X,Li C J,Nan Z B.,Matthew C.Neotyphodiumendophyte increasesAchnatheruminebrians(drunken horse grass) resistance to herbivores and seed predators.Weed Research,2012,52(1):70-78. [20] Zhang X X,Li C J,Nan Z B.Effects of cadmium stress on growth and anti-oxidative systems inAchnatheruminebrianssymbiotic withNeotyphodiumgansuense.Journal of Hazardous Materials,2010,175:703-709. [21] 李芳,张峰,高萍,段廷玉.农业生态系统中AM真菌、禾草内生真菌及病原菌互作.草业科学,2016,33(2):219-229. Li F,Zhang F,Gao P,Duan T Y.Progress of research on the interactions of arbuscular mycorrhizal fungi,grass endophyte and plant pathogens in agro-ecosystem.Pratacultural Science,2016,33(2):219-229.(in Chinese) [22] Mack K M L,Rudgers J A.Balancing multiple mutualists:Asymmetric interactions among plants,arbuscular mycorrhizal fungi,and fungal endophytes.Oikos,2008,117(2):310-320. [23] Chu-Chou M,Guo B,An Z Q,Hendrix J W,Ferriss R S,Siegel M R,Dougherty C T,Burrus P B.Suppression of mycorrhizal fungi in fescue by theAcremoniumcoenophialumendophyte.Soil Biology and Biochemistry,1992,24(7):633-637. [24] Zhou Y,Li X,Qin J H,Liu H,Chen W,Niu Y,Ren A Z,Gao Y B.Effects of simultaneous infections of endophytic fungi and arbuscular mycorrhizal fungi on the growth of their shared host grassAchnatherumsibiricumunder varying N and P supply.Fungal Ecology,2016,(20):56-65. [25] Müller J.Artificial infection by endophytes affects growth and mycorrhizal colonisation ofLoliumperenne.Functional Plant Biology,2003,30(4):419-424. [26] Omacini M,Eggers T,Bonkowski M,Gange A C,Jones T H.Leaf endophytes affect mycorrhizal status and growth of co-infected and neighbouring plants.Functional Ecology,2006,20(2):226-232. [27] Novas M V,Iannone L J,Godeas A M,Scervino J M.Evidence for leaf endophyte regulation of root symbionts:Effect ofNeotyphodiumendophytes on the pre-infective state of mycorrhizal fungi.Symbiosis,2011,55(1):19-28. [28] Larimer A L,Bever J D,Clay K.Consequences of simultaneous interactions of fungal endophytes and arbuscular mycorrhizal fungi with a shared host grass.Oikos,2012,121(12):2090-2096. [29] 刘慧,陈薇,周勇,李夏,任安芝,高玉葆.内生真菌和丛枝菌根真菌对羊草生长的影响.植物生态学报,2015,39(5):477-485. Liu H,Chen W,Zhou Y,Li X,Ren A Z,Gao Y B.Effects of endophyte and arbuscular mycorrhizal fungi on growth ofLeymuschinensis.Chinese Journal of Plant Ecology,2015,39(5):477-485.(in Chinese) [30] 方爱国,李春杰.Neotyphodium属禾草内生真菌和球囊霉属菌根真菌对野大麦生长的影响.草业科学,2014,31(3):457-461. Fang A G,Li C J.Effects ofNeotyphodiumendophyteand AMF onHordeumbrevisubulatumgrowth.Pratacultural Science,2014,31(3):457-461.(in Chinese) [31] Mcgonigle T P,Miller M H,Evans D G,Fairchild D L,Swan J A.A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi.New Phytologist,1990,115(3):495-501. [32] 高萍,闫飞扬,蒙程,李芳,段廷玉.黄土高原不同耕作措施下 AM 真菌的多样性.草业科学,2016,33(10):1917-1923. Gao P,Yan F Y,Meng C,Li F,Duan T Y.Diversity of arbuscular mycorrhizal fungi under different agricultural practices in Loess Plateau in China.Pratacultural Science,2016,33(10):1917-1923.(in Chinese) [33] 黄玺,李秀璋,柴青,李春杰.醉马草内生真菌共生体对土壤微生物和养分的影响.草业科学,2013,30(3):352-356. Huang X,Li X Z,Chai Q,Li C J.Effects ofAchnatheruminebrians/Neotyphodiumendophyte symbiont on microflora and nutrient of soil.Pratacultural Science,2013,30(3):352-356.(in Chinese) [34] Jansa J,Mozafar A,Anken T,Ruh R,Sanders I,Frossard E.Diversity and structure of AMF communities as affected by tillage in a temperate soil.Mycorrhiza,2002,12(5):225-234. [35] 闫飞扬,段廷玉,张峰.农业管理措施对AM 真菌功能影响的研究进展.草业科学,2014,33(12):2230-2241. Yan F Y,Duan T Y,Zhang F.Effects of agricultural managements on the function of arbuscular mycorrhizal fungi.Pratacultural Science,2014,33(12):2230-2241.(in Chinese) [36] Smith F A,Jakobsen I,Smith S E.Spatial differences in acquisition of soil phosphate between two arbuscular mycorrhizal fungi in symbiosis withMedicagotruncatula.New Phytologist,2000,147(2):371-379. [37] 杨春雪,陈飞,岳英男,阎秀峰.松嫩盐碱草地26种植物根围丛枝菌根真菌多样性特征.草业科学,2015,32(12):2008-2020. Yang C X,Chen F,Yue Y N,Yan X F.Diversity characteristics of arbuscular mycorrhizal fungi in the rhizosphere of twenty six species of plants in Songnen saline-alkaline grassland.Pratacultural Science,2015,32(12):2008-2020.(in Chinese) [38] 蔡晓布,彭岳林,冯固,钱成.西藏高原草地植物AM真菌多样性及其环境影响因子研究.土壤学报,2005,42(4):642-651. Cai X B,Peng Y L,Feng G,Qian C.AM fungi diversity and their environmental factors in altiplano grassland in Tibet.Acta Pedologica Sinica,2005,42(4):642-651.(in Chinese) (责任编辑 武艳培) Effect ofEpichlo⊇gansuensison arbuscular mycorrhizal fungi spore diversity in rhizosphere soil of drunken horse grass under different growth conditions Zhong Rui, Zhou Xiao-rong, Zhang Zhi-qin, Xia Chao, Li Na-na, Zhang Xing-xu (State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agricultural Science and Technology, Lanzhou University, Lanzhou 730020, China) The present study was conducted to measure the colonisation rate of arbuscular mycorrhizal fungi (AMF), soil spore density, and AMF diversity under different growth conditions, based on root staining and morphological identification of spores. The results indicated that AMF colonisation rate of cultivated roots were significantly higher than that in wild roots (P<0.05) under cultivated conditions, and that endophytes significantly increased the AMF colonisation rate (P<0.05). Spore density in wild soil was significantly higher than that in cultivated soil (P<0.05). Under cultivated conditions, endophytes significantly enhanced the spore density (P<0.05). Under cultivated conditions, three genera and nine AMF species were detected, including sevenGlomus, oneGigaspora, and oneScutellosporaspecies. Endophyte-infected roots (E+) contained sixGlomusand oneGigasporaspecies; endophyte-free roots (E-) contained threeGlomus, oneGigaspora, and oneScutellosporaspecies. Two genera, including nine AMF species (eightGlomusand oneGigasporaspecies) were found under wild conditions.Glomuswas the most abundant AMF species. The AMF species richness of wild soil was significantly higher (P<0.05) than that under cultivated conditions. However, endophytes had no significant effect (P>0.05) on AMF species richness. These results demonstrated that endophyte infection and growth conditions might change AMF community structure. AMF; diversity; endophyte; growth conditions; AMF colonization rate; soil spore density Zhang Xing-xu E-mail:xxzhang@lzu.edu.cn 10.11829/j.issn.1001-0629.2017-0067 2017-02-14 接受日期:2017-05-21 国家自然科学基金(31402132);中央高校基本科研业务费(Lzujbky-2016-12、Lzujbky-2016-177、Lzujbky-2016-192) 钟睿(1995-),男,甘肃民乐人,在读硕士生,研究方向为草地菌根学。Email:zhongr12@lzu.edu.cn 张兴旭(1983-),男,甘肃临泽人,副教授,博士,研究方向为禾草内生真菌及其次生代谢产物学。Email:xxzhang@lzu.edu.cn Q935 A 1001-0629(2017)08-1627-08 钟睿,周晓蓉,张稚钦,夏超,李娜娜,张兴旭.不同生境下Epichlo⊇gansuensis对醉马草根际土壤丛枝菌根真菌的影响.草业科学,2017,34(8):1627-1634. Zhong R,Zhou X R,Zhang Z Q,Xia C,Li N N,Zhang X X.Effect ofEpichlo⊇gansuensison arbuscular mycorrhizal fungi spore diversity in rhizosphere soil of drunken horse grass under different growth conditions.Pratacultural Science,2017,34(8):1627-1634.2 结果

3 讨论与结论

