低糖基化E-钙黏蛋白对Tca8113舌鳞癌细胞增殖的影响
徐秀英徐 欣高振南,2*
(1 山东大学口腔医院,山东 济南 250012;2 山东省口腔生物医学重点实验室,山东 济南 250012)
低糖基化E-钙黏蛋白对Tca8113舌鳞癌细胞增殖的影响
徐秀英1徐 欣1高振南1,2*
(1 山东大学口腔医院,山东 济南 250012;2 山东省口腔生物医学重点实验室,山东 济南 250012)
目的研究低糖基化的E-钙黏蛋白(E-cadherin)对Tca8113舌鳞癌细胞增殖的影响。方法以Tca8113细胞系作为研究样本,应用含低糖基化的E-cadherin (V13)基因的质粒和含野生型E-cadherin基因的质粒分别转染Tca8113细胞,用western blot实验检测转染基因的稳定表达。通过MTT法和流式细胞术判定V13基因的质粒转染Tca8113细胞对细胞增殖活性的影响;采用SPSS17.0软件包对数据进行统计学分析。结果①Western blot结果显示:空白对照组无标记蛋白表达,V13基因质粒和野生型E-cadherin基因质粒转染Tca8113细胞后均稳定表达,V13的相对分子质量为120 kD小于野生型E-cadherin的相对分子质量150 kD。②MTT结果显示:与空白对照组细胞相比,V13基因转染组细胞的增殖活性有明显降低,而野生型E-cadherin转染组细胞的增殖活性无明显改变。③流式细胞术结果显示:与空白对照组细胞相比,V13基因转染组细胞的S期比率下调约18.42%,降低明显,而野生型E-cadherin转染组细胞的S期细胞比率改变不明显。结论V13基因转染比野生型E-cadherin基因转染Tca8113细胞能更显著地抑制该细胞的体外增殖。
E-cadherin;低糖基化;增殖
E-cadherin是构成相邻上皮细胞间黏附连接 (adherens junctions,AJs)的单次跨膜糖蛋白,细胞外域中有4个N-糖链。E-cadherin介导相邻细胞间的AJs。E-cadherin的表达水平与肿瘤细胞的增殖有密切的关系,研究指出肿瘤细胞间E-cadherin的表达水平均显著下降,而且E-cadherin的表达水平越低,肿瘤细胞增殖性越强,分化程度越低,患者预后也会越差[1-3]。在本课题中,我们将研究V13基因对舌鳞癌细胞体外增殖的影响,为V13基因对肿瘤细胞体内增殖的影响奠定研究基础。
1 材料与方法
1.1 材料。质粒:①减少E-cadherin细胞外域两个N-糖基化位点的低糖基化E-cadherin(V13)基因的质粒;②携带野生型E-cadherin(wildtype E-cadherin)基因的质粒。
细胞株:由上海交通大学第九人民医院建株的人舌鳞状细胞癌Tca8113细胞系。
1.2 Tca8113细胞的培养和基因转染:将Tca8113细胞置于含全营养RPMI1640培养基,37 ℃,5% CO2培养箱中培养,当细胞长至80%融合时传代。将实验细胞分为空白对照组、野生型E-cadherin质粒转染组和V13质粒转染组,转染24 h后,G418筛选3周,建立稳定表达细胞系。
1.3 Western blot检测质粒转染后是否稳定表达及表达蛋白的大小:收集Tca8113细胞,提取总蛋白后测定浓度。取20 μg总蛋白SDS-PAGE电泳,湿法转膜。5%脱脂奶粉封闭液中室温摇动2 h,TBST洗5 s,然后进行抗体孵育。稀释的一抗4 ℃孵育过夜。TBST摇动洗膜数次。室温置于杂交炉中孵育稀释的二抗2 h。TBST摇动洗膜数次去除残留二抗。ECL Plus发光试剂盒于暗室中曝光、显影、定影。
1.4 MTT法检测细胞增殖:对数生长期细胞接种贴壁后,每隔24 h设定检测时间点,向每孔加入5 mg/mL的MTT工作液20 μL,孵育4 h后终止培养,弃上清,每孔加入DMSO 150 μL,震荡10 min后比色,以光吸收值为纵轴,以检测时间点为横轴绘制出生长曲线。以上实验重复3次。
1.5 流式细胞术检测细胞周期:取同步化后的待检测细胞制成单细胞悬液,固定细胞后收集。PBS重悬细胞后轻轻吹打。加入2 μL RNaseA至终浓度50 μg/mL,避光37 ℃孵育30 min。加入50 μL PI至终浓度65 μg/mL,避光冰浴染色30 min。300目尼龙网过滤,流式细胞仪测定分析细胞周期。以上实验重复3次。
1.6 统计学分析:以“平均数±标准差”表示所有数据。应用SPSS17.0统计软件分析数据,采用t检验方法,P<0.05认为有差异,P<0.01认为有显著性差异。
2 结 果
2.1 Western blot检测蛋白表达水平差异:低糖基化E-cadherin的相对分子质量为120 kD,野生型E-cadherin的相对分子质量为150 kD,空白对照组无蛋白表达。即低糖基化的E-cadherin相对分子质量小于野生型E-cadherin的相对分子质量(图1)。
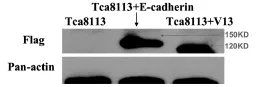
图1 Western blot检测三种细胞的蛋白表达
2.2 MTT法检测细胞增殖能力差异:V13显著抑制Tca8113细胞的增殖,野生型E-cadherin同样抑制Tca8113细胞的增殖,自48h起V13组细胞的OD值显著低于对照细胞(图2)。

图2 三组细胞的增殖曲线
2.3 流式细胞术检测三组细胞的细胞周期分布:相比空白对照组,V13组细胞S期比例下调了约18.42%,二者之间有显著性差异;E-cadherin组细胞S期比例下调约13.91%,二者之间差异不明显(图3)。

图3 流式细胞术分析细胞周期的不同
3 讨 论
口腔癌是全球导致死亡的第八大癌症[4]。2012年,全球有145400例口腔癌致死亡病例,同时有300400例新发口腔癌病例[5]。在口腔癌病例中,口腔鳞状细胞癌(OSCC)占90%以上[6]。虽然在过去的数十年中临床诊断和治疗有很大的提升,但OSCC生存率并没有显著改善,并且5年生存率仍处于50%[7]。因此,我们迫切的需要一种有效干预OSCC细胞增殖的治疗方法。
E-cadherin是细胞表面的单次跨膜N-糖蛋白,它介导构成了上皮细胞间的AJs。E-cadherin的细胞外域经钙离子作用形成二聚体,而后通过嗜同黏附效应,相邻细胞表面的二聚体形成了AJs[8]。蛋白质翻译后最主要的修饰方式是糖基化,被糖链共价修饰形成糖蛋白占50%以上[9]。糖基化能够对蛋白质生物学功能起到重要调节作用,现已知由蛋白质翻译后糖基化的缺陷而引起的遗传性疾病有至少30种[10]。所以我们推断维持细胞间AJs稳定性、细胞间的黏附识别会受到E-cadherin的翻译后N-糖基化修饰改变的影响。
有研究将人、犬和小鼠共有的3个蛋白质翻译后的N-糖基化位点的氨基酸位点进行替换,从而阻止了E-cadherin这些位点的翻译后修饰。而后研究了各种变异的减少N-糖基化位点的E-cadherin与其相关的AJs的稳定性。结果发现减少N-糖基化位点的E-cadherin介导的AJs比野生型E-cadherin介导的AJs更加牢固[10]。
本实验所采用的即为减少了两个N-糖基化位点的低糖基化E-cadherin基因的质粒(V13),对照质粒为野生型E-cadherin基因质粒,实验细胞株为人舌鳞状细胞癌细胞Tca8113。Western blot实验证实,两种质粒转染后均有稳定表达,并且低糖基化的E-cadherin相对分子质量小于野生型E-cadherin的相对分子质量。所以于Tca8113细胞内研究低糖基化的E-cadherin对舌鳞癌细胞增殖的影响及原理是可行的。
本研究从减少E-cadherin的翻译后N-糖基化修饰的新途径,证实低糖基化修饰的E-cadherin(V13)比野生型E-cadherin对肿瘤细胞间AJs的稳定性和抑制肿瘤增殖方面有着更显著的影响,为接下来研究低糖基化E-cadherin抑制肿瘤细胞侵袭、转移奠定理论依据和实验基础,并为临床中阻止肿瘤细胞增殖提供了新的研究途径。在后续的实验研究中,我们将进一步研究低糖基化E-cadherin对肿瘤细胞体外增殖能力减弱的原理,从新的角度展示肿瘤转移的一种新机制,为临床中防止肿瘤转移提供新的有效的治疗方式。
[1] Jeanes A,Gottardi CJ,Yap AS.Cadherins and cancer: how does cadherin dysfunction promote tumor progression?[J]. Oncogene,2008, 27(55):6920-6929.
[2] Foschini MP,Cocchi R,Morandi L,et al.E-cadherin loss and delta-Np73L expression in oral squamous cell carcinomas showing aggressive behavior[J].Head Neck,2008,30(11):1475-1482.
[3] Zhong LP,Li J,Zhang CP,et al.Expression of E-cadherin in cervical lymph nodes from primary oral squamous cell carcinoma patients[J].Arch Oral Biol,2007,52(8):740-747.
[4] Johnson NW,Jayasekara P,Amarasinghe A.Squamous cell carcinoma and precursor lesions of the oral cavity: epidemiology and aetiology[J].Periodontol,2000,57(1):19-37.
[5] Torre LA. Global Cancer Statistics,2012[J].Cancer J Clin, 2015, 65(1):87-108.
[6] Sappayatosok K,Phattarataratip E.Overexpression of claudin-1 is associated with advanced clinical stage and invasive pathologic characteristics of oral squamous cell carcinoma[J].Head Neck Pathol,2015,9(2):173-180.
[7] Chen TC,Wang CP,Ko JY,et al.The impact of pathologic close margin on the survival of patients with early stage oral squamous cell carcinoma[J].Oral Oncol,2012,48(7):623-628.
[8] Iiizumi M,Liu W,Pai SK,et al.Drug development against metastasis-related genes and their pathways: A rationale for cancer therapy[J].Biochim Biophys Acta,2008,1786(2):87-104.
[9] Baranwal S,Alahari SK.Molecular mechanisms controlling E-cadherin expression in breast cancer[J].Biochem Biophys Res Commun,2009,384(1):6-11.
[10] Hart GW,Copeland RJ.Glycomics hits the big time[J].Cell,2010, 143(5):672-676.
Effects of Low Glycosylated E-cadherin on Proliferation of Tca8113 Squamous Cell Carcinoma of Tongue
XU Xiu-ying1, XU Xin2, GAO Zhen-nan1,2*
(1 Stomatological Hospital of Shandong University, Jinan 250012, China; 2 Shandong Provincial Key Laboratory of Oral Biomedical, Jinan 250012, China)
ObjectiveThe effects of hypoglycosylated E-cadherin gene on the tongue aquamous cell’s proliferation after transfected into Tca8113 cells.MethodTca8113 tongue squamous cell lines is our sample. V13 gene and wild-type E-cadherin protein gene were transfected into Tca8113 cell. We use western blot to detect the stable expression of the transfected gene. MTT assay and FACS analysis measured the proliferation of different groups of cells.Result①Western blotting: The V13 gene and wild-type E-cadherin gene were stably expressed after transfected. The result showed that molecular weight of V13 was smaller than wild-type E-cadherin. ②MTT assay: The V13 gene transfected group had a significantly proliferation decrease, while the wild-type E-cadherin gene transfected group had no obvious proliferation change. ③FACS results: The S-phase ratio of V13 gene transfected cells reduced 18.42%, while no significant change in the wild-type E-cadherin transfected group.ConclusionV13 gene inhibits cell proliferation of Tca8113 cell more obviously than the wild-type E-cadherin gene.
E-cadherin; Hypoglycosylate; Proliferation
R739.86
B
1671-8194(2017)22-0026-02
*通讯作者:E-mail: zngao@sdu.edu.cn

