冬季细颗粒物对人支气管上皮细胞的毒性效应
桑楠,岳慧峰
(山西大学 环境与资源学院,山西 太原 030006)
冬季细颗粒物对人支气管上皮细胞的毒性效应
桑楠,岳慧峰
(山西大学 环境与资源学院,山西 太原 030006)
细颗粒物(PM2.5)作为冬季多发的雾霾的主要组成成分,对人呼吸系统有严重的毒害作用。实验采集太原地区冬季PM2.5,考察其对人支气管上皮细胞系(BEAS-2B)的毒性效应。研究发现,处理组细胞内能明显观察到颗粒物沉积,细胞器结构发生显著改变,说明PM2.5中超微颗粒能够进入细胞并且会影响BEAS-2B细胞中细胞器结构。PM2.5处理细胞后,细胞活性氧自由基(ROS)含量随着PM2.5浓度的增高而增加,且在30 μg/mL时达到最大。进一步研究发现,细胞超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)的含量随着PM2.5浓度的增高而减少,并在30 μg/mL浓度时,SOD的含量下降为对照组的51.02%,GPX的含量下降为对照的54.10%。另外,细胞培养液中白介素6(IL-6)和IL-8的含量随着PM2.5浓度的增高而增高,并在30 μg/mL浓度时,IL-6的含量达到对照组的3.18倍,IL-8的含量达到对照的1.90倍。在PM2.5暴露条件下,PM2.5能够引起细胞发生氧化应激和炎性反应,并能抑制抗氧化酶的蛋白表达。
PM2.5;ROS;抗氧化酶;炎性
细颗粒物(PM2.5)是指粒径小于2.5 μm的颗粒物,也称之为可吸入颗粒物。据世界卫生组织报道,每年室外空气污染引起的过早死亡人数将近370万人,其中80%死于心脏病或者中风,而暴露于PM2.5所引起的呼吸系统疾病以及癌症导致的死亡人数占20%[1]。在我国华北地区,作为冬季多发的雾霾的主要组成成分,PM2.5的健康风险也越来越受到重视[2]。大气中的PM2.5表面携带许多有毒物质(如多环芳烃,重金属等),能长时间停留在大气中与体表接触,还能穿过鼻毛,深入呼吸道,积聚在肺部;同时,颗粒物上的有毒物质可以通过气体交换和血液循环而扩散[3]。流行病学显示,PM2.5浓度的上升与心脑血管疾病以及呼吸系统疾病发病率的升高显著相关[4]。大量动物体内以及体外细胞实验研究也证明,PM2.5暴露能够引起细胞氧化应激以及炎性反应[5-6]。
前人的实验研究表明,污染物暴露后,细胞活性氧自由基(ROS)水平显著升高,同时抑制抗氧化酶系统酶的表达,并导致炎性反应发生[7-8]。ROS是细胞氧化代谢的天然副产物,在调节细胞存活,细胞死亡,分化,细胞信号传导和炎症相关因子产生中起重要作用[9]。在各种生理状态下,ROS作为中间体产生,受到各种解毒酶(如超氧化物歧化酶(SOD),谷胱甘肽过氧化物酶(GPX)和过氧化氢酶(CAT))或不同的抗氧化剂(包括黄酮,抗坏血酸,维生素E和谷胱甘肽(GSH))的影响[10]。ROS既是信号分子,又是炎症介质。炎症反应可以由污染物引发,而ROS的产生也会引起炎症反应,并反过来进一步刺激产生ROS[11]。炎症反应中常见的促炎因子有IL-6,IL-8以及IL-1β等。为此,本研究采集太原市小店区冬季PM2.5,通过对人支气管上皮细胞进行不同浓度PM2.5染毒,研究PM2.5对细胞氧化应激、抗氧化酶和炎性反应的影响,考察PM2.5的生物毒性作用,为PM2.5污染健康风险评价提供理论依据。
1 材料和方法
1.1 PM2.5的采集以及悬液的制备
采样前,将采样膜在450℃烘箱中烘干12 h,烘干后在室温平衡24 h,最后对采样膜称重。用TH-150C中流量采样器采集冬季PM2.5颗粒物,采样时间段为2012年11月1日至2013年2月28日,流速为100 L/min,每天采样22 h。采样结束后,将采样膜包被在铝箔纸4℃保存备用。在进行实验之前,将采样膜剪碎浸泡在适量超纯蒸馏水中,超声震荡3次,每次震荡20 min,待膜上颗粒物完全震荡分离后,用6层纱布过滤多次,收集滤液置于真空冷冻干燥器中干燥至水分完全挥发,收集颗粒物备用。
1.2 人支气管上皮细胞系(BEAS-2B)细胞的培养及PM2.5暴露
BEAS-2B细胞系购于中国科学院典型培养物保藏委员会细胞库。将细胞培养在含有体积浓度为10%胎牛血清,100 U/mL链霉素以及100 U/mL青霉素的RPMI 1640培养基中,培养温度为37℃,湿度为95%,CO2体积分数为5%。传代时,取对数生长期的BEAS-2B细胞,吸去培养液,PBS冲洗两次,吸去PBS,加胰酶进行消化,消化完毕后,加入预热含有胎牛血清的RPMI1640培养基终止消化,用吸管反复吹打细胞悬液,确保细胞密度均匀。普通传代细胞在25 mL培养瓶中培养,进行细胞实验时在35 mm培养皿中培养。
PM2.5暴露前,将PM2.5溶于灭菌的生理盐水中配成不同浓度梯度悬浊液备用。将细胞培养在培养皿24 h后,现用现配上述悬浊液,对细胞进行24 h染毒处理(0,1,3,10,30 μg/mL)。每个处理组做3个平行。
1.3 电镜观察
将细胞以5×105个/mL浓度接种在培养皿24 h后,用30 μg/mL PM2.5染毒处理24 h,染毒时间完毕后用胰酶消化细胞并将细胞收集于灭菌的2 mL塑料EP管中,离心后用灭菌的PBS洗3次后,收集细胞片用含有体积分数1%戊二醛和体积分数4%甲醛的0.1 mol/L的磷酸缓冲液(pH=7.4)固定,用体积分数2.5%的四氧化锇后固定处理1 h。最后乙醇梯度脱水、渗透、包埋,切片后用醋酸铀及枸椽酸铅双染色,在80 kV的条件下使用JEM-1011型透射电镜观察拍片。
1.4 活性氧自由基ROS检测
将细胞以5×105个/mL浓度接种在培养皿24 h后,不同浓度PM2.5分别染毒处理24 h。处理时间到后,收集细胞,PBS洗2次,用不含血清的培养基重悬,使用DCFH-DA荧光探针37℃下避光孵育30 min。然后PBS清洗细胞3次,PBS重悬后用流式细胞仪(C6,BD,美国)在530 nm发射波长和488 nm激发波长下检测荧光强度,每次试验收集10 000个细胞。
1.5 蛋白检测
将细胞以5×105个/mL浓度接种在培养皿24 h后,不同浓度PM2.5分别染毒处理24 h。处理时间到后,收集细胞,PBS洗2次,洗净后加入蛋白裂解液100 μL,然后收集细胞并在冰盒中使用玻璃匀浆器对细胞悬液进行充分匀浆,匀浆后收集于1.5 mL塑料离心管并使用1 mL注射器吹打数次,完成后冰上裂解5 min,待细胞裂解完全后离心15 min(4℃,13 000 r/min),收集上清。上清一部分用考马斯亮蓝法测定其中的蛋白含量。
将100 μg样本作为上样量加入到硫酸二辛酯-聚丙烯酰胺凝胶(SDS-PAGE)中电泳,然后将凝胶膜电转至硝酸纤维素膜上。然后用质量浓度3%牛血清白蛋白(BSA)封闭,分别加入SOD2,GPX以及CAT蛋白抗体(1∶200稀释)并在4℃下孵育过夜。孵育完成后用PBS洗膜3次并用荧光二抗(1∶5 000稀释)孵育2 h。用近红外双色激光成像系统Odyssey(LI-COR,美国)扫膜,并用IPwin32软件处理系统分析目标条带的光密度值。最终结果用目的蛋白与β-actin的光密度比值来表示。
1.6 炎性因子IL-6和IL-8检测
将细胞以5×105个/mL浓度接种在培养皿24 h后,不同浓度PM2.5分别染毒处理24 h。收集细胞培养上清液,一部分用考马斯亮蓝法测定其中的蛋白含量,其余部分根据上海西唐生物科技有限公司IL-6、IL-8 ELISA试剂盒检测样本中IL-6和IL-8炎性因子含量。
1.7 数据分析方法
数据表示为平均值±标准误差。使用单因素方差分析(ANOVA)以及Fisher最小显著差异(LSD)检验来确定所有处理组与对照组差异。当P<0.05时认为差异具有统计学意义。使用Origin 8.0进行数据分析和图形生成。
2 结果
2.1 PM2.5在BEAS-2B细胞中的沉积
如图1所示,PM2.5处理细胞24 h后,与对照组相比,处理组细胞内能明显观察到颗粒物沉积,细胞器结构发生显著改变,说明PM2.5中超微颗粒能够进入细胞并且会影响BEAS-2B细胞中细胞器结构。
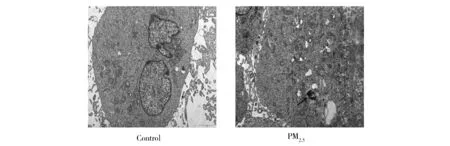
Fig.1 Deposition of PM2.5 with lower diameter in cells and its effect on organelle structure(The arrow indicates the deposition of ultrafine particles in PM2.5 in the cell)图1 PM2.5在细胞内的沉积以及对细胞器结构的影响(箭头表示PM2.5中超微颗粒在细胞内的沉积)
2.2 PM2.5暴露对BEAS-2B细胞ROS的影响
如图2所示,PM2.5处理细胞后,细胞ROS含量随着PM2.5浓度的增高而增加,且在30 μg/mL时ROS荧光强度达到最大。这说明,PM2.5能够引起细胞ROS水平显著上升,导致细胞氧化应激反应。

Fig.2 Effects of PM2.5 exposure on ROS in BEAS-2B cells (*** P<0.001,vs. control)图2 PM2.5暴露对BEAS-2B细胞ROS的影响(与对照组相比,*** P<0.001)
2.3 PM2.5暴露对BEAS-2B细胞抗氧化酶的影响
为了进一步考察PM2.5处理细胞后的氧化应激反应,也对几种抗氧化酶蛋白表达进行了分析。如图3所示,PM2.5处理细胞后,细胞SOD和GPX的含量随着PM2.5浓度的增高而减少,并在30 μg/mL浓度时,SOD的含量下降为对照组的51.02%,GPX的含量下降为对照的54.10%。但是CAT的含量仅在3 μg/mL浓度时有显著下降说明,PM2.5能够抑制细胞内抗氧化酶的表达。

Fig.3 Effects of PM2.5exposure on antioxidant enzymes in BEAS-2B cells(*P<0.05,**P<0.01,***P<0.001,vs. control)图3 PM2.5暴露对BEAS-2B细胞抗氧化酶的影响(与对照组相比,*P<0.05,**P<0.01,***P<0.001)
2.4 PM2.5暴露对BEAS-2B细胞炎性反应的影响
如图4所示,PM2.5处理细胞后,细胞培养液中IL-6和IL-8的含量随着PM2.5浓度的增高而增高,并在30 μg/mL浓度时,IL-6的含量达到对照组的3.18倍,IL-8的含量达到对照的1.90倍,说明,PM2.5能够导致细胞发生炎性反应。

Fig.4 Effects of PM2.5exposure on inflammatory response of BEAS-2B cells(*P<0.05, ***P<0.001, vs. control)图4 PM2.5暴露对BEAS-2B细胞炎性反应的影响(与对照组相比,*P<0.05,***P<0.001)
3 讨论
PM2.5对人体健康产生巨大威胁,而呼吸系统作为首当其冲的靶器官受其影响尤甚,实验研究表明PM2.5与呼吸系统疾病与日俱增,其中氧化应激以及炎性反应是其介导脏器损伤的重要途径[3]。BEAS-2B细胞(永生化的人支气管上皮细胞),其作为肺部疾病发生和生物毒性研究的良好细胞模型,广泛地应用于生物和毒理学研究中[12-13]。
氧化应激是指在有害刺激因素作用下,活性氧自由基ROS产生过多或发生代谢障碍,细胞体内氧化及抗氧化体系失衡,导致细胞的生理生化及代谢功能障碍[14]。机体内存在着氧化和抗氧化这两大系统,两个系统共同存在于机体中既相互制约又相互依存。抗氧化系统包括抗氧化酶类;包括SOD、CAT、GPX等;抗氧化非酶类:硫基蛋白、转铁蛋白(transferrin,TRF)、铜蓝蛋白 (ceruloplasmin,CER)、维生素C、N-乙酰半胱氨酸、一些水溶性及脂溶性的抗氧化物质等。SOD能将超氧化物(O2-)自由基分解为分子氧(O2)或过氧化氢(H2O2),GPX的生物化学功能是将脂质氢过氧化物还原成其相应的醇,并将游离过氧化氢还原成水,而CAT能催化过氧化氢分解成水和氧气。本实验中PM2.5处理细胞24 h后会明显上调ROS的水平,并抑制抗氧化酶的表达。另一研究表明用0、12.5、25 μg/mL的PM2.5刺激BEAS-2B细胞4 h后,ROS水平明显升高;刺激BEAS-2B细胞8 h后,细胞裂解液中脂质过氧化指标MDA以及抗氧化酶SOD的含量显著升高[15]。100和200 mg/L PM2.5处理MLE-12细胞3 h,胞内ROS水平较细胞对照组显著升高,分别升高 27.6%和 60.7%[16]。另外,还有研究表明太原市PM2.5暴露与大鼠肺泡巨噬细胞存活率、SOD和GSH-Px活性下降,MDA及ROS含量浓度升高相关,且呈现剂量-效应关系[17]。
除了氧化应激机制之外,大量研究发现 PM2.5亦能引起机体产生炎性反应,导致炎性因子,促炎因子等大量表达,形成级联反应,从而对机体造成损伤[18-19]。炎性反应是机体常见的一种反应,既是一种自我防御,但同时也会造成不同程度的自我损伤。促炎细胞因子是从诸如辅助性T细胞(Th)和巨噬细胞等免疫细胞以及促进炎症的某些其它细胞类型中分泌的一种信号分子(细胞因子)。IL-6和IL-8是两种典型的促炎细胞因子。本研究表明,PM2.5能够诱导BEAS-2B细胞产生炎性因子IL-6和IL-8,并且呈现一定的剂量依赖效应。太原市以及北京市收集的PM2.5能引起人肺上皮细胞产生炎性因子IL-6及其mRNA的表达增加,而且呈现剂量-效应关系[20]。北京市PM2.5浓度升高及暴露时间延长可能导致机体炎症反应增强(IL-6、TNF-α水平升高),从而造成机体损害[21],也有研究表明发动机尾气颗粒物处理BEAS-2B细胞后能够引起促炎因子IL-6,IL-8基因表达显著上升[22]。
氧化应激可以引起炎症,炎症也可以引起氧化应激[11]。氧化应激引起炎性方面:在“生理浓度”下,ROS作为调节细胞生长的信号分子,能影响细胞对其他细胞的粘附、分化、衰老和细胞凋亡;慢性或长期ROS的产生被认为是炎性疾病进展的核心[23]。例如超氧化物可以与NO结合形成过氧亚硝酸盐等活性氮(RNS),而其结合速率是SOD将超氧化物歧化速率的3到4倍,同时,RNS又会引起亚硝化应激,这增加了ROS引起的促炎症反应[24]。有研究表明,EC-SOD(在线粒体基质和细胞外基质表达的SOD,即SOD2)基因敲除小鼠对脂多糖(LPS)诱导的嗜中性粒细胞肺炎症的敏感性增强[25]。也有研究报道在不同炎症状态下均发现谷胱甘肽(GSH)含量降低,而GSH是GPX对H2O2解毒过程中的还原剂,这表明氧化应激在炎症反应中的重要作用[26]。此外,LPS处理后,小鼠肺中CAT的表达和活性显著降低。反过来,炎性也可以引起氧化应激。在炎症过程中,活化的吞噬细胞如嗜中性粒细胞和巨噬细胞产生大量的ROS,同时,非吞噬细胞也可以通过促炎因子而产生ROS[27]。例如已经发现在非小细胞肺癌,IL-6通过增加NADPH氧化酶4(NOX4)的表达而产生ROS[28]。以上研究结果暗示,ROS的产生可能会引起炎症反应,而炎症反应反过来进一步刺激产生ROS,两者相互影响相互促进。
4 结论
PM2.5处理BEAS-2B细胞后,能够引起细胞ROS水平显著上升并抑制抗氧化酶表达从而导致细胞氧化应激反应。同时,PM2.5暴露也会引起细胞炎性反应。炎症和氧化应激与病理生理过程密切相关并紧密联系,这些研究发现为进一步的PM2.5污染健康风险评价提供理论依据。
[1] WHO.Health and Sustainable Development[EB/OL].http:∥www.who.int/sustainable-development/cities/health-risks/air-pollution/en/[2017-06-29].
[2] Xie Y,Dai H,Dong H,etal. Economic Impacts from PM2.5Pollution-related Health Effects in China:A Provincial-Level Analysis[J].EnvironmentalScience&Technology,2016,50(9):4836-4843.DOI:10.1021/acs.est.5b05576.
[3] Xing Y F,Xu Y H,Shi M H,etal.The Impact of PM2.5on the Human Respiratory System[J].JournalofThoracicDisease,2016,8(1):E69-74.DOI:10.3978/j.issn.2072-1439.2016.01.19.
[4] Yin H,Pizzol M,Xu L.External Costs of PM2.5Pollution in Beijing,China:Uncertainty Analysis of Multiple Health Impacts and Costs[J].EnvironmentalPollution,2017,226:356-369.DOI:10.1016/j.envpol.2017.02.029.
[5] He M,Ichinose T,Kobayashi M,etal.Differences in Allergic Inflammatory Responses Between Urban PM2.5and Fine Particle Derived from Desert-dust in Murine Lungs[J].ToxicologyandAppliedPharmacology,2016,297:41-55.DOI:10.1016/j.taap.2016.02.017.
[6] Ogino K,Zhang R,Takahashi H,etal.Allergic Airway Inflammation by Nasal Inoculation of Particulate Matter (PM2.5) in NC/Nga Mice[J].PLoSOne,2014,9(3):e92710.DOI:10.1371/journal.pone.0092710.
[7] Wan J,Diaz-Sanchez D.Antioxidant Enzyme Induction:A New Protective Approach Against the Adverse Effects of Diesel Exhaust Particles[J].InhalationToxicology,2007,19(sup1):177-182.DOI:10.1080/08958370701496145.
[8] Li Y J,Takizawa H,Kawada T.Role of Oxidative Stresses Induced by Diesel Exhaust Particles in Airway Inflammation,Allergy and Asthma:Their Potential as a Target of Chemoprevention[J].Inflammation&Allergy-DrugTargets,2010,9(4):300-305.DOI:10.2174/187152810793358787.
[9] Holmström K M,Finkel T.Cellular Mechanisms and Physiological Consequences of Redox-dependent Signalling[J].NatureReviewsMolecularCellBiology,2014,15(6):411-421.DOI:10.1038/nrm3801.
[10] Wu H,Yin J J,Wamer W G,etal.Reactive Oxygen Species-related Activities of Nano-iron Metal and Nano-iron Oxides[J].JournalofFoodandDrugAnalysis,2014,22(1):86-94.DOI:10.1016/j.jfda.2014.01.007.
[11] Hakim J.Reactive Oxygen Species and Iflammation[J].ComptesRendusdesSéancesdelaSociétédeBiologieetdesesFiliales,1992,187(3):286-295.
[12] Oh S M,Kim H R,Park Y J,etal.Organic Extracts of Urban Air Pollution Particulate Matter (PM2.5)-induced Genotoxicity and Oxidative Stress in Human Lung Bronchial Epithelial Cells (BEAS-2B Cells)[J].MutationResearch,2011,723(2):142-151.DOI:10.1016/j.mrgentox.
[13] Dergham M,Lepers C,Verdin A,etal.Prooxidant and Proinflammatory Potency of Air Pollution Particulate Matter (PM2.5-0.3) Produced in Rural,Urban,or Industrial Surroundings in Human Bronchial Epithelial Cells (BEAS-2B)[J].ChemicalResearchinToxicology,2012,25(4):904-919.DOI:10.1021/tx200529v.
[14] Valavanidis A,Vlahogianni T,Dassenakis M,etal.Molecular Biomarkers of Oxidative Stress in Aquatic Organisms in Relation to Toxic Environmental Pollutants[J].EcotoxicologyandEnvironmentalSafety,2006,64(2):178-189.DOI:doi.org/10.1016/j.ecoenv.2005.03.013.
[15] 李娟,杨维超,洪丽娟,等.PM2.5对BEAS-2B 细胞脂质过氧化损伤作用[J].中国公共卫生,2014,30(11):1389-1391.DOI:10.11847/zgggws2014-30-11-08.
[16] 龙放,丁文军,邓晓蓓,等.大气细颗粒物PM2.5诱导肺上皮MLE-12细胞的氧化应激和自噬[J].中国药理学与毒理学杂志,2013,27(4):698-703.DOI:10.3867/j.issn.1000-3002.2013.04.016.
[17] 刘婷,魏海英,杨文妍,等.太原市冬季灰霾天气大气PM2.5对肺泡巨噬细胞的氧化损伤作用[J].环境科学学报,2015,35(3):890-896.DOI:10.13671/j.hjkxxb.2014.1000.
[18] Riva D,Magalhaes C,Lopes A A,etal.Low Dose of Fine Particulate Matter (PM2.5) Can Induce Acute Oxidative Stress,Inflammation and Pulmonary Impairment in Healthy Mice[J].InhalationToxicology,2011,23(5):257-267.DOI:10.3109/08958378.2011.566290.
[19] Ramanathan Jr M,London Jr N R,Tharakan A,etal.Airborne Particulate Matter Induces Non-allergic Eosinophilic Sinonasal Inflammation in Mice[J].AmericanJournalofRespiratoryCellandMolecularBiology,2017.DOI:10.1165/rcmb.2016-0351OC. Epub ahead of print.
[20] 张文丽,崔九思,戚其平,等.细颗粒物污染及对炎性因子IL-6表达的影响[J].卫生研究,2003,32(6):548-552.DOI:10.3969/j.issn.1000-8020.2003.06.007.
[21] 翟文慧,黄志刚,冯聪,等.大气细颗粒污染物PM2.5浓度及对肺上皮细胞炎性因子的影响[J].现代生物医学进展,2015,15(6):1028-1031.DOI:10.13241/j.cnki.pmb.2015.06.007.
[22] Skuland T S,Refsnes M,Magnusson P,etal.Proinflammatory Effects of Diesel Exhaust Particles from Moderate Blend Concentrations of 1st and 2nd Generation Biodiesel in BEAS-2B Bronchial Epithelial cells—The Fuel Health Project[J].EnvironmentalToxicologyandPharmacology,2017,52:138-142.DOI:10.1016/j.etap.2017.04.004.
[23] Mittal M,Iddiqui M R,Tran K,etal.Reactive Oxygen Species in Inflammation and Tissue Injury[J].Antioxidants&RedoxSignaling,2014,20(7):1126-1167.DOI:10.1089/ars.2012.5149.
[24] Griffith B,Pendyala S,Hecker L,etal.NOX Enzymes and Pulmonary Disease[J].Antioxidants&RedoxSignaling,2009,11(10):2505-2516.DOI:10.1089/ARS.2009.2599.
[25] Bowler R P,Nicks M,Tran K,etal.Extracellular Superoxide Dismutase Attenuates Lipopolysaccharide-induced Neutrophilic Inflammation[J].AmericanJournalofRespiratoryCellandMolecularBiology,2004,31(4):432-439.DOI:10.1165/rcmb.2004-0057OC.
[26] Lee I T,Yang C M.Inflammatory Signalings Involved in Airway and Pulmonary Diseases[J].MediatorsofInflammation,2013,2013:791231.DOI:10.1155/2013/791231.
[27] Biswas S K.Does the Interdependence Between Oxidative Stress and Inflammation Explain the Antioxidant Paradox?[J].OxidativeMedicineandCellularLongevity,2016,2016:5698931. DOI:10.1155/2016/5698931.
[28] Li J,Lan T,Zhang C,etal.Reciprocal Activation Between IL-6/STAT3 and NOX4/Akt Signalings Promotes Proliferation and Survival of Non-small Cell Lung Cancer Cells[J].Oncotarget,2015,6(2):1031.DOI:10.18632/oncotarget.2671.
Toxic Effects of Fine Particulate Matter in Winter on Human Bronchial Epithelial Cells
SANG Nan,YUE Huifeng
(College of Environmental and Resource,Shanxi University,Taiyuan 030006,China)
As the main components of the haze in winter,fine particles (PM2.5) have been considered had a serious toxic effect on the human respiratory system.We collected PM2.5in a peri-urban residential site of Taiyuan and investigated the toxic effect induced by PM2.5. The results showed that PM2.5with lower diameter could enter and deposit in the BEAS-2B cells and affect the organelle structure,implying that PM2.5with lower diameter could pass through the membrane and act directly on the cells. The levels of reactive oxygen species (ROS) increased with the increase levels of PM2.5concentration,and reached the maximum at 30 μg/mL. Furthermore,the contents of superoxide dismutase (SOD) and glutathione peroxidase (GPX) decreased with the increase levels of PM2.5concentration. The content of SOD and GPXsignificantly decreased to 51.02% and 54.10% of the control at 30 μg/mL,respectively. Finally,the levels of IL-6 and IL-8 in the cell culture supernatant increased with the increase levels of PM2.5concentration,and the concentration of IL-6 and IL-8 reached 3.18 and 1.90 fold of that in the control group at 30 μg/mL,respectively. In conclusion,under the current PM2.5exposure conditions,PM2.5can cause oxidative stress and inflammatory response,and inhibit the expression of antioxidant enzymes in cells.
PM2.5;ROS;antioxidant enzyme;inflammation
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.03.029
2017-06-02;
2017-06-29
山西省青年三晋学者支持计划;山西省回国留学人员科研资助项目(2015-006)
桑楠(1973-),女,山西长治人,博士,教授,主要从事环境毒理学研究。E-mail:sangnan@sxu.edu.cn
X131.1
A
0253-2395(2017)03-0615-07

