近红外罗丹明荧光染料
郭炜,张洪星,刘景
(山西大学 化学化工学院,山西 太原 030006)
近红外罗丹明荧光染料
郭炜,张洪星,刘景
(山西大学 化学化工学院,山西 太原 030006)
由于近红外光(NIR,650~900 nm)深的组织穿透性、小的光损伤以及可避免生物自发荧光干扰的特点,以近红外光激发和发射为特征的近红外荧光染料的开发和应用一直以来是荧光染料和探针领域研究的热点。近年来,通过对传统罗丹明染料10-位O原子的杂原子取代,一系列光物理性质优良的近红外罗丹明类似物被相继开发,其中包括碳-罗丹明、硅(锗、锡)-罗丹明、磷-罗丹明、硫-罗丹明。这些染料不仅继承了传统罗丹明染料优良的光物理性质,而且将发射波长由罗丹明的可见区拓展到了近红外区域,因此在生物医学荧光影像领域显示了巨大的应用前景。文章简要综述了这些近红外罗丹明类似物荧光染料。
荧光染料;近红外;荧光探针;罗丹明
0 引言
2008年,下村修、沙尔菲、钱永健因发现并发展了绿色荧光蛋白,获得该年度诺贝尔化学奖,绿色荧光蛋白的发光标记使得科学家第一次观察到细胞内蛋白的定位、运动以及相互作用。2014年,诺贝尔化学奖授予了白兹格、赫尔、莫尔纳尔,以表彰他们在超分辨率荧光显微技术领域取得的成就,他们借助荧光染料分子,使得荧光显微成像的分辨率极限拓展到了纳米尺度。这些标志性的成就奠定了以非侵袭性和可视化为主要特征的荧光技术在生命科学研究中的重要地位。近十年来,随着生命科学的发展、荧光显微设备的进步以及各种生物兼容的荧光染料或探针分子的相继开发,荧光技术不仅在生命科学研究方面,而且在疾病诊断、药物筛选、外科手术等方面也发挥了越来越重要的作用。
荧光技术的基础和核心是荧光染料。考虑到摩尔吸光系数、荧光量子产率、发射波长、光稳定性等因素,近年来使用最为广泛的荧光染料主要包括罗丹明染料(Rhodamine)、荧光素染料(Fluorescein)、花菁类染料(Cyanine)、正氟硼二吡咯染料(Bodipy)、香豆素染料(Coumarin)、4-胺基-1,8-萘二甲酰亚胺染料(4-Amido-1,8-Naphthalimide)等。在这些染料中,罗丹明染料(图1)因其好的水溶性、高的荧光量子产率和摩尔消光系数、线粒体靶向等优点而备受关注。而且,由于其独特的螺环“开-关”性质,该类染料已成为构建各种荧光探针最为广泛的染料平台之一[1-3]。然而,大部分罗丹明衍生物的吸收和发射波长都小于600 nm,因此限制了其在组织及活体成像方面的应用。
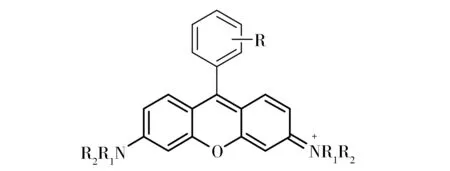
Fig.1 Chemical structures of rhodamine dyes图1 罗丹明染料的结构
近红外光(NIR,650~900 nm)具有强的组织穿透性、低的生物组织破坏性以及能避免生物系统自身背景荧光干扰等特点,因此开发荧光性能优良且稳定性好的NIR染料一直以来是荧光探针领域的重要课题。为把罗丹明染料的发射波长拓展到了更利于生物学研究的近红外区,获得波长更长的罗丹明类似物染料(Rhodmaine-Inspired Dyes),研究者已开展了一系列创新性研究工作。其中最通用的策略是通过扩大π-共轭体系来减小最高占有轨道(HOMO)和最低空轨道(LUMO)的能级差[4-8],然而这种方法存在一些缺陷,例如复杂的合成、大大增加的染料分子量、低的水溶性、低的荧光团亮度等。近年来,通过对传统罗丹明染料10-位O原子的单原子取代,一系列罗丹明类似物被相继开发,如碳-罗丹明、硅(锗、锡)-罗丹明、磷-罗丹明、硫-罗丹明。这些染料不仅继承了传统罗丹明染料优良的光物理性质,而且将发射波长由罗丹明的580 nm拓展到了近红外区域,因此在生物医学荧光影像领域显示了巨大的应用前景。本文简要综述了利用单原子取代罗丹明中心O原子的修饰方法开发的近红外罗丹明类似物荧光染料。
1 碳-罗丹明染料
1963年,英国赫尔大学的Aaron课题组首次报道了碳-罗丹明染料的合成[9]。随后,德国锡根大学的Drexhage课题组[10]以及西北大学杨秉勤课题组[11]对Aaron的方法进行了改进,开发了更优良的合成路线。与罗丹明染料相比,碳-罗丹明染料(图2)的吸收及发射波长红移约50 nm。在此基础上,结合增加芳香环或者固定氮端来扩大该染料的共轭体系以及引入卤素的修饰方法,可以把该染料的吸收和发射波长扩展到600~700 nm。碳-罗丹明目前已经作为化学生物学标记试剂在超分辨激光显微镜领域得到了应用[12]。然而,由于合成的复杂性,该类染料并没有得到广泛的应用,而且基于碳-罗丹明平台的荧光探针也鲜有报道[13-14]。
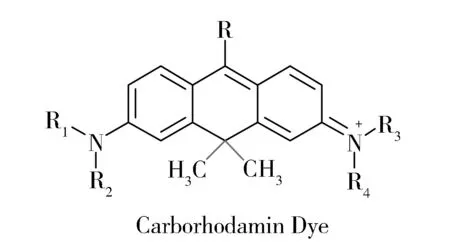
Fig.2 Chemical structures of Carborhodamin dyes图2 碳-罗丹明染料的结构
2 硅(锗、锡)-罗丹明染料
受硅杂环戊二烯(Siloles)的启发,2008年,华东理工大学钱旭红课题组用SiMe2替换吡啰红Y(Pyronine Y)染料中10位的O原子,报道了第一个硅-吡啰红染料(TMDHS)[15](图3)。仅通过一个原子的改变,TMDHS的最大发射波长就红移到了650 nm,并且具有高的荧光量子产率(CH2Cl2中φ=0.39,H2O中φ=0.18)。电化学实验表明,与吡啰红Y相比,TMDHS的HOMO轨道的能量增加0.14 eV,LUMO轨道的能量减小0.18 eV,即O原子被Si原子取代后同时影响了HOMO和LUMO轨道的能量,总的结果是使二者的能量差减小,最终导致发射波长红移。作者将该染料的LUMO轨道能量的降低归因于SiMe2基团与邻近芳环之间的激发态σ*- π*共轭,将HOMO轨道能量升高归因于SiMe2基团的供电子效应。
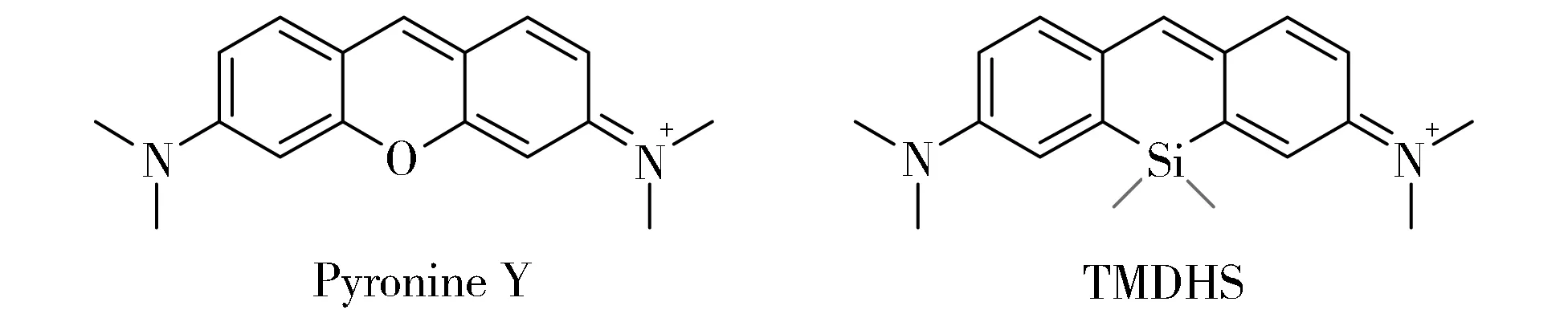
Fig.3 Chemical structures of Pyronine Y and TMDHS图3 Pyronine Y 和TMDHS的结构
由于TMDHS没有可修饰的反应位点,且9号位易受亲核试剂的进攻,该染料的实际影像应用受到一定限制。2011年,日本东京大学Nagano课题组报道了系列包含芳香取代基的硅-罗丹明染料(Si-Rhodamine,SiR)(图4)[16],芳香取代基的引入不仅大大增加了该类染料的化学稳定性,而且为基于该类染料的荧光探针的设计提供了修饰位点。不仅如此,该课题组也设计了Ge-吡啰红(GeP)和Sn-吡啰红(SnP)[16](图4),并发现SnP在DMSO缓冲体系或空气中不稳定,能分解成相应的呫吨酮。为此,该课题组在上述化合物的9号位嵌入2-甲基苯基得到对应的罗丹明类似物,即Ge-罗丹明(GeR)和Sn-罗丹明(SnR),并发现GeR可以稳定存在, SnR极易分解成类似孔雀石绿的化合物。与TMDHS和SiR相似,GeR的吸收和发射波长极大地红移到远红外到近红外区,并且继承了罗丹明染料的优良性质,如高的荧光量子产率(水中φ=0.34)、好的光稳定性和水溶性。重要的是与大部分远红外到近红外荧光染料相比,SiR和GeR的荧光可以通过光诱导电子转移(PET)机理进行调控。作者已经用PET机理设计了基于SiR的近红外pH、Zn2+[16]和Ca2+荧光探针[17]。采用相似的策略,该课题组也开发了硅-荧光素染料平台[18]。随后,基于硅-荧光素染料平台的荧光探针被报道[19]。

Fig.4 Comparison of the classical rhodamine dyes with Si/Ge/Sn NIR dyes图4 Si/Ge/Sn近红外染料与传统罗丹明染料的对比
从组织穿透性和生物背景自发荧光角度考虑,700 nm和800 nm是最适合生物影像的两个发射窗口。因此,Nagano课题组进一步通过在硅杂蒽环的N端引入不同的烷基,开发了系列发射波长更长的硅-罗丹明近红外荧光染料(SiR-NIRs),即SiR680、SiR700和SiR720[20](图5)。与常用的近红外荧光标记物Cy5.5(φ=0.23)相比,SiR680和SiR700具有相对高的荧光量子产率(荧光量子产率分别为0.35和0.12)和优良的光稳定性,因此更加适合进一步的生物影像应用。其中,用SiR-700标记的抗体已用于影像肿瘤老鼠。
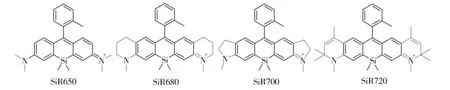
Fig.5 Chemical structures of SiR650, SiR680, SiR700 and SiR720图5 SiR650、SiR680、SiR700和SiR720的结构
3 磷-罗丹明染料
受磷原子独特的几何结构以及电子特性的启发,2015年,上海第二军医大学汪亭课题组用磷原子替换罗丹明染料中10号位的O原子,开发了一系列磷-罗丹明染料(PRs)[21](图6),并将发射波长扩展到了700 nm。PRs染料不仅具有摩尔消光系数大、荧光量子产率高等优良的光物理性质,而且具有水溶性好、光稳定性强、细胞毒性低等特点,因此显示了大的应用前景。与硅-罗丹明相似,作者将磷-罗丹明发射波长的红移归结于磷原子与邻近芳环之间的激发态σ*- π*共轭。2016年,内布拉斯加大学林肯分校Cliff I. Stains课题组用亚磷酸盐及其对应的乙酯替换罗丹明氧杂蒽的桥连O原子,开发了四个新型的近红外荧光染料(NRs)[22],即NR666,NR700,NR698和NR744(图6)。NR666和NR700在水溶液中的吸收及发射波长都在近红外区,NR666的亮度是四甲基罗丹明染料的1.3倍。虽然NR666的激发和发射光谱与NR700相比发生34 nm的蓝移,但是在持续1个小时的光照下仍然表现很强的稳定性,而NR700在光照下会缓慢水解为NR666。这些结果表明,亚磷酸乙酯的引入可为该染料提供一个额外的反应位点来调控染料的光物理性质及光谱性质。该课题组进一步把上述染料的N端替换成久洛尼定基团(Julolidine)得到NR698和NR744,这两个染料的激发和发射波长都大于700 nm,并且保持了母体结构的稳定性。作者也将NR666染料进一步开发并构建了HClO荧光探针[22]。
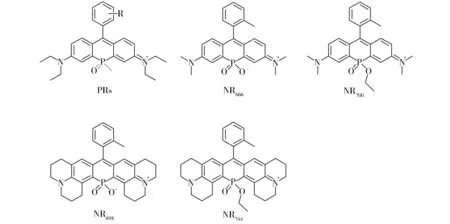
Fig.6 Chemical Structures of PRs and NRs图6 PRs和NRs的结构
4 硫-罗丹明染料
孔雀石绿(MG)染料与罗丹明染料有相似的化学结构(图7),最大吸收波长约为620 nm, 但是由于存在C=C异构化导致的非辐射跃迁过程,该类染料是非荧光的。然而,当MG插入到RNA沟槽或蛋白质中时,C=C异构化得到抑制,荧光得到恢复,发射波长约为650 nm。实际上,罗丹明、碳-罗丹明、硅-罗丹明和磷-罗丹明均可看做是构象锁定的MG染料,因此这些染料发射强荧光。然而,碳-罗丹明、硅-罗丹明和磷-罗丹明的发射波长却远大于罗丹明。通过与罗丹明染料发射波长的比较,之前的研究把硅-罗丹明和磷-罗丹明发射波长红移的原因归结于桥连的硅/磷原子与邻近芳环之间的激发态σ*- π*相互作用。然而,该理论不能解释为什么插入到RNA沟槽或蛋白质中的MG染料不存在σ*- π*相互作用但也具有近红外的发射波长。本课题组以MG作为对比染料,通过理论计算提出了不同的解释[23]:在罗丹明染料中,O原子的吸电子诱导效应能降低HOMO轨道的能量,共轭给电子效应能提高LUMO轨道的能量,从而导致HOMO-LUMO能量间隙增大,因此罗丹明染料的发射波长远小于MG染料;在碳-罗丹明染料中,C原子的诱导或共轭效应都比较弱,对HOMO和LUMO轨道的能量影响较小,因此碳-罗丹明具有与MG相似的发射波长;在硅-罗丹明染料中,Si原子诱导的供电子性能较C原子略强,能提高HOMO水平,其与邻近芳环发生的激发态d*- π*相互作用能降低LUMO水平,因此硅-罗丹明染料具有比MG略长的发射波长;同理,采用d*- π*相互作用并结合P=O基团强的吸电子效应也能合理地解释磷-罗丹明发射波长的红移。在该理论的指导下,本课题组合成了一系列砜基团(—SO2—)桥连的“硫-罗丹明”染料(SO2Rs)(图7),以期待通过砜基团中S原子与邻近芳环发生的d*- π*相互作用以及该基团强的吸电子效应来降低HOMO-LUMO能量间隙,从而扩大激发和发射波长。实验表明,该系列染料的激发和发射最大波长位于近红外区,分别为710 nm和740 nm左右,远远大于罗丹明染料,甚至比碳-罗丹明、硅-罗丹明还要红移80~100 nm,比磷-罗丹明红移20~30 nm;而且,由于强吸电子的砜基团有效地降低了体系的π电子密度,该系列染料具有强的抗光漂白性质。预计该系列染料将在活体影像及超分辨影像领域有潜在的应用价值。
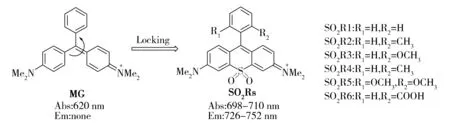
Fig.7 Chemical structures of SO2RS dye series图7 SO2RS染料的化学结构
5 结论
本文综述了近年来基于单原子取代策略发展的碳-罗丹明、硅(锗、锡)-罗丹明、磷-罗丹明、硫-罗丹明近红外荧光染料。这些染料的化学稳定性和光稳定性强,摩尔吸光系数大,荧光量子产率高,且具有近红外的激发和发射波长。这些创新性的研究成果为近红外荧光染料及其探针的发展奠定了重要基础。
[1] Dujols V,Ford F,Czarnik A W.A Long-Wavelength Fluorescent Chemodosimeter Selective for Cu(Ⅱ) Ion in Water[J].JAmChemSoc,1997,119:7386-7387.DOI:10.1021/ja971221g.
[2] Kim H N,Lee M H,Kim H J,etal.A New Trend in Rhodamine-based Chemosensors:Application of Spirolactam Ring-Opening to Sensing Ions[J].ChemSocRev,2008,37:1465-1472.DOI:10.1039/B802497A.
[3] Beija M,Carlos A M A,Martinho J M G.Synthesis and Applications of Rhodamine Derivatives as Fluorescent Probes[J].ChemSocRev,2009,38:2410-2433.DOI:10.1039/B901612K.
[4] Liu J X,Diwu Z J,Leung W Y.Rational Design and Synthesis of a Novel Class of Highly Fluorescent Rhodamine Dyes that Have Strong Absorption at Long Wavelengths[J].TetrahedronLett,2003,V44:4355-4359.DOI:10.1016/S0040-4039(03)00938-9.
[5] Shi J,Zhang X P,Neckers D C.Xanthenes:Flourone Derivatives Ⅱ[J].TetrahedronLett,1993,V34:6013-6016.DOI:10.1016/S0040-4039(00)61715-X.
[6] Yuan L,Lin W Y,Yang Y T,etal.A Unique Class of Near-Infrared Functional Fluorescent Dyes with Carboxylic-Acid-Modulated Fluorescence ON/OFF Switching:Rational Design, Synthesis,Optical Properties,Theoretical Calculations,and Applications for Fluorescence Imaging in Living Animals[J].JAmChemSoc,2012,134:1200-1211.DOI:10.1021/ja209292b.
[7] Chen J H,Liu W M,Zhou B J,etal.Coumarin-and Rhodamine-Fused Deep Red Fluorescent Dyes:Synthesis,Photophysical Properties,and Bioimaging in Vitro[J].JOrgChem,2013,78:6121-6130.DOI:10.1021/jo400783x.
[8] Niu G L,Liu W M,Wu J S,etal.Aminobenzofuran-Fused Rhodamine Dyes (AFR dyes) with Deep-Red to Near-infrared (NIR) Emission for Biological Applications[J].JOrgChem,2015,80:3170-3175.DOI:10.1021/acs.joc.5b00077.
[9] Aaron C,Barke C C.Steric Effects in Di-and Tri-arylmethanes. Part Ⅷ.Electronic Absorption Spectra of Planar Derivatives of Michler’s Hydrol Blue[J].JChemSoc,1963,V5:2655-2662.DOI:10.1039/JR9630002655.
[10] Arden-Jaeob J,Frantzeskos J,Kemnitzer N U.New Fluorescent Markers for the Red Region[J].SpectrochimActaA,2001,57:2271-2283.DOI:10.1016/S1386-1425(01)00476-0.
[11] Gu L J,Yang B Q,Liu F L.Efficent Synthetic Route to Carbopyronine Fluorescent Dye Intermediate[J].ChinJChem,2009,27:1199-1201.DOI:10.1002/cjoc.200990202.
[12] Sednev M V,Wurm C A,Belov V N,etal.Carborhodol:A New Hybrid Fluorophore Obtained by Combination of Fluorescein and Carbopyronine Dye Cores[J].BioconjugateChem,2013,24:690-700.DOI:10.1021/bc3006732.
[13] Grimm J B,Sung A J,Legant W R,etal.Carbofluoresceins and Carborhodamines as Scaffolds for High Contrast Fluorogenic Probes[J].ACSChemBiol,2013,8:1303-1310.DOI:10.1021/cb4000822.
[14] Grimm J B,Gruber T D,Ortiz G L,etal.Virginia Orange:A Versatile,Red-Shifted Fluorescein Scaffold for Single-and Dual-Input Fluorogenic Probes[J].BioconjugateChem,2016,27:474-480.DOI:10.1021/acs.bioconjchem.5b00566.
[15] Fu M Y,Xiao Y,Qian X H,etal.A Design Concept of Long-Wavelength Fluorescent Analogs of Rhodamine Dyes:Replacement of Oxygen with Silicon Atom[J].ChemCommun,2008,52:1780-1782.DOI:10.1039/B718544H.
[16] Koide Y,Urano Y,Hanaoka K,etal.Evolution of Group 14 Rhodamines as Platforms for Near-Infrared Fluorescence Probes Utilizing Photoinduced Electron Transfer[J].ACSChemBiol,2011,6:600-608.DOI:10.1021/cb1002416.
[17] Egawa T,Hanaoka K,Koide Y,etal.Development of a Far-Red to Near-Infrared Fluorescence Probe for Calcium Ion and its Application to Multicolor Neuronal Imaging[J].JAmChemSoc,2011,133:14157-14159.DOI:10.1021/ja205809h.
[18] Egawa T,Koide Y,Hanaoka K,etal.Development of a Fluorescein Analogue,TokyoMagenta,as a Novel Scaffold for Fluorescence Probes in Red Region[J].ChemCommun,2011,47:4162-4164.DOI:10.1039/c1cc00078k.
[19] Best Q A,Sattenapally N,Dyer D J,etal.pH-Dependent Si-Fluorescein Hypochlorous Acid Fluorescent Probe:Spiro-Cycle Ring Opening and Excess HOCl Induced Chlorination[J].JAmChemSoc,2013,135:13365-13370.DOI:10.1021/ja401426s.
[20] Koide Y,Urano Y,Hanaoka K,etal.Development of NIR Fluorescent Dyes Based on Si-rhodamine for In Vivo Imaging[J].JAmChemSoc,2012,134:5029-5031.DOI:10.1021/ja210375e.
[21] Chai X Y,Cui X Y,Wang B G,etal.Near-Infrared Phosphorus-Substituted Rhodamine with Emission Wavelength above 700 nm for Bioimaging[J].ChemEurJ,2015,21:16754-16758.DOI:10.1002/chem.201502921.
[22] Zhou X Q,Lai R,Beck J R,etal.Nebraska Red:A Phosphinate-Based Near-Infrared Fluorophore Scaffold for Chemical Biology Applications[J].ChemCommun,2016,52:12290-12293.DOI:10.1039/c6cc05717a.
[23] Liu J,Sun Y Q,Zhang H X,etal.Sulfone-Rhodamines:A New Class of Near-Infrared Fluorescent Dyes for Bioimaging[J].ACSApplMaterInterfaces,2016,8:22953-22962.DOI:10.1021/acsami.6b08338.
Advanced in Near-Infrared Rhodamine-Based Fluorescent Dyes Researches
GUO Wei,ZHANG Hongxing,LIU Jing
(School of Chemistry and Chemical Engineering, Shanxi University,Taiyuan 030006,China)
Fluorescent dyes that have excitation and emission wavelengths in the near-infrared region (NIR, 650~900 nm) are attractive for biological applications because of minimum photodamage to biological samples, deep tissue penetration, and minimum interference from the background autofluorescence of biomolecules in the living systems. In recent years, by replacing the 10-position O atom of Rhodamine dyes with C, Si, Ge, Sn, P or S atoms, researchers have developed a series of NIR fluorescent dyes, such as C-Rhodamine, Si(Ge,Sn)-Rhodamine, P-Rhodamine, and S-Rhodamine. These dyes not only inherit the remarkable photophysical properties of rhodamine dyes, but also have the excitation and emission wavelengths up to NIR region, thus holding great potentials for practical bioimaging applications. In this short review, these rhodamine-inspired NIR fluorescent dyes were introduced and discussed.
fluorescent dyes;near-infrared;fluorescent probes;rhodamine
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.03.025
2017-05-20;
2017-06-05
国家自然科学基金(21572121 ;21502108);山西省青年自然科学基金(201601D021055);山西省高等学校科技创新项目。
郭炜(1972-),男,山西人,博士,教授,研究领域为有机化学。E-mail:guow@sxu.edu.cn
O657
A
0253-2395(2017)03-0590-06

