锰氧化物/碳氮三维网络结构复合材料的制备及锂电性能
杨蓉 刘绪望 彭路明
(1中国工程物理研究院化工材料研究所,绵阳621000)(2南京大学化学化工学院,介观化学教育部重点实验室,南京210093)
锰氧化物/碳氮三维网络结构复合材料的制备及锂电性能
杨蓉*,1刘绪望1彭路明*,2
(1中国工程物理研究院化工材料研究所,绵阳621000)
(2南京大学化学化工学院,介观化学教育部重点实验室,南京210093)
通过硝酸锰和乙醇的水热反应在三聚氰胺泡棉(MF)上生成三氧化二锰颗粒,氮气下高温处理后形成锰氧化物负载碳氮三维网络结构的复合物。碳氮网络结构提高了充放电过程中材料结构的稳定性及导电性,且烧结过程中产生的孔道结构有利于锂离子传输,使得该复合材料作为负极在锂离子电池中表现出优异的充放电性能和循环稳定性。材料的比容量和循环稳定性大大提高,经500℃处理后的MnO/CNnws-500材料在160次循环后仍然保留590 mAh·g-1的比容量,达到氧化亚锰理论容量755 mAh·g-1的78%。
锰氧化物;三聚氰胺泡棉;碳氮三维网络;锂离子电池;负极材料
0 引言
金属氧化物作为锂离子电池负极材料的反应机理分为三类:即二氧化钛的脱嵌机理,二氧化锡的合金机理,以及铁氧化物、锰氧化物、钴氧化物的转化机理。过渡金属氧化物Fe2O3、Co3O4、MnO2等作为负极材料发生转化反应,相较于石墨类碳材料而言,通常具有更高的体积能量密度和质量密度,更容易实现大能量功率电源的要求,是非常具有发展前景的锂电负极材料,因此受到研究者的广泛关注[1-4]。锰氧化物因具有理论容量高且储量丰富、价格低廉、环境友好等商业化特质更是倍受青睐[5]。然而锰氧化物在充放电过程中与大多数过渡金属氧化物存在同样的问题[6-7]:(1)反应中涉及多种固相结构重组,巨大的体积膨胀导致结构坍塌,最终产生电极极化;(2)金属氧化物及其转化中间产物的电导率较低,易引发容量快速衰减,阻碍循环转化过程的进行,尤其在较高的倍率下难以实现可逆的充放电行为。上述问题的存在导致锰氧化物的实际应用受到了极大阻碍,因此对纯的锰氧化物进行改性处理来提高其电化学性能显得尤其重要。
常见的改善电极性能的方法一般是通过减小颗粒尺寸或者合成一些多孔通道缩短离子传输距离[8-9],或者是设计具有孔道结构的材料提高离子的传输能力[10],或通过碳包覆、石墨烯、碳纳米管复合等方式来提高材料导电性从而提高其电化学性能[11-13]。上述工作对锰氧化物的性能有所提升,但是大部分的合成过程较为复杂,制备工序要求较高,如何选用一种简单且实用的改性方法来制备锰氧化物的复合材料并有效改善其电化学性能是研究者们关注的方向。
Ji等[14]直接将市售MoO3材料在氨气氛围中进行简单地焙烧处理后,得到的MoO2.31N0.24化合物的电化学性能相比原纯相的MoO3材料有大幅度提升。而同样在氨气中一定温度区间处理高价态锰氧化物仅获得较低价态的锰氧化物,无法得到电化学性能提升的锰氧氮化合物。经研究发现,间接复合嵌氮的方法也有助于提高材料的电化学性能。Lu等[15]将嵌氮的碳均匀地覆盖在MnO表面,提高了复合材料的导电性,使MnO电化学性能提升;Liu等[16]通过嵌氮石墨烯和Fe3O4的简单复合来提高四氧化三铁的电化学性能,该材料在100次循环后还保留有约800 mAh·g-1的比容量。Li等[17]通过水热反应将TiO2与嵌氮石墨烯进行复合,得到的材料在0.1 A·g-1的电流密度下充放电,拥有首次放电369 mAh·g-1的比容量。陈旭等[18]的研究结果证明,通过石墨烯掺氮可以打开能带隙并调整导电类型,改变石墨烯的电子结构,提高石墨烯的自由载流子密度,从而提高石墨烯的导电性能和稳定性。因此,构建锰氧化物与嵌氮材料的复合物也同样可能通过改善导电性和结构的稳定性来提升其电化学性能。
然而,在确定对锰氧化物间接嵌氮的过程中,如何寻找一种更为简单且具有普适性的,能够扩展到其他过渡金属氧化物的改性方法仍然是个难题。不断的寻找和尝试中,我们发现,Liu等[19]利用三聚氰胺泡棉载体经过高温处理后,能直接掺入Co源水热得到Co3O4复合碳氮网络结构复合物。本文中采用简单的水热方法在三聚氰胺泡棉上生长三氧化二锰颗粒,再经过高温焙烧使三聚氰胺分解得到锰氧化物/碳氮三维网络结构的复合材料,将其作为锂离子电池负极材料进行了研究,发现在高温下处理后的复合材料具有较为优越的电化学性能。
1 实验部分
1.1 材料制备
取4 mL的硝酸锰溶液(50%水溶液,上海试四赫维化工有限公司)加入到含56 mL无水乙醇(分析纯)的100 mL烧杯中,磁力搅拌均匀后,将裁剪好的0.15 g约0.5 mm×0.5 mm×0.5 mm的三聚氰胺泡棉(河南濮阳绿宇泡棉有限公司)浸入到含硝酸锰的乙醇溶液中,接着将混合物转移至高压釜,于120℃水热反应4 h,自然冷却后在80℃下烘干12 h。称取烘干后的产物约0.3 g,在管式炉氮气氛围中400~600℃保温2 h,升温速率为5℃·min-1,N2的流速为20 mL·min-1,自然冷却后即得到系列复合材料。
1.2 材料表征
采用粉末X射线衍射仪(XRD,6000,岛津)对材料物相进行分析,在Cu Kα辐射(λ=0.154 18 nm)下操作,电压40 kV,电流40 mA,扫描范围10°~80°。场发射扫描电子显微镜及EDX能量散射谱(S-4800,Hitachi)用于观察复合材料处理前后的微观形貌及Mn、C、N元素的分布。C、N元素的含量使用元素分析仪进行测定(Elementar Vario MICRO),其测量误差不大于0.3%。采用红外光谱仪(NICOLET iS10,热电)对不同温度下烧结的样品进行测试,来了解三聚氰胺泡棉的分解情况。使用热分析仪(Pyris 1 DSC,PerKinElmer)对材料加热情况下的质量变化进行分析,操作条件为:氮气氛围,温度区间为20~700℃,升温速率为20℃·min-1。通过N2吸脱附实验来测试不同材料的比表面积,采用的仪器是Micromeritics ASAP-2000型比表面和孔径测试仪,测试条件为:300℃下活化2 h,液氮温度77 K。采用拉曼光谱仪(Optics Senterra R200-L,Bruker)来分析复合材料中碳的存在状态,操作条件为:Ar离子激光器为光源,激发光源波长为514.5 nm,功率为200 mW。利用光电子能谱仪(ESCALAB 250 X,Thermo)对Mn、C和N元素状态进行分析,选用的条件是:单色Al Kα辐射(hν=1 486.6 eV),加速功率为150 W。结合能通过调整C1s谱到284.5 eV进行校正,使用软件XPS Peak 4.1对Mn、C及N元素的XPS图谱进行分峰拟合。
1.3 极片制备及电化学性能测试
将制备的复合材料、粘结剂PVDF以及导电剂乙炔黑按质量比(7.5∶1.5∶1)混合均匀调制成粘稠的浆料,涂布在铜箔上,干燥后选用冲片机将大块极片冲压成直径为15 mm的圆形电极片。120℃真空干燥12 h后,称取极片的重量,按比例得到极片上的活性物质含量约为1.5 mg,干燥称量后迅速将极片放进Ar气手套箱中等待组装成电池。采用CR2032纽扣电池作为模拟电池,以上述极片作为工作电极,金属锂片作为对电极,电解液采用1 mol·L-1LiPF6的DMC(碳酸二甲酯)/EMC(碳酸甲乙酯)/EC(碳酸乙烯酯)(质量比为1∶1∶1)有机溶液(LB315)(国泰华荣化工新材料有限公司),Celgard 2300 PP/PE/PP三层微孔复合隔膜作为电池隔膜,以不锈钢垫片和弹簧片为电池填充物来增加极片与电池壳之间的接触,用封口机将电池封口。整个钮扣电池的组装过程均在氩气手套箱中完成,相关参数的控制通过手套箱设定(威格高纯气体设备科技有限公司,设定质量分数:Ar,>99.99%;H2O,<1×10-6;O2,<1×10-6)。
恒电流充放电测试采用Land-CT2001A型电池性能测试系统,电压范围为0.005~3 V之间。循环伏安测试采用电化学工作站CHI660D对扣式电池进行扫描,扫描速度为0.5 mV·s-1,电压范围为0.005~3 V之间。电化学交流阻抗谱(EIS)选用CHI660D电化学综合测试仪进行测试,操作条件为:振幅为5 mV,测试频率范围为0.01 Hz~100 KHz。
2 结果与讨论
2.1 复合材料的结构及形貌分析
将制备的材料进行XRD测试,测试结果如图1所示。经比对分析后得知,未经过高温处理直接水热得到的是Mn2O3(PDF#65-7467),而在400℃下氮气氛围处理2 h后,部分Mn2O3被还原,生成了Mn3O4(PDF#24-0734)和Mn2O3的混合相。在经过更高的500℃和600℃处理2 h后,Mn2O3全部被还原,得到了均相的MnO(PDF#07-0230)。经过XRD分析后将不同温度下处理得到的材料分别记为Mn2O3/MF、MnO1.3~1.5/CNnws-400(400℃下处理)、MnO/CNnws-500 (500℃下处理)及MnO/CNnws-600(600℃下处理)。

图1 不同温度下处理后得到的复合材料的XRD图Fig.1XRD patterns of the different composites after treatment under different temperature
选用SEM对不同处理条件下得到的材料的结构和表面形貌进行分析,结果如图2所示,分别为MF(a)、Mn2O3(b)、Mn2O3/MF(c)、MnO1.3~1.5/CNnws-400 (d)、MnO/CNnws-500(e)及MnO/CNnws-600(f),Mn2O3/ MF与MnO/CNnws-500高分辨SEM图见S1。从扫描电镜图片中可见,Mn2O3沿着三聚氰胺网络结构外表面生长,二者形成这种结构的原因是,硝酸锰和乙醇水热反应的过程中不仅生成Mn2O3,还会产生部分HNO3,三聚氰胺在酸化的条件下表面形成活性基团吸附锰离子,使Mn2O3沿着三聚氰胺网络结构表面生长,最终形成核壳结构的Mn2O3/MF。表面负载Mn2O3的三聚氰胺网络结构在400、500、600℃氮气氛围中烧结2 h后,内部三聚氰胺逐渐分解并还原Mn2O3,最后形成了含微纳米孔道的MnO管式结构。
采用EDX-Mapping对MF还未分解完全的MnO1.3~1.5/CNnws-400复合材料进行分析,来进一步了解三氧化二锰的生长方式及Mn、C、N元素的分布,结果如图3所示。从图3可以看到,中间的圆头部分主要为C和N元素,结合SEM确定此为未完全分解的三聚氰胺泡棉。Mn元素主要分布在外表面,C和N元素在高温处理后在外围也有少量的分布。经此分析证明了水热合成的复合材料确实是表面负载锰氧化物的三聚氰胺核壳结构。
采用氮气吸脱附实验来测试Mn2O3/MF和MnO/ CNnws-500的比表面积,所得结果如图4所示。经过计算得到图4a中Mn2O3/MF的比表面积为6 m2·g-1,而图4b中MnO/CNnws-500的比表面积为16 m2· g-1,比表面积有较大的提高,证明三聚氰胺泡棉除去的过程中产生了部分孔道,与SEM观测的结果一致。

图2 (a)三聚氰胺泡棉的SEM图;(b)直接水热生成的Mn2O3的SEM图;(c)Mn2O3/MF复合材料的SEM图;(d)MnO1.3~1.5/ CNnws-400复合材料的SEM图;(e)MnO/CNnws-500复合材料的SEM图;(f)MnO/CNnws-600复合材料的SEM图Fig.2(a)SEM of Pure MF;(b)SEM of Pure Mn2O3;(c)SEM of Mn2O3/MF composites;(d)SEM of MnO1.3~1.5/CNnws-400 composites; (e)SEM of MnO/CNnws-500 composites;(f)SEM of MnO/CNnws-600 composites

图3 MnO1.3~1.5/CNnws-400的SEM及元素Mn、C和N的Mapping图Fig.3SEM images and corresponding manganese,carbon and nitrogen elemental mapping of MnO1.3~1.5/CNnws-400
元素分析用于了解在不同温度处理后复合材料中碳氮元素的含量,测试结果如表1所示。未处理的复合材料中氮和碳元素的质量分数为7.61%和5.96%,经过400、500、600℃处理后,氮含量依次减小为2.58%、0.78%及0.34%。而碳的含量也随处理温度的升高而降低,分别为5.35%、4.34%及3.38%。
采用拉曼光谱对500℃下处理的MnO/CNnws-500样品进行测试,来分析样品中残留的碳的状态,所得结果如图5a所示。从图中可以明显的观测到碳的双峰D带(1 341 cm-1)和G带(1 593 cm-1),再次证明复合材料体系中含有碳元素。D带由无定型碳的石墨缺陷和无序诱导产生,G带归因于石墨晶格中碳环中的sp2原子对的拉伸运动,图5a中IG/ID的值大于1,证明石墨碳占主导,这有利于电子和离子传输过程[20]。利用红外来分析不同温度处理后的复合材料中三聚氰胺的分解情况,结果如图5b所示,未经高温处理的Mn2O3/MF在3 480、1 650和1 380 cm-1处有3个峰,分别代表了N-H键、C=N键和C-N键的吸收峰,证明了MF的存在。结合SEM进行分析,400和500℃处理2 h后MF基本分解完全,少量存在于内部无法探测,因此未出现以上3个峰。TG测试用于了解Mn2O3/MF中MF的含量,结果见图S2,如果忽略第一阶段水的蒸发量,则MF在复合物中的质量分数约为16%。
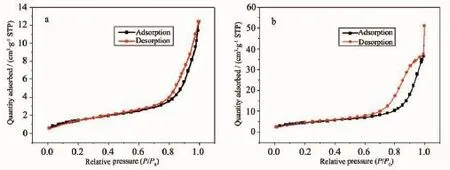
图4 (a)Mn2O3/MF的氮气吸/脱附曲线;(b)MnO/CNnws-500的氮气吸/脱附曲线Fig.4(a)Nitrogen abs/des profiles of Mn2O3/MF;(b)Nitrogen abs/des profiles of MnO/CNnws-500

表1 不同条件下处理得到的复合物的C、N元素含量的分析Table 1Element analysis of carbon and nitrogen of the composites under different treatment condition
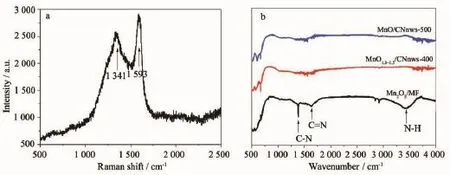
图5 (a)MnO/CNnws-500的拉曼光谱图;(b)不同条件下处理得到的复合材料的红外曲线Fig.5(a)Raman spectrum of MnO/CNnws-500;(b)FTIR spectrum of the composites under different treatment condition
采用光电子能谱(XPS)来进一步了解材料MnO/CNnws-500中的各元素的状态,所得结果如图6所示。在MnO/CNnws-500的XPS全谱图6a中,可以对应的找到C1s、N1s、O1s、Mn2p的峰,证明材料中的确存在C、N、O、Mn 4种元素。高分辨的Mn2p如图6b所示,根据Mn2p轨道之间的间隔为11.6 eV[21],面积比为2∶1,可分为641.3和652.9 eV 2个峰,分别对应Mn2+的2p3/2和2p1/2[22]。C的1s的谱图(图6c)经过分峰处理后可得到284.2、285.1、287.4 eV 3个峰,分别对应单质碳、C-N以及C=O。N的1s轨道(图6d)经过XPS Peak 4.1分峰处理后得到位于400.1、398.3、400.6 eV的3个峰,分别对应吡啶氮、吡咯氮和石墨氮[22],3种氮的结构如图S3所示[18]。
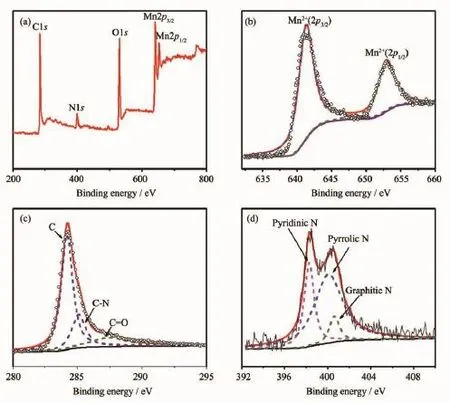
图6 (a)MnO/CNnws-500的XPS全谱;(b~d)MnO/CNnws-500的Mn2p、C1s、N1s的XPS图谱Fig.6(a)XPS spectrum of MnO/CNnws-500;(b~d)XPS spectrum of Mn2p,C1s and N1s of MnO/CNnws-500
2.2 复合材料的电化学性能分析
将Mn2O3/MF、MnO1.3~1.5/CNnws-400、MnO/CNnws-500、MnO/CNnws-600及Mn2O3分别制备成极片,并组装成电池进行电化学循环,测试结果如图7所示。可以发现100次循环后,材料的比容量保留值为:MnO/CNnws-500>MnO/CNnws-600>MnO1.3~1.5/CNnws-400>Mn2O3>Mn2O3/MF。结合材料的形貌及结构分析,推测MnO/CNnws-500和MnO/CNnws-600复合材料烧结后保留的适当的碳氮有利于提高导电性,且生成的管道结构有利于电荷传输,因此比容量高于含有部分未分解MF的MnO1.3~1.5/CNnws-400复合材料,而由于MF为非导电物质,所以Mn2O3的容量高于Mn2O3/MF。为了进一步证实孔道存在有利于电荷传输从而提高材料的比容量,将三聚氰胺泡棉先在500℃下处理,再加入硝酸锰水热反应得到混合均匀的复合材料Mn2O3/CNnws-500,与Mn2O3/MF的电化学性能进行比较,结果如图S4所示,事实证明先复合再烧结产生的孔道结构对材料的容量提升有帮助。
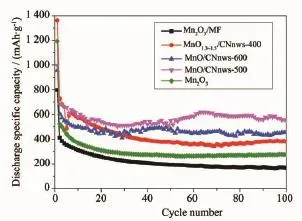
图7 经过不同处理得到的材料的循环性能的比较Fig.7Cycling performance comparison of materials under different treatment condition
接下来将材料MnO/CNnws-500组装为纽扣电池,并在0.005~3 V之间,电流密度100 mA·g-1下做充放电循环的测试,经过不同循环次数得到的充放电曲线如图8a所示。从图中可以看出,在第一次循环时,放电容量为961 mAh·g-1,充电容量为619 mAh·g-1,放电容量高于MnO材料的理论容量;第二次放电和充电容量分别为658和634 mAh·g-1;在第10次循环时仍保留有564 mAh·g-1的放电容量和581 mAh·g-1的充电容量;在第100次循环时充放电容量衰减至533与530 mAh·g-1,相比第二次而言,容量保持率高于80%。将材料MnO/CNnws-500组装为电池,在电化学工作站上设置电压范围为0.005~3 V(vs Li/Li+),扫描速率为0.5 mV·s-1,并进行循环伏安测试,测试结果如图8b所示。在放电过程中,前4次循环均只有1个还原峰位于0.2 V附近,这个峰主要是Mn2+还原为Mn0的峰,而充电过程中位于1.4 V左右的峰则为Mn0向Mn2+转化的氧化峰[17]。在电压范围0.005~3 V间,电流密度为100 mA·g-1时进行循环性能的测试,测试结果如下图8c所示。在首次循环中,放电容量为997 mAh· g-1,充电容量为642 mAh·g-1。第二次循环后,放充电容量分别为683和658 mAh·g-1,接下来的近30次循环中都有下降的趋势,这可能是由于部分MnO未及时参与转化反应或是表面逐渐形成的SEI(固体电解质中间相)阻碍锰的转化反应导致的。30次循环后容量呈缓慢上升的趋势,并最终稳定在600 mAh· g-1左右,可能源于吸附在活性物质表面的电解质发生降解产生的赝电容的贡献[28],到160次循环时,还保留有590和587 mAh·g-1的放电容量和充电容量,放电比容量相当于MnO材料理论容量的78%。结果证明MnO/CNnws-500复合材料的循环稳定性是比较好的。另一方面,除第一次的库伦效率较低为64%以外,其余库伦效率大部分都在100%左右,证明MnO/CNnws-500材料具有比较稳定的库伦效率。不同电流密度下的倍率性能测试结果如图8d所示,在0.1、0.5、1、2 A·g-1时的平均放电比容量分别为570、385、273、140 mAh·g-1,当回到0.1 A·g-1的时候,容量又反弹到549 mAh·g-1,证明复合材料具有较好的倍率性能。
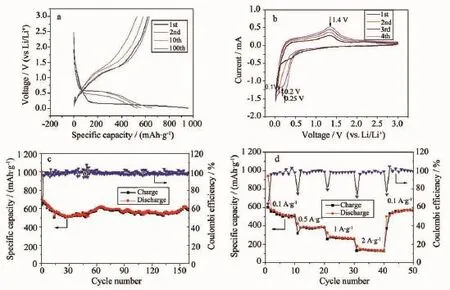
图8 (a)MnO/CNnws-500在第1、2、10、100次循环的充放电曲线;(b)MnO/CNnws-500在电压范围0.005~3 V(vs Li/Li+),扫描速度为0.5 mV·s-1下的循环伏安曲线;(c)MnO/CNnws-500在电压范围为0.005~3 V,电流密度为100 mA·g-1时材料的循环曲线;(d)MnO/CNnws-500在不同电流密度下的循环曲线Fig.8(a)Charge/discharge profiles of MnO/CNnws-500 at 1st,2nd,10th,100th cycle;(b)CV curves of MnO/CNnws-500 in the range of 0.005~3 V(vs Li/Li+)at a scan rate of 0.5 mV·s-1;(c)Cycling performance profile of MnO/CNnws-500 materials tested in the range of 0.005~3 V at a current density of 100 mA·g-1;(d)Cycling profile of MnO/CNnws-500 under different current density
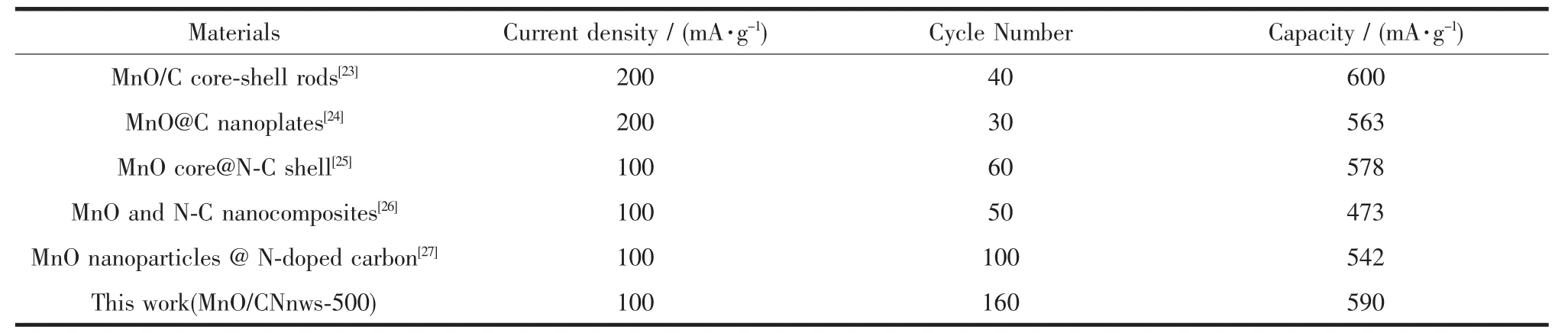
表2 不同MnO复合材料的电化学性能比较Table 2Comparison among different MnO composites
接下来,将我们的工作和已发表的工作进行了对比,结果如表2所示。综合表中的数据得到的结论是:无论是循环次数还是比容量,MnO/CNnws-500复合材料的电化学性能都有不同程度的提升。
为了进一步了解MF高温处理后的碳氮网络结构的引入对氧化亚锰电极发生转换反应的阻抗影响,将材料MnO/CNnws-500和水热生成的Mn2O3材料组装成为电池,并在不同循环次数后测试电化学阻抗谱,测试结果如图9(a,b)所示。从图中可以看到,所有曲线中均包含半圆和直线两部分。一般来说,中高频区域的半圆弧分别对应着电荷转移阻抗(Rct)和界面阻抗(Rf),而低频区域的直线则和锂离子在活性材料的扩散过程(Zw)有关。从图9a可以看出,经过一定循环次数的Mn2O3相比未循环阻抗较小,这说明循环后电荷转移阻抗和界面阻抗有所减小。同样的在图9b中MnO/CNnws-500材料也是遵循循环次数增多,阻抗变小的规律,这是因为电解质的逐渐浸润使得锂离子传输阻力减小。比较图9a和图9b,可以看到在同样的循环次数下,MnO/CNnws-500具有更小的半圆值,远小于Mn2O3的阻抗值。将市售MnO材料组装为电池测其阻抗曲线并与MnO/CNnws-500进行对比,结果如图S5所示,首次循环后阻抗值后者更小。这是因为MnO/CNnws-500相比较Mn2O3和MnO而言,具有电荷转移的孔道结构,更有利于Li+的传输,因此具有更高的比容量和更好的循环性能。
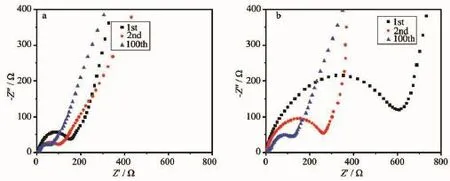
图9 MnO/CNnws-500(a)和Mn2O3(b)在不同循环次数后的阻抗曲线Fig.9ESI curves of MnO/CNnws-500(a)and Mn2O3(b)after different cycles
3 结论
本文采用先水热再高温处理的简单方法制备了锰氧化物复合碳氮三维网络结构的材料,并选用XRD、XPS和SEM等表征手段对材料的组成、结构及形貌进行了分析,将得到的复合材料作为负极组装为电池进行了电化学性能测试。测试的结果显示,将Mn2O3/MF在500℃下进行处理得到的MnO/ CNnws-500具有最优良的电化学循环性能和最高的容量,160次循环后还保留有590 mAh·g-1的放电容量,相比MnO的理论容量而言,达到78%的容量保持能力。这种高的比容量及良好的循环能力可能源于三聚氰胺分解后残留的碳氮具有良好的导电性,且在高温下处理后,形成了更多有利于电荷传输的孔道,因此提高了复合材料作为锂电负极的电化学性能。这种将锰氧化物和三聚氰胺泡棉通过水热复合再烧结即得到目标材料的简单方法,可以应用到其他过渡金属氧化物的改性上,以提高其作为锂离子电池负极材料的电化学性能。
Supporting information is available at http://www.wjhxxb.cn
[1]Poizot P,Laruelle S,Grugeon S,et al.Nature,2000,407: 496-499
[2]Wang B,Chen J S,Wu H B,et al.J.Am.Chem.Soc.,2011, 133:17146-17148
[3]Cheng F,Liang J,Tao Z,et al.Adv.Mater.,2011,23:1695-1715
[4]Gao J,Lowe M A,Abruna H D,et al.Chem.Mater.,2011,23:3223-3227
[5]Jiang H,Hu Y J,Guo S J,et al.ACS Nano,2014,8:6038-6046
[6]Guo S M,Lu G X,Qiu S,et al.Nano Energy,2014,9:41-49
[7]Reddy M V,Rao G V S,Chowdari B V R.Chem.Rev., 2013,113:5364-5457
[8]Jiao F,Bruce P G.Adv.Mater.,2007,19:657-660
[9]Xia Y,Xiao Z,Dou X,et al.ACS Nano,2013,7:7083-7092
[10]LIU Mei-Pin(刘美玭),HU Yu-Xiang(胡宇翔),DU Hong-Bin (杜红宾).Chinese J.Inorg.Chem.(无机化学学报),2015,31 (12):2425-2431
[11]LIU Xiao-Feng(刘晓峰),MI Chang-Huan(米常焕),ZHANG Wen-Qing(张文庆).Chinese J.Inorg.Chem.(无机化学学报),2014,30(2):242-250
[12]Luo W,Hu X L,Sun Y M,et al.ACS Appl.Mater.Interfaces, 2013,6:1997-2003
[13]JI Wen-Xu(纪文旭),WU Di(吴迪),YANG Rong(杨蓉), et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(4): 659-665
[14]Ji W X,Shen R,Yang R,et al.J.Mater.Chem.A,2014,2: 699-704
[15]Lu G X,Qiu S,Lv H L,et al.Electrochim.Acta,2014,146: 249-256
[16]Liu Y P,Huang K,Luo H,et al.RSC Adv.,2014,4:17653-17659
[17]Li Y M,Wang Z G,Lü X J.J.Mater.Chem.A,2014,2: 15473-15479
[18]CHEN Xu(陈旭),HE Da-Ping(何大平),MU Shi-Chun (木士春).Prog.Chem.(化学进展),2013,25(8):1292-1301
[19]Liu M M,He S J,Chen W.Nanoscale,2014,6:11769-11776 [20]Choi S,Jung D S,Choi J W.Nano Lett.,2014,14:7120-7125
[21]Strohmeier B R,Hercules D M.J.Phys.Chem.,1984,88: 4922-4929
[22]Aoki A.Jpn.J.Appl.Phys.,1976,15:305-311
[23]Sun B,Chen Z X,Kim H S,et al.J.Power Sources,2011, 196:3346-3349
[24]Zhang X,Xing Z,Wang L L,et al.J.Mater.Chem.,2012, 22:17864-17869
[25]Liu H,Li Z H,Liang Y R,et al.Carbon,2015,84:419-425
[26]Qiu S,Wang X Z,Lu G X,et al.Mater.Lett.,2014,136: 289-291
[27]Lu G X,Qiu S,Lü H L,et al.Electrochim.Acta,2014,146: 249-256
[28]Wu D,Yang R,Sun Q X,et al.Electrochim.Acta,2016, 211:832-841
Synthesis and Electrochemical Properties of Manganese Oxides/Carbon-Nitrogen Three-Dimensional Networks Composite as an Anode Material for Lithium Ion Batteries
YANG Rong*,1LIU Xu-Wang1PENG Lu-Ming*,2
(1China Academy of Engineering Physics,Institute of Chemical Materials,Mianyang,Sichuan 621000,China)
(2Department of Chemistry,Nanjing University,Key Laboratory of Mesoscopic Chemistry of MOE,Nanjing 210093,China)
Sesquioxide coated on melamine foams(MF)were prepared by hydrothermal method using manganese nitrate and ethanol.After calcinating the resulting material at different temperatures in N2atmosphere,manganese oxides loaded on C-N three-dimensional networks were obtained.Due to the presence of C-N networks,the structure stability and conductivity of the materials have been increased.The pores and channels generated during the calcination processes facilitate the lithium ions transportation.The composites present excellent charge/discharge ability and cycling stability as anode materials for lithium ion batteries.Therefore,the specific capacity and cycling stability have been greatly enhanced.can maintain a specific capacity of 590 mAh·g-1after 160 cycles which accounts for 78%of theoretical capacity(755 mAh·g-1)of manganese monoxide(MnO).
manganese oxide;melamine foams;C-N three-dimensional networks;lithium ion batteries;anode materials
O614.71+1
A
1001-4861(2017)02-0210-09
10.11862/CJIC.2017.025
2016-08-17。收修改稿日期:2016-10-21。
国家重大科学研究计划青年科学家专题(No.2013CB934800);国家自然科学基金(No.21222302)资助项目。*
。E-mail:yangrong@caep.cn,luming@nju.edu.cn;会员登记号:S06N8799M1204。

