复杂先心病术后远期同种移植物衰败的再手术治疗
鲍春荣 梅举 丁芳宝 张俊文 朱家全 张韫佼 马南
作者单位:200092 上海市,上海交通大学医学院附属新华医院心胸外科
临床研究
复杂先心病术后远期同种移植物衰败的再手术治疗
鲍春荣 梅举 丁芳宝 张俊文 朱家全 张韫佼 马南
作者单位:200092 上海市,上海交通大学医学院附属新华医院心胸外科
目的 回顾性总结复杂先心病术后远期同种异体移植物衰败再狭窄的手术方法和疗效。方法 2010年1月至2016年1月,同种异体主动脉重建肺动脉术后远期肺动脉再狭窄的手术治疗共23例,年龄13~31(20.6±4.7)岁,男性15例(65.2%)。病种包括右心室双出口+室间隔缺损+肺动脉狭窄11例,肺动脉闭锁/室间隔缺损6例,矫正性大动脉转位+室间隔缺损+肺动脉狭窄3例,永存动脉干3例。首次手术时均使用同种异体主动脉重建肺动脉,直径14~19(16.6±1.6)mm(其中4例不详)。本次手术前峰值肺动脉压力阶差 86~170(111.7±21.8)mm Hg,本次手术与前次手术的间隔时间为 12~19(15.0±2.3)年。术前通过心脏彩超和心脏及周围大血管CTA明确诊断。术中以涤纶人造血管(以牛心包缝制抗返流活瓣,开胸前缝制好)重建肺动脉,使用的人造血管直径 18~22(20.6±1.5)mm。体外循环时间 106~182(145.7±31.4)min,升主动脉阻断时间70~118(85.3±17.4)min。术后每6个月门诊随访一次,平均随访时间30(6~78)个月。结果 无死亡。术后并发症有纵隔感染1例(4.3%)、术后低心排综合征2例(8.7%)、呼吸机使用时间>72 h 4例(17.4%),均痊愈。无再次开胸止血。术后 ICU 时间 3~15(6.0±2.6)d,术后住院时间 7~30(13.7±4.8)d。术后复查心脏彩超峰值肺动脉压力阶差3~25(12.6±5.4)mm Hg。 随访中无死亡,肺动脉压力阶差无明显增加,无需要再手术患者。结论 对于同种异体主动脉重建肺动脉后远期肺动脉再狭窄患者,可采用带瓣人造血管再次重建肺动脉,手术安全可靠,早期疗效良好。
先天性心脏病; 肺动脉狭窄; 肺动脉闭锁; 同种异体主动脉; 再次手术
肺血流减少的复杂先天性心脏病多伴有不同程度的肺动脉狭窄或肺动脉闭锁,在进行手术矫治时,需要重建右心室-肺动脉连接。重建的材料主要有以下几种:人造血管、同种异体主动脉或肺动脉、牛颈静脉及带瓣人造血管等。这些重建材料各有其优缺点。同种异体(homograft)主动脉或肺动脉与自体肺动脉组织最为接近,而且带单向瓣膜,是优良的重建材料,但其最大的缺点是手术后远期钙化衰败导致瓣膜狭窄或关闭不全。现回顾性总结我院近年收治的同种主动脉重建肺动脉术后远期肺动脉再狭窄患者的手术结果,报道如下。
1 资料与方法
1.1 一般资料 2010年6月至2016年1月,23例患者接受了再次肺动脉重建手术,男性15例,女性 8 例,年龄 13~31(20.7±4.8)岁。其中右心室双出口+室间隔缺损+肺动脉狭窄11例,肺动脉闭锁/室间隔缺损6例,矫正性大动脉转位+室间隔缺损+肺动脉狭窄3例,永存动脉干3例。首次手术均为双心室矫治手术(Rastelli术),之前没有接受过姑息性手术。患者在早期一般情况均良好,于近1~2年出现胸闷、胸痛、乏力等症状。4例有发绀;2例无明显症状,于体检时发现明显的心脏杂音,来院复查后发现重度肺动脉狭窄。本次手术距离首次手术的时间为 12~19(15.0±2.3)年。本次手术前 NYHA 心功能Ⅰ级2例、Ⅱ级13例、Ⅲ级7例、Ⅳ级1例。
1.2 方法 通过心脏彩超检查和CT血管造影检查确诊。心脏彩超检查发现肺动脉重度狭窄,狭窄最严重位于肺动脉瓣处,肺动脉瓣均固定不动,肺动脉峰值压力阶差为 86~170(108.3±20.5)mm Hg(1 mm Hg=0.133 kPa)。心脏彩超检查发现有6例右心室双出口(DORV)患者同时存在中度以上的左心室流出道狭窄,峰值压力阶差为45~68 mm Hg;有6例卵圆孔未闭;6例三尖瓣轻到中度返流;1例有室缺残余分流。CT检查均发现原同种异体主动脉严重钙化,动脉瓣处钙化最为严重,造成严重的血流梗阻。有17例Homograft全长均严重钙化,6例钙化主要位于动脉瓣和Homograft近段,远段呈零散的钙化。钙化的Homograft有18例紧贴于胸骨后缘,5例紧贴于胸骨左缘的左侧胸壁。CT检查同时发现有6例DORV患者存在左心室流出道狭窄。见图1。患者一般资料见表1。
手术中首先游离股动静脉,直接肝素化股动静脉插管建立体外循环。考虑到钙化的Homograft与胸骨后缘紧密贴合,在体外循环下开胸。根据术前CT检查,锯开胸骨时避免直接锯断Homograft。胸骨锯开后首先游离上下腔静脉和主动脉,上腔静脉插管做上腔引流,上下腔静脉套阻断带阻断;然后游离钙化的Homograft,大部分患者的同种主动脉与胸骨或胸壁在分离时不可避免破裂,将其完整移除,随后阻断主动脉,心脏停跳下完成手术。为了缩短体外循环时间,在开胸前首先选择好合适口径的人造血管,取牛心包裁剪成近似主动脉瓣叶形状,缝合于人造血管内壁形成自制带瓣管道。对于有左心室流出道狭窄的病例,打开原室缺补片或经主动脉根部切开显露左心室流出道。本组5例患者均为DORV患者,流出道呈漏斗样肌性狭窄,冗余的心肌组织给予切除。有3例室缺上缘对流出道有一定影响,向后上缘扩大室缺,另取补片修补室缺。随后取之前缝制好的带瓣人造血管,重建肺动脉,近端为防止牵拉狭窄,另取一块牛心包扩大近端吻合口。有6例患者前次手术时保留了卵圆孔未闭,此次手术前有明显发绀,本次手术部分缝闭卵圆孔,保留约4 mm开放。为减少重建的肺动脉受压,打开两侧纵隔胸膜。总体外循环时间为106~182(145.7±31.4)min,升主动脉阻断时间为 70~118(85.3±17.4)min。
术后每6个月随访一次。第1次门诊随访复查心脏彩超和CTA,之后每6个月电话随访一次,每12个月门诊随访一次。
1.3 统计学方法 资料采用SPSS 17.0软件进行统计分析。计量资料用±s表示,计数资料用率(百分比)表示。
2 结果
所有患者均顺利完成手术,无手术后早期(术后30 d内和住院)死亡。术后并发症包括纵隔感染1例(4.3%)、术后低心排综合征 2例(8.7%)、呼吸机使用时间>72 h 4例(17.4%),经治疗后均痊愈出院。术后胸引量(包括心包纵隔引流和胸腔引流)11~32(18.3±4.8)ml/kg,无再次开胸止血。红细胞输注量 0~6(3.1±1.4)U。术后 ICU 时间 3~15(6.0±2.6)d,术后住院时间 7~30(13.7±4.8)d。术后出院前复查心脏彩超,峰值肺动脉压力阶差3~25(12.6±5.4)mm Hg。术后复查CT血管造影,可以看到重建的肺动脉形态良好,无受压成角,血流通畅无梗阻。见图2。无失访,随访6~78个月,平均随访时间30个月。随访中无患者死亡,肺动脉压力阶差无明显增加,无需要再手术患者。21例患者心功能状态均恢复到NYHAⅠ级。

表1 患者一般资料
3 讨论
同种异体移植物Homograft在过去几十年间一直是用于重建右心室-肺动脉连接的主要材料之一,特别对于婴幼儿,Homograft一直是最主要的肺动脉重建材料[1-3]。这种材料在术后早期有优异的血流动力学表现,但术后远期存在两方面的问题。第一,婴幼儿时期往往只能应用直径较小的移植物,随着患儿年龄、身高、体重的增加,不可避免地出现肺动脉再狭窄。第二,一部分年龄较大的儿童,即使使用的是接近成人直径的同种血管,但远期同种移植物钙化导致瓣膜狭窄伴关闭不全特别是瓣膜严重钙化导致肺动脉瓣重度狭窄仍有一定的发生率。文献报道,术后10年高达20%~40%的患者因为肺动脉再狭窄接受再手术治疗[3]。同种移植物钙化再狭窄的严重程度可能与年龄和移植物的种类有关[4]。婴幼儿、应用同种主动脉会导致更严重的钙化和再狭窄,大龄儿童和应用同种肺动脉程度相对较轻。但应用同种肺动脉重建右心室-肺动脉连接术后10年仍然有15%~20%的患者因为肺动脉再狭窄而再次手术[5],成人接受同种移植物重建肺动脉术后10年也有20%左右患者因为钙化衰败接受再次手术[6]。
本组所有病例均表现为同种血管瓣膜的严重钙化导致血流梗阻,可能与本组病例首次手术时均为幼儿和儿童(1~12岁)有关。另外,本组病例首次手术时使用的同种移植物直径偏小,供体多为青少年和儿童,这也导致动脉瓣的衰败主要表现为钙化狭窄[7,8]。来自青少年和儿童的同种血管可能会有更多的组织相容性抗原的表达和存在更多的活细胞而导致其更加容易钙化衰败[8]。有研究发现,应用供体年龄>30岁的同种移植物,同种血管的衰败明显好于使用供体年龄<30岁的患者[9]。
这些以同种血管重建了肺动脉的患者在第一次手术后的早期无症状,在肺动脉狭窄发展到重度之后部分患者出现胸闷、乏力和活动耐量下降,少数患者因卵圆孔处右向左分流出现明显发绀。关于再次接受手术的时机目前缺乏相关报道,特别是对于无症状的重度肺动脉再狭窄患者是否需要手术仍有争论。我们认为,对重度肺动脉再狭窄,不论症状如何应及时进行再次手术,经过充分准备制订手术计划,再次手术的风险可控,效果良好。本组患者无手术死亡,术后并发症发生率也较低。而对于心功能下降患者,及时手术有利于心功能恢复,提高生活质量和远期生存率。本组中有19例(90%)患者出现心脏功能下降,经及时手术后心功能均恢复到NYHAⅠ级。
手术方式的选择,同种移植物衰败如果表现为瓣膜的轻度钙化导致瓣膜狭窄伴关闭不全,可以选择经导管肺动脉瓣植入。但本组病例均为瓣膜重度钙化狭窄,无法进行介入治疗,手术方式只能选择再次开胸移除原同种血管并以人造血管重建肺动脉。手术中要特别注意避免开胸时导致钙化的同种移植物破裂大出血。术前应仔细阅读CT图像,弄清钙化血管与胸骨后贴合的位置,特别对于钙化血管直接贴合于胸骨后正中的患者,锯开胸骨时应略偏向右侧,防止直接锯破血管。本组所有患者钙化血管与胸骨或左侧胸壁均紧密粘连,无法在不破坏血管的情况下将其从胸壁上分离下来,因此均在股股转流体外循环下开胸。开胸后首先游离主动脉和上下腔静脉,上下腔静脉套带阻断后,破坏钙化的同种血管并将其移除。有时冠脉左主干与同种血管后壁距离较近,所以在移除钙化血管时要避免暴力牵拉,以防损伤冠状动脉。这些患者再次手术时植入了直径较粗的人造血管,手术时间较长,心肌水肿较重,有时关胸时人造血管有一定程度的受压,需要充分游离后将两侧纵隔胸膜完全打开以减轻压迫。本组患者在出院前复查肺动脉峰值压力阶差平均仅10 mm Hg左右,随访中压差也无增加,效果良好。考虑到持久性问题,本组均采用涤纶人造血管重建肺动脉,并在人造血管内壁用牛心包自制瓣膜以抗返流。随访中近期效果良好,未见右心室扩大和功能受损;远期效果有待于进一步随访评价远期即使出现肺动脉返流右心功能受损,也可以比较方便地经导管植入肺动脉瓣,解决肺动脉瓣返流的问题。
本研究是回顾性研究,而且病例数较少,亦缺少不同手术方法的比较,未来还需要收集更多的病例数,并继续长期随访。

图1 患者术前心脏彩超及CT图像
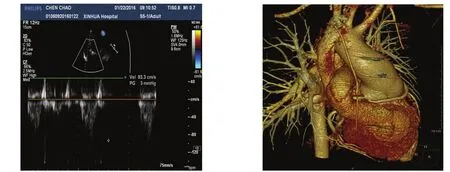
图2 术后患者心脏彩超和CT血管重建图像
[1]Ugaki S,Rutledge J,Al Aklabi M,et al.An increased incidence of conduit endocarditis in patients receiving bovine jugular vein grafts compared to cryopreserved homograft for right ventricular outflow reconstruction.Ann Thorac Surg,2015,99:140-146.
[2]Perri G,Polito A,Gandolfo F,et al.Outcome of Standard and Bicuspidalized Cryopreserved Homografts for Primary Right VentricularOutflow TractReconstruction.J HeartValve Dis 2015,24:83-88.
[3]Skoglund K,Eriksson P,Svensson G,et al.Homograft reconstruction of the right ventricular outflow tract in adults with congenital heart disease:a systematic review.Interact Cardiovasc Thorac Surg,2016,22:57-62.
[4]Sandica E,Boethig D,Blanz U,et al.Bovine Jugular Veins versus Homografts in the Pulmonary Position:An Analysis across Two Centers and 711 Patients-Conventional Comparisons and Time Status Graphs as a New Approach.Thorac Cardiovasc Surg,2016,64:25-35.
[5]Vitanova K,Cleuziou J,Horer J,et al.Which type of conduit to choose for right ventricular outflow tract reconstruction in patients below 1 year of age?Eur J Cardiothorac Surg,2014,46:961-966.
[6]Nordmeyer J,Tsang V,Gaudin R,et al.Quantitative assessment of homograft function 1 year after insertion into the pulmonary position:impact of in situ homograft geometry on valve competence.Eur Heart J,2009,30:2147-2154.
[7]Horer J,Hanke T,Stierle U,et al.Homograft performance in children after the Ross operation.Ann Thorac Surg,2009,88:609-615.
[8]Kalfa D,Macé L,Metras D,et al.How to choose the best available homograft to reconstruct the right ventricular outflow tract.J Thorac Cardiovasc Surg,2011,142:950:953.
[9]Kalfa DM,Loundou A,Nouaille de Gorce Y,et al.Pulmonary position cryopreserved homograft in non-Ross patients:how to improve the results?Eur J Cardiothorac Surg,2012,42:981-987.
Re-operation for homograft failure long-term after surgical treatment of complicated congenital heart disease
BAO Chun-rong,MEI Ju,DING Fang-bao,et al.Department of Cardiothoracic Surgery,Xinhua Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200092,China
MEI Ju,E-mail:ju_mei63@126.com
ObjectiveRetrospectively summarize our experiences about the re-operation method and outcomes for homograft failure and pulmonary stenosis long-term after surgical treatment of complicated congenital heart disease.MethodsFrom Jan 2010 to Jan 2016,23 patients with severe pulmonary stenosis after pulmonaryartery reconstruction with aortic homograft were treated in our institution.The patients were aged from 13-31(20.6±4.7)years.There were 15 males and 8 females.The diagnosis included DORV+VSD+PS (11 cases),PA/VSD(6 cases),cc-TGA+VSD+PS(3 cases) and persistent truncus arteriosus(3 case).In their first operation,aortic homografts were used to reconstruct the pulmonary artery with diameter of 14-19(16.6±1.6)mm(4 unknown).Before the re-operation,the pulmonary artery peak gradient of pressure was 86-170(111.7±21.8)mm Hg.The time interval between first operation and re-operation was 12-19(15.0±2.3)years.A definite diagnosis was made by echocardiography and CT angiography.In operation,a hand-made Dacron vascular graft with valves(bovine pericardium stitched onto the inner wall of the vascular prosthesis before chest open)was used to reconstruct pulmonary artery.The diameter of vascular graft was 18-22(20.6±1.5)mm.The total CPB time was 106-182(145.7±31.4)min.The aortic clamp time was 70-118(85.3±17.4)min.All patients were followed-up every 6 month.The average followup time was 30 months,ranged from 6 to 78 months.ResultsNo patient died after surgery.Surgical morbidities included low cardiac output syndrome(2 cases),sternum infectious(1 case) and prolonged mechanical ventilating time(more than 72 hours)(3 cases).No patient need bleeding reopen.Postoperative ICU stay time was 3-15(6.0±2.6)days.Postoperative hospital stay time was 7-30(13.7±4.8)days.Pulmonary artery peak gradient of pressure decreased to 3-25(12.6±5.4)mm Hg before discharged and remained stable during follow-up.No patient need re-intervening and no patient die during follow-up.ConclusionThe pulmonary artery calcified stenosis long-term after reconstruction with aortic homograft can be repaired using a vascular graft with hand-made‘valve’.This surgery is safe and reliable and the short-term outcome of these patients is good.
Congenital heart disease; Pulmonary stenosis; Pulmonary atresia; Aortic homograft;Redo operation
梅举,E-mail:ju_mei63@126.com
10.3969/j.issn.1672-5301.2017.03.006
R654.2
B
1672-5301(2017)03-0212-05
2016-08-30)

