花生衣中原花青素及多酚物质含量分析研究
裴云逸,陆星星,武翠芳,徐艳飞
(云南省玉溪农业职业技术学院,云南玉溪653106)
花生衣中原花青素及多酚物质含量分析研究
裴云逸,陆星星,武翠芳,徐艳飞
(云南省玉溪农业职业技术学院,云南玉溪653106)
研究用香草醛-盐酸法测定花生衣中原花青素含量以及用紫外法测定多酚物质含量的方法。对香草醛-盐酸法测定花生衣中原花青素含量的方法进行因素研究,在25℃以下温度的“6 mL5%香草醛-乙醇溶液+3 mL浓盐酸”体系中加入0.5 mL反应液,以499 nm为测定波长,以吸光值相对稳定时间为显色时间,测得白、红两种花生衣中原花青素含量差异不大,同时以紫外法测得两种花生衣多酚物质含量也差异不大。试验比较了几种花生衣中原花青素含量与多酚物质含量,结果表明花生衣中多酚物质主要成分是原花青素类物质。
花生衣;原花青素;多酚物质
花生除了用于压榨花生油外,还是我们饭桌上经常直接食用的食品。人们经常直接生吃,或者煮吃、炒吃、油炸吃等。花生同时也是营养保健食品,在我国被称为“十大长寿食品”之一,花生仁的蛋白质和脂肪含量极高。人们对于花生的喜爱还因为花生衣色素中含有多种具有生物活性的多酚类物质,尤其是抗氧化性极强的原花青素与白藜芦醇。
目前对花生衣色素的研究大多数集中在色素的提取技术和抗氧化性研究方面,而不同颜色花生衣中多酚物质含量以及原花青素含量分析方面的研究较少。对原花青素的研究大多数集中在葡萄籽原花青素方面。根据已报道研究[1-2],花生衣原花青素中包含有大量具有生物活性价值的低聚体。
植物中原花青素总含量的测定常用香草醛法、正丁醇-盐酸法、铁盐催化比色法等。其中香草醛法的原理基于酚醛缩合反应[3-4],在酸的催化作用下,含间苯二酚或间苯三酚的化合物与芳香醛类物质发生缩合反应而生成有色正碳离子,儿茶素、表儿茶素类单体及其聚合体PC(原花青素)含有间苯三酚结构,在酸的催化作用下可与香草醛发生缩合反应,生成产物颜色与浓度在一定范围成正比关系。已报道对香草醛-盐酸法测定原花青素含量的研究中,香草醛浓度与盐酸用量多不一致,显色反应时间也有较大差异。本文借鉴已报道香草醛-盐酸法测定原花青素的研究[5-7],通过试验研究确立了香草醛-盐酸法测定花生衣中原花青素含量的方法。采用紫外法分析了花生衣中包括原花青素类物质以及其他酚类物质的总多酚物质的含量。
1 材料与方法
1.1 材料与试剂
白、红花生:本地超市或农贸市场购买;原花青素对照品(UV≥95%):上海金穗生物科技有限公司;无水乙醇:天津风船化学试剂;香草醛:国药集团化学试剂有限公司;浓盐酸:广东西陇化工;超纯水:玉溪农业职业技术学院实验室自制。
1.2 仪器设备
JL-180DT超声波清洗器:上海吉理超声仪器有限公司;UV2550紫外可见分光光度计:岛津仪器(苏州有限公司);BT124S电子天平、BT2202S电子天平:北京赛多利斯仪器有限公司;CX-301家用多功能料理机:中山市九阳小家电有限公司。
1.3 方法
1.3.1 花生衣原花青素及多酚物质的提取
称取花生衣粉2.000 g于100 mL容量瓶中,按照已研究方法[8]用80 mL60%的乙醇溶液在55℃下超声波提取20 min,冷却后定容至100 mL,用中速定量滤纸过滤,所得样液用于原花青素及多酚物质含量分析,其中用于多酚物质含量分析时样液需稀释。
1.3.2 香草醛-盐酸法测定花生衣原花青素
1.3.2.1 显色反应最大吸收波长的确定
以60%乙醇配制0.05 mg/mL~1.00 mg/mL的原花青素的对照品溶液,选取其中一浓度的对照品溶液,参考已报道文献[9-10],采用“6 mL4%香草醛-乙醇溶液+1 mL浓盐酸+0.50 mL对照品溶液”的方式反应5 min以上,同时以“6 mL4%香草醛-乙醇溶液+1 mL浓盐酸+0.50 mL60%乙醇”体系为对照,用UV2550进行光谱扫描。对花生衣提取液同法试验,确定最大吸收波长。
1.3.2.2 显色反应温度控制,反应时间、浓盐酸用量及香草醛浓度选择
根据报道[11]当反应温度较高时吸光值随温度以及时间变化均有较大幅度降低,但当温度低于25℃时,反应产物吸光值随着时间变化比较稳定,因此反应温度应控制在25℃以下。试验中由于浓盐酸在加入过程中放热,因此先配制“香草醛-盐酸”体系,待冷却后再进行显色反应。本文将“香草醛-盐酸”体系放入冰水中摇匀迅速冷却至25℃以下,再加入反应液,每组反应液与对照组的“香草醛-盐酸”体系同时配制。
在2份冷却至25℃以下的“6 mL4%香草醛-乙醇溶液+1 mL浓盐酸”体系中分别加入0.5 mL原花青素对照品溶液及0.5 mL60%乙醇,摇匀,在最大吸收波长下进行反应时间与吸光值的动力学扫描,再以花生衣提取液同法试验,确定合适反应时间。
依次以含 1.50、2.00、2.50、3.00、3.50 mL 浓盐酸与6 mL4%香草醛的反应体系试验,反应液选择0.5 mL及1.0 mL对比,比较不同盐酸用量下吸光值的变化。
依次以含 6 mL3%、4%、5%、6%、7%、8%的香草醛与试验已确定的浓盐酸用量的体系实验,反应液同样选择0.5 mL及1.0 mL对比,比较不同香草醛浓度下吸光值的变化。
1.3.2.3 标准曲线的绘制
取原花青素对照品20 mg,用60%的乙醇配成1 mg/mL的标准储备液20 mL,取储备液用60%的乙醇配制成 0.050 0、0.100 0、0.200 0、0.300 0、0.400 0、0.500 0 mg/mL的原花青素标准系列溶液,以“1.3.2.2”试验所得适合“香草醛-盐酸”体系与0.5 mL不同浓度标准溶液依次反应,绘制499 nm下浓度与吸光值的标准曲线。
1.3.2.4 精密度及回收率试验
对本地白花生衣提取液进行5次显色反应试验,计算方法的精密度。取白、红花生衣提取样液的混合液2 mL,加入一定浓度原花青素对照品溶液2 mL,分别对混合样液、原花青素对照品溶液及二者的混合液进行显色反应,计算方法的回收率。
1.3.2.5 白、红花生衣中原花青素含量的测定
分别取白、红花生衣提取液进行显色反应,测定其吸光值,根据标准曲线所显示浓度计算含量。
1.3.3 紫外法测定花生衣多酚物质含量
1.3.3.1 测定方法
根据花生衣多酚物质及原花青素的60%乙醇溶液在280 nm波长下均有特征吸收峰[8],将原花青素对照品用 60%乙醇配制成 0.010 0、0.020 0、0.050 0、0.100 0、0.150 0、0.200 0、0.250 0、0.300 0 mg/mL 的系列溶液,制作280 nm波长下标准曲线。以此为对照测定花生衣多酚物质浓度。
1.3.3.2 方法回收率试验
取提取液(本地白花生衣)的稀释样液2 mL,再加入一定浓度原花青素对照品溶液2 mL。分别测定稀释样液、加入的原花青素对照品溶液以及二者混合液的浓度,计算方法的回收率。
2 结果与分析
2.1 香草醛-盐酸法试验结果
2.1.1 显色反应最大吸收波长选择
通过对显色反应光谱吸收图像进行峰值检测见图1。
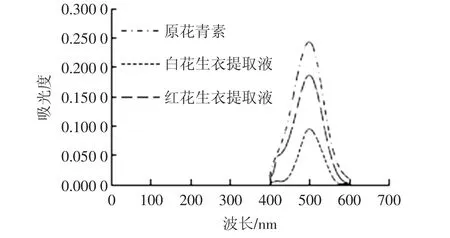
图1 原花青素、花生衣提取液的显色反应光谱图Fig.1 Color reaction spectrum graph of proanthocyanidin and peanut skin extract
白花生衣提取液在499 nm处,红花生衣提取液在499nm与500 nm处,原花青素对照品在500 nm处有最大吸收峰,所以测定波长选择499 nm或500 nm均可,这里选择499 nm。
2.1.2 反应时间的选择
由吸光值的动力学扫描时间曲线见图2。

图2 显色反应吸光值随时间变化曲线Fig.2 Absorption curve of color reaction with time
由图2可见,显色反应吸光值随时间具有以下特点:当产物吸光值<0.2时,吸光值先随时间逐渐有所增大,然后再随时间逐渐减小,吸光值越小,这种现象越明显;当吸光值>0.2时,吸光值随时间而逐渐减小。原花青素的反应当吸光值<0.30时,在270 s~600 s(4.5 min~10 min)时间范围内吸光值较稳定,当吸光值>0.3 时,约在 90~330 s(1.5 min~5.5 min)时间范围内相对稳定。花生衣提取液反应吸光值<0.2时,约在180 s~630 s(3 min~10.5 min)时间范围内吸光值较稳定,当吸光值>0.2 时约在 510 s~780 s(8.5 min~13 min)时间范围内吸光值具有相对稳定性,同时从理论上分析原花青素对照品与花生衣原花青素结构的差别,就存在反应时间上的差异,为此在做标准曲线或样品测定中,反应时间按照以上规律在吸光值相对稳定的时间段内读数,并且吸光值取相对稳定的时间段内至少3个点,取平均值。本试验花生衣提取液吸光值均控制在0.20~0.25之间,每次反应均在10、11、12 min时分别读数一次,取平均值,标准曲线制作时反应均在5 min时读数。
2.1.3 盐酸用量及香草醛浓度的影响
盐酸用量影响:反应中盐酸用量与吸光值的关系见图3。
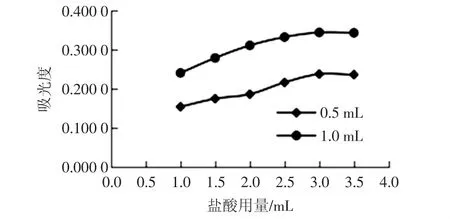
图3 盐酸用量的影响Fig.3 Effect of hydrochloric acid on reaction
由图3可见,吸光值随着盐酸用量的增加而增大,但当盐酸用量增到3.0 mL时,吸光值不再增大。另外,试验发现随着盐酸用量增加对照组的比色管的底部也出现淡淡的粉色,摇匀变为淡黄色。
对对照组颜色进行光谱分析见图4。
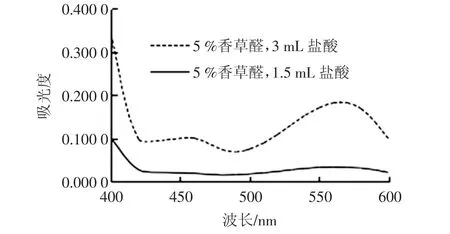
图4 盐酸与香草醛产生吸光值Fig.4 Absorption from vanillin and hydrochloric acid
由图4发现其为在566 nm处有最大吸收的物质,但在499 nm处吸光值比较低,另外在显色反应物体系与对照体系中这个吸光值可以相互抵消,所以选择3.0 mL盐酸为适合的盐酸用量。
香草醛浓度影响:香草醛浓度与显色反应产物吸光值的关系见图5。

图5 香草醛浓度的影响Fig.5 Effect of vanillin concentration on reaction
由图5可见,当香草醛浓度达到5%时吸光值不再增加,或者增加很少,所以香草醛浓度选择5%为宜。
2.1.4 香兰素-盐酸法方法可靠性分析
由2.1.3试验结果,当反应体系中反应液取1.0 mL时,吸光值较大,不便于线性分析,所以反应液取0.5 mL,制作标准曲线见图6。

图6 显色反应标准曲线Fig.6 Standard curves of proanthocyanidin color reaction
由图6可知,曲线相关系数为0.996 3。精密度和回收率试验结果见表1~表2,测得精密度相对标准偏差2.69%,说明该方法的重现性好。通过方法回收率试验,测得平均回收率为97.22%,符合光谱定量分析的准确度要求。

表1 精密度分析试验结果Table 1 Result of precision test

表2 原花青素测定回收率试验结果Table 2 Result of recovery test for proanthocyanidin determination
2.1.5 花生衣原花青素含量测定结果含量测定结果见表3。

表3 花生衣中原花青素含量Table 3 Proanthocyanidin content in peanut skin
分析试验结果具有以下特点:
1)从总体上讲,白、红两种花生衣中原花青素含量差异不大或基本相近。在超市购买的来自昆明地区的白花生衣原花青素含量比玉溪本地的白、红花生衣都明显高一些,这可能属于地区土壤的差异性。
2)本地产新、旧的花生衣所含原花青素也没有明显差异。另外试验对所购买的同一种花生衣进行考察,发现储存一年后测得原花青素与一年前几乎没有变化,这说明花生衣原花青素在花生储存过程中十分稳定。
2.2 花生衣中多酚物质含量分析
通过标准曲线绘制结果,原花青素对照品溶液的紫外吸收在0~0.200 mg/mL浓度范围内有良好的线性关系,由此测得白、红花生衣中多酚物质含量见表4,回收率试验结果见表5。分析以上试验结果可知,白、红两种花生衣中多酚物质含量相差不大。

表4 花生衣中多酚物质含量Table 4 Polyphenol content in peanut skin
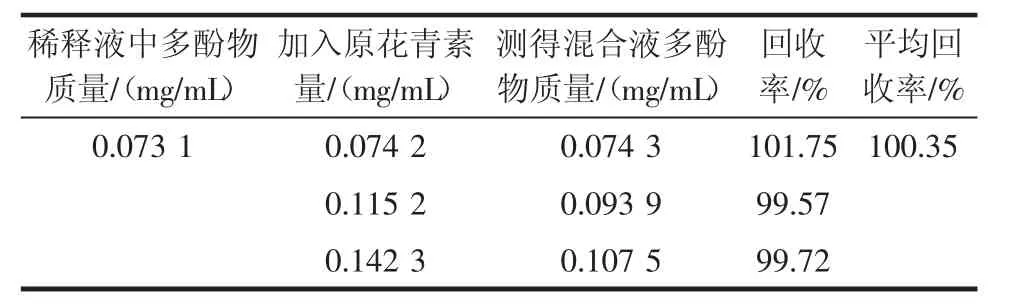
表5 多酚物质测定回收率实验结果Table 5 Result of recovery test for polyphenol determination
3 结论
通过以上试验,对于香草醛-盐酸比色法采用优化的以“6 mL5%香草醛+3.0 mL盐酸”体系加入0.5 mL反应液,并以反应吸光值为最大值时读数的方法来测定花生衣中原花青素含量,以及采用多酚物质的280 nm紫外吸收法测定花生衣多酚物质含量,结果表明白、红两种花生衣中原花青素以及多酚物质的含量基本相当,其中多酚物质含量较高的花生衣原花青素也含量也高,因此从食品功能学抗氧化的角度来讲,这两种颜色的花生衣抗氧化功能基本相同。香草醛-盐酸法测得为儿茶素类单体以及其聚合体原花青素的总量,花生衣多酚物质中所含成分主要为原花青素类化合物。
[1]陈洋,王冰,王佳男,等.RP-HPLC-ESI-MS/MS分离鉴定花生红衣原花青素A型和B型二聚体[J].食品科学,2013,23(34):142-146
[2]杜蕾,李新华.黑、红花生衣中原花青素的分析[J].食品科学,2014,35(4):190-194
[3]赵平,刘俊英,张月萍.香草醛法测定原花青素物质的量浓度[J].中国食品添加剂,2011(3):219-224
[4]王洋,高哲,李晔,等.原花色素分析方法研究进展[J].食品安全质量检测学报,2012,3(2):130-135
[5]李春阳,许时婴,王璋.低浓度香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J].食品科技,2004(6):128-130
[6]李绮丽,吴卫国,彭芳刚,等.莲子皮原花青素测定方法的研究[J].现代食品科技,2012,28(2):241-245
[7]张寒俊,汪海波,习羽.改进香草醛法测定葡萄提取物中的原花青素[J].中国酿造,2010(8):147-149
[8]裴云逸.白·红花生衣多酚物质含量分析及提取技术优化[J].安徽农业科学,2015,43(30):221-224
[9]陈洪玉,迟彩霞,王得新,等.柳树叶中原花青素含量测定[J].应用化工,2012,41(8):1456-1457,1461
[10]董瑞霞.茶籽壳原花青素的提取分离研究[D].合肥:安徽农业大学,2008:1-44
[11]肖付才.葡萄籽原花青素检测方法的研究[D].杨凌:西北农林科技大学,2007:1-48
Analysis of Proanthocyanidins and Polyphenols in Peanut Skins
PEI Yun-yi,LU Xing-xing,WU Cui-fang,XU Yan-fei
(Yuxi Agriculture Vocation-Technical College,Yuxi 653106,Yunnan,China)
Vanillin-hydrochloric acid method for determination of proanthocyanidins and UV method for polyphenols in peanut skins were tested and described.For vanillin-hydrochloric acid method,test way was to add 0.5 mL of sample or standard solution to the solution system of 6 mL of 5%vanillin-alcohol and 3 mL of hydrochloric acid,under temperature of 25℃,and absorption was determined at wavelength of 499 nm when absorption was relatively stable.After a series of comparison,the result showed that the content of proanthocyanidins or polyphenols differed little between white and red peanut skins,and that the mainly component of penaut skin polyphenols was proanthocyanidins.
peanut skin;proanthocyanidins;polyphenols
10.3969/j.issn.1005-6521.2017.17.032
2016-11-09
玉溪农业职业技术学院课题(2014XY02)
裴云逸(1971—),女(汉),讲师,本科,从事实验仪器分析及食品营养成分研究。

