基于SnO2纳米花气体传感器快速检测牛奶中的单增李斯特菌
刘红平,朱永恒,2,刘海泉,2,马欧妹,赵 勇,2,*
基于SnO2纳米花气体传感器快速检测牛奶中的单增李斯特菌
刘红平1,朱永恒1,2,刘海泉1,2,马欧妹1,赵 勇1,2,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
以单增李斯特菌特征性代谢物3-羟基-2-丁酮为检测靶点,水热法合成与之匹配的敏感材料,制备出单增李斯特菌特异检测半导体气体传感器。采用X射线衍射和透射电子显微镜手段对材料的结构和形貌进行表征。并分析传感器对3-羟基-2-丁酮标准气体的气敏性能及其在牛奶中单增李斯特菌的检测效果。结果表明,本研究合成的SnO2材料为纳米花结构。制备出的单增李斯特菌特异检测半导体气体传感器对3-羟基-2-丁酮灵敏度高、响应恢复时间短、选择性和稳定性好。用于检测单增李斯特菌时,传感器的灵敏度与细菌浓度呈现出良好的线性关系,线性方程为lg(S-1)=0.198 3lgC-0.472 5(R2=0.990 1)。本方法快速灵敏、操作简便,可用于食品中单增李斯特菌的快速检测。
单增李斯特菌;3-羟基-2-丁酮;水热法;气敏性能;纳米花;灵敏度
单增李斯特菌(Listeria monocytogenes)是全世界普遍公认的一种重要的人畜共患食源性致病菌[1-2],人感染后可引起呕吐、脑膜炎、败血症和自然流产等症状,免疫力较弱者如孕妇、新生儿和老人尤易被感染[3-5]。该菌广泛存在于各种肉类、蔬菜、乳制品等食品中[6-8],在4 ℃环境中仍可生长繁殖,是冷藏食品威胁人类健康的主要致病菌之一[9],日益引起食品安全工作者的重视。目前国际上对单增李斯特菌的检测还没有统一标准,其检测方法主要包括传统的培养和生理生化方法、分子生物学方法以及免疫学等方法。这些方法可靠准确,但操作繁杂、检测周期长,且对专业技术人员和仪器设备依赖程度高,不适宜快速诊断[10-16]。因此对单增李斯特菌进行实时、灵敏而无损检测迫切需要操作简单、便携、低成本的快速检测技术。
自金属氧化物半导体气体传感器问世以来,因其具有制备简单、价格低廉、体积小和使用寿命长等优点,在工业生产、环境监测以及人类生活等领域中得到了广泛的应用,在检测易燃易爆、有毒有害气体等方面显示了独特的优势[17-19]。其中,SnO2是一种宽禁带(3.6 eV)n型半导体金属氧化物,由于其优越的光学、电学以及催化等性能,成为当今研究最深入、应用最广泛的气敏材料[20-22]。而将其制备成气体传感器运用于微生物挥发性代谢物的特异性检测的实验研究却少见报道。
微生物挥发性代谢产物是微生物在生长代谢过程中利用周围环境中的糖类、蛋白质和脂肪等营养成分产生的一类代谢产物。它与微生物生命活动密切相关,是人类了解微生物生命活动本质规律的重要窗口,已被广泛应用于临床诊断、环境监测和微生物鉴定[23-25]。如李绚梅等[26]研究了肺部感染几种常见致病菌,发现吲哚、十一烷醇、丁基羟基甲苯分别为大肠杆菌、绿脓杆菌、肺炎克雷伯杆菌的特征性挥发物,可用于肺部感染疾病的诊断。本实验室前期研究中发现,3-羟基-2-丁酮是单增李斯特菌产生的特征性挥发物,其含量随细菌的培养时间而变化,当培养时间为18 h时,相对含量高达48.93%[27-28]。因此,本实验以单增李斯特菌特征性代谢物3-羟基-2-丁酮为检测靶点,利用比表面积大的SnO2纳米花敏感材料对气体快速响应的气敏性能,探索出一种基于SnO2气体传感器快速检测单增李斯特菌的方法。
1 材料与方法
1.1 材料与试剂
牛奶 光明集团;盐酸、无水乙醇、氢氧化钠、五水四氯化锡(SnCl4·5H2O) 国药集团化学试剂有限公司;胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、胰蛋白胨大豆琼脂(tryptic soy agar,TSA) 北京陆桥技术股份有限公司;L. monocytogenes WaX12由本实验室从猪肉中分离得到;实验所用试剂均为分析纯。
1.2 仪器与设备
DHG-9055A鼓风干燥箱、GHP-9270隔水式恒温培养箱、SX2箱式电阻炉 上海一恒科技仪器有限公司;Bioscreen C全自动微生物生长曲线分析仪 芬兰Oy Growth Curves Ab公司;MYP11-2A恒温磁力搅拌器上海梅颖浦仪器仪表制造有限公司;SMS-60R半导体气敏传感器阵列测量平台 河南圣玛斯科技有限公司;实验用水为去离子水;实验所用玻璃器皿、去离子水及吸头均经高压灭菌处理。
1.3 方法
1.3.1 材料的合成及表征
将0.5 mol SnCl4·5H2O溶于45 mL去离子水中,磁力搅拌均匀,用NaOH溶液调节体系pH值至10左右,缓慢加入25 mL无水乙醇,再搅拌30 min使其充分混合,得到均匀的反应溶液。将混合均匀的反应溶液引入100 mL的高压釜中,螺钉旋紧密封,置于180 ℃烘箱中反应24 h。关掉烘箱使高压反应釜自然冷却至室温,获得一定量的沉淀产物。将沉淀产物用去离子水和无水乙醇交替洗涤多次,置于70 ℃烘箱中隔夜干燥,得到SnO2纳米花前驱体。将前驱物置于马弗炉中550 ℃煅烧2 h,所获样品即为SnO2纳米花。采用X射线衍射和透射电子显微镜对所得样品进行表征,分析样品的形貌、粒子大小以及分散状况。
1.3.2 传感器的制作

图1 气敏元件的结构Fig. 1 Schematic illustration of the gas-sensor structure
在玛瑙研钵中加入少许样品,研磨均匀后滴入少量去离子水,调成糊状后用毛笔均匀涂于带Pt引线的陶瓷管外面,将涂好气敏材料的陶瓷管立于瓷方舟内放在红外灯下烘干(约10 min)后,置于500 ℃马弗炉中煅烧2 h,以除去材料中所用的黏合剂,自然冷却后备用。将涂有气敏材料的陶瓷管的4 个电极丝焊接在底座上,然后将加热丝从陶瓷管中穿过并将其两端也焊接在底座上,制成气敏元件,结构如图1所示。为了改善器件的性能,增加元件的稳定性,将焊好的元件置于专用的老化台上,通5 V直流电压,老化1周[29]。
1.3.3 3-羟基-2-丁酮标准气体的气敏性能测试
采用静态配气法,在SMS-60R气敏元件测试系统上进行传感器对3-羟基-2-丁酮气敏性能测试,测试内容包括最佳工作电压的判断、响应恢复情况、选择性和长期稳定性分析。基本测试电路如图2所示。Vh为加热电压,Vc为测试回路电压,Vout为负载电阻RL上的电压。加热电压Vh,0~6 V连续可调;回路电压Vc,2~10 V连续可调;负载电阻RL,可换插卡式。通过测试与气敏元件串联的负载电阻RL上的电压Vout来反映传感器的特性。在本实验中,定义元件的灵敏度S=Ra/Rg,Ra和Rg分别为元件在空气中和被测气体中的电阻值。定义响应时间tres为元件接触被测气体后,负载电阻RL上的电压U0变化到U0+90%(UX-U0)所需的时间,恢复时间trev为元件脱离被测气体后,负载电阻RL的电压由UX恢复到U0+ 10%(UX-U0)所用的时间[30]。测试气体包括3-羟基-2-丁酮和几种常见的干扰气体如氨气、二甲苯、甲醛、乙醇、异丙醇、丙酮、一氧化碳、二氧化硫、氢气、乙烯等。
1.3.4 TSB培养基中单增李斯特菌的检测
挑取一环单增李斯特菌单菌落接种到装有10 mL TSB培养基的试管中,于37 ℃、以180 r/min摇床过夜培养,使菌液浓度达到109CFU/mL左右,将菌液按梯度稀释。然后从稀释液中吸取100 μL一定浓度的菌液接种到装有15 mL TSB培养基的顶空收集瓶中,使菌液浓度约为104CFU/mL,37 ℃、180 r/min摇床培养。每隔2 h取出一个顶空收集瓶,在37 ℃水浴、18 r/min磁力搅拌15 min进行顶空气体收集,再用注射器抽取瓶中顶空气体,快速注入气体测试箱中,进行单增李斯特菌气味检测,每次实验做3 个平行。另外,将初始接种量约为104CFU/mL的菌液用全自动微生物生长曲线分析仪进行单增李斯特菌生长曲线的测定,将所得结果与传感器检测结果对比。同时为考察单增李斯特菌气味检测传感器的特异性及培养基背景气味对传感器的影响,本实验还对大肠杆菌、副溶血性弧菌、沙门氏菌和TSB进行了检测。
1.3.5 牛奶样品中单增李斯特菌的检测
为评价本方法在实际样品中的可行性,将浓度约为10、102、103、104、105、106CFU/mL的单增李斯特菌接种到市售无菌牛奶样品中,37 ℃、180 r/min摇床培养,培养12 h后取出样品,进行气味检测。
2 结果与分析
2.1 材料的表征
图3 a为溶剂热条件下180 ℃水热24 h后得到的样品X射线衍射图谱。经过与标准卡片比较分析可知,图3a中标出的所有衍射峰与标准图谱(JCPDS 41-1445)相吻合,属于四方金红石结构。无其他杂质的衍射峰,说明样品是单一的SnO2相,结晶度和纯度均很高。如图3b1、b2所示,所得样品为形貌规则、分布均匀的多级花状结构,它是由若干根纳米棒组成,每根纳米棒的直径大约为200~300 nm,长约1~1.5 µm。
2.2 3-羟基-2-丁酮标准气体的气敏性能测试结果
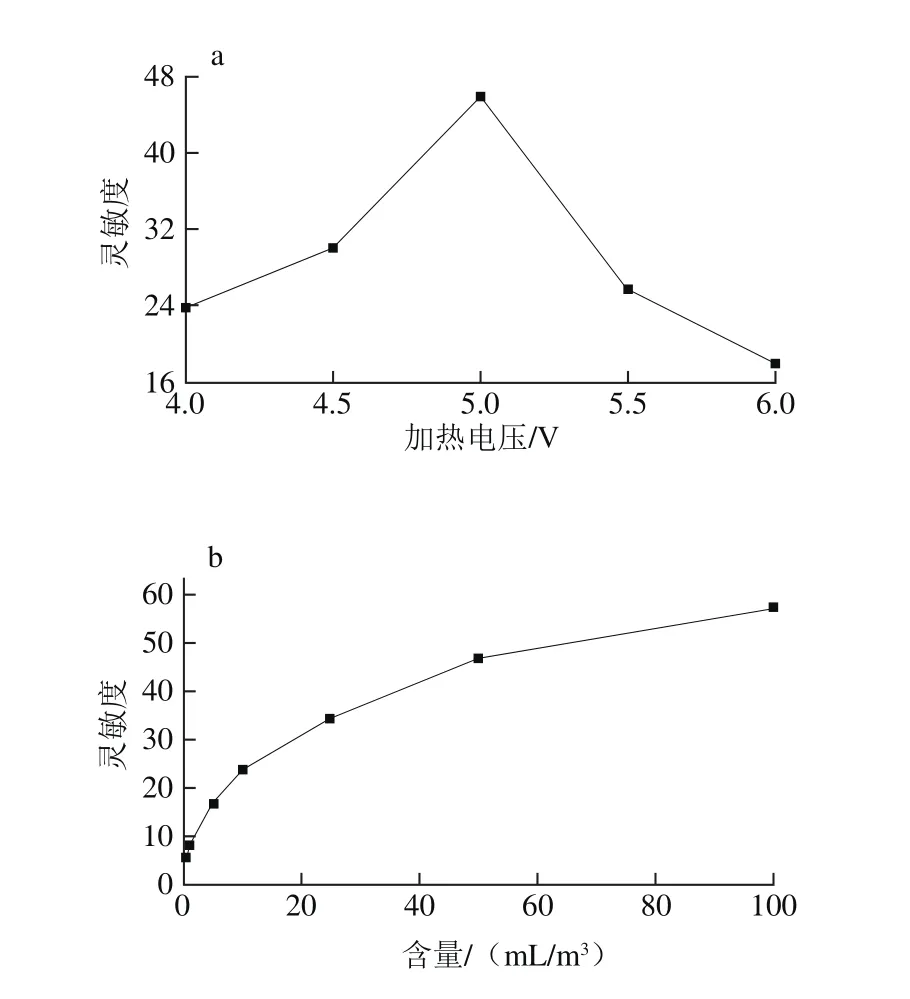
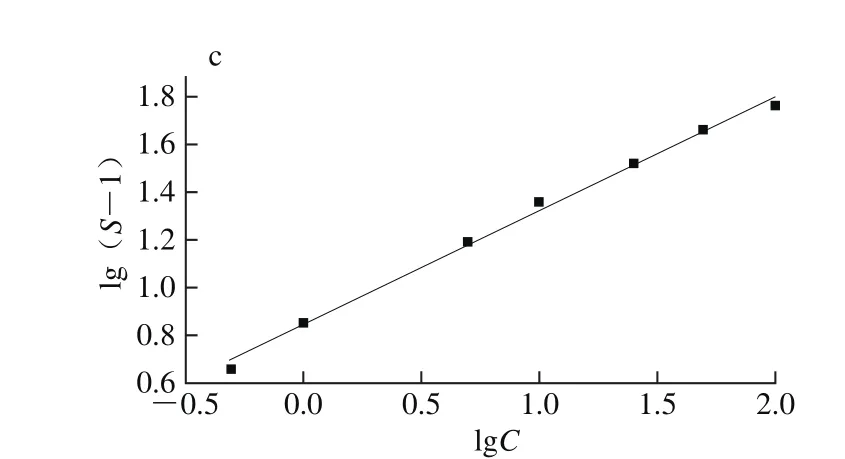
图4 传感器对50 mL/m33-羟基-2-丁酮的灵敏度与加热电压的关系(a)、灵敏度和3-羟基-2-丁酮含量关系(b)及含量对数的线性关系(c)Fig. 4 Heating voltage dependence of response to 50 mL/m33-hydroxy-2-butanone of the sensor (a), relationship between the response of sensor and concentrations of 3-hydroxy-2-butanone (b) and linear relationshipbetween the logarithm of response and concentrations (c)
由图4a可知,传感器的灵敏度与加热电压的关系呈火山形曲线,当加热电压为5 V时传感器的灵敏度最大。因此,5 V选为本实验的工作电压。由图4b可知,基于SnO2纳米花制作的传感器的灵敏度随3-羟基-2-丁酮含量增加而增大,即传感器对3-羟基-2-丁酮的响应随着气体含量的增加而升高,几乎呈线性关系,符合经验公式:S=a[C]b+1(其中a、b为常数,S、C分别为灵敏度和气体含量)[31-32]。如图4c所示,灵敏度和气体含量在对数坐标轴上线性关系为:lg(S-1)=0.478 2lgC+0.844 3,线性系数R2为0.995 2。传感器对3-羟基-2-丁酮响应的重复性好,响应-恢复时间短,其响应和恢复时间分别在11、16 s以内,检测限达10-9级。
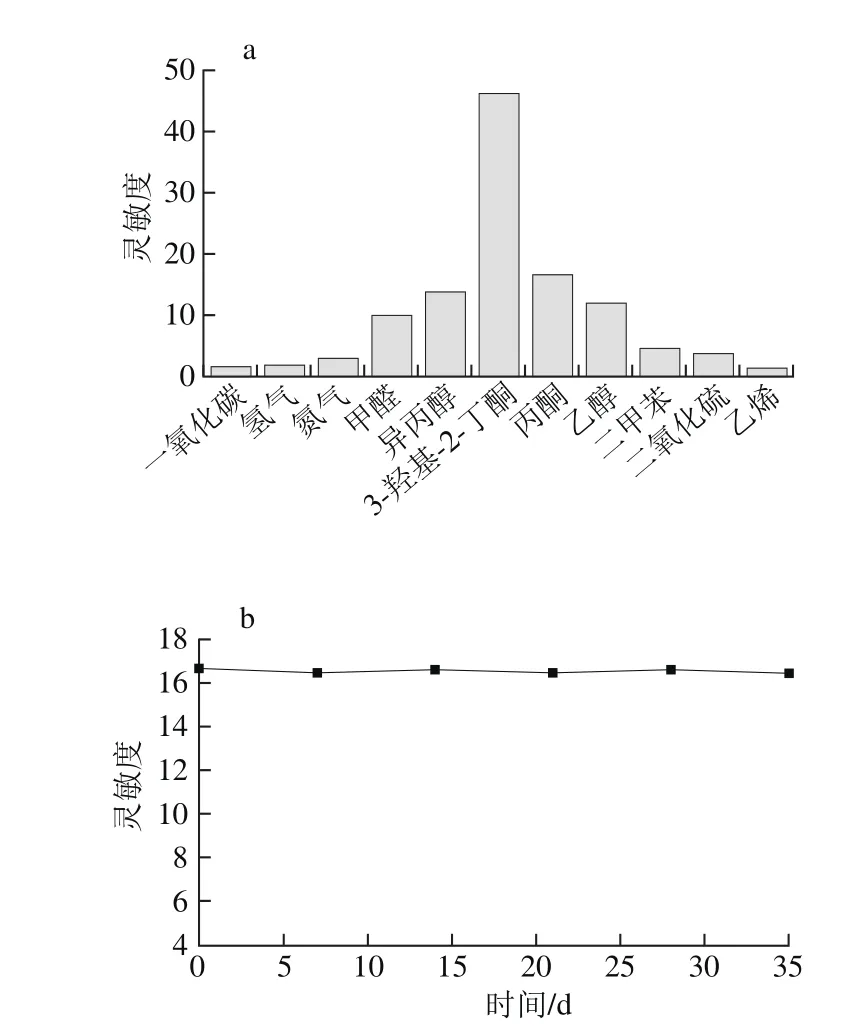
图5 传感器对不同气体响应(a)及长期稳定性(b)Fig. 5 Response of the sensor to different gases (a) and its long-term stability to 3-hydroxy-2-butanone (b)
传感器对氨气、二甲苯、甲醛、乙醇、异丙醇、丙酮、一氧化碳、二氧化硫、氢气、乙烯等11 种气体(含量皆为50 mL/m3)的测试结果如图5a所示。传感器对3-羟基-2-丁酮的灵敏度最高,可达46.26。而对其他气体,丙酮最高灵敏度为16.09。由此可知,传感器对3-羟基-2-丁酮具有很好的选择性。长期稳定性是传感器实际应用中的一个重要指标。将制备好的传感器每隔7 d对50 mL/m3的3-羟基-2-丁酮气体进行测试,从图5b可以看出,传感器在35 d后的灵敏度变化很小,说明该传感器有着很好的长期稳定性。
2.3 TSB培养基中单增李斯特菌的检测结果

图6 单增李斯特菌的生长曲线(a)和灵敏度与细菌培养时间的关系(b)Fig. 6 Growth curve of Listeria monocytogenes (a) and relationship between the response of sensor and bacterial culture time (b)
由图6a可知,随着细菌培养时间的延长,传感器的灵敏度由变化缓慢到变化显著最后趋于稳定。这与用全自动微生物生长曲线分析仪测得单增李斯特菌的生长曲线的结果相一致。微生物在生长过程中会经历延滞期、对数生长期、稳定期和衰亡期4 个生命阶段。当细菌处于延滞期时,细菌生长缓慢,产生的挥发性代谢物3-羟基-2-丁酮少,传感器的灵敏度小。当细菌处于对数生长期时,细菌以对数形式生长,产生的3-羟基-2-丁酮气体急剧增加,传感器灵敏度增大,这段时期灵敏度变化显著。当细菌进入稳定期后,细菌生长速率不再增加,此时细菌产生的3-羟基-2-丁酮的量不再急剧增加,灵敏度变化缓慢,最后将趋于稳定。从图6b中还可以看到,传感器对副溶血性弧菌、大肠杆菌、沙门氏菌和TSB培养基的检测效果。由图6b可知,传感器检测副溶血性弧菌、大肠杆菌、沙门氏菌和TSB培养基时,灵敏度随细菌的培养时间变化缓慢,对TSB培养基几乎无变化。表明本实验所制备的传感器具有良好的特异性,对单增李斯特菌具有很好的检测效果。
2.4 牛奶样品中单增李斯特菌的检测结果
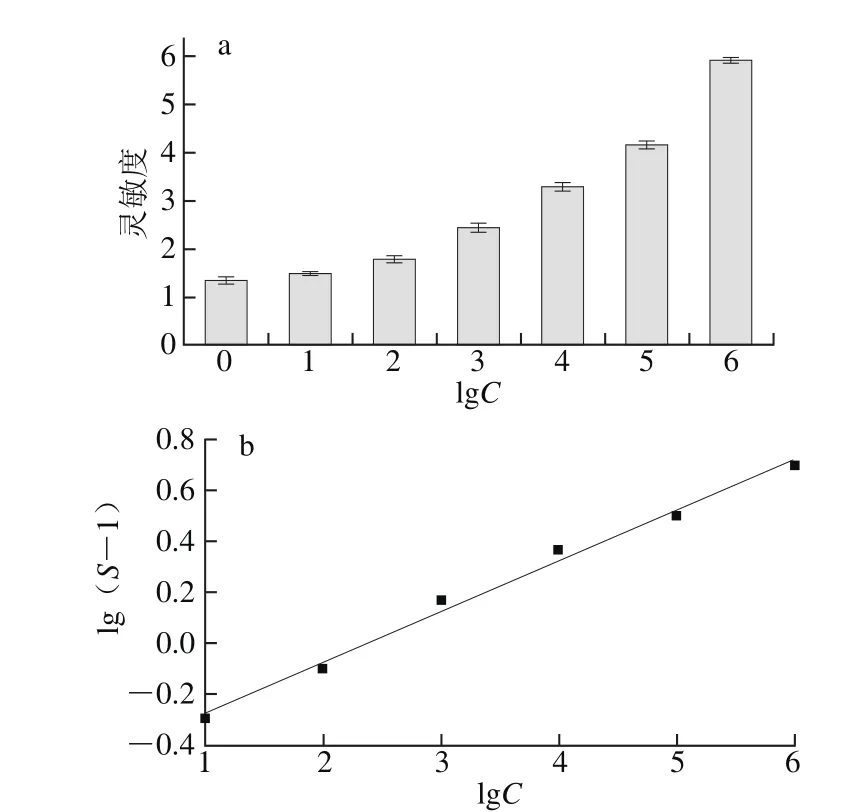
图7 传感器检测不同浓度单增李斯特菌的灵敏度(a)和灵敏度与细菌浓度的线性关系曲线(b)Fig. 7 Response of the sensor to different concentrations of Listeria monocytogenes (a) and linear relationship curve between response and concentrations of L. monocytogenes (b)
将初始接种量约为0、10、102、103、104、105、106CFU/mL的单增李斯特菌接种到无菌牛奶中培养12h后,由图7可知,菌液浓度越大,传感器的灵敏度越大,细菌被传感器检出所需的增菌时间越短。灵敏度与菌液浓度呈现出良好的线性关系,线性方程为lg(S-1)= 0.198 3lgC-0.472 5(R2=0.990 1)。初始接种量约为10 CFU/mL的单增李斯特菌在牛奶中培养12 h后也能被检测出。说明本研究所制备的单增李斯特菌特异检测传感器可以应用于实际样品中单增李斯特菌的检测。
3 结 论
采用水热法成功合成了形貌规则的SnO2纳米花材料。基于SnO2纳米花制备的单增李斯特菌特异检测半导体气体传感器对3-羟基-2-丁酮灵敏度高、选择性强和稳定性好,响应和恢复时间分别在11、16 s以内。用于检测单增李斯特菌时,传感器的灵敏度与细菌培养时间之间的关系符合单增李斯特菌的生长规律。并且灵敏度与菌液浓度呈现出良好的线性关系,线性方程为lg(S-1)= 0.198 3lgC-0.472 5(R2=0.990 1),初始接种量约为10 CFU/mL的单增李斯特菌在牛奶中培养12 h后也能被检测出。说明通过该传感器对单增李斯特菌产生的特征性气味3-羟基-2-丁酮的检测以达到快速检测单增李斯特菌的目的是可行的。不同微生物在生长过程中产生的特征挥发性代谢物不尽相同,可以根据特征性代谢物制备出与其匹配的敏感材料。因此,这种方法还可被借鉴到其他食源性致病菌的快速检测。
[1] GUILLET C, JOIN-LAMBERT O, LE M A, et al. Human listeriosis caused by Listeria ivanovii[J]. Emerg Infect Diseases, 2010, 16(1): 136-138. DOI:10.3201/eid1601.091155.
[2] ORSI R H, den BAKKER H C, WIEDMANN M. Listeria monocytogenes lineages: genomics, evolution, ecology, and phenotypic characteristics[J]. International Journal of Medical Microbiology, 2011, 301(2): 79-96. DOI:10.1016/j.ijmm.2010.05.002.
[3] ALTHAUS D, LEHNER A, BRISSE S, et al. Characterization of Listeria monocytogenes strains isolated during 2011–2013 from human infections in Switzerland[J]. Foodborne Pathogens and Disease, 2014, 11(10): 753-758. DOI:10.1089/fpd.2014.1747.
[4] 丁建英, 韩剑众. 食品中单增李斯特菌的存在现状及检测方法研究进展[J]. 食品研究与开发, 2008, 29(12): 171-174. DOI:10.3969/ j.issn.1005-6521.2008.12.050.
[5] MONTERO D, BODERO M, RIVEROS G, et al. Molecular epidemiology and genetic diversity of Listeria monocytogenes isolates from a wide variety of ready-to-eat foods and their relationship to clinical strains from listeriosis outbreaks in Chile[J]. Frontiers in Microbiology, 2015, 6: 384. DOI:10.3389/fmicb.2015.00384.
[6] BÜLA C J, BILLE J, GLAUSER M P. An epidemic of foodborne listeriosis in western Switzerland: description of 57 cases involving adults[J]. Clinical Infectious Diseases, 1995, 20(1): 66-72. DOI:10.1093/clinids/20.1.66.
[7] MACDONALD P D M, WHITWAM R E, BOGGS J D, et al. Outbreak of listeriosis among Mexican immigrants as a result of consumption of illicitly produced Mexican-style cheese[J]. Clinical Infectious Diseases, 2005, 40(5): 677-682. DOI:10.1086/427803.
[8] KOCH J, DWORAK R, PRAGER R, et al. Large listeriosis outbreak linked to cheese made from pasteurized milk, Germany, 2006–2007[J]. Foodborne Pathogens and Disease, 2010, 7(12): 1581-1584. DOI:10.1089/fpd.2010.0631.
[9] JUNTTILA J R, NIEMELÄS I, HIRN J. Minimum growth temperatures of Listeria monocytogenes and non-haemolytic listeria[J]. Journal of Applied Bacteriology, 1988, 65(4): 321-327. DOI:10.1111/ j.1365-2672.1988.tb01898.x.
[10] JASSON V, JACXSENS L, LUNING P, et al. Alternative microbial methods: an overview and selection criteria[J]. Food Microbiology, 2010, 27(6): 710-730. DOI:10.1016/j.fm.2010.04.008.
[11] DWIVEDI H P, JAYKUS L A. Detection of pathogens in foods: the current state-of-the-art and future directions[J]. Critical Reviews in Microbiology, 2011, 37(1): 40-63. DOI:10.3109/104084 1X.2010.506430.
[12] ZENG H, ZHANG X, SUN Z, et al. Multiplex PCR identification of Listeria monocytogenes isolates from milk and milk-processing environments[J]. Journal of the Science of Food and Agriculture, 2006, 86(3): 367-371. DOI:10.1002/jsfa.2352.
[13] VÄLIMAA A L, TILSALA-TIMISJÄRVI A, VIRTANEN E. Rapid detection and identification methods for Listeria monocytogenes in the food chain-a review[J]. Food Control, 2015, 55: 103-114. DOI:10.1016/j.foodcont.2015.02.037.
[14] 郑晓风, 韩勇, 刘英玉, 等. 单增李斯特菌便捷检测试纸的制备及检测效果[J]. 食品科学, 2016, 37(20): 191-197. DOI:10.7506/spkx1002-6630-201620033.
[15] SHIM W B, CHOI J G, KIM J Y, et al. Enhanced rapidity for qualitative detection of Listeria monocytogenes using an enzymelinked immunosorbent assay and immunochromatography strip test combined with immunomagnetic bead separation[J]. Journal of Food Protection, 2008, 71(4): 781-789. DOI:10.4315/0362-028X-71.4.781.
[16] LONG Y, ZHOU X, XING D. Sensitive and isothermal electrochemiluminescence gene-sensing of Listeria monocytogenes with hyperbranching rolling circle amplification technology[J]. Biosensors and Bioelectronics, 2011, 26(6): 2897-2904. DOI:10.1016/ j.bios.2010.11.034.
[17] 张强, 管自生. 电阻式半导体气体传感器[J]. 仪表技术与传感器, 2006(7): 6-9. DOI:10.3969/j.issn.1002-1841.2006.07.003.
[18] MIRZAEI A, LEONARDI S G, NERI G. Detection of hazardous volatile organic compounds (VOCs) by metal oxide nanostructuresbased gas sensors: a review[J]. Ceramics International, 2016, 42(14): 15119-15141. DOI:10.1016/j.ceramint.2016.06.145.
[19] 郑庆呈, 张鹏, 魏影. 可燃气体检测报警器的原理及其应用[J]. 计量与测试技术, 2014, 41(9): 20-22. DOI:10.3969/j.issn.1004-6941.2014.09.013.
[20] LI Z, ZHOU Y, SONG J, et al. Versatile nanobead-scaffolded N-SnO2mesoporous microspheres: one-step synthesis and superb performance in dye-sensitized solar cell, gas sensor, and photocatalytic degradation of dye[J]. Journal of Materials Chemistry A, 2013, 1(3): 524-531. DOI:10.1039/C2TA00103A.
[21] WEN Z, ZHENG F, YU H, et al. Hydrothermal synthesis of flowerlike SnO2nanorod bundles and their application for lithium ion battery[J]. Materials Characterization, 2013, 76: 1-5. DOI:10.1016/ j.matchar.2012.11.011.
[22] 刘阳, 李勃, 姚有为, 等. 改善SnO2气体传感器气敏性能的研究进展[J]. 传感器与微系统, 2013, 31(12): 5-8. DOI:10.3969/ j.issn.1000-9787.2012.12.002.
[23] WANG Y, LI Y, YANG J, et al. Microbial volatile organic compounds and their application in microorganism identification in foodstuff[J]. TrAC Trends in Analytical Chemistry, 2016, 78: 1-16. DOI:10.1016/ j.trac.2015.08.010.
[24] LEMFACK M C, NICKEL J, DUNKEL M, et al. mVOC: a database of microbial volatiles[J]. Nucleic Acids Research, 2014, 42(D1): D744-D748. DOI:10.1093/nar/gkt1250.
[25] AUDRAIN B, FARAG M A, RYU C M, et al. Role of bacterial volatile compounds in bacterial biology[J]. FEMS Microbiology Reviews, 2015, 39(2): 222-233. DOI:10.1093/femsre/fuu013.
[26] 李绚梅, 应可净. 部分细菌和真菌特征挥发性有机物的研究[D]. 杭州: 浙江大学, 2012.
[27] YU Y, SUN X, LIU Y, et al. Odor fingerprinting of Listeria monocytogenes recognized by SPME-GC-MS and E-nose[J]. Canadian Journal of Microbiology, 2014, 61(5): 367-372. DOI:10.1139/cjm-2014-0652.
[28] 陈雪, 倪鹏, 喻勇新, 等. 李斯特属细菌特征挥发性代谢物的鉴定分析[J]. 食品科学, 2013, 34(10): 231-237. DOI:10.7506/spkx1002-6630-201310051.
[29] WANG D, HU P, XU J, et al. Fast response chlorine gas sensor based on mesoporous SnO2[J]. Sensors and Actuators B: Chemical, 2009, 140(2): 383-389. DOI:10.1016/j.snb.2009.05.027.
[30] WANG H, QU Y, CHEN H, et al. Highly selective n-butanol gas sensor based on mesoporous SnO2prepared with hydrothermal treatment[J]. Sensors and Actuators B: Chemical, 2014, 201: 153-159. DOI:10.1016/j.snb.2014.04.049.
[31] WILLIAMS D E. Semiconducting oxides as gas-sensitive resistors[J]. Sensors and Actuators B: Chemical, 1999, 57(1): 1-16. DOI:10.1016/ S0925-4005(99)00133-1.
[32] ZHANG L, ZHAO J, LU H, et al. Facile synthesis and ultrahigh ethanol response of hierarchically porous ZnO nanosheets[J]. Sensors and Actuators B: Chemical, 2012, 161(1): 209-215. DOI:10.1016/ j.snb.2011.10.021.
Rapid Detection of Listeria monocytogenes in Milk Base on SnO2Nanoflower Gas Sensor
LIU Hongping1, ZHU Yongheng1,2, LIU Haiquan1,2, MA Oumei1, ZHAO Yong1,2,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation (Shanghai), Ministry of Agriculture, Shanghai Aquatic and Storage Engineering Technology Research Center, Shanghai 201306, China)
The aim of this study was to develop a semiconductor gas sensor for the rapid and sensitive detection of L. monocytogenes by targeting 3-hydroxy-2-butanone, the characteristic metabolite of L. monocytogenes. The sensitive material that matches 3-hydroxy-2-butanone was synthesized by a hydrothermal method and used to fabricate the sensor. The structure and morphology of the material were characterized by X-ray diffraction (XRD) and transmission electron microscopy (TEM). The response of the as-prepared sensor to 3-hydroxy-2-butanone calibration gases and its performance for the detection of L. monocytogenes in milk were analyzed. The results indicated that the sensor exhibited high response, quick response-recovery kinetics, and good repeatability to 3-hydroxy-2-butanone. Furthermore, the response showed a good linear relationship with the concentration of L. monocytogenes, and the linear regression equation was lg(S-1)=0.198 3lgC -0.472 5 (R2= 0.990 1). This method could be completed within a short time without extensive sample preparation. Accordingly, it has a great potential as a rapid method for the detection of L. monocytogenes in food samples.
Listeria monocytogenes; 3-hydroxy-2-butanone; hydrothermal method; gas-sensing performance; nanoflower; response
10.7506/spkx1002-6630-201716036
TS201.3
A
1002-6630(2017)16-0228-06
刘红平, 朱永恒, 刘海泉, 等. 基于SnO2纳米花气体传感器快速检测牛奶中的单增李斯特菌[J]. 食品科学, 2017, 38(16): 228-233. DOI:10.7506/spkx1002-6630-201716036. http://www.spkx.net.cn
LIU Hongping, ZHU Yongheng, LIU Haiquan, et al. Rapid detection of Listeria monocytogenes in milk base on SnO2nanoflower gas sensor[J]. Food Science, 2017, 38(16): 228-233. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716036. http://www.spkx.net.cn
2016-10-20
国家自然科学基金面上项目(31571917;31671779);上海市科技兴农重点攻关项目(沪农科攻字2014第3-5号;沪农科攻字2015第4-8号;沪农科攻字2016第1-1号)作者简介:刘红平(1989—),男,硕士研究生,研究方向为食品安全检测。E-mail:liuhp3358189@126.com
*通信作者:赵勇(1975—),男,教授,博士,研究方向为食品安全与生物技术。E-mail:yzhao@shou.edu.cn

