猕猴桃溃疡病菌拮抗菌筛选、鉴定及发酵条件优化
田雪莲,尹显慧,*,龙友华,蔡 滔,李 洪
猕猴桃溃疡病菌拮抗菌筛选、鉴定及发酵条件优化
田雪莲1,尹显慧1,*,龙友华1,蔡 滔2,李 洪1
(1.贵州大学作物保护研究所,贵州 贵阳 550025;2.贵州省农产品质量安全监督检验测试中心,贵州 贵阳 550004)
目的:从不同地区猕猴桃根际土壤中筛选拮抗猕猴桃溃疡病菌的菌株,优化其产生抑菌活性物质的发酵条件,为猕猴桃溃疡病的生物防治提供潜在的资源菌。方法:采用平板稀释法从猕猴桃根际土壤中分离获得菌株,采用抑菌圈法筛选拮抗菌;通过形态学特征、生理生化特征及16S rDNA序列分析对其进行鉴定;并采用单因素及正交试验优化培养基组分及发酵条件。结果:从土壤中共分离到288 株放线菌,其中编号为NA-TXL-1的菌株对猕猴桃溃疡病菌的拮抗效果最佳,采用预防法、治疗法进行盆栽实验,发酵原液的防治效果分别为73.06%、55.62%,初步鉴定该菌株为抗生链霉菌。其最佳发酵配方和培养条件为:乳糖30 g/L、酵母粉3 g/L、NaCl 1 g/L、K2HPO40.5 g/L、MgSO4·7H2O 0.5 g/L、FeSO40.01 g/L,种子培养基为乳糖-酵母粉培养基,接种量为2%,起始pH值为7.0,发酵原液、上清液、重悬液分别培养5、14、5 d。结论:经鉴定,拮抗菌株为Streptomyces antibioticus。在优化的发酵条件下,该菌株对猕猴桃溃疡病菌具有更好的拮抗效果。
猕猴桃溃疡病菌;拮抗菌;筛选;鉴定;发酵条件优化
猕猴桃溃疡病是由丁香假单胞杆菌猕猴桃致病变种(Pseudomonas syringae pv. actinidiae,Psa)引起的细菌性病害[1]。其发生具有范围广、传播快、致病性强、防治难度大等特点,可在短期内造成大面积树体死亡,特别是感病品种,当年病害暴发,当年或第二年造成全园毁灭惨重损失的现象屡见不鲜,现已被列为中国森林植物检疫性病害,是猕猴桃生产和发展中的毁灭性病害[2]。目前防治该病主要采取综合防治和化学防治相结合的方法,但防治效果都不理想,特别是化学农药的过量使用,使Psa对一些化学农药(如硫酸铜和农用链霉素)产生抗药性,更对人类健康造成危害[3]。因此,开展以生物防治为主的综合防治研究,对该病的防治具有重要意义,而筛选高效拮抗菌是进行生物防治研究的基础[4]。
利用拮抗菌防治猕猴桃溃疡病已有研究报道。盛存波等[5-6]从根际土壤中筛选出了芽孢杆菌B56-3,稀释100倍的B56-3发酵滤液采用喷雾和病斑刮除涂抹相结合的方法对溃疡病的治疗效果和病斑治愈率分别可达86.5%和91.4%。邵宝林等[7]从土壤中分离出防治效果较好的蜡样芽孢杆菌(Bacillus cereus)B2。Tu Xuan等[8]筛选出内生放线菌gCLA4,21 d的gCLA4对Psa相对防治效果可达66.7%。黄以超等[9]筛选出链霉菌属的孢杆链霉菌(Streptomyces sporovirgulis)TGNBSA5,进一步研究表明是TGNBSA5的发酵液中分离出的代谢产物苯甲醇对Psa有抑菌作用。但目前利用微生物资源对猕猴桃溃疡病进行生物防治的研究还较少。
本研究从不同地区猕猴桃根际土壤中筛选出一株对猕猴桃溃疡病菌有较好拮抗作用的生防菌株,并优化了拮抗菌的发酵条件,以期为该病的生物防治增加新的生防菌资源。
1 材料与方法
1.1 材料与菌株
土壤:2014年11月分别在贵州省修文县、大方县、三穗县、六盘水,四川苍溪县猕猴桃园中采集土壤样品,风干后进行菌株分离。
供试植株品种为贵长猕猴桃。
供试菌株:从修文县久长镇猕猴桃发病植株上分离,经16S rDNA鉴定为猕猴桃溃疡病菌,基因登记号为KX769816。
1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏5 g、蛋白胨10 g、NaCl 5 g、琼脂15~20 g,蒸馏水1 000 mL,pH 7.2~7.4,121 ℃灭菌30 min。
高氏一号培养基:可溶性淀粉20 g、KNO31 g、K2HPO40.5 g、MgSO40.5 g、NaCl 0.5 g、FeSO40.01 g、琼脂15~20 g、蒸馏水1 000 mL,pH 7.2~7.4,121 ℃灭菌30 min。
1.3 方法
1.3.1 拮抗菌的分离筛选
分离:称取土壤10 g,加入有90 mL无菌水的三角瓶中,200 r/min振荡60 min,即成10-1菌悬液,然后从所得菌悬液中吸取1 mL加入有9 mL无菌水的试管中,依次稀释到10-4和10-5的菌悬液。取0.1 mL 10-4和10-5的菌悬液均匀涂布于高氏一号、NA平板上,每个稀释度重复3次,然后置于28 ℃恒温培养箱中分别培养5、2 d,挑取形态特征相异的单个菌落,经培养纯化后作为供试菌株。
初筛:将纯化保存的放线菌、细菌活化后,采用喷雾法进行初筛。具体操作如下:将活化的放线菌、细菌分别接种于高氏一号、NA培养基中央,于28 ℃培养3 d、6 h后,将过夜培养16 h的猕猴桃溃疡病菌1×108CFU/mL菌悬液对其进行喷雾,培养24 h后观察有无抑菌圈、测量抑菌圈大小,筛选出有明显抑制作用的拮抗菌菌株,编号保存。
复筛:取初筛中抑菌效果较好的放线菌,先在高氏一号平板上活化,后接种于高氏一号液体培养基中,于28 ℃、120 r/min恒温摇床中培养7 d后,获得发酵原液。以分离到的致病力最强的猕猴桃溃疡病菌株为靶标菌,采用抑菌圈法测定其抑菌活性,重复3 次。28 ℃培养24 h后,测量抑菌圈直径大小,本实验中所指的抑菌圈直径均为有效抑菌圈直径,根据公式(1)计算。

式中:滤纸片直径为6 mm。
1.3.2 拮抗菌NA-TXL-1的鉴定
拮抗菌株的形态特征[10-11]及生理生化特性的鉴定参照《链霉菌鉴定手册》[12]方法进行,并与《放线菌的分类和鉴定》[13]中相关菌株特征进行比较。16S rDNA序列分析采用细菌基因组提取试剂盒提取T3-5菌株基因组DNA。采用通用引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’和1492R:5’-GGCTACCTTGTTACGACTT-3’进行菌株16S rDNA PCR扩增。PCR产物电泳检测回收,交上海生工生物工程有限公司纯化并测序。利用NCBI数据库中BLAST程序对所测序列进行比对分析,选择GenBank中与之同源性较高菌种的模式菌株16S rDNA序列,利用Clustal X1.8软件对其进行多重比对,分析菌株T3-5与参比菌株之间的序列相似度,并通过MEGA 4.0软件的Maximum Parsimony构建系统发育树,并进行Bootstrap分析检验,重复1 000 次。
1.3.3 拮抗菌NA-TXL-1发酵条件优化
1.3.3.1 不同种子培养基对NA-TXL-1发酵液抑菌活性的影响
6 种不同初选种子培养基见表1,每组处理设3 个重复,按照双层琼脂法[14]测定抑菌活性。
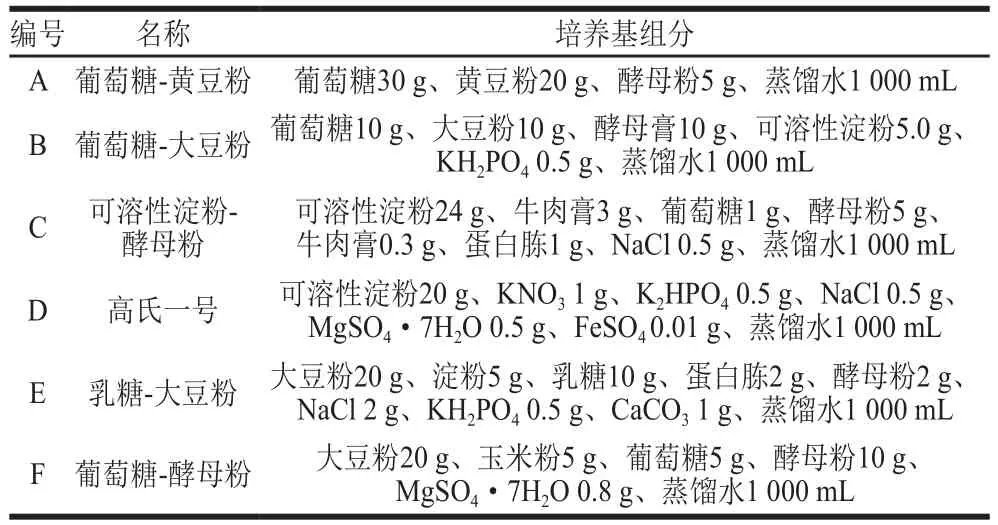
表1 6 种初选种子培养基成分Table 1 Compositions of six seed culture media used for primary screening
1.3.3.2 不同碳源、氮源、无机盐对NA-TXL-1发酵液抑菌活性的影响
在培养条件不变的情况下,分别用葡萄糖、麦芽糖、蔗糖、甘油和乳糖等量代替高氏一号液体培养基中的可溶性淀粉;分别用蛋白胨、牛肉浸汁、硫酸铵、草酸铵、酵母粉等量代替高氏一号液体培养基中的KNO3;分别用KCl、MgSO4等量代替高氏一号液体培养基中的NaCl,按照1.3.3.1节的方法测定,重复3 次,确定最佳碳源、氮源和无机盐。
1.3.3.3 营养条件的正交试验
选择最佳碳源(乳糖)和氮源(酵母粉)以及无机盐(NaCl)的含量共3 个因素,设置3 个水平,选用L9(34)正交表进行正交试验(表2),发酵实验重复3 次,抑菌活性按照1.3.3.1节的方法测定,将3 次的平均值作为实验结果,分析后获得最佳发酵配方。
表2 正交试验因素和水平Table 2 Code and level of factors used fororthogonal array design

表2 正交试验因素和水平Table 2 Code and level of factors used fororthogonal array design
水平因素A乳糖含量/(g/L)B酵母粉含量/(g/L)C NaCl含量/(g/L)1 2010.5 2 3021.0 3 4032.0
1.3.3.4 不同培养条件对NA-TXL-1发酵液抑菌活性的影响
接种量:将NA-TXL-1置于最佳种子培养基中培养2 d后,转接于高氏一号液体培养基中,装液量为100 mL/250 mL,接种量分别为0.2%、0.4%、0.6%、0.8%、1.0%,30 ℃、160 r/min培养5 d后测抑菌活性;起始pH值:分别调成5.0、6.0、7.0、8.0、9.0、10.0,28 ℃振荡在优化后的发酵培养基培养5 d后测抑菌活性;培养时间:将NA-TXL-1接种于优化的发酵培养基中,装液量为100 mL/250 mL,接种量0.2%,28 ℃、160 r/min培养,于第5、8、11、14、17、20天分别测发酵原液、上清液、重悬液的抑菌活性。
1.3.4 拮抗菌NA-TXL-1的盆栽实验
当猕猴桃实生苗长出4~6 片真叶时,选取生长比较健壮、植株大小相似的猕猴桃,根系带土同时将叶片剪去一半移栽到塑料桶中。实验将拮抗菌发酵液分别配制成发酵原液(浓度1×108CFU/mL)、上清液(经0.22 μm滤膜过滤)、重悬液(培养原液离心后,弃上清液,经灭菌水清洗2 次,浓度1×108CFU/mL)、对照(无菌水)共4 个处理,每个处理重复5 次,于2015年2月下旬进行。
预防法:采用喷雾处理的方法,喷施待测发酵滤液,每隔5 d喷施一次。喷施3 次后,于7 d后采用针刺法接种猕猴桃溃疡病菌(每个处理接种部位30 个),接菌后保湿48 h,之后进入常规管理。接种30 d后测量病斑的直径,并计算发病率和防治效果。
治疗法:采用针刺法先接种猕猴桃溃疡病菌,接菌后保湿48 h,之后每隔5 d喷施一次拮抗菌,共喷施3 次。接种30 d后测量病斑的直径,并按公式(2)、(3)计算病情指数和防治效果。

其中,猕猴桃溃疡病分级标准为:0级,无病;1级,轻病,1/3以下的枝条发病或者萎蔫死亡、或者主杆病斑不超过茎围1/3;2级,中病,1/3~1/2的枝条发病或者萎蔫死亡、或者主杆病斑环绕茎围1/3~1/2;3级,重病,1/2~3/4的枝条发病或萎蔫死亡、或者主杆病斑环绕茎围1/2~3/4;4级,全株死亡。
1.4 数据分析
采用SPSS 19.0数据处理系统对实验数据进行单因素方差分析,采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 拮抗菌的分离筛选

表3 拮抗菌对猕猴桃溃疡病菌的抑菌活性Table 3 Antibiotic activity of antagonistic isolates against Pseudomonas syringaepv.actinidiae
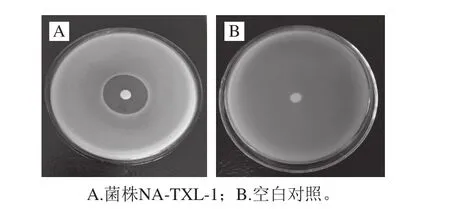
图1 拮抗菌NA-TXL-1抑菌效果Fig. 1 Inhibitory effect of strain NA-TXL-1
采用平板稀释法从不同地区猕猴桃根际土壤中共分离出288 株放线菌、649 株细菌,采用喷雾法筛选出了16 株对猕猴桃溃疡病菌有抑菌活性的拮抗放线菌(表3),其中抑菌圈直径10~20 mm有9 株,20~30 mm有5 株,40~50 mm有2 株,为Jh16、NATXL-1,而分离出的649 株细菌对猕猴桃溃疡病菌均无抑制效果。通过抑菌圈法复筛,表明菌株NA-TXL-1对猕猴桃溃疡病菌的拮抗作用最显著,初筛、复筛直径分别达到50.3、21.0 mm(图1)。
2.2 拮抗菌株NA-TXL-1的鉴定
2.2.1 菌株形态特征

图2 扫描电子显微镜下拮抗菌株NA-TXL-1的形态特征Fig. 2 Morphological characteristics of strain NA-TXL-1 under SEM
拮抗菌株NA-TXL-1在高氏一号培养基上呈白色卵圆形,菌落紧密,不透明,表面皱褶,常以链状排列,菌落灰色,有黄色素产生。在扫描电子显微镜下发现,孢子丝螺旋形,长圆形,表明光滑,纤细直长,相互缠绕,基内菌丝多分支,不断裂,孢子上有泡状物和膨大物(图2)。
2.2.2 菌株生理生化特性由表4可知,拮抗菌NA-TXL-1能产生H2S、黑色素,能使牛奶凝固,但不能使明胶液化、淀粉水解,纤维素不分解;能够利用葡萄糖、蔗糖、果糖、乳糖,但不能利用L-阿拉伯糖、D-甘露醇。而标准Streptomyces antibioticus能产生轻度明胶液化、淀粉水解不明显,拮抗菌NA-TXL-1实验中由于现象不明显故判定为阴性。

表4 拮抗菌株NA-TXL-1的生理生化实验Table 4 Physiological and biochemical characteristics of strain NA-TXL-1
2.2.3 16S rDNA鉴定
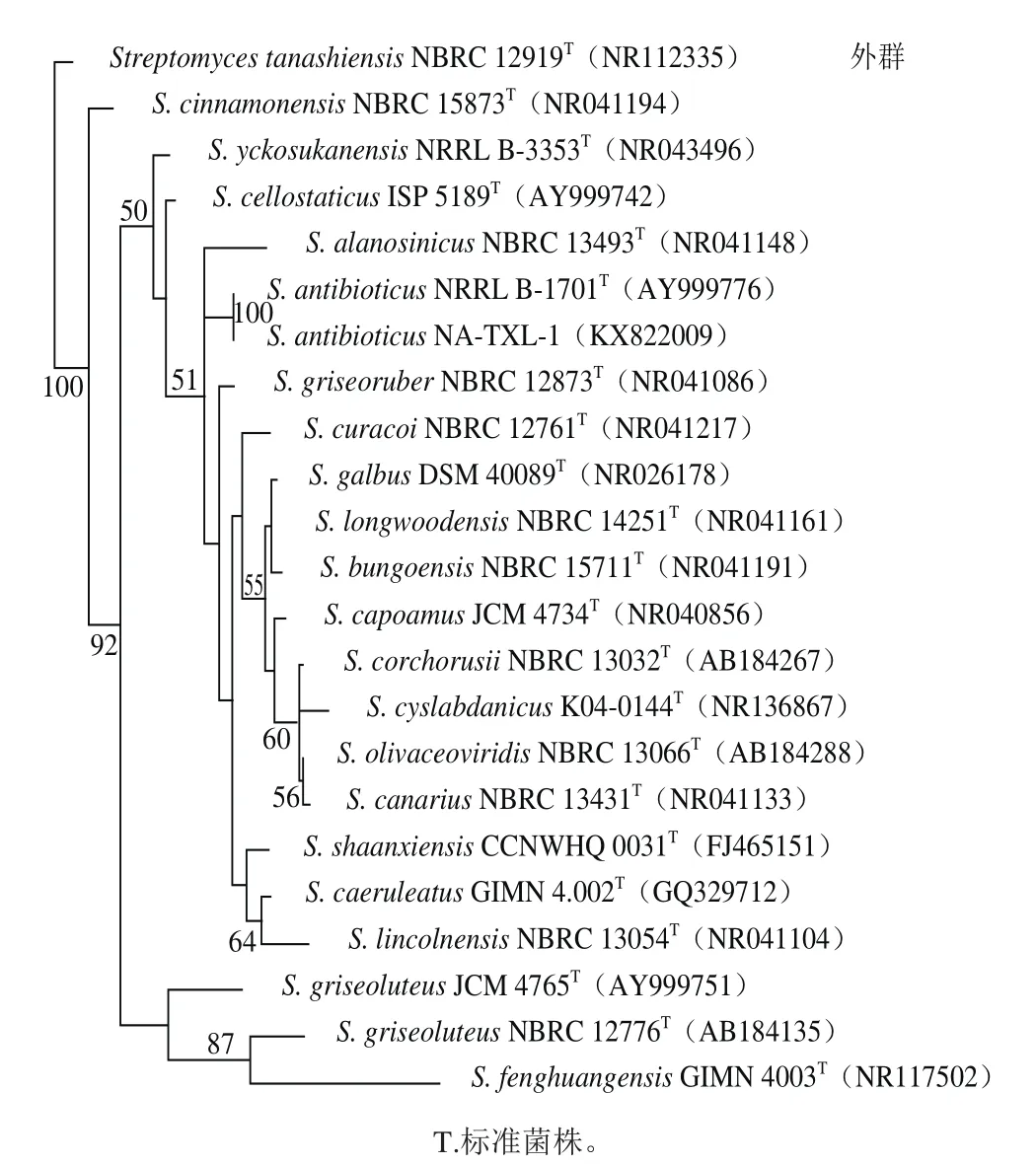
图3 基于16S rDNA 序列构建的NA-TXL-1菌株系统发育树Fig. 3 Phylogenetic tree of strain NA-TXL-1 based on 16S rDNA sequences
NA-TXL-1菌株经测序分析,16S rDNA序列长度为1 300 bp,测序结果提交GenBank注册,登录号为KX822009。在GenBank数据库中进行BLAST同源性检索,绘制系统发育树(图3)。通过Maximum Parsimony系统分析,NA-TXL-1与S. antibioticus(NRRL B-1701)聚在一起,支持率为100%。综合形态、生理生化特征及16S rDNA序列分析,将拮抗放线菌NA-TXL-1鉴定为抗生链霉菌(S. antibioticus)。
2.3 拮抗菌NA-TXL-1发酵条件优化
2.3.1 不同种子培养基对NA-TXL-1发酵液抑菌活性的影响

图4 不同种子培养基对菌株NA-TXL-1发酵液抑菌活性的影响Fig. 4 Effect of different seed media on inhibitory activity of submerged cultured NA-TXL-1
由图4可知,拮抗菌NA-TXL-1以E为种子培养基时,菌体生长较好,对猕猴桃溃疡病菌的抑制作用最显著,抑菌圈为22.3 mm,较D高氏一号培养基提高了12.77%,差异极显著;其次为种子培养基D、C,而以A、B、F为种子培养基时,抑菌效果最差,差异不显著。因此,该菌株的最适种子培养基为E。
2.3.2 不同碳源、氮源、无机盐对NA-TXL-1发酵液抑菌活性的影响

图5 不同碳源(A)、氮源(B)对NA-TXL-1发酵液抑菌活性的影响Fig. 5 Effecst of different carbon and nitrogen sources on inhibitory activity of submerged cultured NA-TXL-1
以所选6 种碳源的培养基得到的NA-TXL-1菌株发酵原液对猕猴桃溃疡病菌均有一定的抑菌活性,其中以乳糖为碳源的发酵液抑菌效果最好,抑菌圈大小均值为22.3 mm,大于高氏一号中可溶性淀粉的抑菌圈(20.3 mm),但差异不显著;其次由高到低依次是甘油、麦芽糖、葡萄糖、蔗糖(图5A)。因此,选用乳糖作为碳源。所选用的6 种氮源中,以酵母粉为氮源的发酵液具有最好的抑菌效果,抑菌圈为23.0 mm,其中酵母粉与牛肉浸汁的抑菌效果均优于对照(KNO3),而硫酸铵抑菌活性较差,酵母粉与硝酸钾差异极显著(图5B)。因此,选用酵母粉作为氮源。选用NaCl、KCl、MgCl2作为无机盐,其抑菌圈直径分别为20.0、16.7、17.3 mm,NaCl与其他处理差异显著,因此选用NaCl作为无机盐。
2.3.3 拮抗菌NA-TXL-1营养条件的优化
表5 拮抗菌NA-TXL-1发酵培养基正交试验及结果Table 5 Orthogonal array design with experimental results for optimization of culture medium for enhanced antagonistic activity of

表5 拮抗菌NA-TXL-1发酵培养基正交试验及结果Table 5 Orthogonal array design with experimental results for optimization of culture medium for enhanced antagonistic activity of
试验号A乳糖含量/(g/L)抑菌圈直径/mm 12010.521.0±0.6 22021.019.7±0.3 32032.020.7±0.7 43011.022.3±0.3 53022.022.0±0.6 63030.521.7±0.3 74012.020.3±0.3 84020.521.0±0.6 94031.023.8±0.7 k120.46721.20021.233 k222.00020.90021.667 k321.43321.80021.000 R1.5330.9000.667 B酵母粉含量/(g/L)C NaCl含量/(g/L)
由表5可知,3 个因素对猕猴桃溃疡病菌的抑菌圈影响大小为A乳糖含量>B酵母粉含量>C NaCl含量,最佳水平组合为A2B3C2。因此确定NA-TXL-1发酵培养基配方为乳糖 30 g/L、酵母粉 3 g/L、NaCl 1 g/L、K2HPO40.5 g/L、MgSO4·7H2O 0.5 g/L、FeSO40.01 g/L。
2.3.4 培养条件的优化
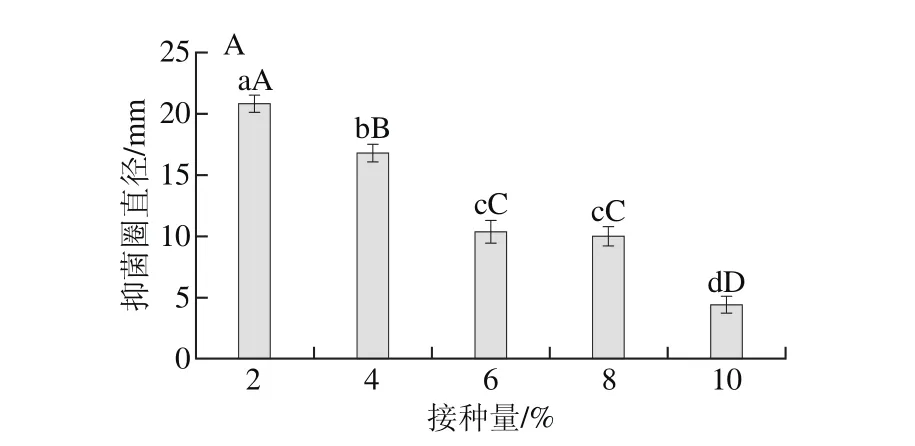
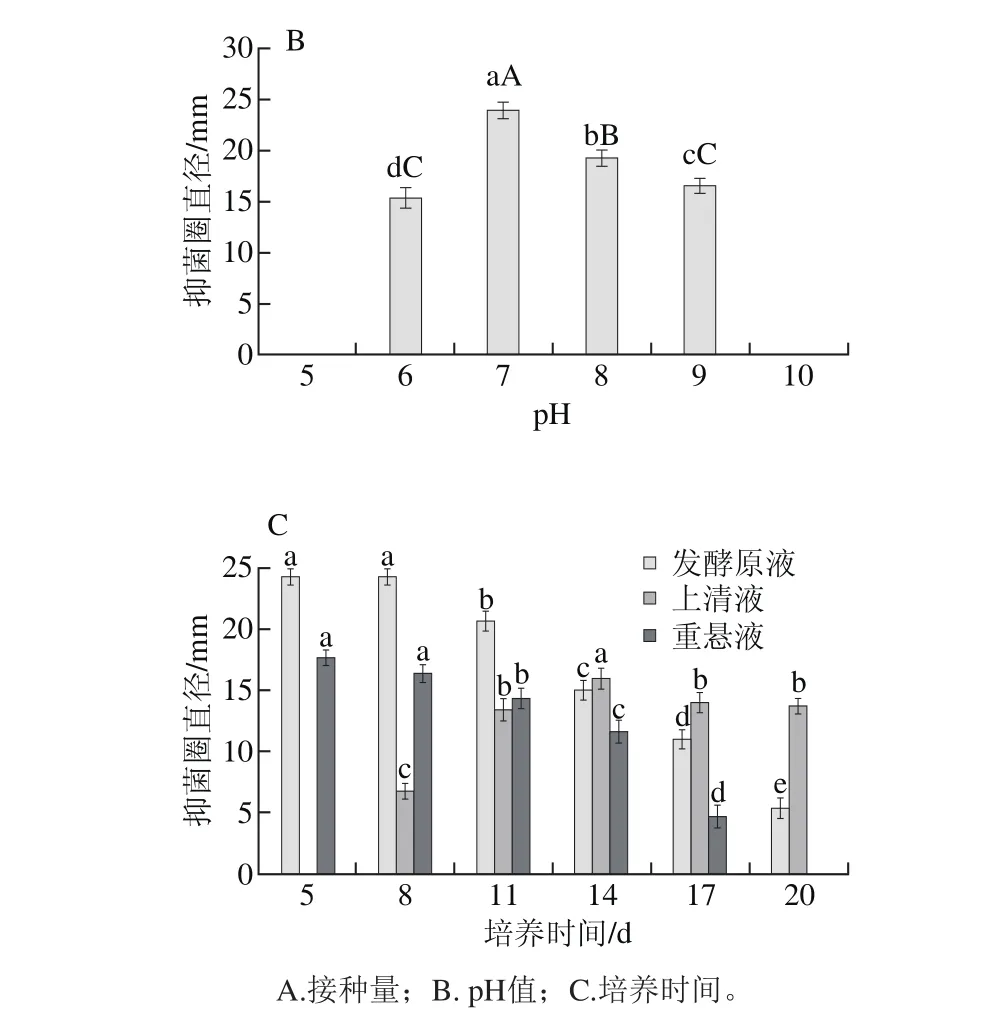
图6 不同培养条件对菌株NA-TXL-1发酵滤液抑菌活性的影响Fig. 6 Effect of different culture conditions on inhibition activity of submerged cultured NA-TXL-1
选择合适的接种量有利于菌体形成群体优势而缩短延迟期。由图6A可知,当接种量在4%~10%,拮抗菌NA-TXL-1大量繁殖,但抑菌效果却较差,抑菌圈直径在4.3~10.3 mm之间,而按2%的接种量,其抑菌圈直径最大,为20.8 mm,与其他处理差异极显著。因此,选择的最佳接种量为2%。
pH值会影响微生物对培养基中一些营养物质的吸收利用及代谢物的合成,本研究在确定发酵培养基配方的基础上,通过单因素试验对发酵pH值进行了优化。从图6B可以看出,当pH值为5、10,拮抗菌NA-TXL-1未生长繁殖,无抑菌效果,随着pH值的升高,抑菌效果先升高后降低,在pH值为7时,抑菌效果最好,抑菌圈为24.0 mm,其次是pH值为8,抑菌圈为19.3 mm,说明NATXL-1适合在中性偏碱的环境中生长,其最适pH值为7。
合适的培养时间有助于获得最佳的抑菌效果,确定发酵原液、上清液、重悬液最佳发酵时间。从图6C可知,发酵原液、上清液、重悬液在不同培养时间抑菌效果有一定差异。随着培养时间的延长,发酵原液、重悬液抑菌活性逐渐降低,上清液抑菌效果先增后降,其中培养5 d,菌体产生的抑菌活性成分较少,上清液抑菌效果不明显,说明拮抗菌NA-TXL-1在5 d时主要是菌体本身产生抑菌作用;培养5 d,发酵原液、重悬液抑菌效果均最佳,分别为24.3、17.7 mm,与培养8 d差异不显著;但在11~20 d,发酵原液、重悬液抑菌效果均逐渐降低,其中重悬液在20 d时无抑菌活性;而上清液在14 d抑菌圈最大,为16.0 mm,其中11、17 d抑菌效果差异不显著。
2.4 拮抗菌株NA-TXL-1的盆栽实验结果

表6 拮抗菌NA-TXL-1不同处理液的盆栽实验Table 6 Effect of NA-TXL-1 in preventing and controlling Pseudomonas syringaepv.actinidiae in pot cultivated plants
由表6可知,拮抗菌NA-TXL-1采用预防法与治疗法对猕猴桃溃疡病的防控效果均较好。其中采用发酵原液喷雾防治效果最佳,预防法、治疗法的防治效果分别为73.06%、55.62%,其次是重悬液,防治效果较差的是上清液,除了预防法中的发酵原液与重悬液差异不显著,其他均达极显著水平,说明拮抗菌NA-TXL-1菌体对猕猴桃溃疡病的防控效果最好,代谢产物次之。
3 讨 论
目前,采用生防菌对植物病害进行防治以其广阔的应用前景而迅速发展为国内外的研究热点。链霉菌(Streptomyces)是一种可产生多种抗生素、天然代谢产物、植物激素等活性物质的高等放线菌,对提高植物的抗病、抗逆性能具有重要作用,具有开发生物农药的潜力[15-17]。目前已有学者分离到对植物病害取得良好防治效果的链霉菌。陆铮铮等[18]从烟草根围土壤中筛选出3 株对烟草青枯病菌具有较好抑制效果的链霉菌。王飞等[19]分离出对香蕉枯萎病病原菌拮抗性能最好的诺尔斯氏链霉菌(S. noursei)8N-10。涂璇等[20]从植物内生放线菌中筛选出对供试12 种靶标真菌均具有较好的抑菌效果的淡紫灰链霉菌(S. lavendularectus)。本研究使用抗生链霉菌拮抗猕猴桃溃疡病菌,报道抗生链霉菌拮抗植物病害,所获得的菌株NA-TXL-1具有较高的杀菌活性,进一步验证了链霉菌是植物病害生物防治的良好资源,具有较大的开发潜能。
链霉菌产生的抗菌活性物质多为次级代谢产物,其产量的高低不仅与菌种自身的性能相关,而且还要有最佳的发酵条件,因此,发酵条件的优化对链霉菌产生目标代谢物必不可少[21]。本研究采用单因素和正交试验进行NATXL-1菌株发酵条件的优化,结果表明NA-TXL-1菌株最佳碳源、氮源、无机盐分别为乳糖、酵母粉、无机盐,初始pH 7、接种量2%时,发酵液的抑菌活性显著提高。这与前人报道的淡紫灰链霉菌(S. lavendulae)[22]、极暗黄链霉菌(S. fulvissimus)[23]、加利利链霉菌(S. galilaeu)[24]产生拮抗物质的发酵条件有所不同,这说明同一菌属的不同种类菌株产生拮抗活性物质的种类及代谢途径有可能不同,从而导致培养条件的不同。此外,本研究对抗生链霉菌的发酵条件进行优化,但尚未考虑交互作用和发酵成本,故后续将重点放在发酵培养基中各成分的利用情况与发酵液活性之间的关系及大规模的发酵条件进行研究。
链霉菌对植物病害的生防作用机制包括分泌抗菌物质、竞争营养和空间、直接寄生病原菌和诱导植物抗性等方面[25-28]。本研究筛选出的抗生链霉菌NA-TXL-1,其发酵原液、上清液、重悬液均对Psa有较好的抑制作用,在培养5~11 d时,发酵原液抑菌活性优于上清液,而14~20 d,上清液抑菌活性却高于发酵原液,分析其可能的原因主要有两方面:第一,抗生链霉菌NA-TXL-1开始是直接寄生病原菌产生拮抗作用,而后是通过分泌的抗菌物质产生拮抗作用;第二,优化后的发酵条件更有利于该菌产生抑菌物质,发酵时间适当延长,产生的抑菌活性物质增多。同时也说明生防作用机制可能不是单方面的,而是几种方式共同作用的结果,而NA-TXL-1生防机制可能是菌株直接寄生病原菌和分泌抗菌物质共同作用。此外,本研究将对NA-TXL-1进行抗菌物质的分离纯化与鉴定,并对活性物质的抗菌机理进行探索,以期为猕猴桃溃疡病致病机理及田间防治研究提供理论支持。
[1] 李瑶, 承河元, 方书苗, 等. 猕猴桃细菌性溃疡病流行预测初探[J].应用生态学报, 2001, 12(3): 359-362.
[2] 李黎, 钟彩虹, 李大卫, 等. 猕猴桃细菌性溃疡病的研究进展[J].华中农业大学学报, 2013, 32(5): 124-133. DOI:10.3969/ j.issn.1000-2421.2013.05.022.
[3] 朱海云, 安超, 李勃, 等. 猕猴桃溃疡病病原菌及检测方法研究进展[J]. 陕西农业科学, 2013, 59(4): 141-145. DOI:10.3969/ j.issn.0488-5368.2013.04.047.
[4] 黄新琦, 雍晓雨, 沈其荣, 等. 土传黄瓜立枯病高效拮抗菌的筛选鉴定及其生物效应[J]. 植物保护学报, 2012, 39(1): 45-50. DOI:10.13802/j.cnki.zwbhxb.2012.01.006.
[5] 盛存波, 安德荣, 鲁燕汶, 等. 一株抗猕猴桃溃疡病的芽孢杆菌分离和筛选研究初报[J]. 中国农学通报, 2005, 21(12): 346-348. DOI:10.3969/j.issn.1000-6850.2005.12.098.
[6] 盛存波, 安德荣, 鲁燕汶, 等. 生防菌株B56-3防治猕猴桃溃疡病的初步研究[J]. 西北农业学报, 2006, 15(3): 75-78. DOI:10.3969/ j.issn.1004-1389.2006.03.017.
[7] 邵宝林, 王成华, 刘露希, 等. 猕猴桃溃疡病生防芽孢杆菌B2的鉴定及应用[J]. 中国农学通报, 2015, 31(26): 103-108.
[8] TU X, SHE Z, GAO Z P, et al. Investigation of kiwifruit bacterial canker disease (Pseudomonas syringae pv. actinidiae Takikawa) in Guanzhong area of Shanxi province and its biological control[J]. Plant Diseases and Pests, 2011, 2(1): 17-20.
[9] 黄以超, 颜霞, 王建华, 等. 生防放线菌TGNBSA5的鉴定及其活性物质的研究[J]. 西北农业学报, 2012, 21(8): 26-31.
[10] MINAMIyAMA H, SHIMIZU M, KUNOH H, et al. Mutiplication of isolates R-5 of Streptomyces galbus on rhododendron leaves and its production of cell wall-degrading enzymes[J]. Journal of General Plant Pathology, 2003, 69(1): 65-70. DOI:10.1007/s10327 -002-0014-y.
[11] 黄大林, 徐雅娟, 袁桂峰, 等. 放线菌扫描电镜样品简便快速的制备方法[J]. 安徽农业科学, 2010, 38(17): 8849-8850. DOI:10.3969/ j.issn.0517-6611.2010.17.008.
[12] 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M].北京: 科学出版社, 1975: 13-16.
[13] 阎逊初. 放线菌的分类和鉴定[M]. 北京: 科学出版社, 1992: 98-1348.
[14] 方中达. 植病研究方法[M]. 北京: 农业出版社, 1979: 225-231 .
[15] PAWEL B, CHIAN K, PAUL S L. Not a peripheral iissue: secretion in plant-microbe interactions[J]. Current Opinion in Plant Biology, 2010, 13(4): 378-387. DOI:10.1016/j.pbi. 2010.05.002.
[16] KIM y C, LEVEAU J, GARDENER B M, et al. The multifactorial basis for plant health promotion by plant-associated bacteria[J]. Applied and Environmental Microbiology, 2011, 77(5): 1548-1555. DOI:10.1128/AEM.01867-10.
[17] 吴雪昌, 缪克排, 钱凯先, 等. 链霉菌基因组及次生代谢研究进展[J].遗传学报, 2005, 32(11): 1221-1226.
[18] 陆铮铮, 彭丽娟, 丁海霞, 等. 烟草青枯菌拮抗放线菌的筛选及鉴定[J]. 中国烟草科学, 2013(2): 54-58. DOI:10.3969/ j.issn.1007-5119.2013.02.012.
[19] 王飞, 周登博, 廉法钦, 等. 香蕉枯萎病拮抗放线菌8N-10的分离鉴定及抑菌效果评价[J]. 江苏农业科学, 2016, 44(4): 179-183. DOI:10.15889/j.issn.1002-1302.2016.04.048.
[20] 涂璇, 黄丽丽, 高小宁, 等. 黄瓜内生放线菌的分离、筛选及其活性菌株鉴定[J]. 植物病理学报, 2008, 38(3): 244-251. DOI:10.3321/ j.issn:0412-0914.2008.03.004.
[21] 曹琦琦, 周登博, 郑丽, 等. 水稻纹枯病菌拮抗菌的筛选、鉴定及培养条件探索[J]. 中国生物防治学报, 2013, 29(2): 270-276.
[22] 崔贵青, 王连君, 姜楠, 等. 葡萄白腐病拮抗链霉菌G4的筛选、鉴定及发酵条件的优化[J]. 吉林农业大学学报, 2012, 34(2): 147-151.
[23] 陈丹, 叶波, 刘燕娟, 等. 水稻纹枯病菌拮抗菌CZB40的筛选、鉴定及其发酵条件优化[J]. 植物保护, 2015, 41(5): 46-53. DOI:10.3969/ j.issn.0529-1542.2015.05.008.
[24] 林雁冰, 陆家贤, 颜霞, 等. 地黄根圈土壤拮抗放线菌筛选、鉴定及发酵条件优化[J]. 植物保护学报, 2010, 37(3): 234-240. DOI:10.13802/j.cnki.zwbhxb.2010.03.001.
[25] AUGUSTINE S K, BHAVSAR S P, KAPADNIS B P. A non-polyene antifungal antibiotic from Streptomyces albidoflavus PU 23[J]. Journal of Biosciences, 2005, 30(2): 201-211. DOI:10.1007/BF02703700.
[26] EL-TARABILy K A. Rhizosphere-competent isolates of streptomycete and non-streptomycete actinomycetes capable of producing cell-walldegrading enzymes to control Pythium aphanidermatum dampingoff disease of cucumber[J]. Canadian Journal of Botany, 2006, 84(2): 211-222. DOI:10.1139/b05-153.
[27] 易龙, 张亚, 廖晓兰, 等. 链霉菌防治植物病害的研究进展[J]. 江苏农业科学, 2014, 42(3): 91-95.
[28] 华娟, 李淋玲, 程华, 等. 拮抗菌生物防治果蔬病害的研究进展[J]. 江西农业学报, 2013, 25(10): 71-74. DOI:10.3969/ j.issn.1001-8581.2013.10.021.
Screening, Identification and Optimization of Fermentation Conditions for Antagonistic Actinomycetes against Pseudomonas syringae pv. actinidiae
TIAN Xuelian1, YIN Xianhui1,*, LONG Youhua1, CAI Tao2, LI Hong1
(1. Instictute of Crop Protection, Guizhou University, Guiyang 550025, China; 2. Guizhou Provincial Supervision and Testing Center for Agricultural Product Quality Supervision, Guiyang 550004, China)
Aims: To isolate and screen the antagonistic strains with inhibitory activity against Pseudomonas syringae pv. actinidiae from a soil sample collected from the rhizosphere of kiwifruit in different areas and to optimize the fermentation conditions for enhanced production of antibacterial substances. Methods: Antagonistic strains were isolated by pour plate method, screened by inhibition zone method, and identified by morphological, physiological and biochemical characteristics and 16S rDNA sequence analysis. The optimal medium composition and fermentation conditions were optimized by onefactor-at-a-time and orthogonal array design methods. Results: A total of 288 actinomycetes strains were isolated, among which strain NA-TXL-1 exhibited the strongest inhibitory activity against Pseudomonas syringae pv. actinidiae. The effects of the fermentation broth in preventing and controlling Pseudomonas syringae pv. actinidiae in pot cultivated plants were 73.06% and 55.62%, respectively. Strain NA-TXL-1 was identified as Streptomyces antibioticus. The seed medium, inoculum size and initial pH value were optimized to be lactose-yeast power culture medium, 2%; and 7.0, respectively. The optimal culture medium consisted of 30 g/L lactose, 3 g/L yeast powder, 1 g/L NaCl, 0.5 g/L K2HPO4, 0.5 g/L MgSO4·7H2O, and 0.01 g/L FeSO4at initial pH of 7.0. The optimal culture times for harvesting fermentation broth, the supernatant, and resuspension were 5, 14, and 5 days, respectively. Conclusions: Strain NA-TXL-1 was identified as Streptomyces antibioticus, exhibiting stronger antagonistic effect under optimized fermentation conditions.
Pseudomonas syringae pv. actinidiae; antagonist; screening; identification; optimization of fermentation conditions
10.7506/spkx1002-6630-201716012
S476;Q939.9
A
1002-6630(2017)16-0079-07
2016-10-13
贵州省科技厅农业攻关资助项目(黔科合NY字(2009)3022);贵阳市科技局农业科技攻关计划资助项目(筑科农合合同字第(2009)2-007)
田雪莲(1991—),女,硕士研究生,研究方向为有害生物绿色治理及农产品质量安全。E-mail:591358886@qq.com
*通信作者:尹显慧(1978—),女,副教授,博士,研究方向为有害生物绿色治理及农产品质量安全。E-mail:agr.xhyin@gzu.edu.cn
田雪莲, 尹显慧, 龙友华, 等. 猕猴桃溃疡病拮抗菌筛选、鉴定及发酵条件优化[J]. 食品科学, 2017, 38(16): 79-85. DOI:10.7506/spkx1002-6630-201716012. http://www.spkx.net.cn
TIAN Xuelian, YIN Xianhui, LONG Youhua, et al. Screening, identification and optimization of fermentation conditions for antagonistic actinomycetes against Pseudomonas syringae pv. actinidiae[J]. Food Science, 2017, 38(16): 79-85. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716012. http://www.spkx.net.cn

