外源ABA对匍枝筋骨草悬浮细胞内源激素及蜕皮甾酮的影响
杨月月,迟德富,宇 佳
(东北林业大学林学院,中国 哈尔滨 150040)
外源ABA对匍枝筋骨草悬浮细胞内源激素及蜕皮甾酮的影响
杨月月,迟德富,宇 佳*
(东北林业大学林学院,中国 哈尔滨 150040)
通过分别向匍枝筋骨草悬浮培养体系中添加不同浓度的脱落酸(ABA)并测定添加后不同时间悬浮细胞的生长状况和生物量,以及蜕皮甾酮(20E)和ABA的浓度变化,筛选出最适宜添加浓度.通过测定悬浮细胞内玉米素(ZR)、赤霉素3(GA3)和吲哚乙酸(IAA)及20E的含量变化,探讨ABA对匍枝筋骨草悬浮细胞生长的影响.结果表明,添加0.15 mg·L-1ABA后细胞生长速度减缓,但在未褐化期ABA促进20E的累积,在第48 h和72 h悬浮细胞中20E含量显著地高于对照组,但在第96 h悬浮细胞出现褐化现象,20E含量下降极显著地低于对照组;向匍枝筋骨草悬浮体系中加入外源ABA,悬浮细胞内ABA含量呈上升趋势,ZR,GA3,IAA含量呈相对下降趋势;在相同条件下添加ABA抑制剂(Na2WO4),则ABA,ZR,GA3和IAA的变化趋势与添加ABA相反,对20E的影响不显著.
匍枝筋骨草;脱落酸;脱落酸抑制剂;钨酸钠;内源激素;蜕皮甾酮(β-蜕皮甾酮)
匍枝筋骨草(AjugalobataD. Don)属唇形目(Lamiales)唇形科(Lamiaceae)筋骨草属(Ajuga),一年或二年生草本植物[1-2],具有清热解毒、凉血平肝的药用作用[3-4].匍枝筋骨草富含蜕皮甾酮(20E),属于萜类化合物,通过类异戊二烯生物合成途径合成[5-6].20E有促进胶元蛋白合成、抗心律不齐、抗疲劳的作用,降胆固醇、血脂、血糖,治疗心肌缺血,股骨头坏死等,也是一种天然的抗癌制剂[7].化妆品中也有应用,具有增强细胞新陈代谢及活化、去斑增白作用[8].在昆虫防治方面,由于植物中的蜕皮甾酮与昆虫体内的蜕皮激素结构类似,具有影响昆虫蜕皮和生长发育的作用,制成植物源杀虫剂和生长调节剂,是对环境无毒无害的生物类农药[9].
脱落酸(abscisic acid,ABA)是一种调节植物生长发育的植物激素[10],有“逆境激素”之称.逆境条件会引起植物体内的ABA含量增加,添加外源ABA同样可诱导植株发生信号传递启动防御系统,抵御外界胁迫[11-12].除此之外,ABA可促使植物中酚类、酮类等次生代谢产物的增加[13-16].钨酸钠(Na2WO4)为ABA合成抑制剂,能抑制ABA合成过程中的ABA醛氧化酶(ABA-aldehydeoxidase),使ABA醛不能转化为ABA,从而抑制植物内源ABA的合成[17].吲哚乙酸(IAA)、赤霉素(GA3)和细胞分裂素(ZR)都是生长类激素,组织培养过程中添加适当浓度的生长类激素可促进植物细胞的分裂、生长和次生代谢产物的积累,其原因是生长类激素促进细胞生长及分裂,影响其代谢,从而次生代谢产物含量上升[18-20].ABA是一种较强的生长抑制剂,其对生长的作用与IAA,GA3和ZR三者相反,它对细胞的分裂与生长起抑制作用[21-24],却同样可以提高次生代谢产物含量,但原因和机制不明.
本研究通过在匍枝筋骨草悬浮培养体系中添加ABA或处理,分析ABA对悬浮细胞的各种内源激素和20E含量的影响,探讨ABA和Na2WO4诱导悬浮细胞中内源激素变化与20E合成存在的关系,为ABA诱导蜕皮激素合成的机制研究奠定基础,也可为利用细胞培养大规模生产植物20E提供一定的理论依据和技术支持.
1 试验与方法
1.1 材料
愈伤组织由匍枝筋骨草叶片诱导形成,再经悬浮培养得到悬浮细胞.
三重四极杆液质联用仪(Waters 公司),C18色谱柱(4.6 mm×250 mm,5 μm粒度,Waters 公司);GA3,IAA,ZR,ABA标准品(Sigma公司);蜕皮激素标品由上海中医大学提供.
1.2 方法
1.2.1 悬浮细胞的培养 采用赵晓杰等[25]方法,将筋骨草在固体培养基(MS+2,4-D 0.4 mg/L)上诱导成愈伤组织,然后将愈伤组织在无菌条件下接种到未添加琼脂的液体培养基内(MS+2,4-D 0.4 mg/L)悬浮培养,接种量为10%(即每50 mL培养基中接种筋骨草细胞鲜质量5 g),pH调至6.0.每隔7 d进行一次继代.本试验使用继代次数为4代的悬浮体系.培养条件:室内光照培养,温度为25 ℃,光/暗周期:16 h/8 h,光照强度2 000 lux,湿度为70%.摇床速度:110~120 r/min.
1.2.2 生物量的测定 将细胞悬浮液经48 μm细胞筛过滤,将滤出的细胞用滤纸吸干多余水分,60 ℃烘干12 h至恒重后,称量得到细胞干质量.每个试验组取5个平行样品,取其结果计算平均值及标准差.
1.2.3 蜕皮甾酮含量测定 蜕皮甾酮(20E)的提取:取干质量0.2 g,色谱纯甲醇5 mL浸泡24 h,超声1 h后进行微波消解(WT-8000,消解条件T:50 ℃,P:2P0,t:10 min,W:300×2).有机过滤膜过滤后,滤液直接用于HPLC检测.每12 h取样,每试验组取5个平行样品.蜕皮甾酮液相图谱如图1所示.
20E的检测条件:20E检测色谱柱(C18);紫外可见光检测波长范围190~800 nm;检测波长242 nm;流动相V(甲醛)∶V(水)=1∶1;流动相速度0.8 mL/min,进样量10 μL.每个样品重复检测3次.
标准曲线的绘制:配置浓度为0.8,0.4,0.2,0.1,0.05 g/L的蜕皮甾酮(20E)标准品溶液,检测方法同上.以峰面积的平均值为纵坐标,质量浓度为横坐标,得β-蜕皮甾酮回归方程为:y=18 498x+226.2,相关系数为0.999. 根据液相色谱检测试样20E相应峰面积,由标准曲线回归方程求出β-蜕皮甾酮含量.
1.2.4 内源激素含量测定 内源激素的提取:每试验组取5个平行样品.称取样品1.0 g于研钵中,加入10 mL -20 ℃过夜的80%甲醇水溶液,研磨成浆,转入PP管中密封,4 ℃冷浸过夜.离心得上清液,残渣加入5~8 mL 80%甲醇水溶液,冷浸2 h后离心得上清液,合并两份清液,室温以水泵旋蒸除去大部分甲醇,加入15 mL正己烷脱色3次,弃有机相,再换油泵将剩余溶剂旋干.加入pH 3.5的甲酸溶液2 mL,过C18 SPE柱,甲醇洗脱,收集液旋干,以移液器加入2.0 mL流动相(含0.1%甲酸),经滤膜过滤后测试.每个样品重复检测3次.
内源激素的检测:参考钟冬莲等方法[26-27].色谱条件,流动相V(乙腈)∶V(水)=3∶7;流速:0.2 mL/min;进样量:2.0 μL;色谱柱温度:35 ℃.质谱条件采用全扫描图谱,选择离子定量进行分析.离子源:电喷雾离子源(ESI),正离子方式检测; 离子喷射电压:5.5 kV;温度:300 ℃;源内气体:N2,压力:379 kPa;气帘气体(N2)压力:69 kPa;扫描方式为多重反应监测(MRM);碰撞气(N2)压力:Medium.内激素质谱图见图2.
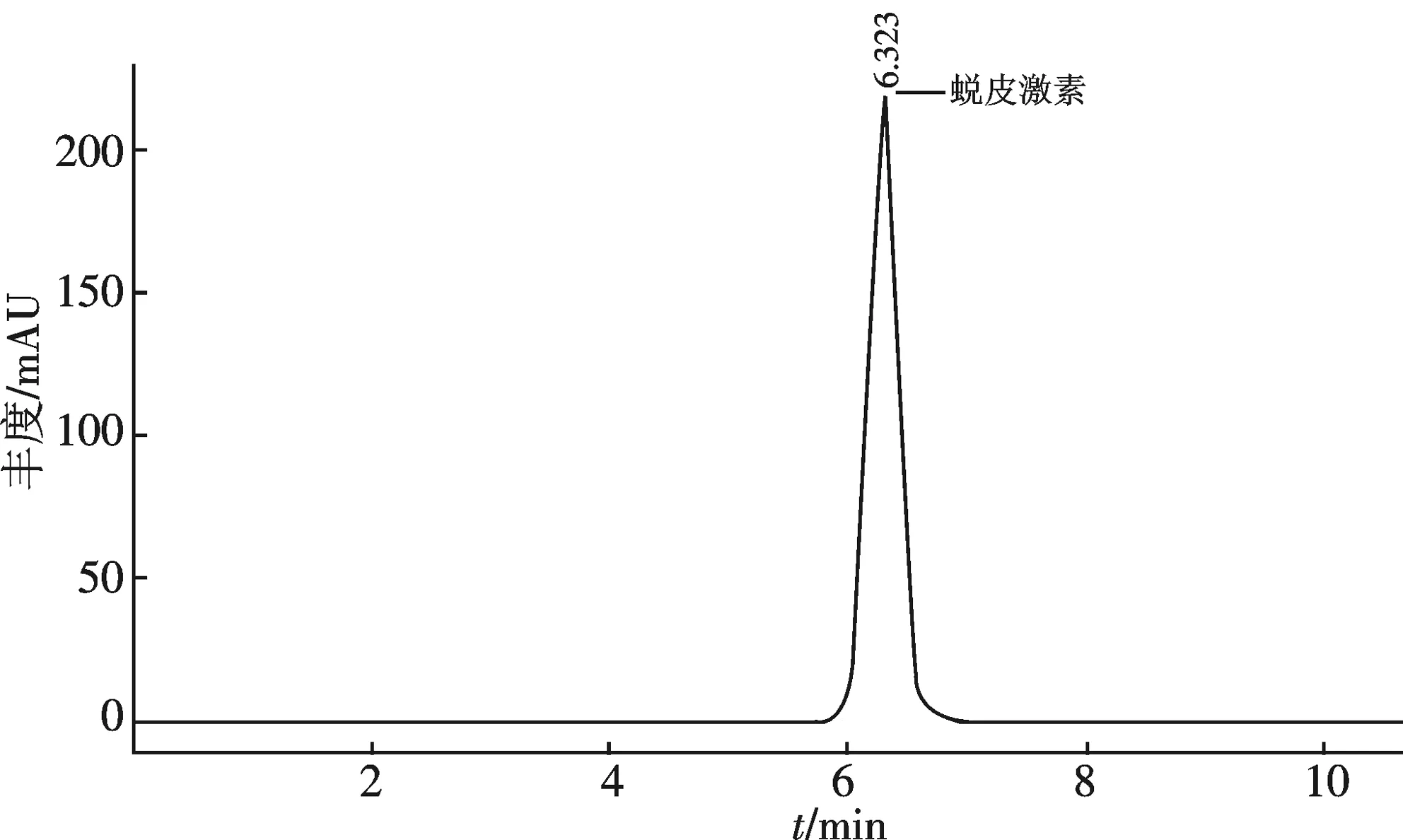
图1 蜕皮甾酮液相图谱Fig.1 The chromatogram of 20E by HPLC
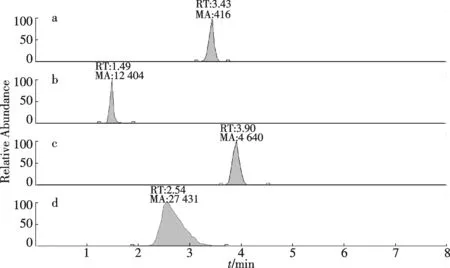
a.吲哚乙酸(IAA);b.玉米素(ZR); c.脱落酸(ABA);d.赤霉素(GA3)图2 内激素质谱图Fig.2 The mass spectrum of plant hormones
标准曲线的绘制:分别配置浓度为0.8,0.4,0.2,0.1,0.05 g/L的ZR,GA3,IAA和ABA标准品溶液,以各内源激素对应峰面积的平均值为纵坐标,质量浓度为横坐标,得内源激素回归方程(见表1).根据质谱检测的试样ZR,GA3,IAA和ABA相应峰面积,由标准曲线回归方程求出内源激素含量.

表1 内源激素标准曲线回归方程
1.2.5 ABA及ABA抑制剂最佳浓度的筛选 按照方法1.2.1的条件培养7 d,分别向悬浮体系中添加0.05,0.10,0.15,0.20 mg/L ABA 后每24 h进行取样,每个处理取3个平行样,按照1.2.3方法检测试样的20E含量,根据标准曲线回归方程求出β-蜕皮甾酮含量.β-蜕皮甾酮含量最高的处理组为最佳ABA添加浓度.
同样条件培养7 d,分别向悬浮体系中添加0.50,0.75,1.00,1.25 mg/L Na2WO4,每24 h取样,每个处理取3个平行样,按照1.2.4方法检测试样ZR,GA3,IAA和ABA含量,根据液相色谱检测的相应峰面积,由标准曲线回归方程求出内源激素含量.
1.3 数据分析
采用SPSS 19.0软件对所测数据统计分析,用平均值和标准误差表示测定结果,分别对ABA处理及Na2WO4处理结果进行单因素方差分析.采用Excel 2010绘图.
2 结果
2.1 ABA及ABA抑制剂对匍枝筋骨草悬浮细胞生长影响及最佳浓度的筛选
2.1.1 ABA对匍枝筋骨草悬浮细胞生长影响 根据前期预实验探究,设定 0.05,0.10,0.15,0.20 mg/L不同梯度ABA,向匍枝筋骨草悬浮体系中添加不同浓度ABA后,前72 h生长状况较为良好,悬浮培养体系为淡黄色,组织均一松散.第96 h悬浮培养的细胞出现褐化,悬浮培养体系为红褐色.生长状况如图3(彩图见封三)所示.

a.处理第24 h; b.处理第48 h; c.处理第72 h; d.处理第96 h图3 不同浓度ABA处理对匍枝筋骨草悬浮细胞生长的影响Fig.3 The growth condition of Ajuga lobata D.Don suspension cell
添加ABA后,细胞生物量增长速度与对照组相比较缓慢,添加的ABA浓度越高,其细胞生物量增长速度越缓慢(图4).添加0.05和0.10 mg/L的ABA与对照差异不显著.添加0.15 mg/L ABA的第96 h与对照差异显著(p<0.05), 添加0.20 mg/L ABA第48 h及第96 h时细胞干重与对照组差异显著(p<0.05).
计算出悬浮体系中蜕皮激素的总含量(细胞干质量×单位量中蜕皮激素含量),做进一步筛选试验,蜕皮激素含量变化如图5所示.添加0.05 mg/L ABA组中蜕皮激素含量变化与对照差异不显著;添加0.10 mg/L ABA组在第48 h蜕皮激素含量高于对照组,与对照差异显著(p<0.05);添加0.15 mg/L ABA组中蜕皮激素含量在第48 h与72 h与对照差异显著,分别高于对照组28.73%(p<0.01)和18.73%(p<0.05).第96 h细胞褐化,蜕皮激素含量较第72 h低但高于对照组;0.20 mg/L ABA处理组蜕皮激素含量呈先上升后下降趋势,分别第96 h低于对照组且差异显著(p<0.05).因此选出最佳ABA添加浓度为0.15 mg/L.
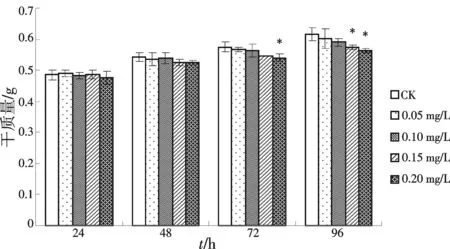
注:*代表与对照相比差异显著,**代表与对照相比差异极显著,下同.图4 不同浓度ABA处理对细胞生物量的影响Fig.4 The changes of cell biomass treated by ABA at different concentrations

图5 不同浓度外源ABA处理后匍枝筋骨草悬浮细胞中蜕皮甾酮含量变化Fig.5 The changes of 20E content in suspension cultured cell of Ajuga lobata D.Don treated by exogenous ABA at different concentrations
2.1.2 ABA抑制剂对匍枝筋骨草悬浮细胞生长影响及最佳浓度的筛选 添加不同浓度Na2WO4后ABA含量变化如图6所示,添加0.50,0.75,1.00 mg/L Na2WO4后细胞干质量有所上升,添加1.25 mg/L Na2WO4后细胞干质量呈下降趋势,在第72 h与第96 h与对照差异显著.
添加不同浓度Na2WO4后ABA含量下降,变化如图7所示.经0.50 mg/L Na2WO4处理后细胞中ABA含量与对照差异不显著,0.75 mg/L Na2WO4处理后的第72 h与第96 h与对照差异显著(p<0.05).经1.00 mg/L Na2WO4处理后的第48 h与对照差异显著(p<0.05),第72 h与第96 h与对照差异极显著(p<0.01).经1.25 mg/L Na2WO4处理后细胞内ABA含量与对照差异极显著.但是,在0.50,0.75及1.00 mg/L Na2WO4等3种浓度处理后的24,48和72 h,匍枝筋骨草悬浮细胞的生长均未表现出明显的不正常状况,而在1.25 mg/L Na2WO4处理后的72 h和第96 h,悬浮细胞生长量明显下降.因此认为1.00 mg/L为向匍枝筋骨草悬浮培养体系中添加Na2WO4的最适浓度.
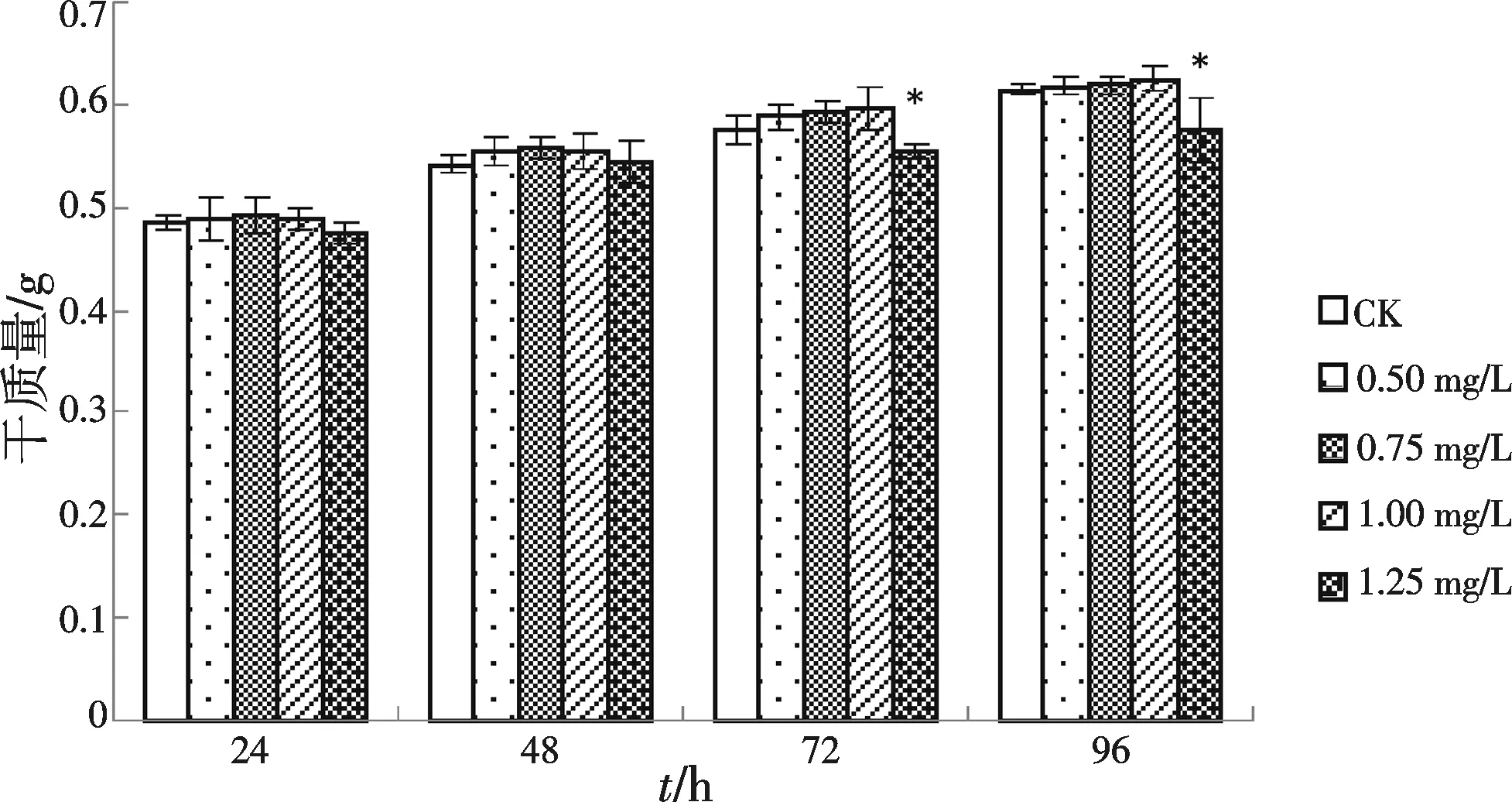
图6 经Na2WO4处理后细胞生物量变化图Fig.6 The changes of cell biomass treated by Na2WO4
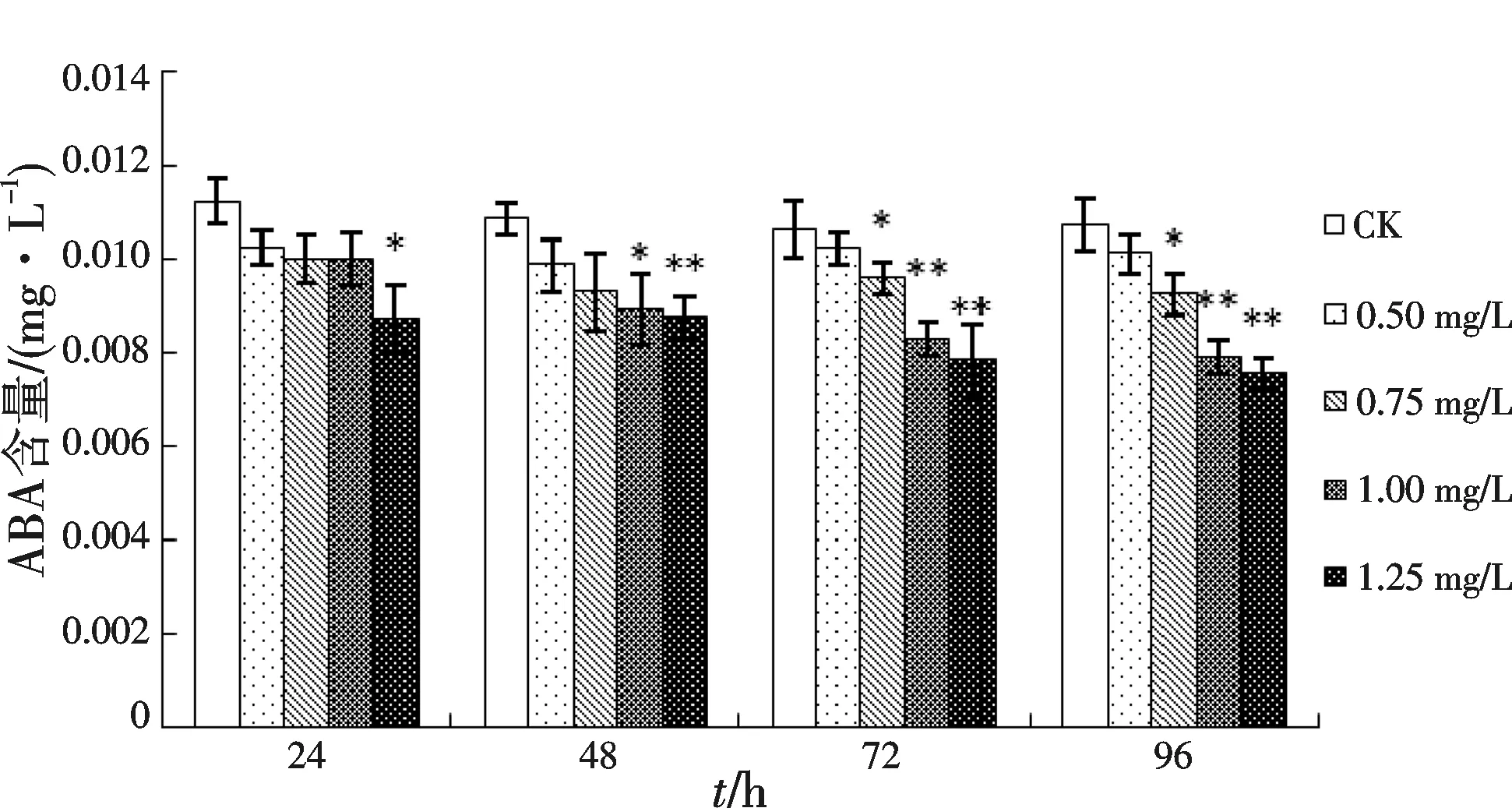
图7 不同浓度Na2WO4处理后匍枝筋骨草悬浮细胞中ABA含量变化Fig.7 The changes of ABA content in suspension cultured cell of Ajuga lobata D.Don treated by Na2WO4 at different concentrations
2.2 外源ABA及ABA抑制剂对细胞内激素影响
2.2.1 外源ABA及ABA抑制剂对ZR含量影响 如图8,向悬浮培养体系中添加0.15 mg/L外源ABA后,悬浮细胞内ZR含量呈下降趋势,到第72 h和第96 h,ZR的含量与对照相比差异极显著,低于对照组27.25%(p<0.01)和30.10%(p<0.01).向悬浮培养体系中添加1.00 mg/L Na2WO4后24~72 h,悬浮细胞中ZR含量与同期对照相比略有上升,但是上升幅度未达到差异显著的水平.而到了第96 h,悬浮细胞中的ZR含量高于对照组12.23%(p<0.05),差异显著.
2.2.2 外源ABA及ABA抑制剂对GA3含量的影响 如图9,向悬浮培养体系中添加0.15 mg/L外源ABA后,悬浮细胞内GA3含量呈下降趋势.添加后的第48 h,悬浮细胞内GA3的下降幅度与同期对照相比差异显著.到第72 h和第96 h,GA3的下降幅度进一步加大,分别低于对照组34.91%(p<0.01)和34.45%(p<0.01),均与其同期对照相比差异极显著.向悬浮系统添加1.00 mg/L Na2WO4后的第24 h,悬浮细胞内GA3含量呈上升趋势,在添加后的72 h和96 h,悬浮细胞内GA3含量均与同期对照相比极显著上升(p<0.01).
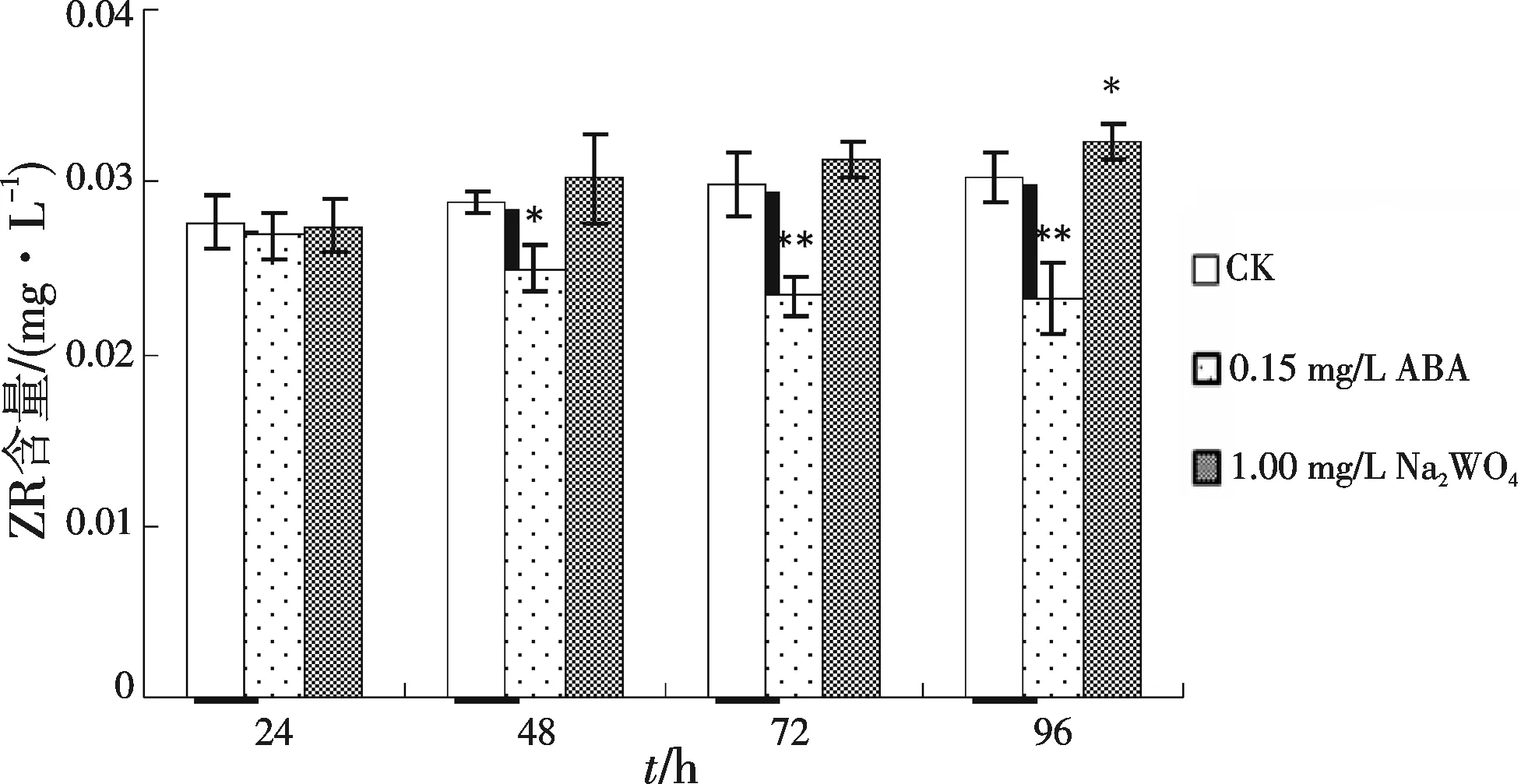
图8 添加外源ABA或Na2WO4后匍枝筋骨草悬浮细胞ZR含量变化Fig.8 The changes of ZR content in suspension cultured cell of Ajuga lobata D.Don after adding exogenous ABA or Na2WO4

图9 添加外源ABA或Na2WO4后匍枝筋骨草悬浮细胞GA3含量变化Fig.9 The changes of GA3 content in suspension cultured cell of Ajuga lobata D.Don after adding exogenous ABA or Na2WO4

图10 添加外源ABA或Na2WO4后匍枝筋骨草悬浮细胞IAA含量变化 Fig.10 The changes of IAA content of suspension cultured cell of Ajuga lobata D.Don after adding exogenous ABA or Na2WO4
2.2.3 外源ABA及ABA抑制剂对IAA含量的影响 如图10,向悬浮培养体系中添加0.15 mg/L外源ABA后,悬浮细胞内IAA含量呈下降趋势.在添加后的第24,48,72 h,IAA的下降水平与同期对照相比差异显著(p<0.01);第96 h IAA的水平与同期对照相比差异极显著.添加1 mg/L Na2WO4后细胞内IAA含量上升,第48 h与对照差异显著(p<0.05),第72 h和96 h IAA含量均与同期对照相比上升极显著(p<0.01).
2.2.4 外源ABA及ABA抑制剂对ABA含量的影响 如图11,向悬浮培养体系中添加0.15 mg/L外源ABA后的第24 h和第48 h,细胞内的ABA含量与同期对照相比呈现了小幅上升的状态,但上升幅度未达到差异显著的程度;在添加后的第72 h和第96 h,细胞内的ABA含量继续上升,分别比同期对照提高46.29%(p<0.01)和49. 61%(p<0.01),并且均达到差异极显著水平.向悬浮培养体系中添加1 mg/L Na2WO4后,悬浮细胞内ABA含量一直呈下降趋势.在添加后的第24 h,ABA含量比同期对照略有下降,但未达到差异显著水平.到第48 h,ABA含量比同期对照下降了24.90%(p<0.05),处于差异显著状态;在添加后的第72 h和第96 h,ABA含量分别比同期对照下降了44.61%(p<0.01)和52.24%(p<0.01),均处于极显著下降状态.
2.3 外源ABA及ABA抑制剂对蜕皮甾酮含量的影响
在悬浮培养体系中添加0.15 mg/L外源ABA和1 mg/L Na2WO4后,20E含量变化如图12所示.添加外源ABA后24 h,匍枝筋骨草悬浮细胞中20E含量略有上升,但与同期对照相比,未达到差异显著水平;在添加后的48 h,悬浮细胞中20E含量极显著地高于同期对照的水平(p<0.01);第72 h,20E含量显著地高于同期对照(p<0.05);第96 h细胞褐化死亡,20E含量极显著地低于同期对照组的水平(p<0.01).向悬浮培养体系中添加Na2WO4后,20E含量在第24,48,72或96 h分别出现了与同期对照相比略微升高或略微下降的波动,但是这种波动始终未达到差异显著的水平.
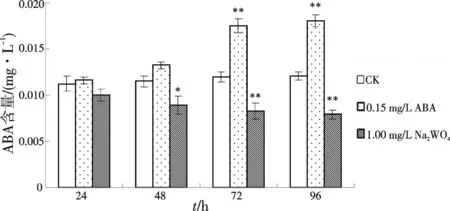
图11 添加外源ABA或Na2WO4后匍枝筋骨草悬浮细胞内ABA含量变化Fig.11 The changes of ABA content in suspension cultured cell of Ajuga lobata D.Don after adding exogenous ABA or Na2WO4

图12 添加外源ABA或Na2WO4后匍枝筋骨草悬浮细胞内蜕皮甾酮(20E)含量变化Fig.12 The changes of 20E content in suspension cultured cell of Ajuga lobata D.Don after adding exogenous ABA or Na2WO4
3 讨论
3.1 外源ABA及ABA抑制剂对细胞内激素影响
本试验添加外源ABA后,ZR,IAA和GA3含量下降,而ABA含量升高.该现象与其他外施ABA的实验结果非常相似,如研究发现在盆栽烟草(NicotianatabacumL.)的叶片上喷施ABA后,抑制了烟草叶片中内源激素IAA 与GA3的合成[21].在3年生紫花苜蓿(Medicagosativa)的植株上喷施ABA后,其顶芽和第一展开叶中ABA 含量均随外源ABA 喷施浓度水平的提高而增加,IAA和GA3含量则表现出与ABA 相反的递减趋势[22].ABA处理柱花草的结果表明,ABA处理植株的ABA含量升高,IAA,GA1+3和iPAs的含量降低[23].其原因是植物激素具有相互调节功能,ABA的含量增多对生长类激素产生抑制作用[28].
添加ABA抑制剂Na2WO4后,ABA含量大幅度下降,ZR,GA3和IAA含量小幅度上升.其原因是,Na2WO4抑制了ABA合成过程中的ABA醛氧化酶,使ABA醛不能转化为ABA[17],因而抑制悬浮细胞内ABA的生物合成,降低了细胞中的ABA含量,也增强了细胞进一步分裂和生长的势头,所以出现了ZR,GA3和IAA含量上升的现象.本研究的现象与周碧燕等的研究结果相似,以ABA 合成抑制剂Na2WO4处理柱花草,ABA含量降低,IAA,GA1+3和iPAs 的含量升高[23].本试验添加Na2WO4后悬浮细胞内ABA,ZR,GA3和IAA的变化规律,进一步说明了内源ABA对其他内源激素的影响,及细胞中各种内源激素协调平衡.
匍枝筋骨草悬浮细胞褐化的现象也与内激素的变化有关,玉米素ZR是细胞分裂素,可促进细胞分裂并使细胞体积扩大;生长素IAA通过细胞核的分裂来进行组织的生长;赤霉素GA3则通过缩短细胞分裂周期的G1期和S期来加速细胞分裂[28-29].在添加了外源ABA后,此时用于缩短分裂周期、促进细胞核分裂、刺激细胞分裂的相应激素含量降低,细胞的生长发育变缓,促使悬浮细胞提前进入到衰老及死亡进程[29].
3.2 外源ABA及ABA抑制剂对蜕皮甾酮含量的影响

到目前为止没有检索到添加ABA抑制剂Na2WO4后,如何影响植物萜类含量变化的相关研究.本研究也只是发现,尽管在匍枝筋骨草悬浮培养体系中添加Na2WO4后,出现了ZR,GA3和IAA含量上升及ABA含量下降的现象.但是在添加后24~96 h悬浮细胞中20E的含量与同期对照相比出现了小幅波动,而且波动过程始终未达到显著差异的水平,说明由于ABA含量下降导致其他生长类激素含量上升,但未达到促进匍枝筋骨草蜕皮激素积累的程度,影响作用不大.其原因尚需要从添加Na2WO4后对悬浮细胞合成20E相关的各种激素水平、关键前体物质的浓度、多种酶的活性等方面加以深入地研究.
[1] COLL J, TANDRON Y A. Nro-Clerodane diterpenoids fromAjugastructural elucidation and biological activity[J]. Phytochem Rev, 2008,23(7):25-49.
[2] TAKASAKI M, TOKUDA H, NISHINO H,etal. Cancer chemopreventive agents (Antitumor-promoters) fromAjugadecumbens[J]. J Nat Prod, 1999,62(7):972-9755.
[3] 郭新东,黄志纾,鲍雅丹,等. 筋骨草的化学成分研究[J]. 中草药, 2005,36(5):646-648.
[5] BACH T. Some new aspects of isoprenoid biosynthesis in plants—a review[J]. Lipids, 1995,30:191-202.
[6] DINAN L. Phytoecdysteroids: biological aspects[J]. Phytochemistry, 2001,57(3):325-339.
[7] 熊 焰,曲 玮,梁敬钰.筋骨草属植物化学成分和药理作用研究进展[J].海峡药学 ,2012,24(2):1-7.
[8] 赵一璐,邢朝云,陈晶磊,等. 植物蜕皮激素药理活性研究进展[J]. 抗感染药学, 2010,7(3):147-152.
[9] 迟德富,邵景文,孙 凡,等. 筋骨草内蜕皮激素类似物对一些刺吸式口器昆虫及其天敌的影响[J]. 东北林业大学学报, 1997,25(5):91-96.
[10] 徐平珍,刘 涛,杨莹,等. 脱落酸在植物花发育过程中的作用[J].植物分类与资源学报, 2007,29(2):215-222.
[11] 刘春玲,陈慧萍,刘娥娥,等. 水稻品种对几种逆境的多重耐性及与ABA的关系[J]. 作物学报, 2003,29(5):725-729.
[12] REN F, ZHANG R J, QIANG C. Progress in ABA and SA improving plant drought resistance and salt resistance[J]. Biotechnol Bull, 2012,3:17-21.
[13] SANDHU A K, GRAY D J, LU J,etal. Effects of exogenous abscisic acid on antioxidant capacities anthocyanins and flavonol contents of muscadine grape (Vitisrotundifolia) skins[J]. Food Chem, 2011,126(3):982-988.
[14] BURAN T J, SANDHU A K, AZEREDO A M,etal. Effects of exogenous abscisic acid on fruit quality, antioxidant capacities, and phytochemical contents of southern high bush blueberrie[J]. Food Chem, 2012,132(3):1375-1381.
[15] 崔北米,梁宗锁,刘 岩,等. ABA及其生物合成抑制剂对丹参毛状根酚酸类成分和关键酶的影响[J]. 中国中药杂志, 2012,37(6):754-759.
[16] 盛东峰,张永亮. 脱落酸处理对丹参毛状根中丹参酮积累的影响[J]. 中药材, 2013,36(3):354-358.
[17] MANSOURI H, ASRAR Z, SZOPA J. Effects of gibberellic acid on primary terpenoids and 9-tetrahydrocannabinol in cannabis sativa at flowering stage[J]. J Integr Plant Bio,2009, 51(6):553-561.
[18] 戴梓茹,黎继烈. 激素对植物细胞悬浮培养代谢产物的影响研究进展[J]. 中国生物工程杂志, 2007,27(6):118-122.
[19] EL-SAYED M, VERPOORTE R. Effect of phytohormones on growth and alkaloid accumulation by a Catharanthus roseus cell suspension cultures fed with alkaloid precursors tryptamine and loganin[J].Plant Cell Tissue Organ Cult, 2002,68(3):265-270.
[20] QIAN J J, YANG Y Y, LI X,etal. 20-hydroxyecdysone accumulation and regulation inAjugalobataD. Don suspension culture[J]. Biosci Biotechnol Biochem, 2016,80(3):591-599.
[21] 周继华,聂红资,豆显武,等. 外源GA3与ABA 对烤烟叶片内源激素及钾素含量的影响[J]. 甘肃农业大学学报, 2009,44(5):61-66.
[22] 王成章,潘晓建,张春梅,等. 外源ABA对不同秋眠型苜蓿品种植物激素含量的影响[J]. 草业学报, 2006,15(2):30-36.
[23] 周碧燕,郭振飞. ABA及其合成抑制剂对柱花草抗冷性及抗氧化酶活性的影响[J].草业学报, 2005,14(6):94-99.
[24] 黄 杏,陈明辉,杨丽涛,等.低温胁迫下外源ABA 对甘蔗幼苗抗寒性及内源激素的影响[J]. 华中农业大学学报, 2013,32(4):6-11.
[25] 赵晓杰,李晓灿,宇 佳,等.生长调节剂和培养方式对匍枝筋骨草生根及β-蜕皮激素量的影响[J].中草药, 2011,42(9):1828-1832.
[26] 钟冬莲,丁 明,汤富彬,等.高效液相色谱串联质谱同时测定毛竹笋中4种内源性植物激素[J]. 分析化学, 2013,41(17):1739-1743.
[27] 贾鹏禹,曾明飞,冯乃杰,等. 在线固相萃取-高效液相色谱-串联质谱法同时检测大豆不同部位的4种植物激素[J].分析化学, 2014,42(12):1743-1749.
[28] 段 娜,贾玉奎,徐 军,等. 植物内源激素研究进展[J]. 中国农学通报, 2015,31(2):159-165.
[29] 郭文雅,赵京献,郭伟珍. 脱落酸(ABA)生物学作用研究进展[J]. 中国农学通报, 2014,30(21):205-210.
[30] YANG D F, SHENG D F, DUAN Q M,etal. PEG and ABA trigger the burst of reactive oxygen species to increase tanshinone production inSalviamiltiorrhizahairy roots[J]. J Plant Growth Regul, 2012,31:579-587.
[31] 刘莉嘉,杨 鑫,彭玉帅,等. 丹参酮生物合成的关键酶研究进展[J].中草药, 2015,46(1):140-147.
[32] 覃柳燕,李 力,缪剑华. 环境胁迫对药用植物次生代谢产物的影响[J]. 湖北农业科学, 2012,51(8):1528-1532.
[33] 杨月月,迟德富,宇 佳. ABA对匍枝筋骨草防御酶活性及蜕皮激素合成的影响[J]. 湖南师范大学自然科学学报, 2015,38(3):16-21.
(编辑 WJ)
Influence of Exogenous ABA on Endogenesis Hormone and Ecdysterone in Suspension Cultures Cell ofAjugaLobataD. Don
YANYYue-yue,CHIDe-fu*,YUJia
(College of Forest, Northeast Forest University, Harbin 150040, China)
The optimal concentration of abscisic acid (ABA) was evaluated in this work by adding different concentrations of ABA into the suspension cell cultures system ofAjugalobataD. Don. The growing status, biomass of suspension cultures cell, concentration of ecdysterone (20E) were measured after adding those substances. Upon the selection of optimal concentration, 0.15 mg·L-1ABA was added intoAjugalobataD.Don suspension cell culture system, then changes of endogenous phytohormones, such as zeatin(ZR), gibberellin 3(GA3), Hetero auxin(IAA) and 20E content were determined with HPLC, and the impact of ABA on plant endogenous hormone content and 20E synthesis in suspension cultures cell ofAjugalobataD. Don were analyzed. Adding ABA in the suspension cell culture system, we found that the growing speed of suspension cell was decreased, but without browning, ABA promoted the accumulation of 20E. At 48 h and 72 h after the addition of ABA, the content of 20E was significantly higher than that in the control group, and at 96 h after its addition, those treated with suspension cells became browning, and the dry weight of those cells was significantly lower than that of the control group. The content of endogenous ZR, GA3and IAA in the treated suspension cell was also decreased. After the addition of Na2WO4into the suspension cell culture system, the change trend of ABA, ZR, GA3and IAA was opposite to that of adding ABA, and their range of 20E concentration change never reached to the significant difference level as compared with that of the control group.
AjugalobataD.Don; abscisic acid (ABA); ABA inhibitors; Na2WO4; endogenous hormone; ecdysterone (20E,20-hydroxyecdysone)
10.7612/j.issn.1000-2537.2017.04.005
2016-12-02
国家自然科学基金资助项目(31370649)
Q946;Q813
A
1000-2537(2017)04-0026-08
*通讯作者,E-mail:chidefu@126.com

