铯催化高立体、区域选择性制备硫(硒)代替加氟烯烃
谭 平,罗湘贵,许新华
(1.湖南机电职业技术学院,中国 长沙 410151;2.湖南省机械研究所,中国 长沙 410116;3.湖南大学化学化工学院,中国 长沙 410082)
铯催化高立体、区域选择性制备硫(硒)代替加氟烯烃
谭 平1,罗湘贵2,许新华3**
(1.湖南机电职业技术学院,中国 长沙 410151;2.湖南省机械研究所,中国 长沙 410116;3.湖南大学化学化工学院,中国 长沙 410082)
以替加氟和3-对甲苯磺酰基丙炔为原料,制备出替加氟炔烃化合物,继而以廉价的氢氧化铯作为催化剂,催化替加氟炔烃和二芳基二硫(硒)醚反应,高立体、区域选择性制备硫(硒)代替加氟烯烃.该方法具有环境友好,产率高,反应条件温和,立体、区域选择性高等优点,为硫(硒)代替加氟烯烃的制备提供了一个新方法.该类硫(硒)代替加氟烯烃化合物有望成为一种有效的抗肿瘤药物.
氢氧化铯;替加氟;二芳基二硫(硒)醚;替加氟炔烃;硫(硒)代替加氟烯烃
替加氟是一种抗嘧啶药5-氟尿嘧啶的衍生物,可以阻止肿瘤细胞嘧啶类核苷酸形成的抗代谢药物[1].替加氟主要在肝内活化为氟尿嘧啶而起作用,其作用机理与氟尿嘧啶相同.替加氟在体内能干扰、阻断蛋白质、DNA及RNA的合成而发挥抗肿瘤作用,主要用于治疗胃、直肠、结肠、肝、乳癌等癌症.替加氟由于存在一定的不良反应而受到一定的限制[2-4]. 如何使其在发挥抗肿瘤作用的同时减少毒副作用,成为广大科研工作者关注的焦点[5-7].有机硫族化合物由于其良好的生物活性及其在化学反应中的立体及区域选择性,成为有机化学中极具吸引力的合成目标产物[8-9].近十年来,许多有用的有机硫化合物相继被合成[10-14].在这些化合物合成过程中,有机硫基烯烃作为中间体发挥着重要的作用,尤其在某些功能性烯烃化合物的区域选择性和立体选择性合成方面[15-17].同时,有机硫基烯烃也是重要的配体[18],在新型光学材料的先导化合物的制备中也具有重要作用[19].此外,有机硫族化合物在毒理学和药物化学中也具有重要的作用[20].因此,有机硫族烯烃化合物的制备引起了广大科研工作者的兴趣,这些方法主要包括Pd[21]或Rh[22]等过渡金属催化下的二芳基二硫醚与端炔的反应,PhSeBr催化炔硫醚与硫酚反应[23],光催化下端炔与二芳基二硫(硒)醚反应[24].这些方法中有些使用强刺激性、毒性较大的硫醇或难以制备的PhSeBr作为催化剂,增加了反应操作的危险性和复杂性.在光催化或Pd(Rh)等过渡金属催化下,端炔与二芳基二硫(硒)醚的反应可以有效进行,但这些方法通常得到难以分离的E/Z构型混合物.本文使用廉价、易得的CsOH·H2O作为催化剂,催化替加氟炔烃和二芳基二硫(硒)醚反应,高立体、区域选择性地制备了 (Z)-1,2-二芳硫(硒)基-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯.该方法为硫(硒)代替加氟烯烃的制备提供了一个简便的方法.该类新型的替加氟衍生物结合了有机硫(硒)的生物活性和替加氟的抗肿瘤活性,有望通过结构修饰增强替加氟的抗炎抗肿瘤生物活性,降低其毒副作用,开发出一种新的抗菌抗肿瘤药物.
1 实验
1.1 原料和分析方法
1H NMR与13C NMR (以CDCl3作溶剂,TMS为内标) 用BRUKER AC-P400型仪测定,质谱由VG Auto Spec-300仪测定.
氢氧化铯从Aldrich公司购买,炔丙醇、对甲苯磺酰氯、替加氟、溴苯从上海国药集团购买,苯硫酚、硒粉从百灵威公司购买.硅胶为青岛海洋化工厂产品,型号为GF254.
1.2 3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙炔的制备 (1a)
在50 mL的单口瓶中加入3-对甲苯磺酰基丙炔 (1.0 mmol)、替加氟 (1.0 mmol)、碳酸钾 (1.0 mmol)和乙腈 (3 mL),油浴中80 ℃回流,TLC跟踪反应进程.反应结束后,冷却至室温,过滤除去碳酸钾.旋蒸溶剂乙腈,然后通过柱层析纯化 (洗脱剂:V(石油醚)∶V(乙酸乙酯)=2∶1),得到3-(N1-(2-呋喃基)-N3-(5-氟尿嘧啶))-1-丙炔(1a),产率98%.1H NMRδ(ppm) 1.89~1.98 (m, 1H), 2.02~2.12 (m, 2H), 2.20 (s, 1H), 2.40~2.50 (m, 1H), 3.98~4.02 (m, 1H), 4.20~4.28 (m, 1H), 4.72 (t,J=4.0 Hz, 2H), 6.01~6.03 (m, 1H), 7.42 (d,J=6.0 Hz, 1H);13C NMRδ(ppm) 23.80, 30.68, 33.07, 70.68, 79.55, 88.24, 122.12, 138.72, 141.06, 148.37, 156.20; MSm/z(M+): 238.
1.3 化合物3a-3h的合成
以(Z)-1,2-二苯硒基-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯的制备为例,室温下,将1.0 mmol CsOH·H2O加入2.0 mL DMF溶液中,搅拌下加入3-(N1-(2-呋喃基)-N3-(5-氟尿嘧啶))-1-丙炔1.0 mmol,搅拌15 min后,加入1.0 mmol二苯基二硒醚, 氮气保护下反应2 h, TLC跟踪反应,反应完全后,将20 mL水倒入反应瓶中,用乙醚萃取三次(20 mL×3),合并有机相,无水Na2SO4干燥,将旋蒸溶剂后的剩余物经快速柱层析得到目标产物3a,用石油醚/乙酸乙酯(体积比2∶1)做洗脱剂,产率85%.
(Z)-1,2-二苯硫基-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3a):1H NMRδ(ppm): 1.78~1.83 (m, 1H), 1.93~1.98 (m, 2H), 2.32~2.36 (m, 1H), 3.58 (s, 2H), 3.94~3.98 (m, 1H), 4.15~4.18 (m, 1H), 4.82 (d,J=8.9 Hz, 2H), 5.80 (s, 1H), 7.15~7.58 (m, 10H).13C NMRδ(ppm): 22.8, 34.3, 46.8, 68.8, 102.0, 118.9, 128.3, 128.9, 129.9, 131.7, 132.1, 134.8, 138.9, 140.2, 150.6, 163.8. MSm/z(M+): 456.
(Z)-1,2-二(对甲苯硫基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3b):1H NMRδ(ppm): 1.80~1.88 (m, 1H), 2.00~2.03 (m, 2H), 2.34 (s, 6H), 2.39~2.43 (m, 1H), 3.63 (s, 2H), 3.94~3.98 (m, 1H), 4.23~4.26 (m, 1H), 4.85 (d,J=8.6 Hz, 2H), 5.80 (s, 1H), 7.23~7.62 (m, 8H).13C NMRδ(ppm): 21.5, 23.5, 34.6, 46.5, 68.4, 102.8, 120.0, 126.7, 127.9, 128.8, 129.7, 131.5, 136.6, 138.8, 140.0, 141.2, 151.8, 162.6. MSm/z(M+): 484.
(Z)-1,2-二(对甲基苯硫基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3c):1H NMRδ(ppm): 1.76~1.81 (m, 1H), 1.93~1.99 (m, 2H), 2.33~2.36 (m, 1H), 3.63 (s, 2H), 3.85 (s, 6H), 4.01~4.05 (m, 1H), 4.18~4.22 (m, 1H), 4.79 (d,J=8.5 Hz, 2H), 5.76 (s, 1H), 7.18~7.58 (m, 8H).13C NMRδ(ppm): 23.3, 34.5, 46.6, 56.8, 68.5, 102.8, 114.6, 119.1, 121.9, 123.33, 129.1, 135.2, 137.8, 140.8, 150.9, 160.8, 163.0. MSm/z(M+): 516.
(Z)-1,2-二(对溴苯硫基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3d):1H NMRδ(ppm):1.77~1.82 (m, 1H), 1.91~1.95 (m, 2H), 2.36~2.40 (m, 1H), 3.52 (s, 2H), 3.90~3.95 (m, 1H), 4.16~4.19 (m, 1H), 4.76 (d,J=8.8 Hz, 2H), 5.78 (s, 1H), 7.20~7.66 (m, 8H).13C NMRδ(ppm): 22.7, 33.6, 45.7, 68.3, 102.1, 119.0, 123.3, 128.0, 129.6, 131.8, 134.1, 138.0, 140.5, 151.0, 163.6. MSm/z(M+): 614.
(Z)-1,2-二(对苯硒基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3e):1H NMRδ(ppm):1.75~1.82 (m, 1H), 1.90~2.08 (m, 2H), 2.28~2.38 (m, 1H), 3.59 (s, 2H), 3.89~3.98 (m, 1H), 4.12~4.20 (m, 1H), 4.82 (d,J=8.8 Hz, 2H), 5.82 (m, 1H), 7.17~7.60 (m, 10H).13C NMRδ(ppm): 23.0, 34.1, 46.0, 68.3, 102.4, 118.7, 128.4, 128.7, 129.3, 130.7, 131.1, 134.4, 138.1, 140.2, 151.4, 162.9. MSm/z(M+): 552.
(Z)-1,2-二(对甲基苯硒基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3f):1H NMRδ(ppm): 1.73~1.80(m, 1H), 1.92~2.06 (m, 2H), 2.34 (s, 6H), 2.39~2.43 (m, 1H), 3.60 (s, 2H), 3.94~4.03 (m, 1H), 4.18~4.23 (m, 1H), 4.83 (d,J=8.7 Hz, 2H), 5.85 (s, 1H), 7.15~7.58 (m, 8H).13C NMRδ(ppm): 21.3, 23.2, 34.3, 46.3, 68.2, 102.6, 119.0, 126.3, 127.7, 128.4, 129.8, 131.0, 136.9, 138.1, 138.4, 140.2, 151.4, 162.9. MSm/z(M+): 580.
(Z)-1,2-二(对甲氧苯硒基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3g):1H NMRδ(ppm): 1.72~1.79 (m, 1H), 1.94~1.99 (m, 2H), 2.30~2.37 (m, 1H), 3.61 (s, 2H), 3.83 (s, 6H), 3.98~4.03 (m, 1H), 4.15~4.20 (m, 1H), 4.81 (d,J=9.0 Hz, 2H), 5.79 (s, 1H), 7.12~7.55 (m, 8H).13C NMRδ(ppm): 23.1, 34.0, 46.2, 55.8, 68.5, 102.5, 114.3, 118.7, 121.6, 123.0, 128.4, 134.7, 138.1, 140.2, 151.3, 160.6, 162.8. MSm/z(M+): 612.
(Z)-1,2-二(对溴苯硒基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯 (3h):1H NMRδ(ppm): 1.79~1.86 (m, 1H), 1.93~2.00 (m, 2H), 2.38~2.43 (m, 1H), 3.56 (s, 2H), 3.94~4.00 (m, 1H), 4.19~4.24 (m, 1H), 4.79 (d,J=8.6 Hz, 2H), 5.81 (s, 1H), 7.25~7.60 (m, 10H).13C NMRδ(ppm): 22.8, 33.8, 45.8, 68.0, 102.0, 118.7, 123.1, 128.3, 129.7, 131.6, 134.5, 138.1, 140.0, 151.2, 163.2. MSm/z(M+): 708.
2 结果与讨论
2.1 反应条件优化
以3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙炔 (1.0 mmol)与二苯基二硫醚(1.0 mmol)的反应作为模型反应(Scheme 1), 考察不同催化剂、反应温度、溶剂、催化剂用量和反应时间对反应的影响(见表1).

Scheme 1 替加氟炔烃与二苯基二硒醚反应Scheme 1 The reaction of tegafur alkynes with diphenyl diselenide
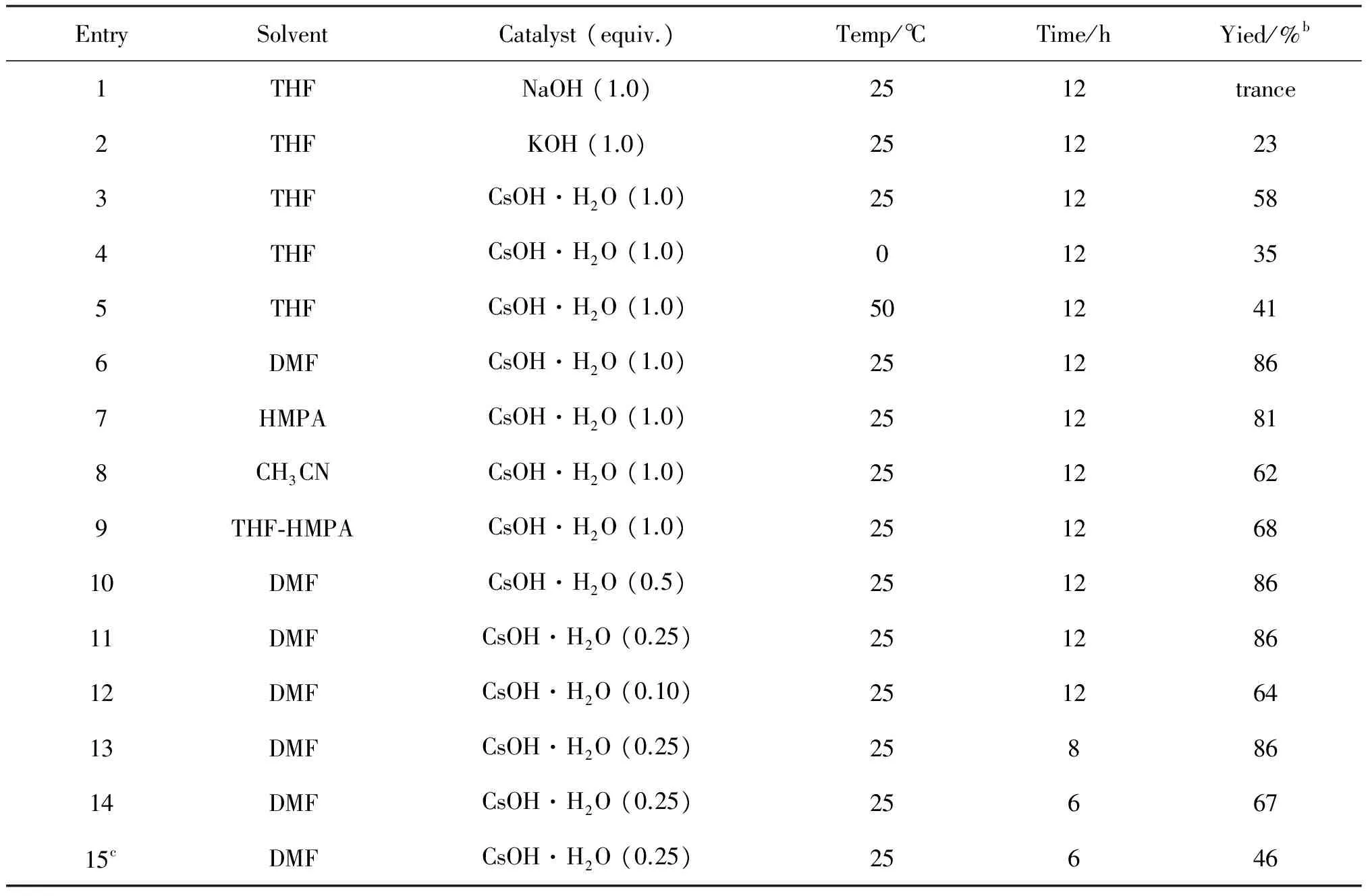
EntrySolventCatalyst(equiv.)Temp/℃Time/hYied/%b1THFNaOH(1.0)2512trance2THFKOH(1.0)2512233THFCsOH·H2O(1.0)2512584THFCsOH·H2O(1.0)012355THFCsOH·H2O(1.0)5012416DMFCsOH·H2O(1.0)2512867HMPACsOH·H2O(1.0)2512818CH3CNCsOH·H2O(1.0)2512629THF⁃HMPACsOH·H2O(1.0)25126810DMFCsOH·H2O(0.5)25128611DMFCsOH·H2O(0.25)25128612DMFCsOH·H2O(0.10)25126413DMFCsOH·H2O(0.25)2588614DMFCsOH·H2O(0.25)2566715cDMFCsOH·H2O(0.25)25646
a反应条件: 3-(N1-(2-呋喃基)-N3-(5-氟尿嘧啶))-1-丙炔(1a, 1.0 mmol), 二苯基二硫醚(2a, 1.0 mmol), 反应溶剂 (2 mL), N2.b分离产率.c反应在空气氛围下进行.
由表1可知,CsOH·H2O是最好的催化剂,在CsOH·H2O催化下,3-(N1-(2-呋喃基)-N3-(5-氟尿嘧啶))-1-丙炔与二苯基二硫醚的反应在室温条件下就可以有效进行,以58%的产率得到目标产物(entry 3).由entries 3~5可知,25 ℃为该反应进行的最佳反应温度,当反应温度升高或降低时反应产率均有所下降.反应温度太低,反应速率较慢,而当反应温度升高时,反应选择性降低.考察不同反应溶剂可知,DMF是该反应进行的最佳溶剂,主要因为DMF对反应底物和催化剂都具有较好的溶解性.最后考察催化剂用量和反应时间对反应的影响,在0.25当量催化剂的催化下,反应进行8 h,即可获得86%的产率(entry 13).在最优化反应条件下,将反应置于空气氛围下,反应产率较低,且有部分炔硒醚存在.综上所述,该反应进行的最佳条件为:3-(N1-(2-呋喃基)-N3-(5-氟尿嘧啶))-1-丙炔(1a, 1.0 mmol), 二苯基二硫醚(2a, 1.0 mmol), DMF (2 mL), CsOH·H2O (0.25 equiv.),反应在25 ℃下,N2氛围下进行8 h.
2.2 反应适用性
在最优化条件下, 考察3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙炔与不同的二芳基二硫(硒)醚的反应情况,结果见表2.

表2 硫(硒)代替加氟烯烃的合成a
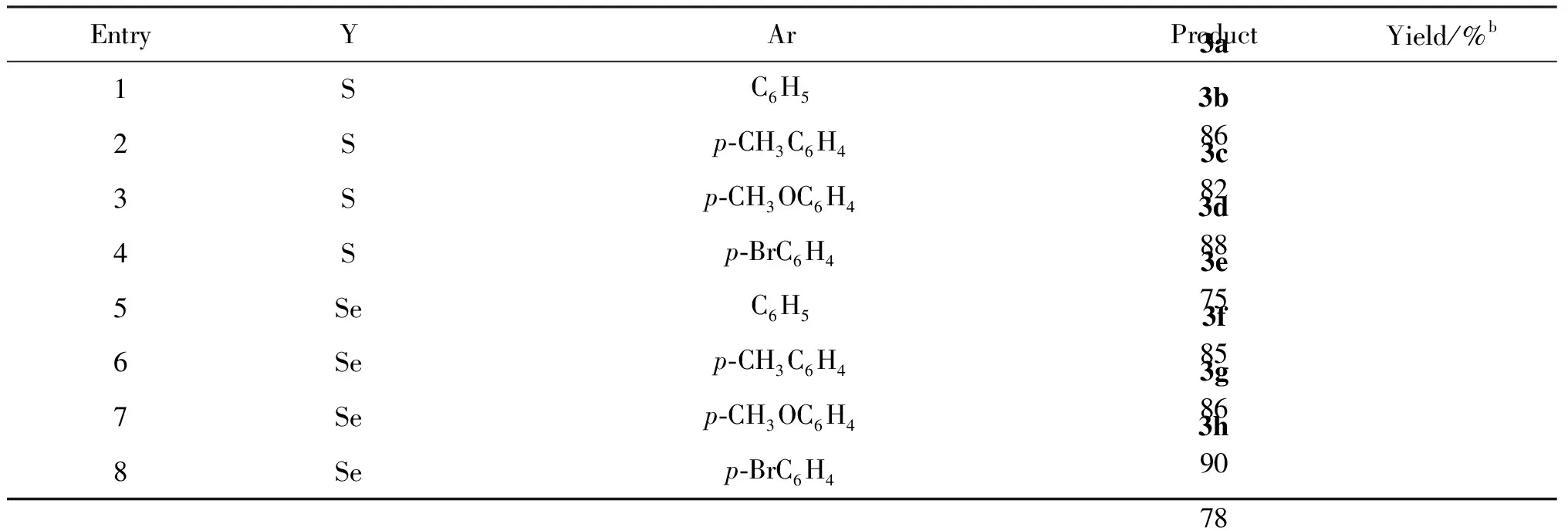
EntryYArProductYield/%b1SC6H53a862Sp⁃CH3C6H43b823Sp⁃CH3OC6H43c884Sp⁃BrC6H43d755SeC6H53e856Sep⁃CH3C6H43f867Sep⁃CH3OC6H43g908Sep⁃BrC6H43h78
a反应条件: 3-(N1-(2-呋喃基)-N3-(5-氟尿嘧啶))-1-丙炔 (1a, 1.0 mmol), 二芳基二硫(硒)醚 (2, 1.0 mmol),CsOH·H2O (0.25 mmol), DMF (2mL), 25 ℃, N2.b分离产率.
由表2可知,该反应对不同取代的二芳基二硫醚和二芳基二硒醚都具有较好的适用性,反应均能较高效地得到目标产物.苯环上的取代基无论是吸电子基还是给电子基都对反应产率没有明显的影响.所有目标产物都通过1H NMR,13C NMR,MS进行表征、确证.

Scheme 2 可能的反应机理Scheme 2 A plausible mechanism of reaction
根据本课题组前期对CsOH·H2O催化炔烃和二芳基硒硫杂醚反应机理的研究[13],笔者提出以下可能的反应机理(Scheme 2):CsOH·H2O夺取端炔上的H原子得到炔负离子中间体A, 中间体A中带负电的C进攻二芳基二硒醚得到炔硒醚中间体C和芳基硒负离子B和CsOH·H2O,使反应得以循环进行.这与实验结果相一致, 当反应在空气氛围下进行时, 只有痕量的目标产物生成.
3 结论
本文首先制备了一种新型的替加氟炔烃(3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙炔).在CsOH·H2O催化下,替加氟炔烃与二芳基二硫(硒)醚反应,高立体、区域选择性地制备了(Z)-1,2-二芳硫基(硒基)-3-[N1-(2-呋喃基)-N3-(5-氟尿嘧啶)]-1-丙烯.该方法具有反应条件温和、操作简便、产率高、立体选择性好等优点,为硫(硒)代替加氟烯烃的合成提供了一种新方法.该类硫(硒)代替加氟烯烃同时含有替加氟和具有生物活性的硫族原子,有可能在今后的临床应用中与替加氟产生协同作用,开发出一种新型的替加氟抗肿瘤治疗药物.
[1] KOMATSU T, YAMAZAKI H, SHIMADA N,etal. Involvement of microsomal cytochrome P450 and cytosolic thymidine phosphorylase in 5-fluorouracil formation from tegafur in human liver[J]. Clin Cancer Res, 2001,7(3):675-681.
[2] 陈嘉莹,徐珊琪.小梁切除术后应用5-氟尿嘧啶对泪膜的影响[J]. 眼外伤职业眼病杂志, 2003,25(3):43-45.
[3] HAMERSLEY J, LUCE J K, FLORENT T R,etal. Excessive lacrimation from flurouracil treatment[J]. J Am Med Assoc, 1993,225(4):747-748.
[4] LEE D A, HERSH D K, KERSATER D,etal. Complications of subconjunctival 5-flurouracil following glaucoma filtering surgery[J]. Ophthalmic Surg, 1997,18(2):187-190.
[5] 秦三海,刘爱芹,于胜海,等. 替加氟衍生物M1的合成及其体内外抗肿瘤活性研究[J]. 中国药理学通报, 2013,29(1):145-146.
[6] ZHANG Z Y, LIU S Q, XU X H,etal. Synthesis and antitumor activity of conjugate of phosphate zwitterions and tegafur derivatives [J]. Hecheng Huaxue, 2007,15(2):192-194.
[7] SHI D Q, CHEN Q, ZHONG H,etal. Synthesis of novel phosphoramide-tegafur derivatives containing aminopropylsilatrane[J]. Phosphorus Sulfur, 2005,180(7):1621-1627.
[8] BALKRISHNA S J, BHAKUNI B S, CHOPRA D,etal. Cu-catalyzed efficient synthetic methodology for ebselen and related Se-N heterocycles[J]. Org Lett, 2010,12(23):5394-5397.
[9] AMOSOVA S V, MARTYNOV A V, MAHAEVA N A,etal. Unsaturated five-membered selenium-silicon containing heterocycles based on the reactions of selenium di-and tetra-halides with diorganyl diethynyl silanes[J]. J Organometallic Chem, 2007,692(5):946-952.
[10] YANG F L, MA X T, TIAN S K. Oxidative Mizoroki-heck-type reaction of arylsulfonyl hydrazides for a highly regio- and stereoselective synthesis of polysubstituted alkenes[J]. Chem-Eur J, 2012,18(6):1582-1585.
[11] ITAMI K, HIGASHI S, MINENO M,etal. Iron-catalyzed cross-coupling of alkenyl sulfides with Grignard reagents[J]. Org Lett, 2005,7(7):1219-1222.
[12] ERDELMEIER I, GAIS H J. Nickel-catalyzed cross-couplings of alkenyl and alpha-metalated alkenyl sulfoximines with organometallics: Stereoselective synthesis of carbacyclins[J]. J Am Chem Soc, 1989,111(3):1125-1126.
[13] GAIS H J, BULOW G. Double metal-catalyzed cross-coupling reactions of alkenyl sulfoximines with diorganozinc reagents: Stereoselective synthesis of a key optically active 3-oxa-carbacyclin intermediate[J]. Tetrahedron Lett, 1992,33(4):465-468.
[14] YANG Q, WU S, QUAN Z,etal. Reusable biomacromolecule-Pd complex catalyzed C-C cross-coupling reactions via C-S cleavage of disulfides[J]. Tetrahedron, 2015,71(44):8462-8471.
[15] DABDOUB M J, BEGNINI M L, GUERRERO P G,etal. Hydrozirconation of lithium alkynylselenolate anions. Generation and reactions of α-zirconated vinyl selenide Intermediates[J]. J Org Chem, 2000,65(1):61-67.
[16] CHEN J Y, TANG Z, XU X H,etal. Cesium-catalyzed regioselective synthesis of trisubstituted heteroatom alkenes: A new strategy for the preparation of functional alkenes[J]. Org Lett, 2015,17(7):2162-2165.
[17] CHEN J Y, CHEN S H, XU X H,etal. Nickel-catalyzed regioselective cleavage of Csp2-S bonds: Method for the synthesis of tri- and tetra-substituted alkenes[J]. J Org Chem, 2016,81(9):3246-3255.
[19] YOU N H, TOMOYA H, ANDO S,etal. Highly refractive polymer resin derived from sulfur-containing aromatic acrylate[J]. Wiley Inter Sci, 2010,12(48):2604-2609.
[20] KUTSCHY P, SALAYOVA A, CURILLOVA Z,etal. 2-(Substituted phenyl) an ion analogs of 1-mothoxyspirobrassinol methyl ether synthesis and anticancer activity[J]. Bioorg Med Chem, 2009,17(10):3698-3712.
[21] KUNIYASU H, OGAWA A, MIYAZAKI S I,etal. Palladium-catalyzed addition and carbonylative addition of diaryl disulfides and diselenides to terminal acetylenes[J]. J Am Chem Soc, 1991,113(26):9796-9803.
[22] ARISAWA M, YAMAGUCHI M, Addition reaction of dialkyl disulfides to terminal alkynes catalyzed by a rhodium complex and trifluoromethanesulfonic acid[J]. Org Lett, 2001,3(5):763-764.
[23] MANARIN F, ROEHRS J A, PRIGOL M,etal. Regio- and stereoselective synthesis of vinyl sulfides via PhSeBr-catalyzed hydrothiolation of alkynes[J]. Tetrahedron Lett, 2007,48(28):4805-4808.
[24] OGAWA A, YOKOYAMA K, OBAYASHI R,etal. Photo-induced ditelluration of acetylenes with diphenyl ditelluride[J]. Tetrahedron, 1993,49(6):1177-1188.
(编辑 WJ)
Cesium-Catalyzed Highly Regio- and Stereo-Selective Synthesis of S(Se)-Substituted Tegafur Alkenes
TAN Ping1, LUO Xiang-gui2, XU Xin-hua3*
(1.Hunan Mechanical Electrical Polytechnic, Changsha 410151, China;2. Hunan Academy of Mechanical Sciences, Changsha 410116, China;3.College of Chemistry and Chemical Engineering, Hunan University, Changsha 410082, China)
Tegafur alkynes are synthesized by using tegafur and 3-(p-toluene sulfonyl) propyne as starting materials, which were then treated with diaryl disulfides or diaryl diselenides catalyzed by cesium hydroxide monohydrate to yield S (Se)-substituted tegafur alkenes in high regio- and stereo-selectivity. This method has the advantages of environmentally friendly, high yield, mild conditions and high regio- and stereo-selectivity, providing a convenient and efficient way to obtain S (Se)-substituted tegafur alkenes, which could be used as effective drugs for cancer treatment in the future.
cesium hydroxide monohydrate; tegafur; diaryl disulfides (diselenides); tegafur alkynes; S(Se)-substituted tegafur alkenes
10.7612/j.issn.1000-2537.2017.04.009
2017-02-24
湖南省教育厅科学研究资助项目(14C0405)*通讯作者,E-mail:xhx1581@hnu.edu.cn
O614.81+2
A
1000-2537(2017)04-0051-06

