QuEChERS方法联合HPLC-MS/MS和GC-MS测定土壤中110种农药残留
蔡霖,席普宇,谢晴,李雪花,乔显亮,谢宏彬,陈景文,蔡喜运
(大连理工大学环境学院,工业生态与环境工程教育部重点实验室,辽宁大连 116024)
QuEChERS方法联合HPLC-MS/MS和GC-MS测定土壤中110种农药残留
蔡霖,席普宇,谢晴,李雪花,乔显亮,谢宏彬,陈景文,蔡喜运*
(大连理工大学环境学院,工业生态与环境工程教育部重点实验室,辽宁大连 116024)
采用QuEChERS前处理方法联合高效液相色谱串联二级质谱(HPLC-MS/MS)和气相色谱串联质谱(GC-MS),建立了测定土壤中110种农药残留的方法。通过调整加入水中的乙酸含量对QuEChERS方法进行优化,结果表明加入1%的乙酸提高了农药的回收率。基于农药的极性、热稳定性、挥发性等特性差异,分别采用HPLC-MS/MS测定其中的43种农药和GC-MS测定另外的67种农药。采用内标法测定回收率,内标为阿特拉津-d5、磺酰磺隆、1,3-二甲基-2-硝基苯、磷酸三苯酯、苝-d12。在3个添加水平(10、20、50 μg·kg-1)下,由HPLC-MS/MS测定的43种农药的平均回收率范围为59.1%~129.4%,相对标准偏差(RSD)在0.3%~15%之间;由GC-MS测定的67种农药的平均回收率范围为44.9%~168.1%,RSD在0.5%~20%之间。方法的检出限范围为0.01~5.00 μg·kg-1。采用该方法检测某土壤样品,共检出农药68种,其中主要包括烟嘧磺隆、炔苯酰草胺、乙氧氟草醚、灭菌丹、烯酰吗啉、高效氯氟氰菊酯和部分有机磷、有机氯农药等,结果表明该方法简单有效、检测灵敏度高,可用于土壤中农药多残留的检测。
QuEChERS;高效液相色谱串联质谱;气相色谱串联质谱;农药残留;土壤
据国家统计局年度数据,2012年以来我国农药年施用量超过180万t,且呈现出递增趋势[1]。农药的大量使用导致土壤中农药的残留,例如阿特拉津、乙草胺等农药因长期大量使用而在土壤中广泛残留,已禁用的滴滴涕、六六六等有机氯农药则因其自身结构稳定,也能够长期残留在土壤中,仍被频繁检出。残留的农药易被农作物吸收,被食用后则会危害人类健康。据王万红等[2]报道,辽宁省北部农田中阿特拉津、乙草胺和丁草胺检出率为100%,最大残留量分别为21.2、203.2、30.9 μg·kg-1;艾氏剂、狄氏剂和六氯苯也被检出,六氯苯检出率为100%。尹可锁等[3]报道,滇池流域农田中有机氯农药检出率达到95.9%,残留浓度在ND~63.4 μg·kg-1之间。因此,需要开展土壤中农药多残留分析技术研究,为农田土壤中农药残留特征分析和风险评估提供技术支撑。
土壤中农药残留检测主要包括样品前处理和仪器分析两部分。常见前处理方法包括加速溶剂萃取法[4]、固相萃取法[5]、微波辅助萃取法[6]、QuEChERS方法[7-8]等。其中:加速溶剂萃取法需要装柱、洗脱、净化等步骤,耗时较长;固相萃取法则因存在柱子选择问题,使其能够萃取的化合物比较单一;微波辅助萃取法对实验条件要求较高,实验繁琐且耗时较长。QuEChERS方法因其具有快速、简单、有效、廉价、安全、耐用等特点受到了广泛应用,例如:Rashid等[7]采用QuEChERS方法结合GC-MS测试了土壤中19种有机氯农药,回收率在70%~100%之间,相对标准偏差在3%~20%之间;熊伟娜等[8]采用QuEChERS方法作为前处理技术结合HPLC对苯线磷及其两种代谢产物进行了分析测定,回收率在82.5%~97.4%之间,相对标准偏差在2.5%~6.1%之间。常用的仪器测试技术为HPLC、GC、HPLC-MS/MS和GC-MS。本文基于农药极性、热稳定性、挥发性等特点的不同进行分类测试,采用HPLC-MS/MS分析磺酰脲类、三嗪类除草剂等43种农药,GC-MS分析有机氯、有机磷杀虫剂、酰胺类除草剂等67种农药,建立了土壤中110种农药的残留分析方法。与前人建立的农药残留分析方法相比,本方法操作简单、灵敏度高、检测农药种类多。
1 材料与方法
1.1 仪器和试剂
高效液相色谱三重串联四级杆质谱联用仪(Agilent 2100SL液相色谱,Agilent 6410B质谱),配有电喷雾离子源,Eclipse XDB-C18分析柱(150×3 mm,3.5 μm,Agilent公司);Agilent 6890-5975型气相色谱-质谱(Agilent 6890N气相,Agilent 5975质谱),DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm);BS224S电子天平(北京赛多利斯);QKPURE实验室超纯水仪器(上海涞科);QL-901涡旋振荡器(海门其林贝尔);TDL-5-A台式离心机(上海安亭);KQ5200DB数控超声仪(昆山舒美);WD-12氮吹仪(杭州奥盛)。
正己烷、丙酮、乙腈、甲酸均为色谱纯(美国Sigma-Aldrich公司);乙二胺-N-丙基硅烷(PSA)、无水硫酸镁、氯化钠均为分析纯;噻菌灵、噻虫嗪、啶虫脒、甲霜灵、异丙威、烯酰吗啉、嘧菌酯、丙溴磷、戊唑醇、异菌脲、丙环唑、苯醚甲环唑、2,4-滴丁酯、乙氧氟草醚、联苯菊酯、哒螨灵、高效氯氟氰菊酯来自企业馈赠,其余购自北京百灵威科技有限公司(纯度>97%);分别称取一定量43种农药(HPLC-MS/MS测定)和67种农药(GC-MS测定),分别采用乙腈和正己烷溶解,将农药配制成1 mg·L-1的混标储备液,保存在-20℃。分别采用乙腈和正己烷稀释,配制5、10、20、50、100、200、500共7个浓度的标准曲线,供HPLC-MS/ MS和GC-MS分析测试,现配现用。
1.2 样品前处理
取10 g(精确至0.01 g)土壤置于50 mL离心管中,加入含1%乙酸的超纯水6 mL,然后加入10 mL乙腈涡旋振荡1 min;称取4 g无水硫酸镁和1 g氯化钠加入离心管中,充分涡旋振荡除水;在4000 r·min-1转速下离心分离5 min,转移全部上清液到10 mL离心管中,称取1 g无水硫酸镁和200 mg PSA加入离心管中,振荡后在4000 r·min-1转速下离心分离5 min;取3 mL上清液加入到氮吹管中,氮吹至近干,加入1 mL乙腈和水(体积比1∶1)的混合液,涡旋振荡后过0.22 μm滤膜到液相小瓶中,供HPLC-MS/MS分析;同时取3 mL上清液加入到氮吹管,氮吹至近干,加入1 mL正己烷,涡旋振荡后过0.22 μm滤膜到液相小瓶中,供GC-MS分析。
1.3 液相色谱与质谱条件
液相条件:流动相为乙腈(A相)和含0.1%甲酸的超纯水(B相);流速0.25 mL·min-1;进样量10 μL。进样梯度:0~4 min,50%A~60%A;4~6 min,60%A~70%A;6~6.1 min,70%A~75%A;6.1~10 min,75%A~80%A;10~15 min,80%A~90%A。
质谱条件:电喷雾离子源,正离子模式;干燥气温度350℃;干燥气流速8 L·min-1;毛细管电压4 kV;电喷雾压力25 psi(1 psi=6.895 kPa);检测方式为多离子反应监测模式(MRM)。
配制农药混标溶液,ESI源选择正离子模式,采用SCAN模式,扫描得到各农药的母离子、碎片离子及其对应的碰撞能量等参数,分析优化参数见表1。
1.4 气相色谱串联质谱测试条件
色谱条件:载气为氦气(纯度99.999%);恒流模式,流速1.2 mL·min-1;进样口温度290℃;进样量1 μL;不分流进样,无分流进样后打开分流阀和隔垫吹扫阀。柱温箱升温程序:80℃,保持3 min,然后以30 ℃·min-1升温到150℃,再以6℃·min-1升温到290℃,保持1 min。
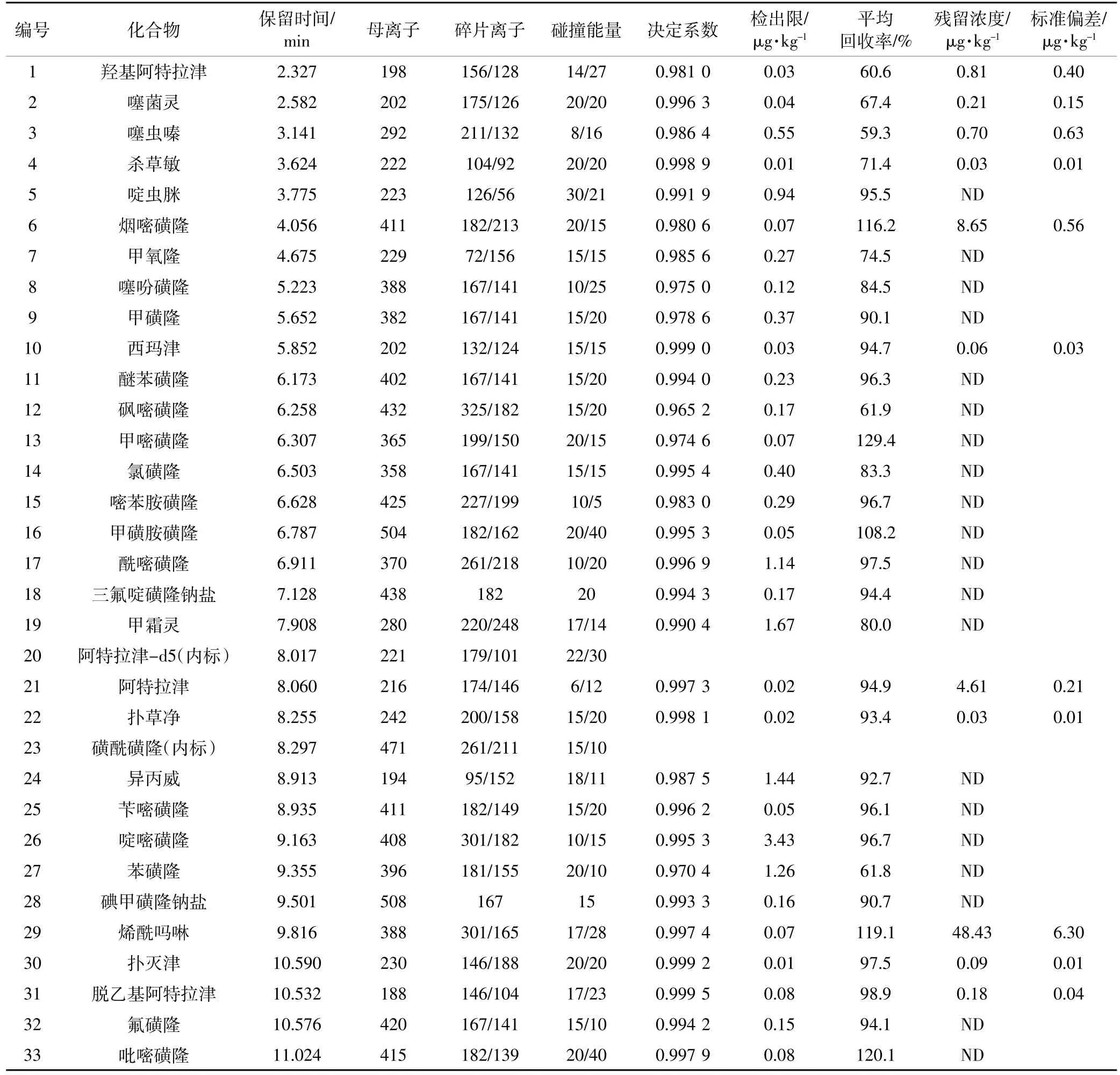
表1 农药残留HPLC-MS/MS测试条件及结果Table 1 Test conditions and results of pesticides for HPLC-MS/MS analysis

续表1 农药残留HPLC-MS/MS测试条件及结果Continued table 1 Test conditions and results of pesticides for HPLC-MS/MS analysis
质谱条件:电子轰击源70 eV;离子源温度230℃;电离模式为电子轰击电离(EI);MS接口温度280℃;溶剂延迟时间4 min;数据采集模式选择离子扫描模式(SIM)。
配制农药混标溶液,采用SCAN模式,扫描得到各农药的定量离子和定性离子等参数,分析优化参数见表2。
2 结果与讨论
2.1 测试条件的优化
2.1.1 HPLC-MS/MS测试条件优化
在SCAN模式下,对各农药进行一级质谱扫描,获得各农药的母离子,采用二级质谱分析扫描各农药的母离子,确定碎片离子,然后对碎片离子对应的碰撞能量(CE)值等参数进行了优化。以碘甲磺隆钠盐为例,在SCAN模式下扫描得到母离子为508,其碎片离子为167,然后对碎片离子167对应的CE值进行优化,通过比对发现,CE=10、15、20、25 eV时对应的丰度分别为5000、5200、5100、5100,故选择碎片离子167对应的CE值为15 eV。
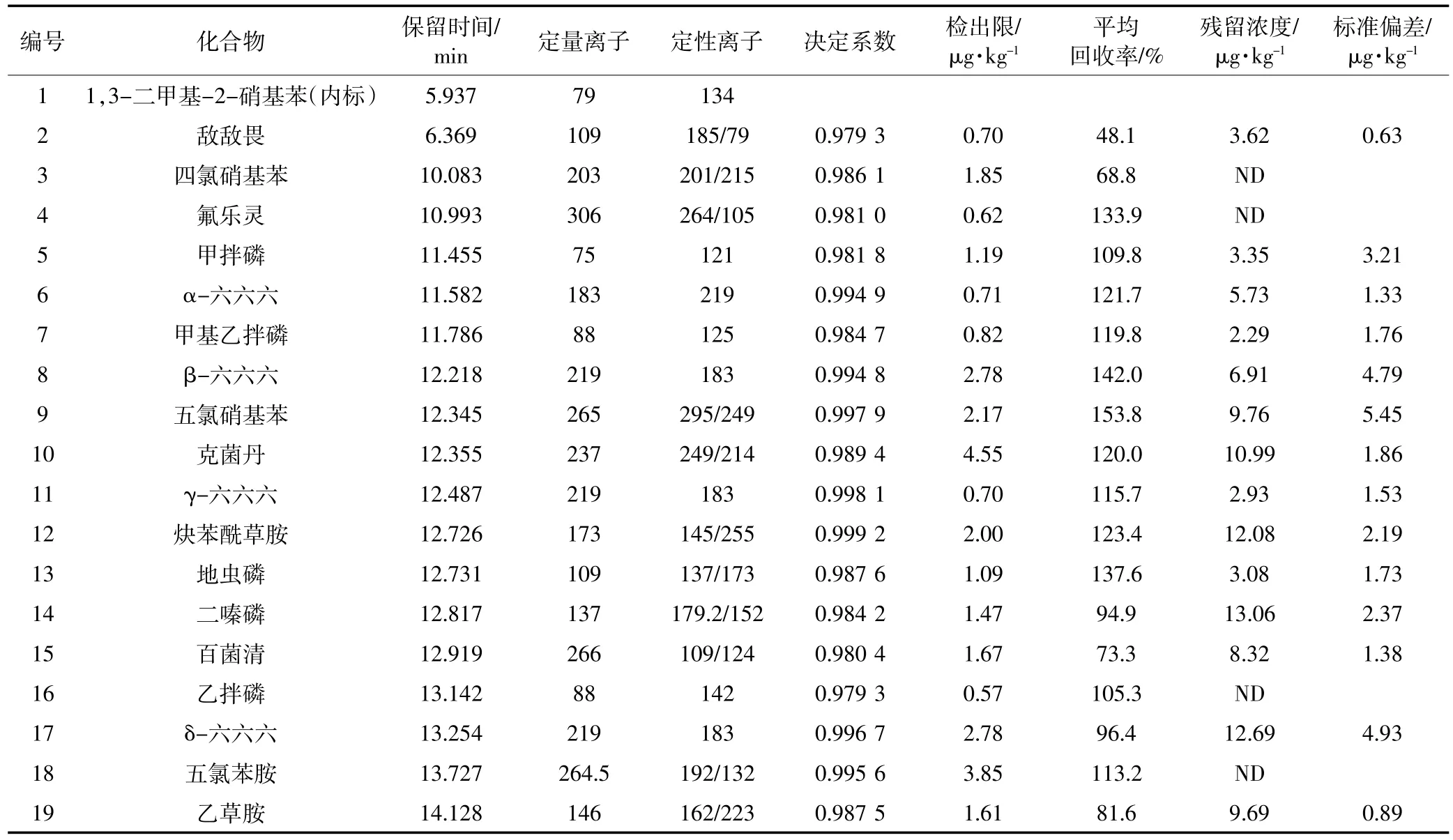
表2 农药残留GC-MS测试条件及结果Table 2 Test conditions and results of pesticides for GC-MS analysis
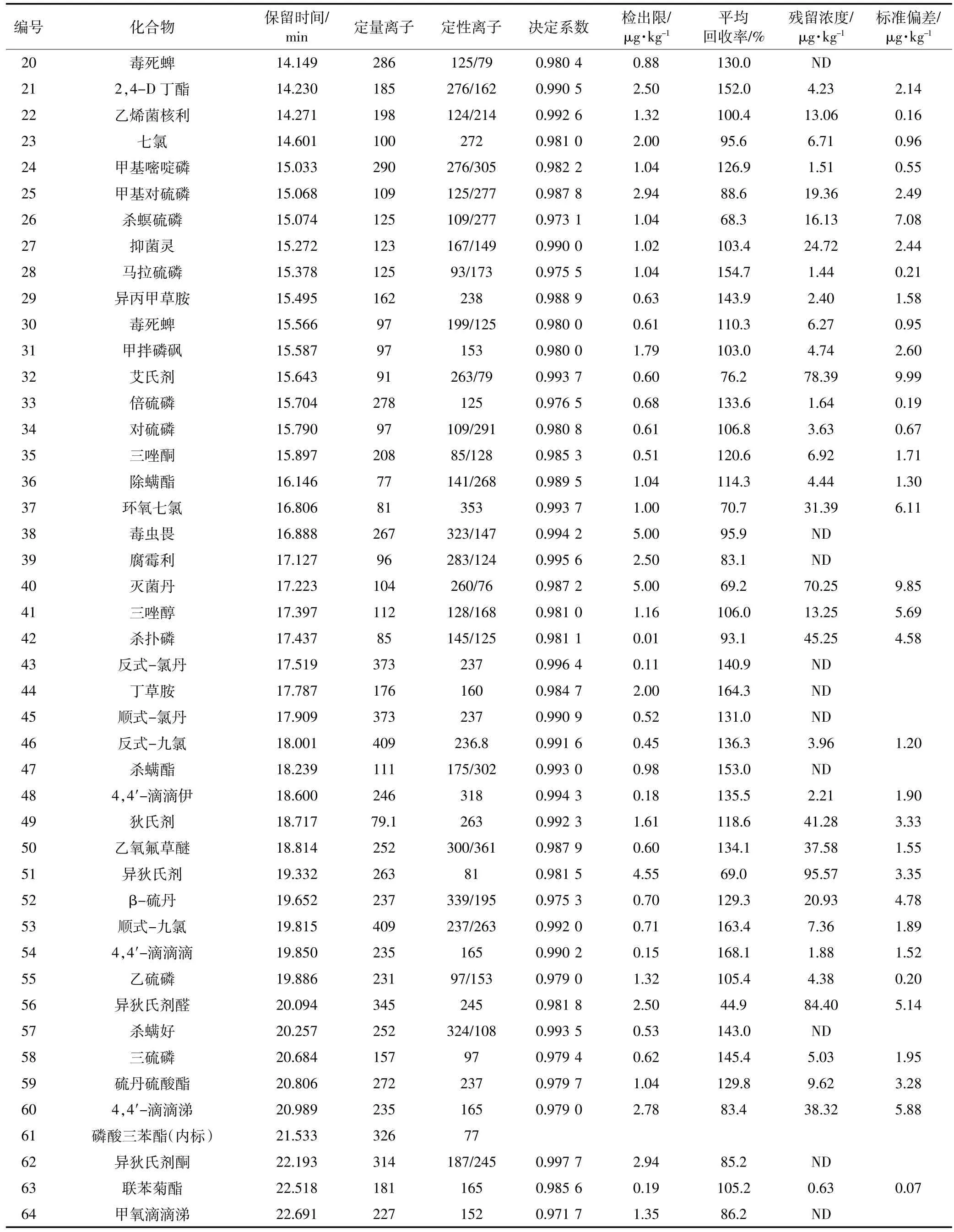
续表2 农药残留GC-MS测试条件及结果Continued table 2 Test conditions and results of pesticides for GC-MS analysis
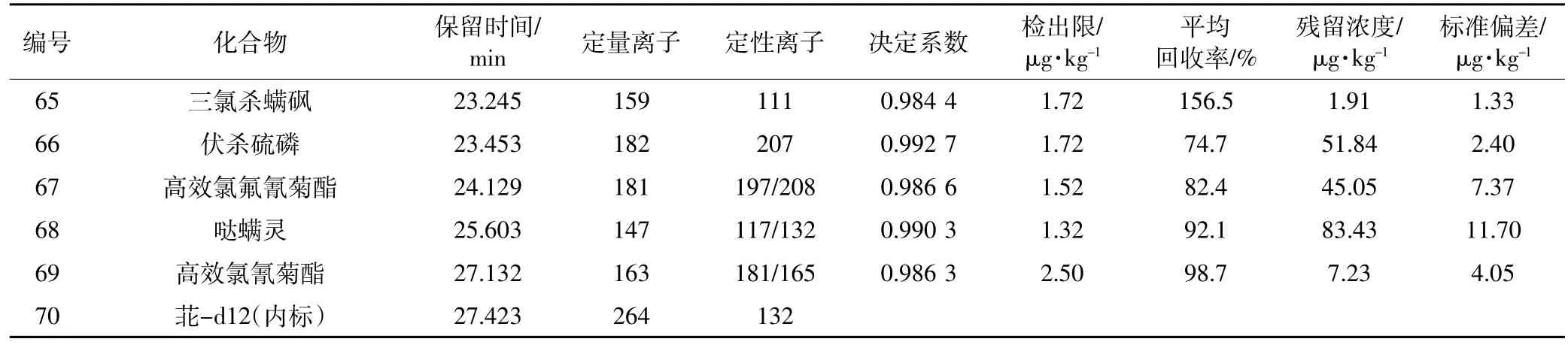
续表2 农药残留GC-MS测试条件及结果Continued table 2 Test conditions and results of pesticides for GC-MS analysis
对液相色谱流动相梯度也进行了优化(表3),其中采用梯度3时,45种化合物的色谱峰分布均匀,15 min就可以得到所有农药的色谱峰(图1)。与前人在20 min得到4种农药的色谱峰和在30 min得到12种农药的色谱峰[4-5]相比,本方法检测效率较高。
2.1.2 GC-MS测试条件优化
在SCAN模式下,扫描得到各农药的碎片离子,选择丰度最大的碎片离子作为对应农药的定量离子,选择其他碎片离子作为定性离子。以乙草胺为例,在SCAN模式下扫描得到的碎片离子146和162对应丰度分别为4000和3300,故选择碎片离子146作为定量离子,选择162作为定性离子。根据质谱数据库中的化合物比对功能,核对乙草胺的分子结构,确定保留时间,同时采用SIM模式测试样品,扫描待测化合物的定性碎片离子和定量碎片离子以提高仪器灵敏度。图2为SIM模式下得到的67种农药和3种内标标准品的总离子色谱图。

表3 用于优化的3种流动相梯度Table 3 3 mobile phase gradients used for optimization
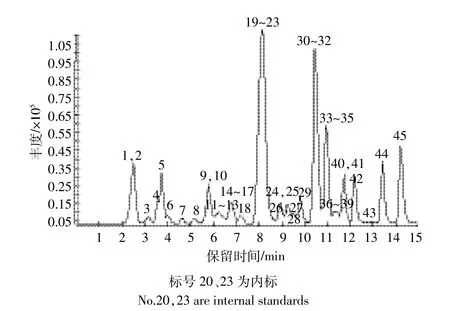
图1 43种农药和2种内标标准品的总离子色谱图Figure 1 Total ion chromatograms of 43 pesticides and 2 internal standards
2.2 QuEChERS前处理方法的优化
本方法的前处理过程采用AOAC(Association of Official Analytical Chemists)2007.01官方QuEChERS方法,具体包括:在10 g(精确至0.01 g)土壤中加入10 mL乙腈及6 mL含有缓冲物质的水涡旋振荡1 min,然后加入4 g无水硫酸镁和1 g氯化钠涡旋振荡0.5 min,离心分离,接着取1 mL上清液加入25 mg的PSA和150 mg无水硫酸镁,振荡后离心分离,过0.22 μm滤膜到液相小瓶中,供HPLC-MS/MS或GC-MS分析测定。而本方法在第一次离心分离后取出所有上清液加入200 mg的PSA和1 g的无水硫酸镁,振荡后离心分离,取两份上清液进行后续处理分析。
AOAC2007.01官方QuEChERS方法中需要加入含有缓冲物质的水,由于磺酰脲类除草剂为弱酸性化合物[5],方法中加入的乙酸含量对其回收率影响较大,故以21种磺酰脲类除草剂为例,通过实验比较了加入含0.1%和1%乙酸的水对其回收率的影响(图3)。结果显示,加入含0.1%乙酸的水的回收率范围为20.5%~125.7%,加入含1%乙酸的水的回收率范围为47.7%~128.6%,其中17种磺酰脲类除草剂回收率得到不同程度提高,平均提高了21.6%。此外,由于经过改进的QuEChERS方法将农药残留浓度浓缩了300%,因此可提高样品中农药残留的检出限。

图2 67种农药和3种内标标准品的总离子色谱图Figure 2 Total ion chromatograms of 67 pesticides and 3 internal standards
2.3 方法的决定系数和检出限
配制5~500 μg·L-1一系列浓度梯度的标准液,绘制标准曲线,r2在0.965 2~0.999 6之间(表1、表2)。由检出限定义信噪比为3时对应的浓度,配制0.1~10 μg·L-1一系列的低浓度梯度的标准液,确定了110种农药的方法检出限为0.01(杀扑磷)~5.00(毒虫畏、灭菌丹)μg·kg-1(表1、表2)。
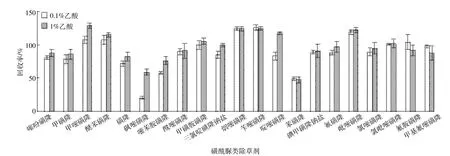
图3 加入含0.1%和1%乙酸时21种磺酰脲类除草剂的回收率Figure 3 Recoveries of 21 sulfonylurea herbicides with addition of 0.1%and 1%acetic acid
同一种农药采用GC-MS和HPLC-MS/MS测定时具有不同的灵敏度,例如:Alder等[9]整理的文献中介绍阿特拉津在GC-MS的定量限为10 μg·kg-1,而在HPLC-MS/MS上的定量限仅为0.1 μg·kg-1;西玛津在GC-MS的定量限为100 μg·kg-1,而在HPLCMS/MS上的定量限为1 μg·kg-1[10-12]。本方法采用HPLC-MS/MS测定的阿特拉津和西玛津的定量限分别为1.56、0.6 μg·kg-1。4,4′-DDE通常采用GC-MS测定,检出限为4.5 μg·kg-1[13],而鲜有报道采用HPLC-MS/MS测定4,4′-DDE,本方法采用GC-MS测定的4,4′-DDE的检出限为0.54 μg·kg-1。本方法将GC-MS与HPLC-MS/MS结合起来测定农药残留,显著提高了农药的检测灵敏度。
2.4 方法的回收率、精密度和土壤样品测定结果
在10、20、50 μg·kg-1添加水平下,采用内标法测定110种农药的回收率,内标为阿特拉津-d5、磺酰磺隆、1,3-二甲基-2-硝基苯、磷酸三苯酯和苝-d12,其中阿特拉津-d5和磺酰磺隆用于校正HPLC-MS/MS测定的43种农药,1,3-二甲基-2-硝基苯、磷酸三苯酯和苝-d12用于校正GC-MS测定的67种农药。3种添加水平下各农药的回收率范围见图4。在10 μg· kg-1添加水平下,回收率为50%~150%的农药共99种,占检测农药总数的90.0%;在20 μg·kg-1添加水平下,回收率为50%~150%的农药共94种,占85.5%;在50 μg·kg-1添加水平下,回收率为50%~150%的农药共93种,占84.5%。根据欧盟农药残留检测标准导则,测试农药种类较多(百种以上)时,它们的回收率在50%~150%范围内和相对标准偏差小于20%时,测试方法是可行的[14-16]。由HPLC-MS/MS测定的43种农药的平均回收率范围为59.1%~129.4%,相对标准偏差(RSD)在0.3%~15%之间;由GC-MS测定的67种农药的平均回收率范围为44.9%~168.1%,RSD 在0.5%~20%之间。只有GC-MS测定的10种农药(异狄氏剂醛、敌敌畏、五氯硝基苯、2,4-D丁酯、马拉硫磷、丁草胺、杀螨酯、顺式九氯、4,4′-DDD、三氯杀螨砜)平均回收率在50%~150%范围外,而这些农药在10 μg·kg-1添加水平下,其回收率均在50%~150%范围内,能够满足农药残留检测的要求。因此该方法可用于土壤中农药残留的检测。
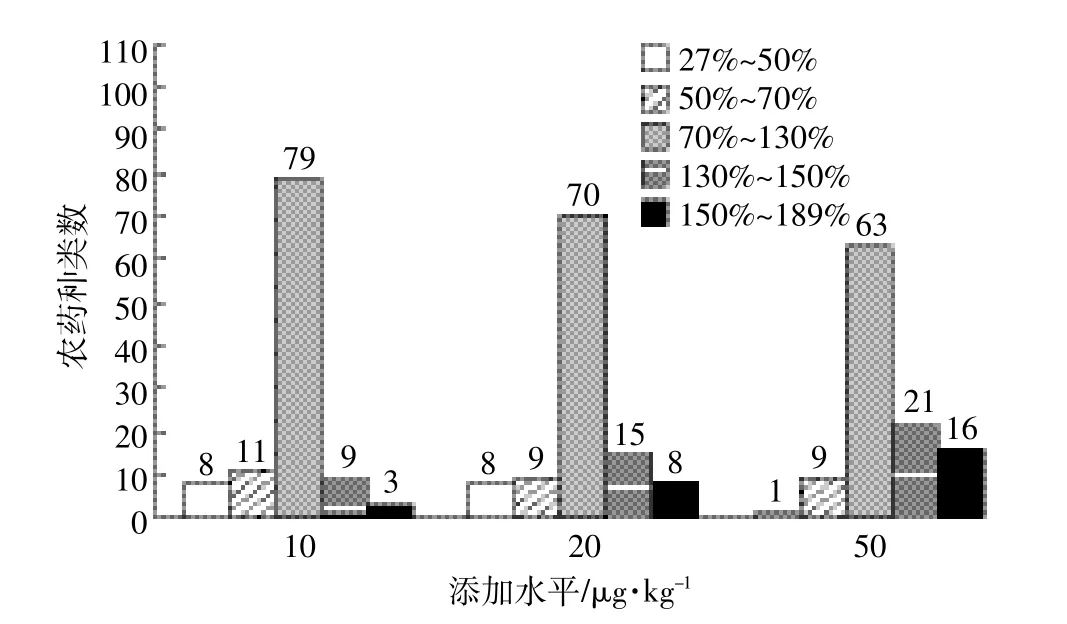
图4 不同添加水平各回收率范围下农药种类数Figure 4 Pesticide number of every each range at different spike level
采用本方法检测了采集自辽宁省某玉米田(42° 37′50″N,121°57′58″E)的土壤样品,检出农药68种(表1、表2),主要包括阿特拉津、烟嘧磺隆、炔苯酰草胺、乙氧氟草醚、灭菌丹、烯酰吗啉、高效氯氟氰菊酯和部分有机磷、有机氯农药等。其中烟嘧磺隆的残留浓度为8.65 μg·kg-1,据报道土壤中含有0.01~0.07 μg·kg-1的磺酰脲类除草剂残留就会对一些敏感作物产生影响[17],因此该区域磺酰脲类除草剂残留可能会对农作物产生不利影响。该检测土壤中有机磷农药共检出20种,总残留浓度为198.93 μg·kg-1,其中伏杀硫磷、杀扑磷均超过25 μg·kg-1,根据加拿大颁布的土壤环境质量标准规定,有机磷农药残留总量不应超过25 μg·kg-1[18],显然该检测样点有机磷农药残留浓度超标。有机氯农药共检出18种,其中六六六、滴滴涕、艾氏剂、狄氏剂、异狄氏剂、七氯都能够被检出,残留浓度范围为6.71~95.57 μg·kg-1,均未超过国家土壤环境质量标准。
3 结论
(1)建立了QuEChERS方法联合HPLC-MS/MS 和GC-MS测定土壤中110种农药残留的方法,通过对前处理条件和仪器条件的优化,该方法能够快速准确测定土壤中110种农药的残留浓度。
(2)110种农药在5~500 μg·L-1浓度范围内线性关系良好,r2在0.965 2~0.999 6之间。由HPLC-MS/ MS测定的43种农药的平均回收率范围为59.1%~129.4%,相对标准偏差在0.3%~15%之间;由GC-MS测定的67种农药的平均回收率范围为44.9%~168.1%,相对标准偏差在0.5%~20%之间。方法的检出限范围为0.01~5.00 μg·kg-1。
(3)采用该方法检测了某土壤样品,共检出农药68种。该方法具有简便有效、灵敏度高等特点,可以满足土壤中农药多残留检测的需求。
[1]国家统计局.中国统计年鉴年度数据[DB/OL].[2017-01-19].http:// data.stats.gov.cn/easyquery.htm?cn=C01.
National Bureau of Statistics.Annual date of China statistical yearbook [DB/OL].[2017-01-19].http://data.stats.gov.cn/easyquery.htm?cn= C01.
[2]王万红,王颜红,王世成,等.辽北农田土壤除草剂和有机氯农药残留特征[J].土壤通报,2010,41(3):716-722.
WANG Wan-hong,WANG Yan-hong,WANG Shi-cheng,et al.Residue character of herbicides and organochlorine pesticides in soil in the north of Liaoning[J].Chinese Journal of Soil Science,2010,41(3):716-722.
[3]尹可锁,吴文伟,张雪燕,等.滇池流域农田土壤有机氯农药残留特征[J].农业环境科学学报,2010,29(4):674-679.
YIN Ke-suo,WU Wen-wei,ZHANG Xue-yan,et al.Residues characteristics of organochlorine pesticides in the cultivated soils from Dianchi Lake watershed[J].Journal of Agro-Environment Science,2010,29(4):674-679.
[4]王小飞,刘潇威,王璐,等.加速溶剂提取-固相萃取净化-高效液相色谱法测定土壤中12种三嗪类除草剂的残留量[J].农业环境科学学报,2013,32(10):2099-2104.
WANG Xiao-fei,LIU Xiao-wei,WANG Lu,et al.Determination of twelve triazine herbicide residues in soil by high performance liquid chromatography with accelerated solvent extraction and solid-phase extraction[J].Journal of Agro-Environment Science,2013,32(10):2099-2104.
[5]Wu Q H,Wang C,Liu Z M,et al.Dispersive solid-phase extraction followed by dispersive liquid-liquid microextraction for the determination of some sulfonylurea herbicides in soil by high-performance liquid chromatography[J].Journal of Chromatography A,2009,1216(29):5504-5510.
[6]Merdassa Y,Liu J F,Megersa N.Development of a one-step microwaveassistedextractionmethodforsimultaneousdeterminationof organophosphorus pesticides and fungicides in soils by gas chromatography-mass spectrometry[J].Talanta,2013,114(10):227-234.
[7]Rashid A,Nawaz S,Barker H,et al.Development of a simple extraction and clean-up procedure for determination of organochlorine pesticides in soil using gas chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2010,1217(17):2933-2939.
[8]熊伟娜,夏婷婷,陈景文,等.土壤中苯线磷及其转化产物对映体的同时分析[J].农业环境科学学报,2014,33(4):708-714.
XIONG Wei-na,XIA Ting-ting,CHEN Jing-wen,et al.Direct enantioselective determination of fenamiphos and its two metabolites in soils using QuEChERS-HPLC[J].Journal of Agro-Environment Science, 2014,33(4):708-714.
[9]Alder L,Greulich K,Kempe G,et al.Residue analysis of 500 high priority pesticides:Better by GC-MS or LC-MS/MS?[J].Mass Spectrometry Reviews,2006,25(6):838-865.
[10]Bossi R,Vejrup K V,Mogensen B B,et al.Analysis of polar pesticides in rainwater in Denmark by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2002,957(1):27-36.
[11]Ac B D C,Mj L D A,Barceló D,et al.Multianalyte determination of different classes of pesticides(acidic,triazines,phenyl ureas,anilines, organophosphates,molinate and propanil)by liquid chromatographyelectrospray-tandem mass spectrometry[J].Analytical and Bioanalytical Chemistry,2004,378(4):940-954.
[12]Fillion J,Sauvé F,Selwyn J.Multiresidue method for the determination of residues of 251 pesticides in fruits and vegetables by gas chromatography/mass spectrometry and liquid chromatography with fluorescence detection[J].Journal of AOAC International,2000,83(3):698-713.
[13]Zhu P,Miao H,Du J,et al.Organochlorine pesticides and pyrethroids in Chinese tea by screening and confirmatory detection using GCNCI-MS and GC-MS/MS[J].Journal of Agricultural and Food Chemistry,2014,62(29):7092-7100.
[14]Sack C,Smoker M,Chamkasem N,et al.Collaborative validation of the QuEChERS procedure for the determination of pesticides in food by LC-MS/MS[J].Journal of Agricultural and Food Chemistry,2011,59 (12):6383-6411.
[15]Hill A R C,Startin J R,Fussell R J.Quality control procedures for pesticide residues analysis[M].Brussels:European Commission,2006:10232-10233.
[16]朱永哲,冯雅男,金正汉.超高效液相色谱-串联质谱法同时测定土壤中239种农药的残留量[J].色谱,2013,31(9):850-861.
ZHU Yong-zhe,FENG Ya-nan,KIM J.Determination of 239 pesticide residues in soil by ultra performance liquid chromatographa-tandem mass spectrometry[J].Chinese Journal of Chromatography,2013,31 (9):850-861.
[17]Mansoori H,Zand E,Baghestani M A,et al.Effect of sulfonylurea herbicides residues on canola,sunflower and cotton:A bioassay approach [J].World Journal of Environmental Pollution,2012,2(2):22-28.
[18]Acton D F,Gregorich L J.The health of our soils:Toward sustainable agriculture in Canada[M].Ottawa:Agriculture and Agri-Food Canada, 1995:88-89.
Development of a multiresidue method for determination of 110 pesticide residues in soil using QuEChERSHPLC-MS/MS and QuEChERS-GC-MS
CAI Lin,XI Pu-yu,XIE Qing,LI Xue-hua,QIAO Xian-liang,XIE Hong-bin,CHEN Jing-wen,CAI Xi-yun*
(Key Laboratory of Industrial Ecology and Environmental Engineering(Ministry of Education),School of Environmental Science and Technology,Dalian University of Technology,Dalian 116024,China)
A method was established for the determination of 110 pesticides in soil using high performance liquid chromatography tandem mass spectrometry(HPLC-MS/MS)and gas chromatography tandem mass spectrometry(GC-MS)with modified QuEChERS(Quick,Easy, Cheap,Effective,Rugged,and Safe).Levels of acetic acid used in the QuEChERS procedure were optimized,and results indicated that higher recoveries were obtained when 1%acetic acid was added.Based on differences in polarity,thermostability,volatility,and other characteristics of pesticides,analysis of 43 pesticides was conducted via HPLC-MS/MS and the other 67 pesticides were analyzed using GC-MS. Five internal standards(atrazine-d5,sulfosulfuron,1,3-dimethyl-2-nitrobenzene,triphenyl phosphate,and perylene-d12)were used for the method validation.The average recoveries of the 43 pesticides analyzed via HPLC-MS/MS at three spike levels(10,20,and 50 μg·kg-1)ranged from 59.1%to 129.4%with relative standard deviations(RSDs)between 0.3%and 15%;whereas the average recoveries of the 67 compounds analyzed using GC-MS ranged from 44.9%to 168.1%with RSDs of 0.5%~20%.The detection limits of the method ranged from 0.01 to 5.00 μg·kg-1.The established method was used to determine pesticide resides in a soil sample,in which 68 pesticides were found,including nicosulfuron,propyzamide,oxyfluorfen,folpet,dimethomorph,lambda-cyhalothrin,some organophosphorus pesticides,and some organochlorine pesticides.Overall,the method is simple,efficient,and sensitive,and thus can be used for the simultaneous determination of pesticide residues in soil.
QuEChERS;high performance liquid chromatography tandem mass spectrometry;gas chromatography tandem mass spectrometry; pesticide residues;soil
X592
A
1672-2043(2017)08-1680-09
10.11654/jaes.2016-1657
2016-12-26
蔡霖(1990—),男,硕士研究生,主要从事污染物残留分析。E-mail:cailinyushui@163.com
*通信作者:蔡喜运E-mail:xiyuncai@dlut.edu.cn
公益性行业(农业)科研专项(201503107);国家自然科学基金项目(21477013)
Project supported:The Special Scientific Fund for Agro-scientific Research in the Public Interest(201503107);National Natural Science Foundation of China(21477013)
蔡霖,席普宇,谢晴,等.QuEChERS方法联合HPLC-MS/MS和GC-MS测定土壤中110种农药残留[J].农业环境科学学报,2017,36(8):1680-1688.
CAI Lin,XI Pu-yu,XIE Qing,et al.Development of a multiresidue method for determination of 110 pesticide residues in soil using QuEChERS-HPLC-MS/ MS and QuEChERS-GC-MS[J].Journal of Agro-Environment Science,2017,36(8):1680-1688.

