青葙对镉的超富集特征及累积动态研究
姚诗音,刘杰,*,王怡璇,朱园芳,丰顺
(1.桂林理工大学环境污染控制理论与技术广西重点实验室,广西桂林 541004;2.桂林理工大学岩溶地区水污染控制与用水安全保障协同创新中心,广西桂林 541004)
青葙对镉的超富集特征及累积动态研究
姚诗音1,刘杰1,2*,王怡璇1,朱园芳2,丰顺1
(1.桂林理工大学环境污染控制理论与技术广西重点实验室,广西桂林 541004;2.桂林理工大学岩溶地区水污染控制与用水安全保障协同创新中心,广西桂林 541004)
通过盆栽试验,研究了青葙(Celosia argentea Linn.)在0(对照)、1、5、10、15、20、25 mg·kg-1七个浓度下对土壤Cd的耐受和富集特征,评价了青葙对CdCl2、CdSO4、CdCO3、Cd(OH)2、CdS、CdO和Cd(NO3)2等形态Cd的富集能力,并在Cd污染的水稻田土壤中测试了青葙体内Cd的动态累积过程。结果表明,青葙对Cd具有极强的耐受和富集能力,在土壤Cd处理浓度≤15 mg·kg-1时,其生物量未出现显著下降(P>0.05)。除对照外,青葙叶片Cd含量均高于100 mg·kg-1,并且转运系数和富集系数均大于1,符合Cd超富集植物的基本特征。实验同时发现,青葙不仅能大量富集水溶性Cd,对难溶性Cd也表现出很强的超富集能力,在外源添加Cd(OH)2、CdS和CdO等难溶性Cd的土壤中,青葙叶片Cd含量分别达到134、102、90.20 mg·kg-1,表明青葙具有修复不同形态Cd污染土壤的性能。总体而言,青葙对Cd的累积量随时间增加而增大,但在第8~12周时,其地上部植株Cd的富集量增加不显著(P>0.05),由此判断第8周是青葙收获的适宜时期。青葙收获期短这一特性,对于缩短修复周期,提高修复效率有重要的意义。由于青葙生长快速,具有较大的生物量,对Cd耐受和富集能力强,可以认为青葙是一种具有潜在应用价值的Cd超富集植物资源。
青葙;超富集植物;镉;植物修复
Cd(镉)是土壤中最普遍的污染物之一。全国土壤污染状况调查公报显示,我国土壤Cd的点位超标率为7.0%,是所有无机污染物中最高的[1]。因为Cd与其他重金属元素相比,具有较高的移动性和生物有效性,易于通过食物链威胁人体健康[2],所以该元素也被认为是土壤中危害性最大的污染物之一[3]。摄入过量的Cd会损伤肾脏和神经系统,并导致骨质疏松和免疫力下降[4]。因此,土壤Cd污染的治理已成为关系公众健康的重要环境问题。
植物提取技术具有操作简单、经济和技术上能够大面积实施、不会给修复地区造成二次污染等优点,在清除土壤Cd及其他重金属污染方面有着广阔的应用前景[5]。该技术主要依靠超富集植物的超量富集作用去除污染土壤中的重金属污染物,超富集植物作为植物提取技术的核心载体成为研究的热点。目前,国内外已发现约17种Cd超富集植物[6],但许多植物受地区环境条件限制且生物量小,如遏蓝菜(Thlaspi caerulescens)不易直接用于重金属污染的土壤植物修复,仅能作为一种模式植物进行重金属富集机制研究[7]。因此,筛选具有潜在应用价值的Cd超富集植物仍然是植物提取技术的重要基础性工作[8]。
青葙(Celosia argentea Linn.)是苋科青葙属一年生草本植物,分布于我国大部分地区。在前期研究中,我们发现青葙能在锰矿渣堆积区域大量生长且生物量较大(株高最大可达170 cm左右),并经过试验证明具有锰超富集特征[9],同时发现青葙对Cd也有较高的耐受和富集能力,可能是一种潜在的具有应用价值的Cd超富集植物[10]。本文通过盆栽实验研究了青葙对不同浓度、不同形态土壤Cd的富集能力,以及外源添加有机酸强化青葙修复实际Cd污染土壤的效果,从耐受特征、富集特征、生物量和富集动态等方面评价了青葙对土壤Cd污染的修复性能,以期为开发该植物用于土壤Cd污染的修复提供科学依据。
1 材料与方法
1.1 供试植物和土壤
青葙种子采集于广西桂林市平乐县锰矿区。选取颗粒饱满的青葙种子播种于苗床中,置于温室培养,温室温度恒定在20~35℃。种子萌发后,每周用Hoagland’s营养液浇灌一次[11],平日使土壤含水量保持在田间持水量的80%左右。待幼苗长出4~6片真叶,高度为3~4 cm时,移栽进行盆栽实验。
供试土壤分别采自桂林理工大学雁山校区树林中0~30 cm的表层(S0)和广西某矿区尾砂污染水稻田10~30 cm的耕作层(S1)。将采集的土样置阴凉处风干,压碎后过2 mm筛,利用土壤检测仪(SL-3A)测定pH、有机质、有效氮、速效磷和速效钾等基本理化性质(表1)。土壤总Cd采用HNO3-HClO4-HF消煮,可提取态Cd采用0.005 mol·L-1DTPA+0.01 mol·L-1CaCl2+0.1 mol·L-1TEA浸提,25℃振荡2 h[12],原子吸收光谱仪(PE-AA700型)测定。
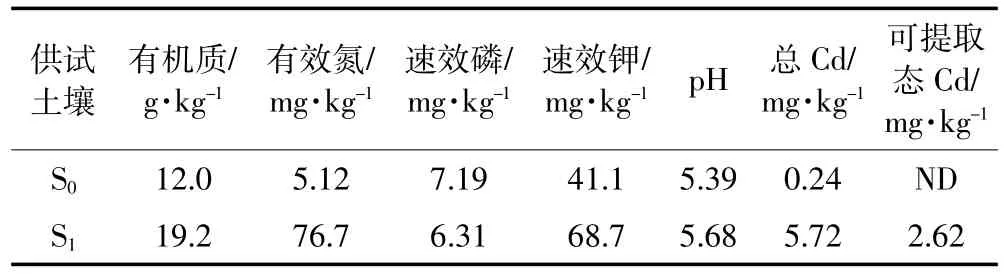
表1 供试土壤的化学性状Table 1 Some chemical properties of soil used in pot experiments
1.2 盆栽实验
实验1:准确称取1 kg的土壤S0装于规格为2 L (14.5 cm×19 cm)的塑料盆内,按照0(对照)、1、5、10、15、20、25 mg·kg-1的Cd浓度梯度加入CdCl2粉末,充分混匀后加水并晒干,如此反复3次,平衡2周后备用。选取生长一致的青葙幼苗移栽到污染土壤中,每盆3棵,每个处理设3个重复。培养期间,使土壤含水量保持在田间持水量的80%左右,生长期为50 d。
实验2:准确称取质量为1 kg的土壤S0装于2 L塑料盆内,分别以粉末形式将CdCl2、CdSO4、CdCO3、Cd(OH)2、CdS、CdO、Cd(NO3)2加入盆中与土壤混合均匀,制成含Cd浓度为5 mg·kg-1的污染土壤,加水后晒干并如此反复3次,平衡2周后备用。同时采用土壤S0作为对照。称取质量为1 kg的土壤S1装于2 L塑料盆内,根据前人的研究,选取5 mmol·kg-1的小分子量有机酸——柠檬酸和苹果酸作为土壤重金属Cd活化剂分别向盆内添加(S1+柠檬酸,S1+苹果酸)[13]。加水后晒干并反复3次,平衡2周后备用。同时采用未添加有机酸的土壤S1作为对照。每个处理设置3个重复。选取生长一致的青葙幼苗移栽到试验土壤中,每盆3棵,生长期为50 d。
实验3:准确称取质量为1 kg过筛后土壤S1,装入容量为2 L的塑料盆中,选取生长一致的青葙幼苗移栽到盆中,每盆3棵,共36盆。植物在移栽后,每周收获3盆植物,分析生物量和Cd含量。持续收获12周,并以移栽前的植物作为对照(第0周)。
1.3 样品处理和分析
收获的植物分成根、茎、叶三部分。根部先用5 mmol·L-1Ca(NO3)2溶液浸泡15 min,交换掉表面吸附的Cd离子[14],超声波清洗仪清洗10 min,再用去离子水冲洗3次。茎和叶直接用去离子水清洗3次。将洗净的样品于105℃杀青30 min,60℃烘干至恒重,测定干重,粉碎后过5 mm筛。粉碎的样品用HNO3+ HClO4(9∶1)湿消化法消解后[15],采用原子吸收光谱仪(PE-AA700)测定Cd含量。采用国家标准参比物质GBW10015(GSB-6)和平行全空白样进行植物样品消解及质量控制,为保证结果的准确,加标回收率控制在95%~105%。
1.4 数据处理
试验数据采用3个重复样的算术平均值±标准偏差(SD)表示。统计分析采用SPSS 19.0中的单因素方差(ANOVA),并用最小显著差数法(LSD)进行显著性检验(P<0.05)。用Origin 8.5作图。富集系数(BCF)和转运系数(TF)的计算公式如下:
富集系数=植物叶Cd含量(mg·kg-1)/土壤Cd含量(mg·kg-1)
转运系数=植物叶Cd含量(mg·kg-1)/植物根Cd含量(mg·kg-1)
2 结果与讨论
2.1 青葙对不同浓度Cd的耐受和富集特征
整个实验周期中,所有处理组的青葙均能正常生长,植株未出现肉眼可见的中毒症状,表明青葙对Cd具有较强的耐受能力。如图1所示,当土壤Cd处理浓度≤15 mg·kg-1时,根、茎和叶的生物量较对照组均没有出现显著下降(P<0.05);在1 mg·kg-1Cd处理组中,青葙的总生物量较对照显著增加(P<0.05),并达到最大值。这一结果与超富集植物遏蓝菜对Cd的生理响应相似[16],即较低浓度的Cd能促进植物的生长。Cd并非植物生长的必需元素,但低剂量的Cd显著增加了植物的生物量,表明青葙对Cd可能存在Hormesis效应[17]。当土壤Cd处理浓度为20 mg·kg-1时,植株生物量出现显著下降,较对照减少了32.9%(图1),即20 mg·kg-1为青葙耐受Cd胁迫的临界浓度,与已报道的Cd超富集植物龙葵(Solanum nigrum L.)耐受Cd胁迫的临界浓度(25 mg·kg-1)[5]相似,但低于鬼针草(Bidens pilosaL.)耐受Cd胁迫的临界浓度(32mg·kg-1)[18]。由于我国90%以上Cd污染土壤为中轻度污染(≤1.5 mg·kg-1)[1],青葙对Cd的耐受能力完全可以满足土壤修复的需要。
普遍认为Cd超富集植物必须符合两个基本特征:植物茎或叶中的Cd大于100 mg·kg-1的临界浓度;转运系数大于1[19]。由表2可知,除对照外青葙叶片中的Cd含量均大于100 mg·kg-1,最高含量高达388 mg·kg-1,并且在Cd污染土壤中,青葙对Cd的转运系数在1.40~4.45之间,大于1。这表明,青葙符合Cd超富集植物的基本特征。此外,要有效去除土壤中的Cd,修复植物对土壤Cd的富集系数必须大于1[20]。本实验中,青葙对土壤Cd的富集系数在9.78~135之间,远远大于1。本研究同时发现,青葙对土壤Cd的富集系数随土壤Cd的处理浓度增加而减少,在1 mg·kg-1土壤Cd处理水平时,其富集系数最大。这一特征表明,青葙对中低浓度Cd污染的土壤有较强的提取能力。在相同的土壤Cd浓度下(15 mg·kg-1),青葙对Cd的富集系数为21.2,约是超富集植物少花龙葵(Solanum photeinocarpum)的3倍[21]。青葙对Cd的超富集能力可能与Cd转运蛋白的表达上调有关。前人的研究表明,Cd超富集植物中与Cd转运相关的ZIP和Nramp家族蛋白的表达水平显著高于普通植物[6]。另外,重金属在超富集植物的叶片中都存在区隔化分布,青葙的解毒机制很可能是通过使Cd有效地分布在液泡中,而使液泡成为Cd向地上部运输的贮存库[22-23]。吴秉奇等[14]的研究显示,青葙对Cd耐受浓度达40 mg·kg-1以上,但茎或叶中的Cd浓度未达到Cd超富集植物的临界标准(100 mg·kg-1),且转移系数<1。这可能是由于同种青葙因趋异适应而形成了生态型差异,导致异于本实验结果,故对青葙的生态型差异还有待进一步的研究。
2.2 青葙对不同形态Cd的富集能力

图1 不同Cd处理浓度下青葙的生物量Figure 1 Biomass of C.argentea grown in soils with different Cd concentrations
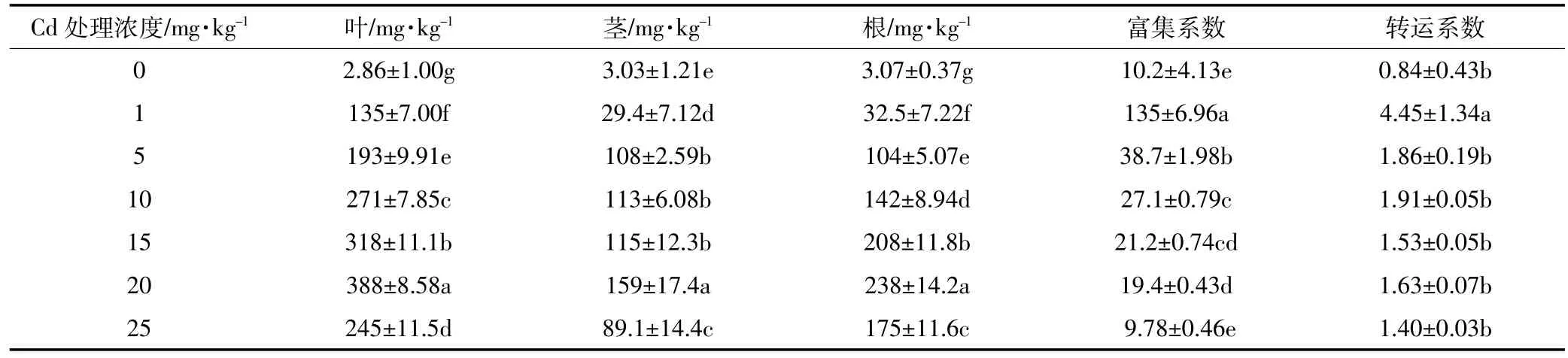
表2 青葙对不同浓度土壤Cd的富集特征Table 2 Cd accumulation in roots,stems and leaves of C.argentea grown in soils with different Cd concentrations
土壤中的Cd通常以不同的形态存在,在旱地土壤中多以CdCO3、Cd3(PO4)2、Cd(OH)2形态存在,在水田土壤中,Cd多以CdS的形态存在[24]。这些不同形态的Cd生物有效性差异较大,可能造成植物修复效率的差异。为全面了解青葙对土壤Cd的修复性能,实验2测试了青葙对7种形态Cd的富集能力。结果显示,青葙对不同形态的Cd富集能力存在显著差异,对CdSO4和CdCl2富集能力显著高于其他形态(表3)。这与CdSO4和CdCl2的水溶性好、生物有效性较高有关。值得关注的是,青葙对难溶性的CdS、CdCO3和CdO也有较高富集性能,富集系数分别达到20.4、19.9和18.0。这一结果表明青葙对不同形态的Cd均有较强的富集能力,因而适用于不同形态Cd污染的土壤修复。Hammer等[25]认为,超富集植物的根分泌物能直接改变重金属的形态,或者通过改变根际土壤pH值促进对重金属的吸收利用。Li等[26]的研究也发现,土壤中Cd的溶解度在东南景天(Sedum alfredii)超富集生态型根分泌物存在的情况下比原土壤提高了89.1%,非富集生态型提高了82.8%,因此东南景天超富集生态型根分泌物对土壤Cd的活化作用显著高于非富集生态型。青葙能富集难溶性的Cd可能也与其根分泌物的活化作用有关。

表3 不同Cd化合物处理下青葙叶、茎、根Cd含量Table 3 Effects of different Cd species on Cd concentrations in roots,stems and leaves of C.argentea
稻田土S1中的Cd污染是由洪水带入大量含Cd尾砂造成的,而尾砂中的Cd主要以植物几乎不能利用的残渣态存在[27],其生物有效性远低于任何一种人为添加的Cd化合物。因此,青葙对土壤S1中的Cd富集能力显著低于其他外源Cd处理的土壤(表3)。此外,土壤S1中有机质的含量高于土壤S0(表1),而有机质中的腐植酸能够与Cd络合生成腐植酸结合态Cd,降低Cd的生物有效性[28]。尽管如此,青葙对稻田土S1中Cd的富集系数仍然能达到10.5。在相同的土壤(S1)中,青葙、少花龙葵(Solanum photeinocarpum)和商陆(Phytolacca acinosa Roxb)的叶Cd含量分别为50.3、51.6、40.6 mg·kg-1,由此可以看出青葙对Cd的富集能力与这两种超富集植物相当[29]。加入柠檬酸和苹果酸后,青葙对土壤S1中的Cd富集能力提高了1倍以上(表3),表明低分子量有机酸能够有效地促进青葙对Cd的富集。低分子量有机酸能够与Cd2+强烈结合形成有机复合态Cd,而有机复合态的Cd比离子态Cd更易于在植物体内转运和积累[30]。在土壤Cd生物有效性极低的情况下,青葙配合重金属活化剂的使用能有效提高Cd的修复效率。在今后的研究中,有必要对活化剂的种类和剂量进行优化。
2.3 青葙对土壤Cd积累的动态特征
青葙对土壤Cd积累量随时间的变化,可以帮助判断修复实践中的收获时间。由图2可知,青葙生长到第10周时叶Cd富集量达到最大值62.3 μg·株-1,随后由于老叶片的脱落导致叶片生物量下降,叶中Cd的积累量在第11、12周时有所下降。青葙茎和根的Cd积累量均随时间增长而升高,但在第5~7周时,积累量增加最快(斜率最大),第12周时达到最大,分别为38.0、15.7 μg·株-1。一般而言,在植物修复的工程实践中,可收获的是植物的地上部。因此,地上部Cd的积累量是评价植物修复性能的重要指标。青葙地上部Cd的积累量在生长的前8周显著增加,但在第8~12周无显著增加(图2)。结合以前的研究结果,青葙在前8周时相对生长率较高[9]。因此可以认为,第8周是青葙最佳的收获时间。根据我国南方的气候条件,青葙一年可收获2~3季。以往的研究表明,适当的增加收获次数可以提高植物对Cd的修复效率[31]。青葙具有较短收获周期,有利于通过增加收获次数提高修复效率。以第8周收获的地上部Cd积累量为依据,每株青葙可去除土壤中的Cd约为80 μg。按照盆栽实验的种植密度和土壤容重计算,单次收获青葙对土壤Cd的提取率约为4.2%。但这是在没有添加活化剂并且土壤S1中Cd生物有效性极低的情况下,计算获得的数据。如果修复Cd生物有效性较高的土壤,或者加入柠檬酸等活化剂,青葙对Cd的提取率会显著提高。由于盆栽实验的条件与土壤修复工程的实际条件有较大差异,有待开展田间实验以便对青葙Cd修复效率进行更准确的评价。
3 结论
在实验的土壤Cd浓度范围内(0~25 mg·kg-1),青葙对土壤Cd具有极强的耐受能力。除对照外,所有处理组均符合Cd超富集植物的基本特征。因此,可以认为青葙是一种Cd超富集植物。

图2 青葙叶、茎、根及地上部Cd富集量随时间的变化Figure 2 The time-dependent accumulation of Cd in leaves,stems,roots and aboveground parts of C.argentea
青葙不仅能大量富集可溶性的土壤Cd,对CdS、CdCO3、Cd(OH)2和CdO等难溶性的Cd也有很高的富集和转运能力,表明该植物可适用于修复不同形态Cd污染的土壤。添加柠檬酸等低分子量有机酸能显著提高青葙对Cd的富集能力。因此,在土壤Cd生物有效性较低的情况下,适当添加活化剂以提高青葙对土壤Cd的修复效率是必要的。
青葙根和地上部的Cd含量随着生长时间呈逐渐增加趋势,第8周以后地上部Cd富集量无显著增加。因此,可以确定第8周是青葙在Cd污染土壤修复中适合的收获时间。盆栽实验单次收获青葙对土壤Cd的提取率为4.2%。从提取率和收获周期看,青葙是一种具有较高应用潜力的Cd超富集植物。
[1]环境保护部,国土资源部.全国土壤污染状况调查公报[R].北京:环境保护部,国土资源部,2014:1-5.
Ministry of Environmental Protection of PRC,Ministry of Land and Resources of PRC.National soil survey[R].Beijing:Ministry of Environmental Protection of PRC,Ministry of Land and Resources of PRC, 2014:1-5.
[2]Liu J G,Qian M,Cai G L,et al.Uptake and translocation of Cd in different rice cultivars and the relation with Cd accumulation in rice grain[J]. Journal of Hazardous Materials,2007,143:443-447.
[3]Bauddh K,Singh R P.Cadmium tolerance and its phytoremediation by two oil yielding plants Ricinus communis(L.)and Brassicajuncea(L.)from the contaminated soil[J].International Journal of Phytoremediation, 2012,14(8):772-785.
[4]Bernhoft R A.Cadmium toxicity and treatment[J].The Scientific World Journal,2013,doi:10.1155/2013/394652.
[5]魏树和,周启星,王新.超积累植物龙葵及其对镉的富集特征[J].环境科学,2005,26(3):167-171.
WEI Shu-he,ZHOU Qi-xing,WANG Xin.Cadmium-hyperaccumulator Solanum nigrum L.and its accumulating characteristics[J].Chinese Journal of Environmental Science,2005,26(3):167-171.
[6]Cappa J J,Pilon-Smits E A.Evolutionary aspects of elemental hyperaccumulation[J].Planta,2014,239(2):267-275.
[7]刘戈宇,柴团耀,孙涛.超富集植物遏蓝菜对重金属吸收、运输和累积的机制[J].生物工程学报,2010,26(5):561-568.
LIU Ge-yu,CHAI Tuan-yao,SUN Tao.Heavy metal absorption,transportation and accumulation mechanisms in hyperaccumulator Thlaspi caerulescens[J].Chinese Journal of Biotechnology,2010,26(5):561-568.
[8]Ali H,Khan E,Sajad M A.Phytoremediation of heavy metals-conceptsand applications[J].Chemosphere,2013,91(7):869-881.
[9]Liu J,Shang W W,Zhang X H,et al.Mn accumulation and tolerance in Celosia argentea Linn.:A new Mn-hyperaccumulating plant species[J]. Journal of Hazardous Materials,2014,267:136-141.
[10]Liu J,Zhang X H,Li T Y,et al.Soil characteristics and heavy metal accumulation by native plants in a Mn mining area of Guangxi,South China[J].Environmental Monitoring and Assessment,2014,186(4):2269-2279.
[11]Hoagland D R,Arnon D I.The water-culture method for growing plants withoutsoil[J].CircularCaliforniaAgriculturalExperimentStation,1950, 347(5406):357-359.
[12]徐亚平,刘凤枝,蔡彦明,等.土壤中铅镉有效态提取剂的选择[J].农业资源与环境学报,2005,22(4):46-48. XU Ya-ping,LIU Feng-zhi,CAI Yan-ming,et al.Selection of effective Pb and Cd extraction agent in soil[J].Journal of Agricultural Resources and Environment,2005,22(4):46-48.
[13]张敬锁,李花粉,衣纯真.有机酸对活化土壤中镉和小麦吸收镉的影响[J].土壤学报,1999,36(1):61-66. ZHANG Jing-suo,LI Hua-fen,YI Chun-zhen.Effects of organic acids on cadmium uptake and cadmium uptake in wheat[J].Acta Pedologica Sinica,1999,36(1):61-66.
[14]吴秉奇,刘淑杰,张淼,等.接种耐镉细菌对青葙吸收积累土壤中镉的影响[J].生态学杂志,2014,33(12):3409-3415.
WU Bing-qi,LIU Shu-jie,ZHANG Miao,et al.Effect of Cd-tolerance bacterium inoculation on Cd uptake in soil by Celosia argentea[J].Chinese Journal of Ecology,2014,33(12):3409-3415.
[15]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社, 1999:205-226.
LU Ru-kun.Soil argrochemistry analysis protocoes[M].Beijing:China Agriculture Science Press,1999:205-226.
[16]Roosens N,Verbruggen N,Meerts P,et al.Natural variation in cadmium tolerance and its relationship to metal hyperaccumulation for seven populations of Thlaspi caerulescens from western Europe[J].Plant Cell Environ,2003,26(10):1657-1672.
[17]Cornu J Y,Bakoto R,Bonnard O,et al.Cadmium uptake and partitioning during the vegetative growth of sunflower exposed to low Cd2+concentrations in hydroponics[J].Plant and Soil,2016,404(1):263-275.
[18]Sun Y B,Zhou Q X,Wang L,et al.Cadmium tolerance and accumulation characteristics of Bidens pilosaL.as a potential Cd-hyperaccumulator[J].Journal of Hazardous Materials,2009,161(2/3):808-814.
[19]Ent A V D,Baker A J M,Reeves R D,et al.Hyperaccumulators of metalandmetalloidtraceelements:Factsandfiction[J].PlantandSoil,2013, 362(1):319-334.
[20]Chaney R L,Malik M,Li Y M.Phytoremediation of soil metals[J].Current Opinions in Biotechnology,1997,8(3):279-284.
[21]Zhang X F,Xia H P,Li Z A,et al.Identification of a new potential Cdhyperaccumulator Solanum photeinocarpum by soil seed bank-metal concentration gradient method[J].Journal of Hazardous Materials,2011, 189(1/2):414-419.
[22]Blamey F P C,Asher C J,Edwards D G,et al.Role of trichomes in sunflower tolerance to manganese toxicity[J].Plant Soil,1986,91(2):171-180.
[23]Lasat M M,Baker A,Kochian L V.Physiological characterization of root Zn2+absorption to shoots in Zn hyperaccumulator and nonaccumulator species of Thlaspi[J].Plant Physiol,1996,112(4):1715-1722.
[24]夏汉平.土壤-植物系统中的镉研究进展[J].应用与环境生物学报, 1997,3(3):289-298. XIA Han-ping.Studies on cadmium in soil-plant system[J].Chinese Journal of Applied and Environmental Biology,1997,3(3):289-298.
[25]Hammer D,Keller C.Change in the rhizosphere of metal-accumulating plants evidenced by chemical extractants[J].Journal of Environmental Quality,2002,31(5):1561-1569.
[26]Li T Q,Liang C F,Han X,et al.Mobilization of cadmium by dissolved organic matter in the rhizosphere of hyperaccumulator Sedum alfredii [J].Chemosphere,2013,91(7):970-976.
[27]许超,夏北成,吴海宁.尾矿库尾砂及周边农田土壤重金属形态分布及其生物有效性[J].农业环境科学学报,2009,28(11):2293-2296.
XU Chao,XIA Bei-cheng,WU Hai-ning.Speciation and bioavailability of heavy metals in tailings and agricultural soils[J].Journal of Agro-Environment Science,2009,28(11):2293-2296.
[28]余贵芬,蒋新,赵振华,等.腐植酸存在下镉和铅对土壤脱氢酶活性的影响[J].环境化学,2006,25(2):168-170.
YU Gui-fen,JIANG Xin,ZHAO Zhen-hua,et al.Dehydrogenase activity of Cd and Pb-contaminated soil in the presence of humic substances[J].Environmental Chemistry,2006,25(2):168-170.
[29]吴惠瑾,刘杰.三种富集植物对广西兴源铅锌矿区周边Cd污染农田土壤修复性能研究[J].工业安全与环保,2016,42(2):1-4.
WU Hui-jin,LIU Jie.Study of three accumulators for phytoremediation of paddy soil contaminated by cadmium at Pb-Zn mining district in Guangxi Province[J].Industrial Safety and Environmental Protection, 2016,42(2):1-4.
[30]Ehsan S,Ali S,Noureen S,et al.Citric acid assisted phytoremediation of cadmium by Brassica napus L.[J].Ecotoxicology and Environmental Safety,2014,106:164-172.
[31]Wei S H,Zhou Q X.Phytoremediation of cadmium-contaminated soils by Rorippa globosa using two-phase planting[J].Environ Sci&Pollut Res,2006,13(3):151-155.
Cd hyperaccumulation and accumulative kinetics of Celosia argentea Linn.for phytoremediation of Cd-contaminated soil
YAO Shi-yin1,LIU Jie1,2*,WANG Yi-xuan1,ZHU Yuan-fang2,FENG Shun1
(1.Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology,Guilin University of Technology,Guilin 541004,China;2.Guangxi Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area,Guilin University of Technology, Guilin 541004,China)
In the present work,Cd tolerance and accumulation in Celosia argentea were evaluated using pot experiments with soils spiked with different levels(0,1,5,10,15,20,and 25 mg·kg-1)of Cd or different Cd compounds[CdCl2,CdSO4,CdCO3,Cd(OH)2,CdS,CdO,and Cd(NO3)2]at 5 mg·kg-1.Kinetics of Cd uptake and accumulation in the plants were also studied in natural Cd-contaminated soil.The results showed that C.argentea has a high ability to accumulate and tolerate Cd.The biomass of C.argentea did not decrease significantly when the soil Cd was≤15 mg·kg-1.The Cd accumulation in leaves was above 100 mg·kg-1,and the transfer factor and bioconcentration factor were both higher than 1 in all plants except for control.Therefore,C.argentea could be identified as a Cd-hyperaccumulator.In addition,C.argentea can hyperaccumulate not only soluble Cd but also insoluble Cd.Cd concentrations were 134,102,and 90.2 mg·kg-1in the leaves of C.argentea grown in the soils with exogenous Cd(OH)2,CdS,and CdO,respectively.This finding indicated that C.argentea has a potential to remediate soils contaminated by different Cd species.In general,the concentrations of Cd in tissues increased progressively with time.However,the uptake of Cd in shoots increased insignificantly from the 8th to the 12th week(P>0.05),indicating that the 8th week is the best harvest time for C.argentea.A short harvest time is favorable to improve the efficiency of phytoremediation.In conclusion,C.argentea has a great potential for Cd phytoextraction because of its rapid growth,considerable biomass,and high Cd tolerance and accumulation.
Celosia argentea Linn;hyperaccumulator;cadmium;phytoremediation
X506
A
1672-2043(2017)08-1470-07
10.11654/jaes.2016-1677
2016-12-30
姚诗音(1990—),女,河北石家庄人,硕士研究生,主要研究方向为受损土壤环境的生态修复。E-mail:1194720576@qq.com
*通信作者:刘杰E-mail:liujie@glut.edu.cn
国家自然科学基金项目(41471270);广西自然科学基金杰出青年基金项目(2014GXNSFGA118009);国家重点研发计划子课题(2016YFD080080402)
Project supported:The National Natural Science Foundation of China(41471270);Distinguished Young Scholars of the National Natural Science Foundation of Guangxi Province,China(2014GXNSFGA118009);The Sub Project of National Development Program of China(2016YFD080080402)
姚诗音,刘杰,王怡璇,等.青葙对镉的超富集特征及累积动态研究[J].农业环境科学学报,2017,36(8):1470-1476.
YAO Shi-yin,LIU Jie,WANG Yi-xuan,et al.Cd hyperaccumulation and accumulative kinetics of CelosiaargenteaLinn.for phytoremediation of Cd-contaminated soil[J].Journal of Agro-Environment Science,2017,36(8):1470-1476.

