紫外-可见分光光度法测定3种酒中氰化物的浓度
李 悦,何 颖,李彦懿,肖得力
(1.天津医学高等专科学校,天津300222; 2.中国药科大学,江苏南京211198)
紫外-可见分光光度法测定3种酒中氰化物的浓度
李 悦1,何 颖2,李彦懿2,肖得力1
(1.天津医学高等专科学校,天津300222; 2.中国药科大学,江苏南京211198)
采用紫外可见分光光度法测定了3种常见酒中氰化物浓度,并在此基础上探究不同种类酒对吸光度的影响。结果显示,在500 nm波长处,氰化物浓度在0.00~8.00 μg/mL范围内,与吸光度呈良好的线性关系,表明此方法准确可靠。在测定的3种酒中,氰化物浓度顺序为红酒<白酒<木薯酒,其中氰化物浓度最高的木薯酒为0.86 μg/mL;氰化物浓度最低的红酒为0.38 μg/mL。不同种类的酒通过紫外-可见分光光度法进行测定时,在检测波长处均未见明显干扰,因此紫外-可见分光光度法是测定不同酒中氰化物浓度经济有效、切实可行的分析方法。同时本研究对不同种类酒氰化物浓度比较的准确度及精密度的评定与后续相关研究的展开具有重要意义。
氰化物; 酒; 紫外可见分光光度法; 浓度比较; 干扰
氰化物通过消化道与呼吸道进入人体,作用于细胞内呼吸酶抑制细胞正常呼吸,从而引起组织衰竭,对人体产生极强的毒害作用[1]。作为酒水安全检测的重点关注对象之一,酒中的氰化物主要来源于其植物原料,如葡萄、木薯中含有的氰化物或氰甙类配糖体[2,3]。原料中的氰化物在酸性条件下或加热过程中可生成剧毒的氰化氢或氰离子,无毒的氰苷则在植物细胞被破坏时经β-葡萄糖苷酶催化水解生成氢氰酸。大部分的氢氰酸在原料蒸煮制备过程中经挥发排出,少量的氢氰酸溶解残留在酒中,对人体健康产生威胁,严重到甚至可致死亡[2,4]。国家执行标准GB 2757—2012[5]中规定:酒中氰化物含量需小于8 mg/L。目前,检测酒中氰化物浓度的方法有很多:巴比妥酸-异烟酸比色法能够测定植物酶解反应中氰化物含量,是国标GB/T 5009.48中氰化物检测方法,但该方法显色剂不易保存,检测结果中常存在浑浊现象干扰测定,且检测限为0.10 mg/kg,不能满足更为微量的测定要求[6,7];Giorgio Nota建立的顶空-气相色谱法突破性采用ECD检测器,提高了氰化物检测的灵敏度,但酒中的高浓度乙醇会对检测结果产生影响[8,9];吡啶-吡唑酮法灵敏度高,是氰化物检测的国家标准方法之一,但该方法操作复杂,同时作为试验试剂的吡啶易挥发,且对人体产生毒害作用[10]。本研究根据《中国药典》2015年版氰化物检测法第二法,氰化物水解产生氰化氢与三硝基苯酚锂反应生成红色异红紫酸盐,通过采用紫外可见分光光度法测定3种酒中氰化物浓度,进而比较不同酒种类对氰化物浓度检测的影响。
目前,在国内关于酒中氰化物浓度测定的研究报道较多,关于同一检测方法下不同种类酒氰化物浓度比较的报道较少,因此,本研究对不同种类酒氰化物浓度比较的准确度及精密度的评定与后续相关研究的展开具有重要意义。
1 材料与方法
1.1 材料、仪器与试剂
酒样:木薯酒购自常州市启迪化工有限公司;白酒购自江苏博汉工贸有限公司;红酒购自中国长城葡萄酒有限公司。
试验仪器:UV-1800紫外可见分光光度计,日本岛津;石英比色皿;100 mL量筒;10 mL烧杯;200 mL具塞广口瓶;电子天平(精度0.0001 g)。
试剂及耗材:氰化钠固体;2,4,6-三硝基苯酚(分析纯);碳酸锂(分析纯);氰化钠固体购自中国药科大学危险品仓库;2,4,6-三硝基苯酚(分析纯)购自西陇化工有限公司;碳酸锂(分析纯)购自国药集团化学试剂有限公司;三硝基苯酚锂试液:称取0.25 g碳酸锂与0.50 g 2,4,6-三硝基苯酚溶于80 mL沸水中,室温下冷却,用蒸馏水定容到100 mL。
标准氰化钠溶液:称取18.85 mg的氰化钠固体用蒸馏水定容到500 mL,稀释到20.00 μg/mL。
1.2 实验方法
1.2.1 吸光度标准曲线的制定
移取0.40 mL、1.00 mL、2.00 mL标准氰化钠溶液置于3个200 mL具塞广口瓶中,分别加蒸馏水至5 mL,摇匀,得浓度分别为1.60 μg/mL、4.00 μg/mL、8.00 μg/mL的氰化钠溶液,同时设置1个200 mL具塞广口瓶加入蒸馏水5 mL作为空白组。将4个精密加有1 mL三硝基苯酚锂试液的10 mL烧杯分别置于上述4个具塞广口瓶中,密塞,在暗处25℃放置14 h后取出烧杯,精密加水2 mL,混匀,测定500 nm处吸光度,绘制浓度-吸光度曲线。
1.2.2 测定酒样中的氰化物浓度
分别取红酒、白酒、木薯酒3种酒各5 mL于200 mL具塞广口瓶中,将3个精密加有1 mL三硝基苯酚锂试液的10 mL烧杯分别置于3个具塞广口瓶中,密塞,在暗处25℃放置14 h后取出烧杯,精密加水2 mL,混匀,测定500 nm处吸光度,通过浓度-吸光度标准曲线得3种酒中氰化物浓度。
2 结果与讨论
2.1 标准曲线的绘制
将配制的氰化钠溶液进行全波长扫描(图1),同时根据《中国药典》2015年版中关于氰化物检测法第二法中的说明,采用500 nm作为检测波长。氰化钠标准曲线(图2)显示,氰化物的吸光度与氰化物浓度的线性回归方程为Y=0.1386X+0.05252,相关系数为0.98062,表明氰化物浓度在0.00~8.00 μg/mL范围内,氰化物浓度与吸光度呈良好的线性关系。
2.2 不同酒样中的氰化物浓度(表1)
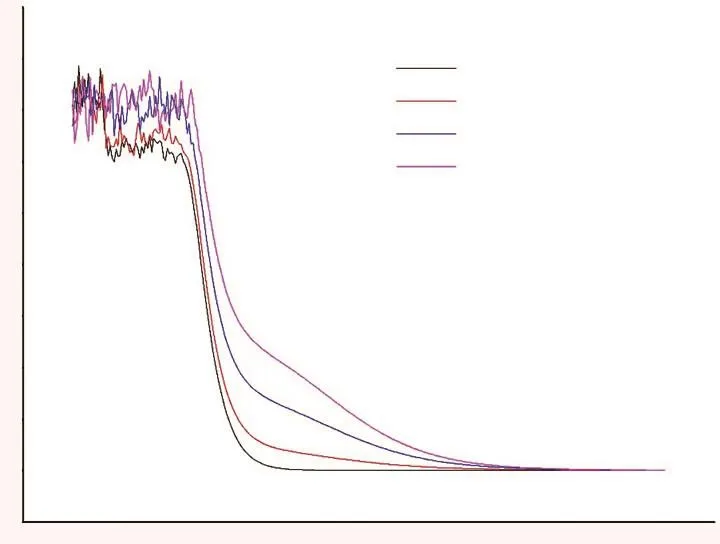
图1 不同浓度氰化钠溶液在不同波长下的吸光度
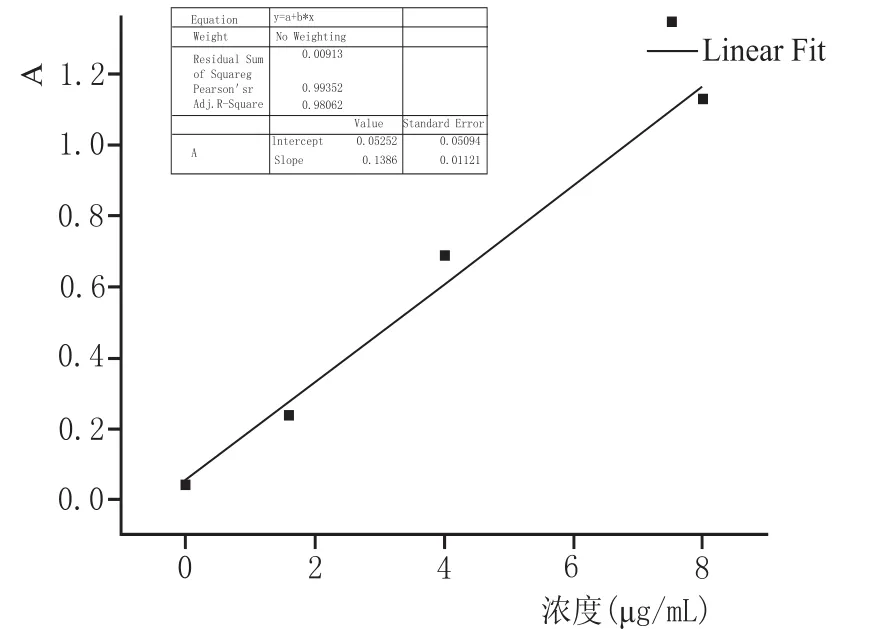
图2 氰化物浓度与紫外吸光度值的线性关系

表1 3种酒中的氰化物浓度
从表1可以看出,3种测试酒样中氰化物浓度顺序为红酒<白酒<木薯酒,其中,氰化物浓度最高的木薯酒为0.86 μg/mL,氰化物浓度最低的红酒为0.38 μg/mL。许多酒原料中含有氰化物或氰苷,如木薯、玉米、高粱、杨梅、葡萄籽等[11]。植物、水果中的氰苷常见有苦杏仁苷、野樱苷、亚麻苦苷等,不同种类植物中氰化物或氰苷含量相差较大:木薯原料中含有高含量亚麻苦苷,木薯叶分解产生的氰化氢含量为202.7~284.8 mg/kg,木薯块根分解产生的氰化氢含量为46.8~92.6 mg/kg[12],同时苦木薯中氰化物含量高于甜木薯[13,14];桃仁中苦杏仁苷含量为47.7~275.1 μg/g[15];枇杷仁、樱桃仁中苦杏仁苷含量为2.67%±0.05%[16]。葡萄酒以葡萄为原料发酵而成,在发酵过程中,亚麻苷在亚麻苦苷酶与β-糖苷酶的作用下降解,随发酵时间延长,氰化氢释放量减少。白酒与木薯酒属于蒸馏酒类,在蒸煮过程时,有少量未挥发的氰化氢残留在酒中[17,18]。市售白酒多以高粱、小麦、玉米等为原料酿造,这些原料中氰化物或氰苷含量低于木薯。在此次研究检测的不同种类酒中,果酒氰化物浓度低于粮食型蒸馏酒类,白酒检测出氰化物浓度低于木薯酒,与前人的研究结果一致[12-16]。
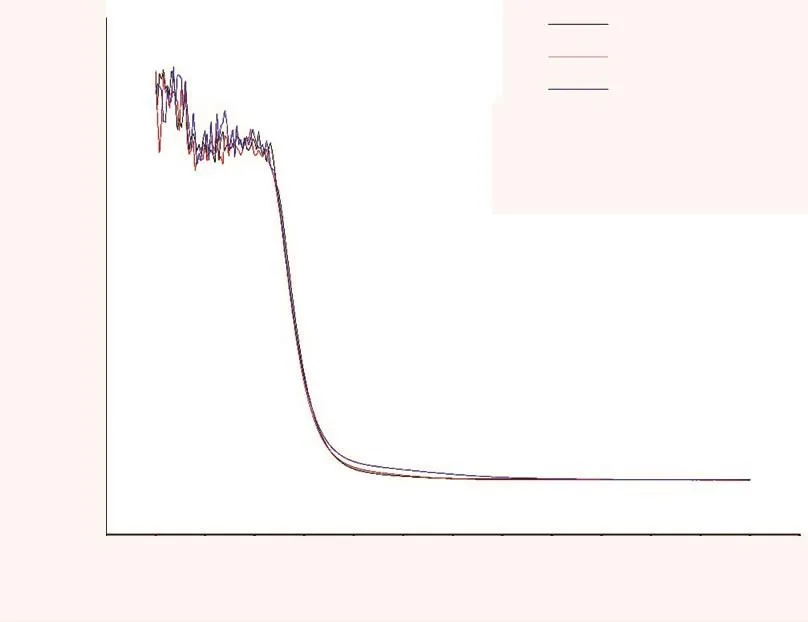
图3 3种酒在不同波长下的吸光度
白酒、木薯酒为无色透明液体,红酒中花色苷使红酒呈现出颜色[19]。图3为3种酒在不同波长下的吸光度。从图3可以看出:在紫外吸收波长范围内,3种酒样均有明显吸收,但是在450~480 nm范围内,干扰迅速降低至很低水平,在检测波长500 nm处3种酒均未见明显干扰,表明不同种类酒可以采用紫外可见分光光度法进行测定。相对传统的半定量方法、灵敏度低的比色法及一些需要昂贵仪器的方法,本文探讨的紫外可见分光光度法可以是测定不同酒中氰化物浓度经济有效、切实可行的分析方法。
3 结论
根据《中国药典》2015年版中关于氰化物检测法第二法,采用紫外可见分光光度法测定3种酒中氰化物浓度,氰化钠浓度-吸光度标准曲线结果显示氰化物浓度在0.00~8.00 μg/mL范围内,与吸光度呈良好的线性关系。进一步研究表明,3种供测试的酒中氰化物浓度顺序为红酒<白酒<木薯酒,其中氰化物浓度最高的木薯酒为0.86 μg/mL;氰化物浓度最低的红酒为0.38 μg/mL。不同种类酒采用紫外可见分光光度法进行测定,在检测波长500 nm处均未见明显干扰。因此紫外可见分光光度法是测定不同酒中氰化物浓度经济有效、切实可行的分析方法。
[1] 张新威.毒品和毒物检验[M].北京:中国人民公安大学出版社,2003:213.
[2] 魏云,杨红文,邵栋梁,等,白酒中氰化物检测影响因素分析[J].酿酒,2013,40(2):60-62.
[3] 车明秀,胡明燕,刘睿,等.蒸馏酒及配制酒中氰化物测定方法的研究[J].酿酒科技,2013(10):90-91.
[4] 中华人民共和国卫生部.食品安全国家标准蒸馏酒及其配制酒:GB 2757—2012[S].北京:中国标准出版社,2013.
[5] Joint FAO/WHO Expert Committee on Food Additives.Toxicological evaluation of certain food additives and naturally occurring toxicants[R].Geneva:World Health Organization,1993:398.
[6]KOBAISY M,OOMAH B D,MAZZA G.Determination of cyanogenic glycosides in flaxseed by barbituric acid-pyridine,pyridine-pyrazolone,and high-performance liquid chromatography methods[J].J agric food chem,1996,44(10):3178-3181.
[7]BERENGUER-NAVARRO V,GINER-GALVAN R M,GRANE-TERUEL N,et al.Chromatographic determination of cyanoglycosides prunasin and amygdalin in plant extracts using a porous graphitic carbon column[J].J agric food chem,2002,50(24):6960-6963.
[8]NOTA G,PALOMBARI R.Determination of cyanides and thiocyanates in water by gas chromatography[J].J chromat A,1973,84(1):37-41.
[9] 阎冠洲,钟其顶,李国辉,等.顶空气相色谱测定白酒中氰化物方法研究[J].酿酒科技,2013(3):89-92.
[10] 胡海涛,马金波,彭德才,等.异烟酸-巴比妥酸法测定食酒中的氰化物[J].中国卫生检验杂志,2004,14(1):58-59.
[11] 高渌汶.有毒中药临床精要[J].北京:学苑出版社,2004:271.
[12] 陈建新,刘家运,刘翠珍,等.不同处理方法对木薯氢氰酸含量的影响[J].广东畜牧兽医科技,1992(4):31-34.
[13] 邓绍平,邝嘉萍,钟伟祥,等.香港食用植物中氰化物含量及加工过程对其含量的影响[J].中国食品卫生杂志,2008,20(5):428-431.
[14] Cyanogenic glycosides in cassava and bamboo shoots:a human health risk assessment[R].Food Standards Australia New Zealand,2005.
[15] 马艳,徐锡增,马荣才.根瘤菌入侵刺槐的途径研究[J].南京林业大学学报(自然科学版),2003,27(4):55-58.
[16] 甄攀,王德宝,贾天军,等.郁李仁中苦杏仁甙的HPLC分析[J].神经药理学报,2002,19(5):13-14.
[17] 陈琨,夏春,王之明,等.流动注射法测定红酒中总氰化物的不确定度评定[J].广州化工,2013,41(21):119-121.
[18] 穆道莉,魏云.白酒中氰化物测定方法的探讨[J].中小企业管理与科技,2012(10):298-299.
[19] 陈继峰.红葡萄酒颜色研究[J].酿酒科技,2008(5):95-100.
Determination of Cyanides Concentration in 3 Kinds of Alcoholic Drinks by UV-Vis Spectrophotometry
LI Yue1,HE Ying2,LI Yanyi2and XIAO Deli2
(1.Tianjin Medical College,Tianjin 300222;2.China Pharmaceutical University,Nanjing,Jiangsu 211198,China)
The content of cyanides in three kinds of alcoholic drinks was detected by UV-Vis spectrophotometry.On this basis,the influence of different kinds of alcoholic drinks on the absorbance was further investigated.The results showed that,there was a good linear relationship between cyanide concentration(0.00~8.00 μg/mL)and absorbance value at 500 nm wavelength.The content of cyanides in three kinds of alcoholic drinks ranked in increasing sequence as red wine<Baijiu<cassava liquor.The content of cyanides was the highest in cassava liquor(0.86 μg/mL)and the lowest in red wine(0.38 μg/mL).Moreover,as the three different kinds of alcoholic drinks were measured by UV-Vis spectrophotometry,no significant interference presented at the detection wavelength.Therefore,UV-Vis spectrophotometry for the determination of cyanides content in alcoholic drinks was economical and feasible.Meanwhile,this study was of great significance in the evaluation of the accuracy and precision of cyanides concentration in alcoholic drinks and the related follow-up studies.
cyanide;alcoholic drinks;UV-Vis spectrophotometry;comparison of concentration;interference
TS262;TS261.7;TS261.4
:A
1001-9286(2017)08-0128-04
10.13746/j.njkj.2017087
青年教师学科研究培育基金项目(项目号:YZQN20151411)。
2017-04-10
李悦,硕士,讲师,E-mail:liyue130521@126.com。
肖得力,博士,讲师,从事药物分析研究工作,E-mail:xiao49562001@163.com。
优先数字出版时间:2017-06-02;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170602.1352.002.html。

