芝麻菜可溶性蛋白提取工艺的研究
徐坤范
(山东省临清市农业局,临清 252600)
芝麻菜可溶性蛋白提取工艺的研究
徐坤范
(山东省临清市农业局,临清 252600)
以芝麻菜为试验材料,对考马斯亮蓝法提取可溶性蛋白的工艺进行了研究。采用单因素试验对影响可溶性蛋白的主要因素提取溶剂及其浓度、料液比和提取时间进行初步研究,然后进行正交试验,再采用方差分析验证正交实验确定的提取工艺,并进行优化。结果表明:NaCl溶液为最佳的提取溶剂;芝麻菜可溶性蛋白提取的最佳条件为0.15 mol/L NaCl溶液、料液比1∶20、提取时间15 min,平均提取量为15.43 mg/g;3个因素对芝麻菜可溶性蛋白提取的影响程度大小先后顺序为:NaCl溶液浓度>料液比>提取时间。
芝麻菜 可溶性蛋白 考马斯亮蓝法
芝麻菜(Eruca sativa Mill),又称火箭生菜、紫花南芥等,是十字花科芝麻菜属,一年生草本植物,原产欧洲南部,我国西北、华北、华东等地均有野生种,或作油料作物栽培,因叶片含有芝麻香味,故称芝麻菜[1]。芝麻菜含有丰富的营养物质,如维生素、铁、钙、锌、硒和粗蛋白质,味道鲜美,清香可口,深受消费者青睐[1];经常食用可以提高免疫力和肝脏解毒的功能,而且还可以降低血液中胆固醇含量,防止或减缓动脉粥样硬化的进程[1];并具有保健作用,如具有较强的防癌作用,能促进细胞活性,对久咳有特效,还可治疗尿频[2]。因此芝麻菜极具开发价值,而且能填补淡季蔬菜品种[3]。
芝麻菜中蛋白质含量是影响其营养品质、风味品质的重要因素之一。果蔬可溶性蛋白测定方法较多,有Folin—酚试剂(Lowry)法、双缩脲法、微量凯式定氮法等,但是这些方法都存在很多的不足,如Folin—酚试剂法操作繁琐,费时,干扰物质多,专一性差,误差较大[4,5];双缩脲法虽较快速、蛋白质特异性影响小,但是灵敏度差,所需样品量大,准确度较差[4];微量凯氏定氮法虽然准确度高、具有普遍性,但是操作繁琐[4];考马斯亮蓝(Bradford)法以反应快速、操作简便、灵敏度高、干扰物质较少,而且稳定性好[6]等优点,被广泛地应
用在苹果[7]、猕猴桃[8]、小米[9]等多种植物组织可溶性蛋白测定和酶比活力[10]的测定。该文以芝麻菜为实验材料,首先对影响蛋白质提取的因素(提取溶剂、提取溶剂的浓度、料液比和提取时间)进行了单因素测定试验,然后综合单因素试验进行正交优化试验,再采用方差分析验证正交实验确定的提取工艺,并进行优化。确定可溶性蛋白提取的最佳条件,以期为其它蔬菜可溶性蛋白提取条件提供理论依据。
1 材料与方法
1.1 试验材料的制备
于2016年3月20日将白花芝麻菜播种于拱圆大棚中,待芝麻菜生长到30 d,5片真叶时达到商品成熟度,随机取芝麻菜叶片洗净(待水滴干)。称取芝麻菜鲜样1.00 g,放入研钵中加入2 ml提取溶剂研磨成匀浆,转移到离心管中,再用8 ml提取溶剂分次洗涤研钵,洗涤液收集于同一离心管中,放置0.5~1 h以充分提取,然后放入离心机3 000r/min 离心10 min,即得待测样品提取液,上清液备用,重复3次[7]。
1.2 方法
1.2.1 考马斯亮蓝G-250溶液和牛血清白蛋白标准溶液的配制方法
参考邓丽莉[7]等的研究方法。
1.2.2 标准曲线的绘制
取6支试管,在试管中分别精确移取牛血清白蛋白标准溶液(100μg/ml)0.0 ml、0.2 ml、0.4 ml、0.6 ml、0.8 ml、1.0 ml,加蒸馏水至1 ml,分别配制成浓度为0、20、40、60、80、100 μg/ ml的蛋白质标准溶液。然后在各支试管中分别加入5 ml考马斯亮蓝G-250试剂,摇匀,在室温下静置反应5 min左右。在595 nm波长处比色测定吸光度。以牛血清白蛋白标准溶液浓度为横坐标,以吸光度为纵坐标,绘制标准曲线[6,11~13]。
1.3 试验设计
1.3.1 不同提取溶剂对芝麻菜可溶性蛋白提取量的影响
精确称取芝麻菜鲜样1.00 g,在45 ℃,料液比为1∶10,提取时间为45 min条件下,考察不同提取溶剂对测定芝麻菜可溶性蛋白含量的影响,分别加10 ml蒸馏水(pH=7)、NaOH溶液(pH=12.56)、NaCl(pH=6.71)溶液和醋酸(pH=3)溶液(0.1 mol/L),3 000r/min离心10 min,各重复3次,采用考马斯亮蓝G-250染色法测定芝麻菜中可溶性蛋白含量,以确定最佳提取溶剂。
1.3.2 不同浓度的提取溶剂对芝麻菜可溶性蛋白提取量的影响
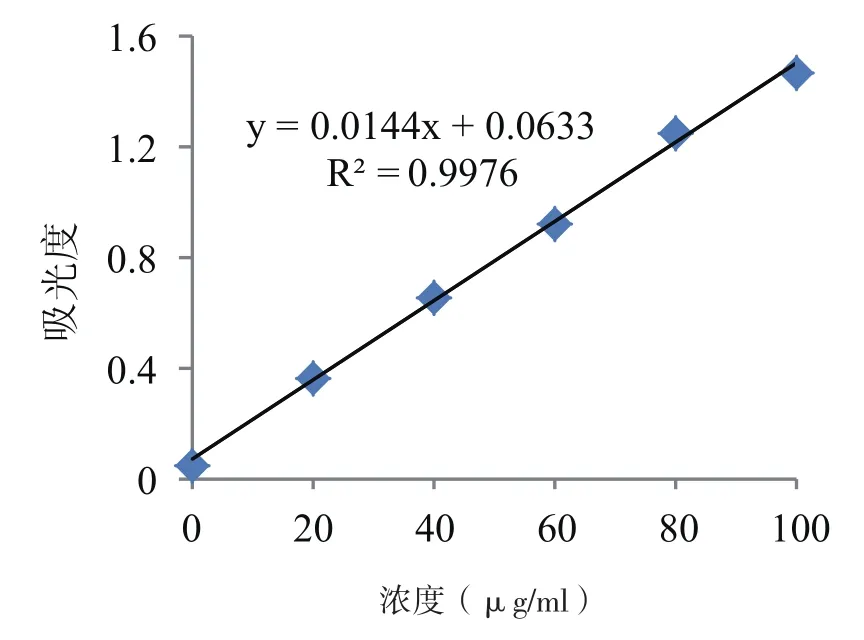
图1 标准曲线图
以1.3.1确定的提取溶剂为基准,控制其他因素不变,考察该提取溶剂溶液浓度对芝麻菜可溶性蛋白提取量的影响,精确称取芝麻菜鲜样,共计5份,每份1.00 g,分别加入10 ml(0.05 mol/L、0.10 mol/L、0.15 mol/L、0.2 mol/L、0.25 mol/L)的该提取溶剂溶液,各重复3次,确定提取溶剂的最佳浓度,其它操作同上。
1.3.3 不同料液比对芝麻菜可溶性蛋白提取量的影响
以1.3.1和1.3.2确定的提取溶剂及其浓度为基准,分别精确称取芝麻菜白花品种鲜样1.00 g,控制其他因素不变,对不同料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25进行试验,各重复3次,确定最佳的料液比。
1.3.4 不同提取时间对芝麻菜可溶性蛋白提取量的影响
以上述确定的提取溶剂及其浓度和料液比为基准,考察不同时间对芝麻菜可溶性蛋白提取量的影响,精确称取芝麻菜鲜样,共计5份,每份1.00 g,分别放置15 min、30 min、45 min、60 min、75 min,各重复3次,确定最佳的提取时间。
1.3.5 正交试验
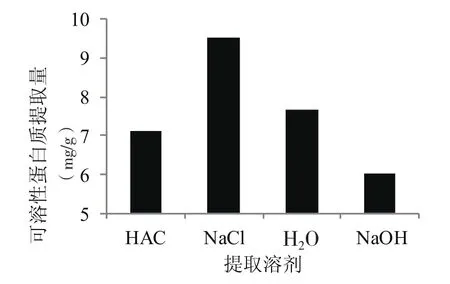
图2 提取溶剂对芝麻菜可溶性蛋白提取量的影响
在单因素实验的基础上,采用3因素3水平正交试验,因素水平表见表1。根据确定的提取条件,重复3次实验,进行验证。在以上单因素试验的基础上,以NaCl盐溶液浓度(A)、料液比(B)、提取时间(C)为考察因素,确定每个因素的3个水平,根据L9(34)正交表设计试验,并计算可溶性蛋白提取量,以可溶性蛋白含量为评价指标优选工艺。
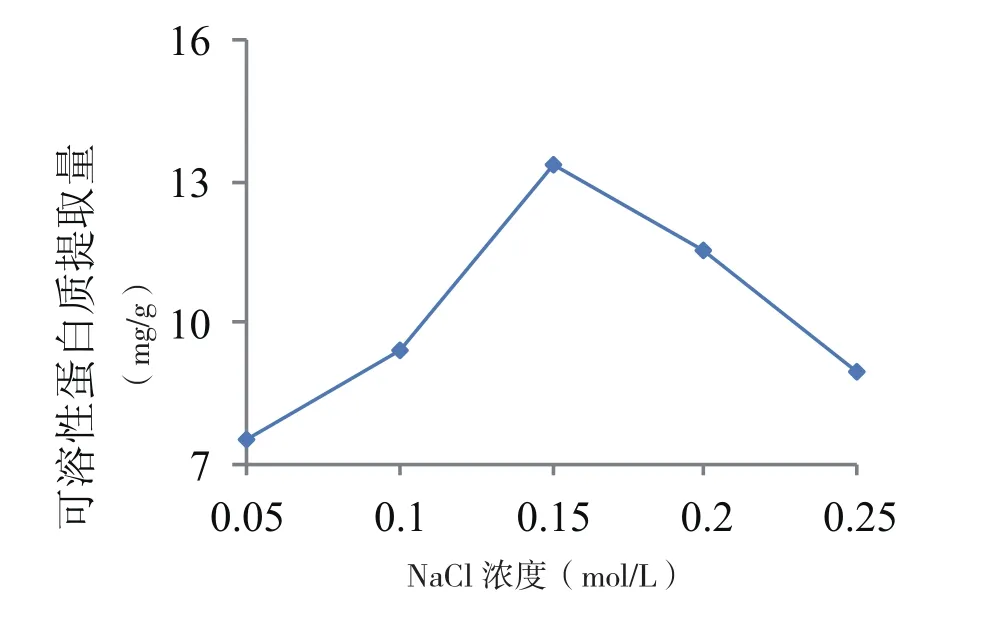
图3 不同浓度的NaCl盐溶液对芝麻菜可溶性蛋白提取量的影响
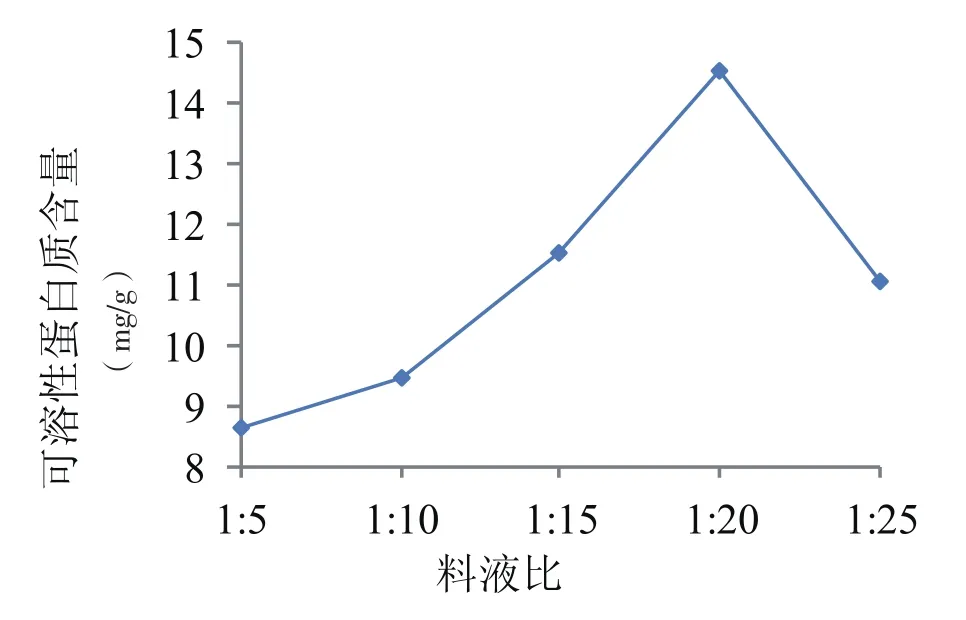
图4 不同料液比条件对芝麻菜可溶性蛋白提取量的影响
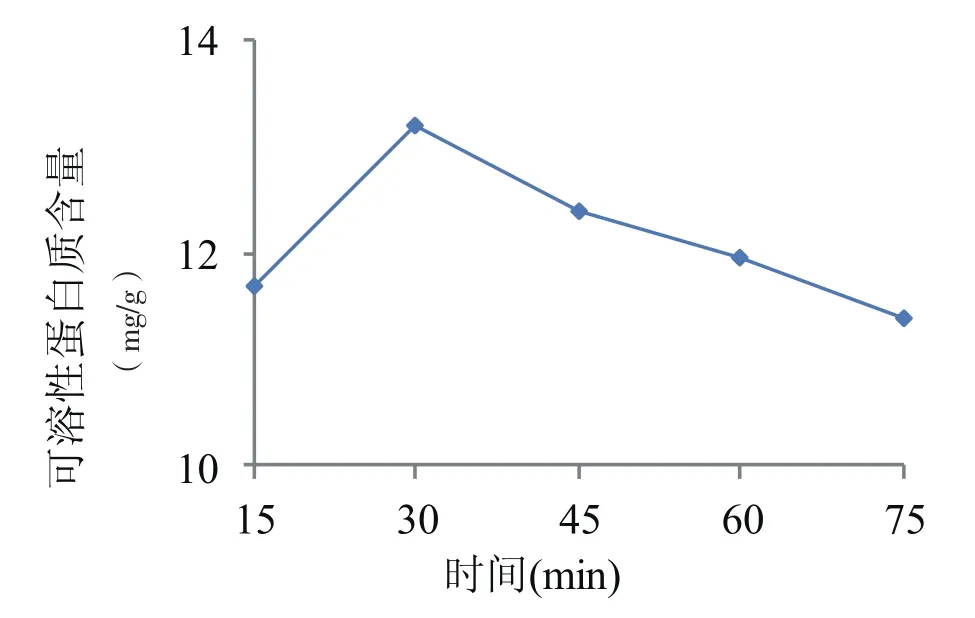
图5 不同提取时间对芝麻菜可溶性蛋白提取量的影响
1.4 数据处理与结果计算
采用 Excel 2 010统计分析所有数据并作图,利用DPS9.5软件对差异显著性进行分析。
样品中蛋白质的含量(mg/g)=C*VT(/V1*FW) *1 000[13]
C:查标准曲线值(μg);VT:提取液总体积(ml);FW:样品鲜重(g);V1:测定时加样量(ml)。
2 结果与分析
2.1 标准曲线绘制
考马斯亮蓝提取可溶性蛋白时,R在0.99~1是可接受的[21]。由图1可知,考马斯亮蓝提取可溶性蛋白时R2(相关系数)=0.997 6,说明线性关系较好,此法提取芝麻菜可溶性蛋白质是可行的。
2.2 不同溶剂对可溶性蛋白提取量的影响
由图2可知,提取溶剂对测定芝麻菜中可溶性蛋白含量有着显著的影响,随着提取溶剂pH值的增加,可溶性蛋白提取量呈现先增加后降低的趋势,当提取溶剂为NaCl(pH为6.71)时可溶性蛋白提取量最大,显著大于提取溶剂的提取量;提取溶剂为NaOH(pH为12.56)时提取量最低;因此确定以NaCl溶液为提取溶剂。
2.3 可溶性蛋白提取量的单因素试验
2.3.1 不同浓度的NaCl溶液对可溶性蛋白提取量的影响
由图3可以看出,芝麻菜可溶性蛋白提取量随NaCl溶液浓度的增加呈先上升后下降的趋势,当盐溶液浓度为0.15 mol/L时,可溶性蛋白的提取量最大,显著高于其他各浓度处理,可溶性蛋白提取量为13.32 mg/g;当NaCl溶液浓度>0.15 mol/L时,再增加盐溶液的浓度,提取量反而降低,这可能是由于随着NaCl溶液浓度的增加,芝麻菜中其它的杂质也被更多地提取出来,使提取液中杂质含量增加,有效成分含量反而降低。因此试验选择0.15 mol/L作为盐溶液浓度筛选其他因素。
2.3.2 不同料液比对测定可溶性蛋白提取量的影响
由图4可知,可溶性蛋白提取量开始时随着料液比的增大而增大,料液比在1∶20时提取量最大为14.52 mg/g;随溶剂用量的增加,提取出的蛋白质反而减小。考虑到料液比的大小会影响后续过滤操作以及溶剂回收过程的难易,故试验选择料液比为1∶15~1∶25较为合适。
2.3.3 不同提取时间对芝麻菜可溶性蛋白提取量的影响
由图5可知,提取时间对芝麻菜可溶性蛋白提取量的影响与NaCl浓度和料液比对可溶性蛋白提取量的影响一致,即随着提取时间的增加提取量先升高后降低,提取时间30 min时提取量最高,显著高于其他各时间处理,芝麻菜可溶性蛋白提取量为13.20 mg/ g,随后再延长提取时间,提取出的可溶性蛋白反而减小,尤其当提取时间延长到75 min时提取量迅速降低,可溶性蛋白为11.40 mg/g,可溶性蛋白提取量迅速降低的原因可能是放置的时间过长,有些蛋白质可能发生了变质现象,且考虑到提取时间的延长会影响试验的操作,因此试验提取时间选择为30 min左右较为合适。
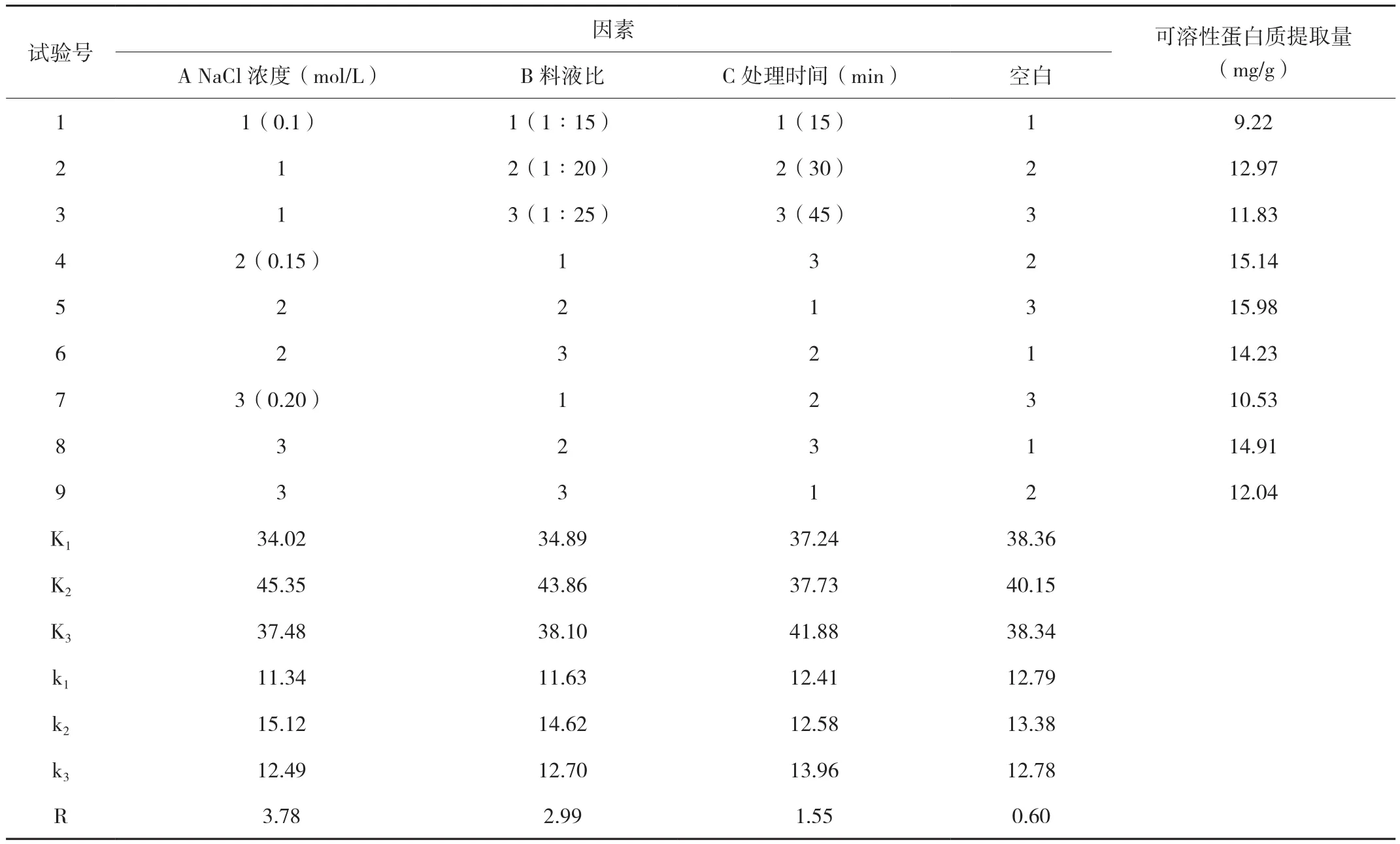
表1 正交试验结果

表2 方差分析
2.4 芝麻菜可溶性蛋白提取条件的正交试验
根据芝麻菜可溶性蛋白提取的单因素实验的结果,选取NaCl浓度、料液比及提取时间进行3因素3水平正交试验。
由表1可知,芝麻菜可溶性蛋白提取的最佳组合为A2B2C3,即最佳提取条件为NaCl溶液浓度为0.15 mol/L、料液比为1∶20、提取时间为45 min;由R值可知,三个单因素对芝麻菜可溶性蛋白提取的影响程度大小先后顺序为:A(NaCl溶液浓度)> B(料液比)>C(提取时间)。
通过方差分析,因为A(NaCl溶液浓度)和 B(料液比)的F值>均大于 F0.05(2,2)=19.00,是显著因子,对A(NaCl溶液浓度)和 B(料液比)的选择应选最好的水平A2和B2,即(NaCl溶液浓度为0.15 mol/L,料液比为1∶20,因为C因子提取时间不是显著因子,可以任选,从节约时间角度可选择C1(15 min);方差分析结果NaCl溶液浓度的F值大于料液比的F值,提取时间的F值最小,这与极差R分析结果一致。
称取芝麻菜样品3份,每份1.00 g,按优选工艺条件A2B2C1进行重复验证试验,测定结果分别为15.49 mg/g、15.22 mg/g、15.58 mg/g,平均提取量为15.43 mg/g,表明可溶性蛋白提取的工艺条件较好,说明此工艺稳定可行。
3 结论与讨论
在不同提取剂中,以NaCl盐溶液提取,芝麻菜可溶性蛋白提取量最高;芝麻菜中可溶性蛋白提取的最佳工艺条件为0.15 mol/L NaCl溶液、料液比为1∶20、提取时间为15 min,可溶性蛋白的平均提取率为15.43 mg/g,芝麻菜中蛋白质平均含量为2.48%[1],因此芝麻菜可溶性蛋白的提取率为62.22%;由R值和F值可知,3个单因素对芝麻菜可溶性蛋白提取的影响程度大小先后顺序为:NaCl溶液浓度>料液比>提取时间;实验结果表明该提取工艺简单、稳定、可行,为芝麻菜进一步开发利用提供了科学的理论基础。
[1] 寇凤仙,樊新华,齐巧丽.芝麻菜的开发利用及栽培技术.河北农业科技,2002,(8):14
[2] 杨银娟,王伟群,施颖红,等.珍稀蔬菜—芝麻菜的栽培技术及营养价值.上海蔬菜.2011,(3):76~77
[3] 林蒲田.保健新蔬—芝麻菜.湖南农业,2008,(3):14
[4] 蒋立科,罗曼.生物化学实验设计与实践.北京:高等教育出版社,2007.10
[5] 何幼鸾,汤文浩.物化学实验.武汉:华中师范大学出版社,2006.8
[6] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry,1976,72(1/2):248~254
[7] 邓丽莉,潘晓倩,生吉萍,等.考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化.食品科学,2012,33(24):185~189
[8] 李淼,檀根甲,李瑶,等.猕猴桃品种酚类物质及可溶性蛋白含量与抗溃疡病的关系.植物保护,2009,35(1):37~41
[9] 刘剑利,曹向宇,李其久.小米蛋白提取方法比较研究.食品工业,2009,(3):30~31
[10] BERÜUTER J. Carbohydrate metabolism in two apple genotypes that differ in malate accumulation. Journal of Plant Physiology,2004,161(9):1011~1029
[11] 吕巧枝,木泰华,孙艳丽.甘薯叶可溶性蛋白提取工艺研究.食品研究与开发,2007,28(03):18~21
[12] A.Ghazi,S.Metwali etal.Protein isolates from Egypeian sweet potato leaves.Die Nahrung,1982,33(2):145~151
[13] 李雪雁,张维,张秀兰,等.菊芋可溶性蛋白的提取及其分子质量的测定.食品与发酵工业,2010,136(13):184~186
[14] 王福荣.生物工程分析与检验.北京:中国轻工业出版社,2005,140~148.


