药桑叶多糖提取工艺优化及其降血糖活性研究
韩爱芝,王丽君,贾清华,王子坤,马玲,杨玲*
(1.塔里木大学分析测试中心,新疆阿拉尔843300;2.新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室,生命科学学院,塔里木大学,新疆阿拉尔843300)
药桑叶多糖提取工艺优化及其降血糖活性研究
韩爱芝1,2,王丽君1,贾清华1,王子坤1,马玲1,杨玲1,2*
(1.塔里木大学分析测试中心,新疆阿拉尔843300;2.新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室,生命科学学院,塔里木大学,新疆阿拉尔843300)
采用Box-Behnken试验设计对药桑叶多糖提取条件(液料比、提取温度、提取时间)进行优化,并用对硝基苯-α-D-吡喃葡萄糖苷(p-NPG)法对药桑叶多糖进行α-葡萄糖苷酶抑制活性测定。结果显示,药桑叶粗多糖提取最佳工艺为:在液料比25∶1(m L∶g),提取温度90℃、提取时间3 h条件下,药桑叶粗多糖提取率最高为(13.39±0.53)%。降血糖初步研究结果为:药桑叶粗多糖对α-葡萄糖苷酶有较好的抑制活性,其半抑制浓度(IC50)为0.96mg/m L。
药桑叶;Box-Behnken试验;多糖;降血糖活性
药桑叶为桑科(Moraceae)桑属(Morus Linn.)黑桑种的一种树叶,我国国家卫生部于1993年公布桑叶为药食两用品。2010年版的《中华人民共和国药典》中记载桑叶性甘、苦、寒,归肺经和肝经[1]。《本草纲目》中记载桑叶不仅可以清肝明目,而且能去除水肿与脚气;可代茶止渴;且煎煮饮用后,还有利于五脏六腑[2]。现代大量药理学研究证明,桑叶具有降低血糖、血压、血脂,抗氧化、保肝、抑制体内有害过氧化物生成与有害细菌繁殖等生理活性[3-6]。桑叶多种生理活性与其活性成分密切相关,根据文献报道,药桑叶含有丰富的多糖、生物碱、黄酮、多酚类和微量元素等活性成分[7-8]。
近年来,糖尿病患者急剧上升,抗糖尿病药物的研究成为当前新药研发的重点领域。众多医学研究发现,人体内存在诸多活性生物酶(如α-葡萄糖苷酶和醛糖还原酶等),血糖水平要通过这些酶进行调节。α-葡萄糖苷酶的活性就是由其抑制剂通过竞争性抑制而阻断双糖溶液水解成单糖溶液,从而延缓单糖的吸收,进一步达到治疗糖尿病的效果,所以抑制α-葡萄糖苷酶活性成为控制血糖水平的关键。因此提取制备抑制α-葡萄糖苷酶活性的物质具有十分重要的现实意义,李洁等[9]提取的雪菊多糖和季涛等[10]制备的桑叶多糖在体外显示出对α-葡萄糖苷酶的较好抑制作用。
目前,对药桑叶的研究多集中在生物碱[11]和黄酮类[12]的研究,对药桑叶多糖及其降血糖活性研究相对较少。本实验采用响应面法(response surfacemethodology,RSM)的Box-Behnken试验设计对药桑叶粗多糖的提取工艺进行优化,用对硝基苯-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,p-NPG)的方法测定药桑叶粗多糖对α-葡萄糖苷酶的抑制活性,从而初步评估药桑叶粗多糖的降血糖活性,结果可为选取药桑叶资源及其降血糖活性研究奠定理论与实验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
药桑叶于2016年7月采于新疆库车、和田,经塔里木大学植科院李志军教授鉴定为药桑(Morusnigra L.)叶。将采摘的药桑叶自然阴干后,粉碎过60目筛,备用。
1.1.2 试剂
葡萄糖标准品、对硝基苯-α-D-吡喃葡萄糖苷(p-NPG)、α-葡萄糖苷酶(酶活力107 U/m L):美国Sigma公司;浓硫酸、苯酚、无水乙醇(均为分析纯):天津市致远化学试剂有限公司;阿卡波糖片:拜耳医药保健有限公司。
1.2 仪器与设备
Varian cary 100型紫外-可见光分光光度计:美国瓦利安公司;AE240S型电子分析天平:德国梅特勒-托利多公司;TDL-5-A低速大容量离心机:上海安亭科学仪器厂;HH-S2系列恒温水浴锅:江苏金坛市环宇科学仪器厂;InfiniteM 200 PRO多功能酶标仪:瑞士帝肯(Tecan)公司。HPX-9272MBE恒温箱:上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1 多糖提取工艺流程
过60目筛的药桑叶粉→热水浸渍提取(温度90℃、提取时间3 h、液料比25∶1(g∶m L))→离心(5 000 r/m in,5min)取上清液定容→计算多糖提取率→浓缩提取液→体积分数为80%乙醇沉淀→离心(5 000 r/min、5m in)取沉淀→无水乙醇、丙酮、乙醚洗涤→冷冻干燥→药桑叶粗多糖。
1.3.2 多糖含量测定
多糖含量的测定采用硫酸-苯酚法[13]。于波长490 nm处测定吸光度值,以葡萄糖质量浓度(C)为横坐标,吸光度值(A)为纵坐标,得标准曲线方程A=0.0158C+0.0067(R2= 0.998),在范围0~50.4μg/m L内线性关系良好。
药桑叶多糖的测定:准确量取2m L药桑叶多糖提取溶液,按照标准曲线操作步骤测定吸光度值后计算多糖质量浓度,药桑叶粗多糖提取率按照下式计算:

式中:C为多糖质量浓度,μg/m L;V为样品溶液体积,m L;D为样品稀释倍数;m为样品总质量,g。
1.3.3 单因素试验
准确称取药桑叶粉末各5 g,浸提溶剂为蒸馏水,依次按照液料比(10∶1、15∶1、20∶1、25∶1、30∶1(m L∶g))、提取温度(60℃、70℃、80℃、90℃、100℃)、提取时间(1 h、2 h、3 h、4 h、5 h)、提取次数(1、2、3、4、5次)进行提取。每组3个平行试验,以药桑叶多糖提取率为评价指标,考察液料比、提取温度、提取时间和提取次数对药桑叶多糖提取率的影响。
1.3.4 响应面法对工艺进行优化
以单因素试验结果为基础,取影响比较显著的液料比(A)、提取温度(B)、提取时间(C)为自变量,以多糖提取率(Y)为响应值,根据DesignExpertV8.06软件的Box-Behnken中心组合试验设计优化试验工艺,所取因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiments
1.3.5 药桑叶粗多糖的α-糖苷酶抑制活性测定
多糖抑制α-葡萄糖苷酶活性的测定参照赵堂彦等的方法[14],略加改进,采用96微孔板筛选法,首先加入磷酸缓冲液(pH=6.8)80μL,加入16μL不同质量浓度的样液,再加入0.2 U/m L的α-葡萄糖苷酶溶液16μL,置于37℃恒温箱内恒温15min,然后再加入2.5mmol/L的p-NPG 16μL,在37℃恒温30min,分别加入1.0mol/LNa2CO3溶液100μL,在波长405 nm条件下采用酶标仪测定吸光度值A1,测定样品本底吸光度值A2,并用不加样品测定酶的活力吸光度值A0。用同种方法以阿卡波糖作为阳性对照,α-葡萄糖苷酶清除率计算公式如下:
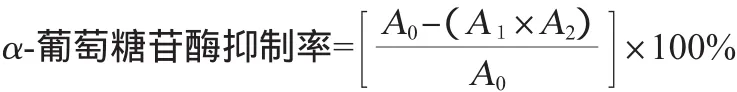
2 结果与分析
2.1 单因素试验
2.1.1 液料比对多糖提取率的影响

图1 液料比对多糖提取率的影响Fig.1 Effect of liquid-so lid ratio on polysaccharides extraction rate
由图1可知,随着液料比在10∶1~30∶1(m L∶g)范围内增大,药桑叶多糖提取率呈上升趋势,在液料比15∶1~25∶1(m L∶g)时多糖提取率迅速上升,从7.70%上升至12.29%。但是在25∶1~30∶1(m L∶g)范围内,多糖提取率上升缓慢,仅增加了0.85%。综合考虑,选取液料比为25∶1(m L∶g)。
2.1.2 提取温度对多糖提取率的影响
由图2可知,提取温度从60~90℃范围内药桑叶多糖提取率迅速上升,从7.33%上升至13.70%;当提取温度从90~100℃时,多糖提取率几乎不变,仅提高0.03%,因此确定90℃为最佳提取温度。

图2 提取温度对多糖提取率的影响Fig.2 Effect of extraction tem perature on polysaccharides extraction rate
2.1.3 提取时间对多糖提取率的影响
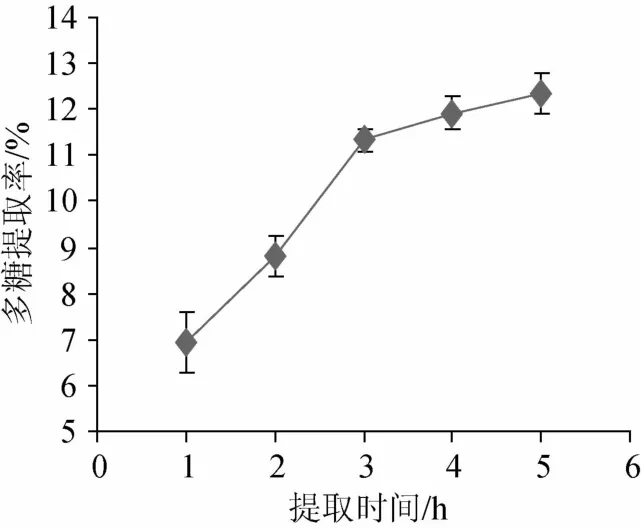
图3 提取时间对粗多糖提取率的影响Fig.3 Effect o f extraction time on polysaccharides extraction rate
由图3可知,提取时间为1 h时,多糖提取率较低,为6.93%;当提取时间在1~3 h时,多糖提取率大幅度的提高,增加了4.41%。提取时间从3~5 h时,多糖提取率上升缓慢,为了提高效率,综合考虑选最佳提取时间为3 h。
2.1.4 提取次数对多糖提取率的影响

图4 提取次数对粗多糖提取率的影响Fig.4 Effect of extraction tim es on polysaccharides extraction rate
由图4可知,提取次数从1次到2次,药桑叶多糖提取率迅速上升,多糖提取率增加了4.63%;随着提取次数的增加,多糖提取率上升缓慢,从2次到5次,只提高1.48%,综合成本及效率,确定2次为最佳提取次数。
2.2 响应面试验结果
2.2.1 响应面试验设计结果
在单因素试验基础上,以对提取率影响显著的液料比(A)、提取温度(B)、提取时间(C)为自变量,以多糖提取率(Y)为响应值进行评价,采用3因素3水平响应面分析试验,试验方案及结果见表2,通过Box-Behnken中心组合对试验数据进行二次响应面回归分析,得到的药桑叶多糖提取率与各自变量的模拟方程为:

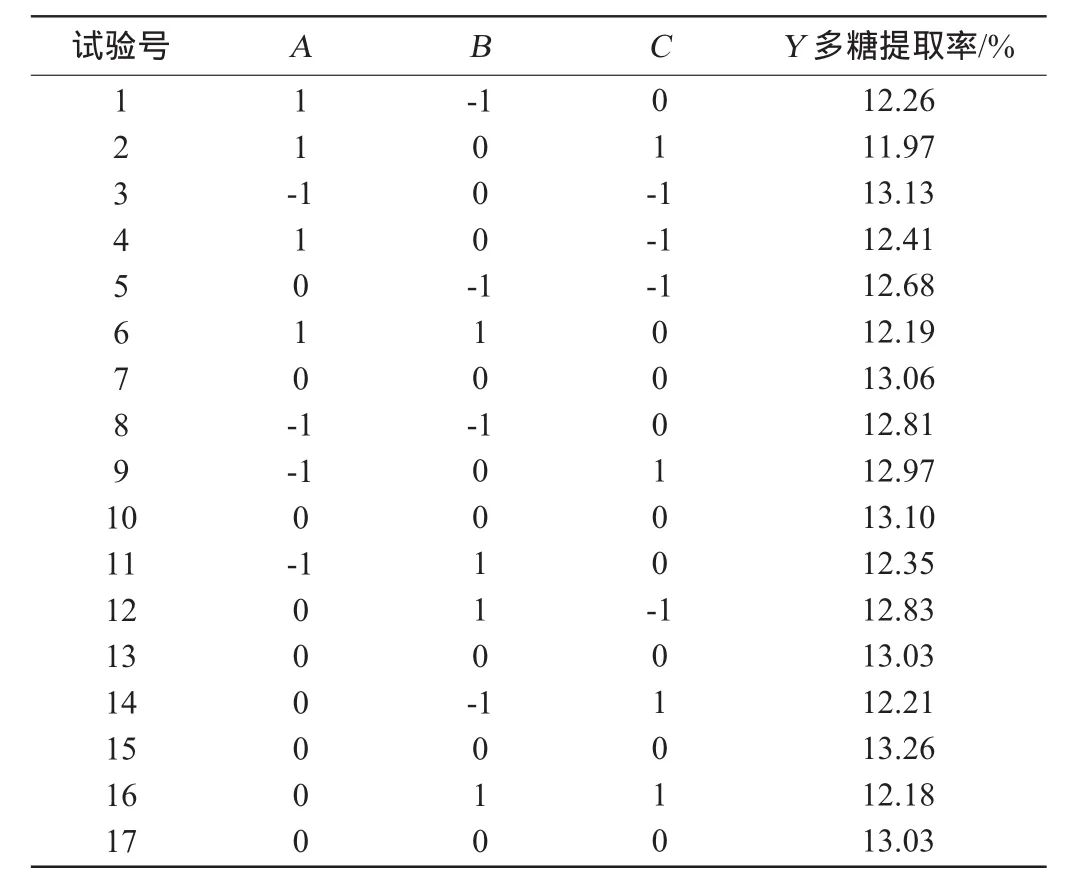
表2 响应面分析试验设计及结果Table 2 Design and results of response surface experiments
2.2.2 响应面试验方差分析
回归方程各因素方差分析结果见表3。

表3 二次响应面回归模型方差分析Table 3 Variance analysis of quadratic response surface regression mode l
由表3可知,该模型P<0.01,说明该二次方程模型为极显著,该模型具有统计数意义。决定系数R2=0.996 1,表明该回归模型拟合度较好,回归方程具有代表性,有99.61%响应值变化来自于所选的变量;由模型调整系数为R2adj= 0.9912,表明此模型的预测性较好,所得实验值与预测值较为接近。方程的失拟项P=0.501 7>0.05,为不显著,说明此方程对试验拟合程度好、误差小,可用该回归方程代替试验真实点对试验结果分析和预测[15],因此该方程模型适合药桑叶多糖提取工艺参数的优化。
表3结果显示,F值的大小可以判断各因素对多糖提取率影响的强弱。F值越大对提取率影响作用越强。对药桑叶多糖提取率的影响程度大小的各因素次序为:提取温度(B)>液料比(A)>提取时间(C)。其中一次项提取温度(B)对多糖提取率的影响为差异显著影响因素(P<0.05);交互项AB、AC、BC,二次项A2、B2、C2对多糖提取率的影响极显著(P<0.01)。2.2.3响应面模型充分性诊断
由图5可知,试验值和预测值结果较为一致,说明此药桑叶多糖提取回归模型拟合度较好。由残差分析结果可知,所得实验数据没有异常出现,均落在置信区间内。残差的正态概率分布图上所有的数据点基本都接近一条直线,且方差不具有偏差性。说明此试验响应值的残差概率分布符合正态分布。

图5 模型充分性的诊断Fig.5 Diagnostic plots for the mode ladequacy
2.2.4 响应面分析结果
将模型中的某一因素固定在零水平而获得另外两个因素的交互作用,其等高线图及响应曲面的形状可以反映交互效应的强弱,结果见图6。由图6可知,在试验范围内,药桑叶多糖提取率随液料比和提取温度的升高而逐渐增大,各因素间表现出显著的交互作用关系。随着温度的升高多糖分子内能逐渐增大,分子运动增强,从而使溶解性变大;但是温度过高会破坏多糖分子结构,可能使杂质溶入更多,以造成最后样品中多糖提取率偏低。所以应将温度应控制在一个适宜的范围内。在一定范围内,随着液料比增大,多糖提取率逐渐大,液料比达到一定值后,溶剂基本将多糖全部溶出,液料比再增加多糖提取率变化不大。从节约溶剂的角度考虑液料比应选择一个较合适的范围。随着提取时间的延长,有利于药桑叶多糖溶出而使提取率逐渐变大,但提取时间过长,反而影响生产效率,所以提取时间也要选择在一个较合适的范围。
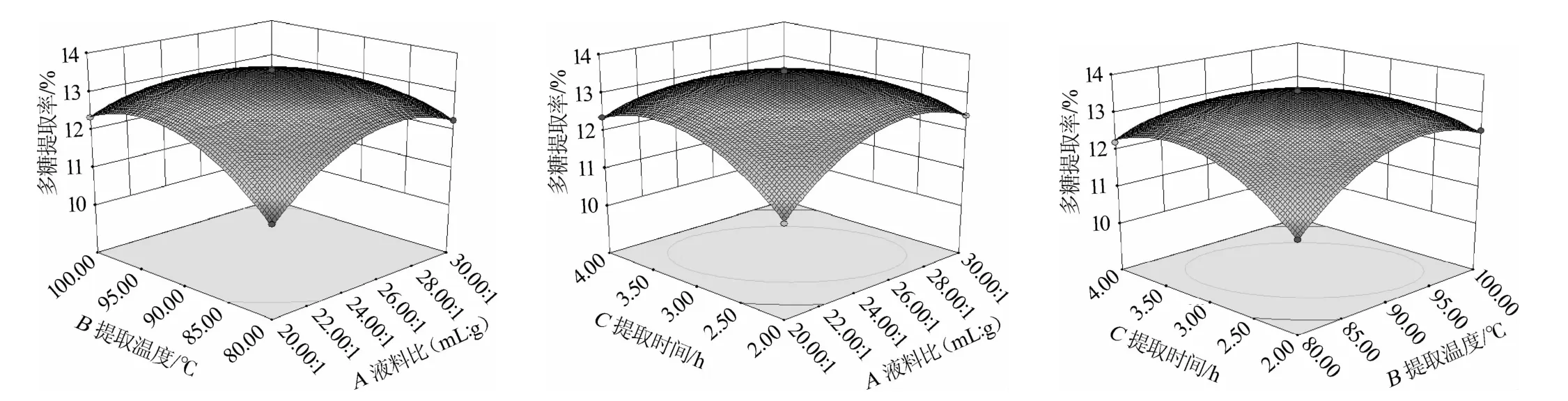
图6 液料比、提取温度及提取时间交互作用对多糖提取率影响的响应面及等高线Fig.6 Response surface plots and contour line of e ffects o f interaction between liquid-solid ratio,extraction tem perature and extraction tim e on polysacchrides extraction rate
根据Box-Behnken中心组合试验设计对多糖提取工艺条件进行优化,在模型取值范围内选择起始点作为最低点,将高值选择一个极大值,采用模型快速上升法进行优化,得最优工艺条件为液料比25.06∶1(m L∶g)、提取温度90.55℃、提取时间2.98 h。在此条件下药桑叶多糖提取率理论值为13.54%。为了验证真实值与优化结果的一致性,将上述优化结果进行验证试验,为便利试验操作,将优化结果修正为液料比25∶1(m L∶g)、提取温度90℃、提取时间3 h。在此条件下做5组验证试验,结果药桑叶多糖提取率实际平均值为(13.39±0.53)%,与预测值接近,且重复性好,说明优化结果可靠。
2.3 α-糖苷酶抑制活性的测定
经硫酸-苯酚法测定,醇沉后药桑叶多糖含量为48.85%(后文中的药桑叶多糖均指醇沉后用无水乙醇、丙酮、乙醚洗涤后的药桑叶多糖)。将药桑叶多糖用于α-葡萄糖苷酶活性的检测,以阿卡波糖为阳性对照,结果如图7所示。由图7可知,随着药桑叶多糖质量浓度的增加,抑制率也在增加,在药桑叶多糖质量浓度范围0.25~2.00mg/m L内对α-葡萄糖苷酶的抑制活力表现出强烈的质量浓度依赖性,其质量浓度与抑制率呈一定的线性相关,其回归方程为y=30.572x+ 13.546(R2=0.938 3),得其相应半抑制浓度(halfmaximal inhibitory concentration,IC50)值为0.96mg/m L,当多糖质量浓度>2.00mg/m L时进入平台期,抑制活力随抑制剂质量浓度增大变化不大。这表明药桑叶多糖具有抑制糖吸收的功能,这与赵骏等[16]的研究结果相一致。而药桑叶多糖降糖效果明显稍弱于阳性对照阿卡波糖,且与阿卡波糖呈现几乎平行的抑制曲线。总体上药桑叶多糖具有较好的α-葡萄糖苷酶抑制活性。

图7 α-葡萄糖苷酶抑制率随多糖质量浓度变化的关系Fig.7 Relationship ofα-glycosidase inhibitory activity and po lysacchrides concentration
3 结论
采用Box-Behnken中心组合试验设计进行药桑叶多糖提取工艺优化方法可靠。优化的工艺参数结果为:液料比25∶1(m L∶g)、提取温度90℃、提取时间3 h。此条件下的药桑叶多糖提取率为(13.39±0.53)%,验证试验结果表明优化工艺条件可靠。
醇沉洗涤后的药桑叶多糖含量升至48.85%。以此药桑叶多糖进行α-葡萄糖苷酶抑制剂活性检测,结果表明,在药桑叶多糖质量浓度为0.25~2.00mg/m L范围内,其半抑制浓度(IC50)为0.96mg/m L,说明药桑叶粗多糖有较好的α-葡萄糖苷酶抑制活性,为开发利用药桑叶提供了一定的理论依据。
[1]中华人民共和国国家药典委员会.中华人民共和国药典一部[M].北京:中国医药科技出版社,2010:279-280.
[2]李时珍.本草纲目[M].北京:人民卫生出版社,1976:174.
[3]ELMAWLA A M A A,KHALED M M,ASHRAFM M,etal.Induction of biologically active flavonoids in cell cultures of Morus nigra and testing theirhypoglycem ic efficacy[J].Sci Pharm,2011,79(4):951-961.
[4]HEND M T.Hepatoprotective effect ofmulberry(Morus nigra)leaves extractagainstmethotrexate induced hepatotoxicity inmalealbino rat[J]. BMC Complem ent Altern M ed,2015,15(1):252-253.
[5]MUHAMMAD IQ,MUHAMMAD A,ZUBAIR I.Anticancer activity of Morusnigra leavesextract[J].Bangladesh JPharmacol,2014,9(4):496-497.
[6]KUMARSA,SHARMARK,SHARMA V,etal.Isolation,morphological identification and in vitro antibacterial activity of endophytic bacteria isolated from Morusnigra(Mulberry)leaves[J].J Anim Res,2017,7(1): 155-164.
[7]阴新负,彭效明,李翠清,等.桑叶生物碱和多糖的分离纯化研究进展[J].中医药导报,2016,22(14):108-110,113.
[8]王贺,韩爱芝,贾清华,等.新疆药桑和黑桑营养成分及活性成分分析[J].食品科学,2016,37(8):91-96.
[9]李洁,曾红,吕喜凤,等.昆仑雪菊多糖抗氧化及对α-淀粉酶和α-葡萄糖苷酶的抑制[J].中国酿造,2014,33(9):124-128.
[10]季涛,宿树兰,郭盛,等.基于α-葡萄糖苷酶抑制活性评价桑叶多组分药效相互作用研究[J].中国中药杂志,2016,41(11):1999-2006.
[11]孙莲,朱卫敏,何悦,等.新疆药桑叶中1-脱氧野尻霉素定性及定量分析[J].中国现代中药,2016,18(10):1291-1295.
[12]TALLINIA LR,GRAZIELEPR P,BORDIGNONB SA L,etal.Analysisof flavonoidsin Rubuserythrocladus and M orusnigra leavesextracts by liquid chromatography and capillary electrophoresis[J].Rev Bras Farm acogn,2015,25(3):219-227.
[13]吴龙月,陈瑶,向福,等.杏鲍菇多糖的酶法提取及其保湿和抗氧化活性评价[J].中国酿造,2017,36(5):161-165.
[14]赵堂彦,孟茜,王琴,等.鹰嘴豆水提物对α-葡萄糖苷酶的抑制作用研究[J].食品研究与开发,2016,37(5):4-7.
[15]SHANNON E,ABUGHANNAM N.Optimisation of fucoxanthin extraction from Irish seaweedsby responsesurfacemethodology[J].JAppl Phycol,2017,29(2):1027-1036.
[16]赵骏,方玲,于坤路,等.桑叶多糖不同分子量段降血糖作用研究[J].中药材,2010,33(1):108-110.
Optim ization of polysaccharidesextraction technology from Morusnigra leavesand itshypoglycem ic activity
HAN Aizhi1,2,WANG Lijun1,JIA Qinghua1,WANG Zikun1,MA Ling1,YANG Ling1,2*
(1.Analytic Center,Tarim University,Alar843300,China;2.Key Laboratory ofProtection&Utilization ofBiologicalResources in Tarim Basin ofXinjiang Production and Construction Corps,College ofLife Sciences,Tarim University,A lar843300,China)
Extraction parameters of polysaccharides from Morus nigra leaves,such as liquid-solid ratio,extraction temperature and time,was optimized with Box-Behnken experiments.The inhibition rate of polysaccharides from M.nigra leaves againstα-glycosidasewasmeasured by p-NPG method.The resultsshowed thatthepolysaccharidesextraction rateof M.nigra leaveswas thehighestof(13.39±0.53)%under theoptimized conditions of extraction temperature 90℃,time 3 h and liquid-solid ratio 25∶1(m l∶g).The preliminary resultsof hypoglycem ic activity showed that the crude polysaccharides from M.nigra leaves had good hypoglycemic inhibition activity againstα-glycosidase,and halfmaximal inhibitory concentration (IC50)was0.96mg/m l.
Morusnigra leaves;Box-Behnken experiment;polysaccharides;hypoglycemic activity
Q946.3
0254-5071(2017)08-0139-05
10.11882/j.issn.0254-5071.2017.08.030
2017-06-12
国家自然科学基金(N0.31460080);塔里木大学校长基金(TDZKQN201513)
韩爱芝(1973-),女,实验师,硕士,研究方向为天然产物分子结构及功能。
*通讯作者:杨玲(1965-),女,教授,硕士,研究方向为天然产物分子结构及功能。

