红油豆瓣酱中产气芽孢杆菌的分离、鉴定与抑制研究
李靖,马嫄*,徐丹,蒋珍菊,车振明,高飞
(1.西华大学粮油加工与食品安全重点实验室,四川成都610039;2.雀巢(中国)有限公司成都分公司,四川成都610041)
红油豆瓣酱中产气芽孢杆菌的分离、鉴定与抑制研究
李靖1,马嫄1*,徐丹2,蒋珍菊1,车振明1,高飞1
(1.西华大学粮油加工与食品安全重点实验室,四川成都610039;2.雀巢(中国)有限公司成都分公司,四川成都610041)
在储藏过程中,红油豆瓣酱中的微生物会利用剩余营养物质二次发酵产生气体导致胀罐,影响产品品质。该实验对产气胀罐的红油豆瓣酱中微生物进行分离、鉴定,共分离得到两株产气菌分别为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、地衣芽孢杆菌(Bacillus licheniform is);而后利用复配防腐剂对产气菌株PX012进行抑制,并通过正交试验确定最佳的防腐剂复配配方为Nisin 0.2‰,尼泊金复合酯0.2‰,双乙酸钠0.6‰,富马酸3.0‰,可有效抑制产气微生物的生长,保证产品质量。
红油豆瓣酱;产气芽孢杆菌;鉴定;复配防腐剂
郫县豆瓣因其风味独特、酯香浓郁、色泽油润而成为“川菜之魂”。其大致加工工艺为:鲜椒选取→辣椒醅→椒醅配料→拌入甜瓣子→制曲→保温发酵→混合发酵→翻晒→成熟豆瓣→成品检验[1]。作为郫县豆瓣酱生产过程中最为关键的步骤,发酵的质量直接决定产品质量。从制曲到发酵,不同阶段有着不同的功能菌参与,其种类与数量都有着较大的差异。豆瓣酱的发酵过程可分为发酵前期、发酵期和发酵后期[2]。发酵前期为制曲阶段,在此阶段霉菌占据着绝对的优势,通过曲霉分泌的各种酶类,如蛋白酶、肽酶、淀粉酶、植物分解酶等将豆瓣中的蛋白质、多糖等分解、转化为多肽、氨基酸、葡萄糖等物质以供后续微生物的生产发酵,植物组织分解酶则主要将瓣子中的纤维类转化分解为糖类,同时还有利于被纤维包裹的蛋白质的释放、分解[3];发酵期由于加入了大量的盐,不适合霉菌和酵母菌的生长,主要是巨大芽孢杆菌(Bacillusmegaterium)、植物乳杆菌(Lactobacillus plantarum)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)等菌株在作用[4],解淀粉芽孢杆菌(B.amyloliquefaciens)作为发酵期的优势菌种之一,其具有很强的分解淀粉以及利用蛋白合成有机酸和双乙酰的能力,在豆瓣的发酵过程中,将体系中的淀粉快速分解,促进豆瓣酱的快速发酵,同时产生香气物质,如有机酸、二乙酰等物质[5];发酵后期主要是芽孢杆菌属、乳杆菌、酵母菌等微生物[6],在甜瓣子和辣椒醅混合后即进入后发酵(混合发酵)阶段。
郫县豆瓣后发酵的时间从几个月到1~2年不等,不同类型的产品其后发酵时间存在较大的差异。后发酵时间长,微生物产生的酶可充分降解豆瓣酱中的淀粉、蛋白等物质[7]。而红油豆瓣酱后发酵时间较短,一般为30~60 d,是在辣椒醅和瓣子调配完成后,等到其中无明显气泡产生就进行防腐剂的添加、成品检验和灌装等工艺。由于后发酵时间短,豆瓣酱中存在的芽孢杆菌等会利用体系中未降解完全的氨基酸、糖等物质进行二次发酵产生气体,严重影响产品的品质。董丹等[2]对两个不同发酵时期的豆瓣酱中微生物研究发现其中微生物的种类和数量都有着很大的差异,发酵中期主要以Bacillus、W ickerhamomyces、Candida为优势菌株,分别占到分离菌株的54%、14%、11%;发酵后期则以芽孢杆菌属、海洋芽孢杆菌、嗜盐单孢菌为优势菌,分别占总分离菌株的55%、16%和14%。
作为一种短期发酵豆瓣酱,红油豆瓣酱的产气胀罐经常发生,尤其在夏季产气现象加剧,不仅严重影响产品品质,也给企业造成大量损失。现今关于红油豆瓣酱产气问题的研究鲜有报道,因此本研究以出现胀罐问题的红油豆瓣酱为原料,通过分离、纯化、分子生物学鉴定,确定产气微生物的种类,而后根据豆瓣酱贮藏内环境以及产气微生物的种类初筛防腐剂,通过单因素抑菌试验,选择出抑菌效果较好的防腐剂,再通过正交试验设计优化复配防腐剂的配方,通过复合防腐剂对红油豆瓣酱中产气微生物的有效抑制,从而解决其在储藏过程中的产气胀罐问题。
1 材料与方法
1.1 材料与试剂
出现产气胀罐的红油豆瓣酱:由四川省郫县豆瓣股份有限公司提供。
平板计数琼脂(plate countagar,PCA)培养基、MRS培养基、孟加拉红培养基、大豆酪蛋白琼脂(soybean-casein digestagar,TSA)培养基、酵母浸出粉胨葡萄糖(yeastextract peptone dextrose,YPD)培养基、酵母麦芽(yeastmalt,YM)培养基、葡萄糖发酵培养基:北京路桥技术股份有限公司。
DNA提取试剂盒:Biotech生物科技有限公司;核糖核酸酶(ribonuclease,R-Nase):美国Sigma公司;细菌所用引物为通用引物Eu27f(5'-AGAGTTTGATCCTGGCTCAG-3'),1490R(5'-GGTTACCTTGTTACGACTT-3')、Taq酶:天根生化科技(北京)有限公司;Nisin:浙江银象生物技术工程有限公司;尼泊金复合酯、富马酸、山梨酸钾、脱氢乙酸钠、双乙酸钠(均为分析纯):成都市科龙化工公司。
1.2 仪器与设备
5422型台式离心机、AG22331型聚合酶链反应(polymerase chain reaction,PCR)仪:Eppendorf(中国)有限公司;T2A凝胶成像系统:美国Bio-Rad公司;DYY-8C型电泳仪:北京六一仪器厂;G154DWS型立式高压蒸汽灭菌锅:致微(厦门)仪器有限公司。
1.3 实验方法
1.3.1 菌株分离
按照1.1中所述配制培养基,121℃灭菌25m in。用无菌生理盐水对产气胀罐红油豆瓣酱样品进行10倍系列梯度稀释,分别吸取稀释液0.1m L于各培养基上,细菌培养基于37℃培养1~2 d,真菌培养基于27℃培养2~7 d。
1.3.2 菌株纯化
根据1.3.1中平板培养菌落的形态、大小、颜色、透明度等指标对菌落进行分类编号,分别用划线法接种到对应的分离培养基上,进行纯培养。
1.3.3 产气验证试验
运用葡萄糖发酵培养基对纯化菌株进行产气验证试验,初步确定产气微生物的数量。将刚出厂的红油豆瓣酱进行121℃灭菌25m in,而后将初步确定的产气微生物菌液接种于其中进行培养观察,对产气微生物进行再次验证,确定产气微生物。
1.3.4 PCR扩增及序列比对
利用无菌竹签挑取产气微生物单菌落于1.5m L的EP管中,参照Biotech试剂盒说明书,提取菌体DNA。
以提取到的菌体DNA为模板,通过引物Eu27f(5'-AGA GTTTGATCCTGGCTCAG-3'),1490R(5'-CGGTTACCTT GTTACGACTT-3')扩增对象菌序列,PCR扩增条件:95℃变性5m in;循环:95℃变性1m in,50℃退火1m in,72℃延伸2m in,35个循环;72℃延伸10min[8-9]。所得PCR产物利用2.0%琼脂糖凝胶电泳在标准条件下进行检测,电泳时间30m in。并将扩增成功的PCR原液送至成都擎科梓熙生物技术有限公司进行测序。
将测序结果输入美国国家生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库进行基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)序列分析,确定产气微生物种属。
1.3.5 杯碟法抑菌实验
(1)防腐剂的筛选[10]
将供试防腐剂配成含量为0.5%的溶液,采用杯碟法进行抑菌实验。供试菌的菌悬液浓度为107~108CFU/m L。在37℃培养24 h后测量抑菌圈的直径。根据每种防腐剂的抑菌圈直径及抑菌稳定性,确定抑菌效果较好的几种防腐剂。
(2)最低抑菌浓度的测定
将筛选出的防腐剂分别配制成系列浓度梯度,测定其针对产气微生物的最低抑菌浓度(m inimal inhibitory concentration,M IC)值,操作方法参考1.3.5。根据M IC值,选择产气微生物中M IC值较大的菌株进行后续的防腐剂正交复配试验。
(3)正交试验优化防腐剂配方
根据防腐剂M IC值及国标GB 2760—2014《食品添加剂使用标准》中的防腐剂使用限量制定正交试验的因素与水平,见表1。

表1 防腐剂配方优化正交试验因素与水平Tab le 1 Factors and levels of orthogonalexperiments for preservative form ula optim ization
1.3.6 抑菌验证试验
将复合防腐剂按照0.1‰浓度,选取PX012号菌进行抑菌实验,评估复合防腐剂抑菌效果。同时分别将工厂原配方防腐剂和优化的复合防腐剂分别加入到刚出厂的红油豆瓣酱中,37℃培养,在10 d的观察期内,记录两种样品的产气情况。
1.3.7 数据处理
试验数据结果运用SPSS 17.0进行数据处理。
2 结果与分析
2.1 菌株分离纯化
2.1.1 分离纯化
通过分离纯化结合菌落颜色、形态、大小、边缘形状等,从产气红油豆瓣样品中筛选出26株微生物,分别编号为PX001~PX026。
2.1.2 产气验证试验
通过葡萄糖发酵培养基利用杜氏发酵管进行产气验证试验,发现共有两株菌表现出产气性能,分别为菌株PX012和PX019。
2.2 菌株的微生物多样性分析
通过对PCR产物进行凝胶电泳验证、碱基对序列测定,电泳图谱见图1。而后将序列输入NCBI基因库中进行Blast比对,确定两株产气微生物的种属,结果见表2。
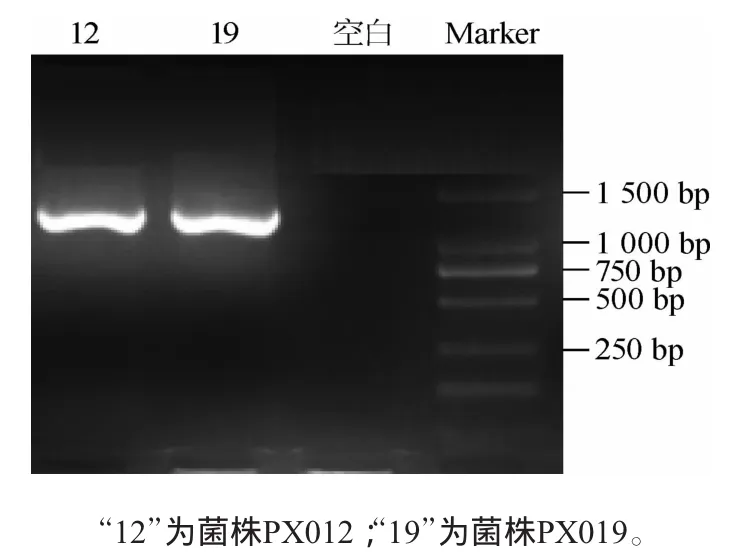
图1 两株菌PCR扩增产物的琼脂糖凝胶电泳图Fig.1 Agarose ge lelectrophoresis o f PCR am plification product of two strains

表2 分离菌株微生物多样性分析Tab le 2 Microbialdiversity analysis o f isolated strains
由表2可知,通过对菌株进行序列比对后,确定菌株PX012为解淀粉芽孢杆菌(Bacillusamyloliquefaciens);菌株PX019为地衣芽孢杆菌(Bacillus licheniform is)。
从红油豆瓣酱中分离的微生物来看,大多为细菌、芽孢杆菌类。B.licheniformis为豆瓣酱发酵中的常见菌种,其主要功能是在发酵过程中协助真菌分解食品中的蛋白质和淀粉,为其他微生物的生长创造条件以及形成风味物质[11],B.amyloliquefaciens在豆瓣的发酵过程中,将体系中的淀粉快速分解,促进豆瓣酱的快速发酵,同时产生香气物质,如有机酸、二乙酰等物质。B.licheniformis、B.amyloliquefaciens大多是通过附着在原料的表面带入到体系中,在发酵阶段利用体系中的营养物质进行繁殖,在豆瓣酱的发酵过程中产香产酯,促进风味物质的形成,在后期储藏过程中,B.licheniform is和B.amyloliquefaciens利用红油豆瓣酱体系中的剩余糖、淀粉等进行二次发酵,产生气体。
2.3 防腐剂的筛选
分别利用6种防腐剂对两株产气微生物进行抑制实试验,通过单因素试验,确定对产气微生物抑制效果较好的防腐剂,试验结果见图2。

图2 单因素抑菌筛选试验结果Fig.2 Results of single factor antibacteria screening experiments
由图2可知,脱氢乙酸钠和山梨酸钾对两株菌的抑菌效果不佳。作为食品中最常用的防腐剂,山梨酸钾有着极广泛的应用,其对革兰氏阴性菌的抑菌效果强于革兰氏阳性菌[12]。红油豆瓣酱属于弱酸性环境,其中大多为芽孢杆菌,故山梨酸钾对其抑制效果不好,其抑菌圈直径从几乎无现象到9mm之间波动,抑菌效果不稳定[13]。脱氢乙酸钠对细菌有着较好的抑制作用,同时对酵母菌的抑制作用更佳,且受pH值的影响较小,不同菌种对其耐受性不同,因此对菌株PX019,其抑菌圈直径完全不明显,抑制作用很弱,而对菌株PX012的抑制作用大致为12mm左右,但抑菌效果均弱于尼泊金复合酯、Nisin、双乙酸钠和富马酸,但是强于山梨酸钾,这与黎婉园等[14]研究结果一致。Nisin作为一种生物型窄谱防腐剂,对革兰氏阳性菌(G+)的抑菌效果好于革兰氏阴性菌(G-)[15]。尼泊金酯类防腐剂作为一种广谱抑菌剂,对G+具有较好的抑菌效果,研究结果显示其对枯草芽孢杆菌、霉菌等都具有较好的抑菌效果。富马酸能够较好的抑制食品中的细菌,同时对温度、pH值等敏感性小[16]。实验数据也表明,尼泊金复合酯、Nisin、双乙酸钠、富马酸四种防腐剂对产气菌株的抑制效果较好,抑菌圈直径的大小较集中,分别集中在22mm、25mm、19mm、17mm左右,抑菌效果稳定,因此选择这四种防腐剂进行复配试验。
2.4 最低抑制浓度值测定
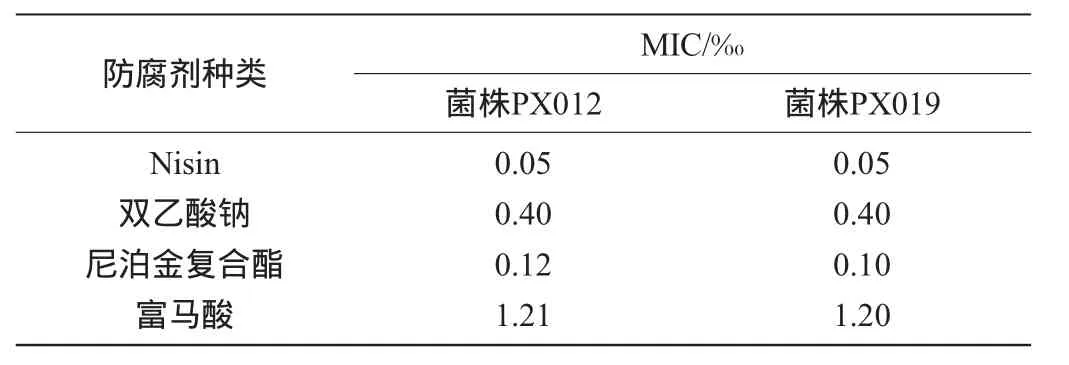
表3 各防腐剂的最低抑菌浓度Table 3 MIC value of different preservatives
由表3可知,Nisin的抑菌效果最好,而后依次为双乙酸钠、尼泊金复合酯和富马酸。Nisin对两株菌的M IC值较小,为0.05‰;而尼泊金复合酯和富马酸对菌株PX012的抑制效果稍弱于菌株PX019。综合四种防腐剂的M IC值,选择菌株PX012作为后续试验的对象菌进行4种防腐剂配方优化正交试验。
2.5 正交试验优化防腐剂配方
以菌株PX012抑菌圈直径为考察指标,对防腐剂Nisin、尼泊金复合酯、双乙酸钠和富马酸的添加量进行优化,正交试验结果与分析见表4,方差分析结果见表5。
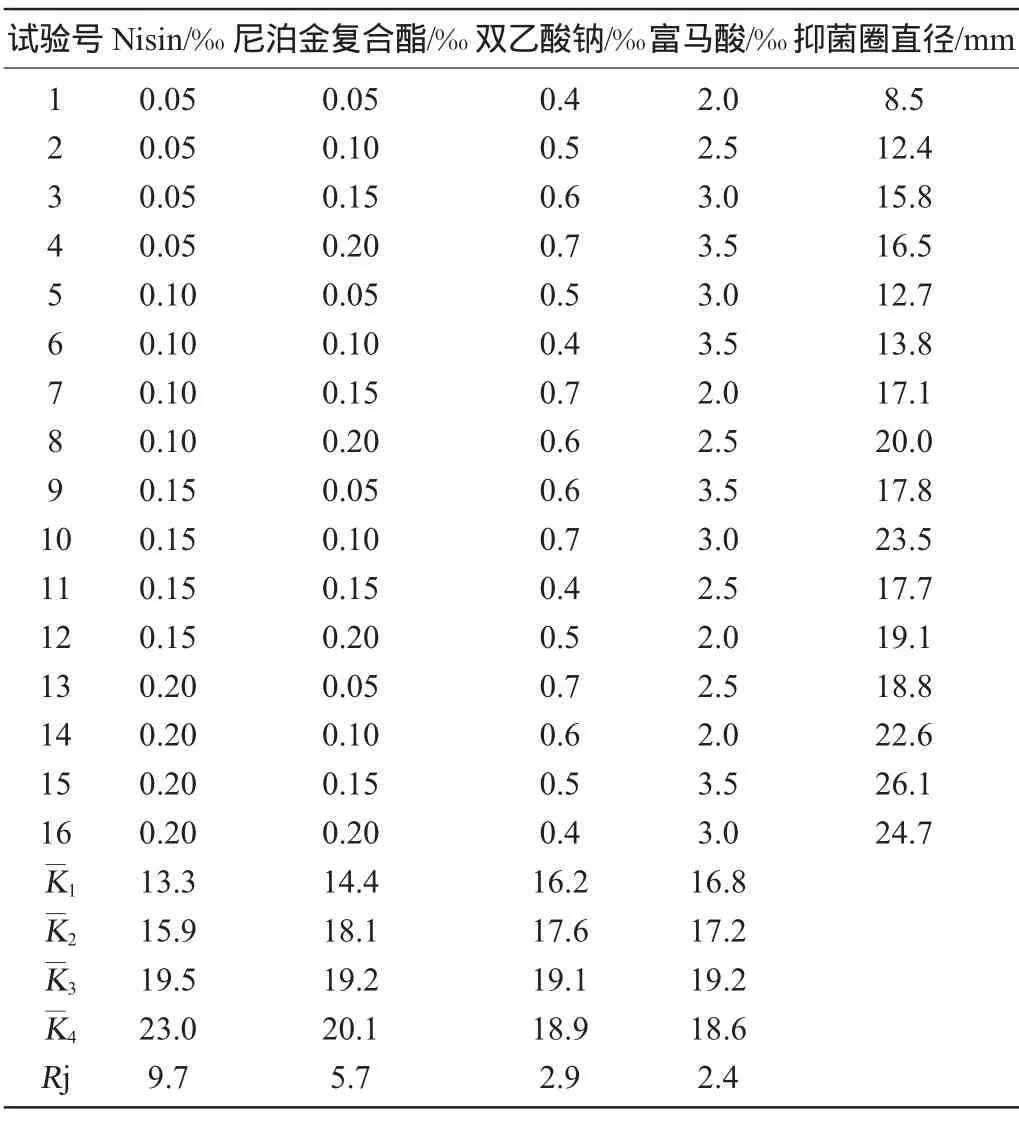
表4 防腐剂配方优化正交试验结果与分析Table 4 Results and analysis of orthogonalexperiments for preservative form ula optim ization
由表4可知,对抑菌效果的影响大小为Nisin>尼泊金复合酯>双乙酸钠>富马酸。最优防腐剂配方组合为A4B4C3D3,即Nisin 0.2‰,尼泊金复合酯0.2‰,双乙酸钠0.6‰,富马酸3.0‰。在此优化条件下,菌株PX012的抑菌圈直径为26.5mm。
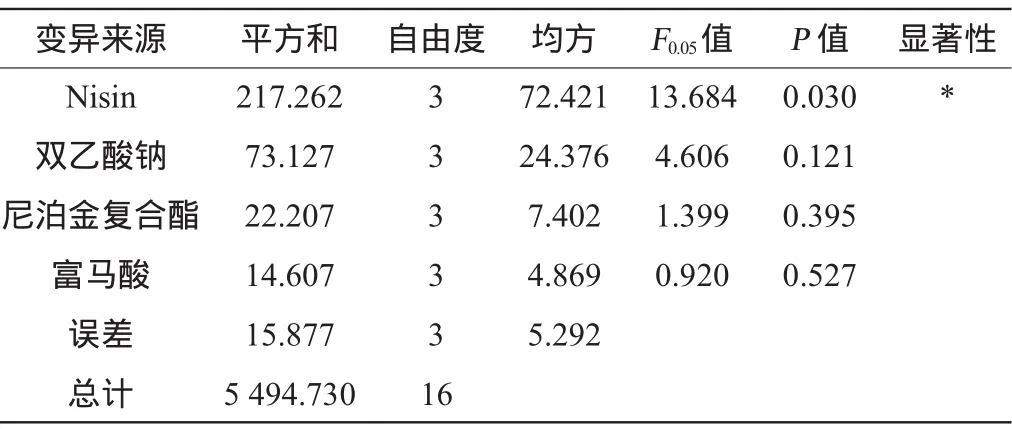
表5 正交试验结果方差分析Table 5 Variance analysis of orthogonalexperim ents results
由表5可知,Nisin添加量对结果的影响显著(P<0.05),双乙酸钠、尼泊金复合酯和富马酸添加量对结果的影响不显著(P>0.05)。
2.6 抑菌验证试验
将复合防腐剂按照0.1‰的比例加入到刚出厂的红油豆瓣酱中,另一组按照工厂原生产工艺添加防腐剂,37℃培养,在10 d的观察期内对所有样品的产气情况进行记录,实验结果见表6。

表6 出厂红油豆瓣添加不同配方防腐剂产气情况Table 6 Aerogenesis condition o f finalproduct of broad bean paste w ith chilioilwith different preservatives
由表6可知,前2 d,添加原配方和复合配方的豆瓣酱中均未出现产气现象,此时环境中的微生物对处于适应期,且受到防腐剂的抑制作用,生理生化反应减弱。从第4天开始,原配方中的微生物对环境的适应性增强,且由于防腐剂的抑制作用弱,微生物开始大量增殖,产气现象逐渐明显,而且随着储藏期的延长,从第6天开始产气现象不断加重,最后造成胀袋。而添加复合防腐剂的样品,在10 d观察期内,由于各种防腐剂的相互作用,对产气微生物始终表现出较好的抑制作用,使其增殖和生理生化作用受到抑制,未观察到产气现象。
3 结论
从产气红油豆瓣酱样品中筛选出26株微生物,通过葡萄糖发酵培养,确定其中两株菌为产气微生物,分别为PX012、PX019,分子生物学鉴定表明,菌株PX012为解淀粉芽孢杆菌(Bacillusamyloliquefaciens);菌株PX019为地衣芽孢杆菌(Bacillus licheniformis)。通过防腐剂正交优化试验,确定出对产气菌株PX012有抑制作用的最佳防腐剂配方为Nisin 0.2‰,尼泊金复合酯0.2‰,双乙酸钠0.6‰,富马酸3.0‰。将复配防腐剂加入刚出厂的红油豆瓣中,进行37℃恒温培养,在10 d的观察期内未出现产气现象。结果表明,该复配防腐剂可以有效地抑制红油豆瓣酱产品在储藏过程中产气。
[1]李幼筠.“郫县豆瓣”剖析[J].中国酿造,2008,27(11):19-23.
[2]董丹,关统伟,赵辉平,等.两个不同发酵时期豆瓣中微生物多样性的差异对比[J].中国酿造,2014,33(11):55-58.
[3]牛天娇,马莹.中国传统发酵豆制品中微生物的发掘与利用[J].中国酿造,2005,24(2):1-5.
[4]ZHAO JX,DAIX J,LIU X M,et al.Changes in microbial community during Chinese traditionalsoybean paste fermentation[J].Int J Food Sci Technol,2010,44(12):2526-2530.
[5]赵建新.传统豆酱发酵过程分析与控制发酵的研究[D].无锡:江南大学,2011.
[6]NAM Y D,LEESY,LIM S I.M icrobial community analysisof Korean soybean pastesby next-generation sequencing[J].Int J Food M icrobiol, 2012,155(1-2):36-42.
[7]李治华,黄弛,王自鹏.不同后熟发酵时间郫县豆瓣酱挥发性成分分析[J].食品科学,2014,35(16):180-184.
[8]李治华,黄弛,王自鹏,等.发酵豆瓣酱微生物宏基因组DNA提取研究[J].西南农业学报,2013,26(6):2663-2665.
[9]高秀芝,王小芬,刘慧,等.PCR-DGGE分析天源酱园豆酱发酵过程中微生物多样性[J].食品科学,2011,32(1):112-114.
[10]陈南南,徐歆,商丰才.不同防腐剂对3种模式腐败菌抑菌效果的比较[J].食品科学,2011,32(1):14-18.
[11]KIM TW,LEE JH,PARK M H,etal.Analysisof bacterial and fungal communities in Japanese and Chinese-fermented soybean pastes using nested PCR-DGGE[J].Current M icrobiol,2010,60(5):315-320.
[12]腾菲,郭桂萍,赵勇,等.革兰氏阳性菌和阴性菌对山梨酸钾的耐受性差异[J].食品与生物技术学报,2012,31(4):117-122.
[13]丁文慧,陆利霞,熊晓辉.提高山梨酸及钾盐防腐效果的研究进展[J].食品工业科技,2012,33(3):410-412.
[14]黎婉园,姚朔影,夏枫耿,等.脱氢醋酸钠及其抗菌性试验[J].中国食品添加剂,2004(2):41-44.
[15]吕淑霞,白泽朴,代义,等.乳酸链球菌素(Nisin)抑菌作用及其抑菌机理的研究[J].中国酿造,2008,27(9):87-91.
[16]闫澍.富马酸酯类防腐剂的合成与抑菌性能研究[D].大连:大连理工大学,2006.
Isolation,identification and inhibition ofaerogenic Bacillussp.from broad bean paste with chilioil
LIJing1,MA Yuan1*,XU Dan2,JIANG Zhenju1,CHEZhenm ing1,GAO Fei1
(1.Key Laboratory ofGrain Processing and Food Safety,Xihua University,Chengdu 610039,China; 2.Nestle(China)Co.,Ltd.,Chengdu Branch,Chengdu 610041,China)
Themicroorganism in broad bean paste w ith chili oil can conduct secondary fermentation by using residual nutrients,and cause serious bulging bag during storage,thus affect the product quality.Themicroorganism from the broad bean pastew ith chilioil in aerogenic packageswas isolated,purified,and identified.Results showed that two strains of Bacillus amyloliquefaciens,Bacillus licheniform is were isolated.Furthermore, strain PX012 was inhibited by compound preservative.Through orthogonal experiments,the optimal preservative formula was as follows:nisin 0.2‰,nipagin complex 0.2‰,sodium diacetate0.6‰,fumaric acid 3.0‰.Itcould effectively inhibit thegrow th ofaerogens,which assures thequality of the product.
broad bean pastew ith chilioil;aerogenic Bacillus sp.;identification;compound preservative
TS264.29
0254-5071(2017)08-0031-05
10.11882/j.issn.0254-5071.2017.08.007
2017-06-01
四川省“郫县豆瓣”研究所委托项目(12205508);四川省三创项目(10623086)
李靖(1992-),男,硕士研究生,研究方向为食品安全。
*通讯作者:马嫄(1978-),女,副教授,硕士,研究方向为食品生物技术。

