低值海藻浒苔乙醇发酵条件的研究
夏艳秋,朱强,李伟伟,尹凤鸣
(江苏省海洋生物技术重点实验室,江苏连云港222005)
低值海藻浒苔乙醇发酵条件的研究
夏艳秋,朱强,李伟伟,尹凤鸣
(江苏省海洋生物技术重点实验室,江苏连云港222005)
通过单因素试验及正交试验,采用硫酸水解法,以酸解液中还原糖产率为检测指标,考察适宜的浒苔酸解条件;之后采用浒苔酸解液直接发酵法,以发酵液中乙醇产率为检测指标,研究浒苔酸解液乙醇发酵条件。结果表明,优化的浒苔酸解条件为:浒苔悬液质量浓度40 g/L、硫酸体积分数4%、80℃酸解2 h。在此条件下,还原糖产率最高可达40.05%。优化的浒苔酸解液乙醇发酵条件为:酿酒高活性干酵母、接种量10%、初始pH6.0、30℃发酵48 h。在此条件下,乙醇产率最高可达16.46%。结果为浒苔生物质燃料乙醇生产提供一定的理论依据与试验数据。
浒苔;酸解液;乙醇;发酵
浒苔(Enteromorpha prolifera)为绿藻门、石莼科、大型绿藻。我国野生浒苔资源十分丰富[1-2],报道称,浒苔含70%以上碳水化合物,主要为多糖类和粗纤维,另外还含有13%粗蛋白、15%灰分和1%粗脂肪等,可作为食品、药品、饲料、肥料等开发原料,但与浒苔的生长速度及目前的存有量相比,依然缺乏大规模资源化利用的新途径[3-5]。自2008年至今,我国已连续9年频繁爆发浒苔“绿潮”灾害,大量浒苔的堆积,生物资源浪费且严重影响海洋生态环境及海水养殖业,积极探索合理有效处理浒苔的新途径已迫在眉睫[2,6]。在能源紧缺的当下,生物质燃料的生产理应成为浒苔资源化应用的一个重要突破口,必将掀起工业研究热潮[7]。目前,关于浒苔生物燃料的文献报道主要集中于浒苔生物燃油的制备[8-10]。然而,关于浒苔生物乙醇生产的研究相对较少[11-13]。本研究采用连云港海域缘管浒苔,旨在通过浒苔硫酸酸解液酵母菌直接发酵法生产燃料乙醇,探索一条浒苔乙醇发酵的产率高、简单可行、节能降耗的新工艺,拟为浒苔生物质燃料乙醇生产提供一定的理论依据与试验数据。
1 材料与方法
1.1 材料与试剂
浒苔:2015年3月底于连云港市附近海域采集,经过清洗、脱盐、晒干、粉碎过80目筛,于干燥箱中保存备用。
酿酒高活性干酵母、面包酵母、黄酒酵母、啤酒酵母:安琪酵母股份有限公司。
浓硫酸、重蒸苯酚、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、葡萄糖、重铬酸钾、氢氧化钠、无水碳酸钠(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
WF-20B型锤式万能粉碎机:南京申运佳机械有限科技有限公司;GZX-9140MBE型数显鼓风式干燥箱:上海博迅实业有限公司医疗设备厂;BZS-82型往复式恒温水浴振荡器:上海博珍仪器设备制造厂;HZQ-F160型卧式恒温振荡培养箱:黑龙江省哈尔滨市东联电子技术开发有限公司;UV-2550型紫外可见分光光度计:美国Varian公司;SW-CJ-1F型单人双面净化工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 浒苔酸解条件研究
基础条件为30 g/L浒苔悬液中硫酸体积分数为2%,70℃水浴振荡酸解2h,pH自然。在此基础上,分别调整浒苔悬液质量浓度梯度为10~60g/L,硫酸体积分数梯度1%~6%,酸解温度梯度为50~120℃,酸解时间梯度0~4h,酸解液过滤,滤液8000 r/min离心5m in,取上清液测定还原糖含量,以酸解液中还原糖产率为检测指标,分别研究适宜的浒苔悬液质量浓度、硫酸体积分数、酸解温度及酸解时间,并分析浒苔酸解过程中还原糖的消长规律。3次平行试验,取平均值。

1.3.2 浒苔酸解液乙醇发酵条件研究
采用1.3.1优化条件酸解浒苔,在250m L三角瓶中加入50m L上述浒苔酸解液作为发酵液,冷却至30℃接种活化的酵母菌(细胞浓度为4×107CFU/m L),以发酵液中乙醇产率为检测指标,研究浒苔酸解液乙醇发酵条件。3次平行试验,取平均值。
单因素试验:基础条件为浒苔酸解液初始pH5.5,接种量10%,酿酒高活性干酵母28℃发酵48h。在此基础上,分别采用酿酒高活性干酵母、啤酒酵母、黄酒酵母、面包酵母,调整浒苔酸解液初始pH梯度为5.0~7.0,接种量为5%~20%,发酵温度梯度为15~35℃,分别研究适宜的发酵菌种、初始pH、接种量、发酵温度区间。
正交试验:在单因素试验基础上,采用正交试验确定优化的浒苔酸解液乙醇发酵条件并验证。

1.3.3 检测方法
还原糖的测定采用3,5-二硝基水杨酸法;乙醇含量的测定采用重铬酸钾-DNS比色法[14]:在经典重铬酸钾氧化比色法测定乙醇含量的基础上,使用DNS氧化比色法测定发酵液中葡萄糖含量,修正乙醇含量的测定结果。
2 结果与分析
2.1 浒苔酸解条件研究
2.1.1 浒苔悬液质量浓度的确定
浒苔悬液质量浓度对还原糖产率的影响见图1。由图1可明显看出,随浒苔悬液质量浓度增加,酸解液中还原糖产率呈增加趋势,其中,10~40 g/L低质量浓度区增加幅度远大于40~60 g/L高质量浓度区。可见,采用硫酸水解浒苔适宜选择较低悬液浓度,以实现酸根离子与浒苔糖苷键的充分接触,亦可避免因葡萄糖浓度的增加而发生的葡萄糖复合反应及分解反应,从而减少副产物的生成,提高糖液质量。因此,试验确定最佳浒苔悬液质量浓度为40 g/L。

图1 浒苔悬液质量浓度对还原糖产率的影响Fig.1 Effects of E.prolifera concentration on reducing sugar yield
2.1.2 硫酸体积分数的确定
硫酸体积分数对浒苔还原糖产率的影响见图2。由图2可知,随硫酸体积分数增加,酸解液中还原糖产率呈先增加后下降趋势。其中,硫酸体积分数为4%时还原糖产率最高。由于H+对浒苔糖苷键的水解作用没有一定的秩序,水解过程中,同时有鼠李糖、葡萄糖和木糖等的生成[11]。因此,硫酸体积分数越高,水解速度越快,但同时副反应和副产物也随之增加,酸解液色泽也相应加深,必将影响后续乙醇发酵。因此,试验确定最佳硫酸体积分数为4%。
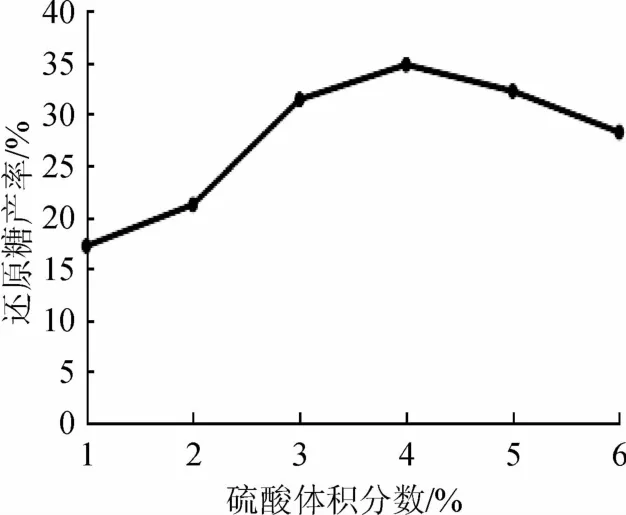
图2 硫酸体积分数对浒苔还原糖产率的影响Fig.2 Effects of sulfuric acid concentration on reducing sugar yield of E.prolifera
2.1.3 酸解温度的确定

图3 酸解温度对浒苔还原糖产率的影响Fig.3 Effects of acidolysis tem perature on reducing sugar yield of E.prolifera
酸解温度对浒苔还原糖产率的影响见图3。由图3可知,酸解温度100℃以内,随酸解温度升高,酸解液中还原糖产率呈先快速增加后缓慢增加趋势。事实上,硫酸体积分数一定时,浒苔水解速度与温度成正比,温度越高,水解速度越快,水解时间亦越短,但是超过80℃上升趋势不明显,故选择酸解温度为80℃。
2.1.4 酸解时间的确定
酸解时间对浒苔还原糖产率的影响见图4。由图4可知,浒苔长时间接触硫酸会导致已生成的还原糖减少,高温条件下尤其剧烈。因此,试验确定硫酸水解浒苔最佳温度和时间分别是80℃、2 h,与已报道的高温酸解相比[15],较低的温度既可以改善工业生产环境,又能降低热耗,还能提高还原糖产率。

图4 酸解时间对浒苔还原糖产率的影响Fig.4 Effect o f acidolysis time on reducing sugar yie ld o f E.prolifera
结合图1~图4,综合考虑还原糖产率、能量、设备等成本投入及操作的便利性、安全性和副产物的生成,试验确定适宜的浒苔酸解条件为:浒苔悬液质量浓度40 g/L、硫酸体积分数4%、80℃、2 h的高温短时硫酸水解法。在此条件下,还原糖产率最高可达40.05%。
2.2 浒苔酸解液乙醇发酵条件研究
2.2.1 单因素试验
菌种、初始pH、接种量以及发酵温度对浒苔水解液乙醇发酵的影响见图5。图5A表明,酿酒高活性干酵母最适宜浒苔酸解液乙醇发酵,其次是面包酵母,啤酒酵母和黄酒酵母则不适宜。
由图5B可知,乙醇产率随浒苔酸解液初始pH的升高呈先上升后下降的趋势,浒苔酸解液初始pH6.0时乙醇产率较高。酸根离子浓度过高,则不利于浒苔酸解液的乙醇发酵,这也同时印证了2.1.2试验结果。
由图5C可知,酵母接种量2%~10%时有利于乙醇积累。接种量过高,酵母耗糖主要用于生长繁殖产生单细胞,乙醇产率大大降低。接种量过低,迟滞期将延长,发酵缓慢,一部分酵母因环境不适而自溶,发酵液中残糖多、乙醇少,且发酵过程中由于酵母没有快速形成优势菌群易滋生杂菌,非乙醇发酵糖耗增加,导致乙醇产率降低,故选择酵母接种量为10%。
由图5D可知,发酵温度为25~30℃时,乙醇产率较高,与酿酒酵母的适宜生长温度接近,利于温度控制及生产管理,且发酵温度高,发酵速度快,发酵周期则短,亦可节约冷却成本,实现了发酵工业的低投高产目标。

图5 菌种(A)、初始pH(B)、接种量(C)、及发酵温度(D)对浒苔酸解液乙醇发酵的影响Fig.5 Effects o f strains(A),initialpH(B),inoculum(C)and fermentation tem perature(D)on ethanol fermentation of E.prolifera acid solution
2.2.2 正交试验
在单因素试验的基础上,以接种量、初始pH、发酵温度为评价因素,乙醇产率为评价指标,进行3因素3水平正交试验,结果与分析见表1,方差分析见表2。
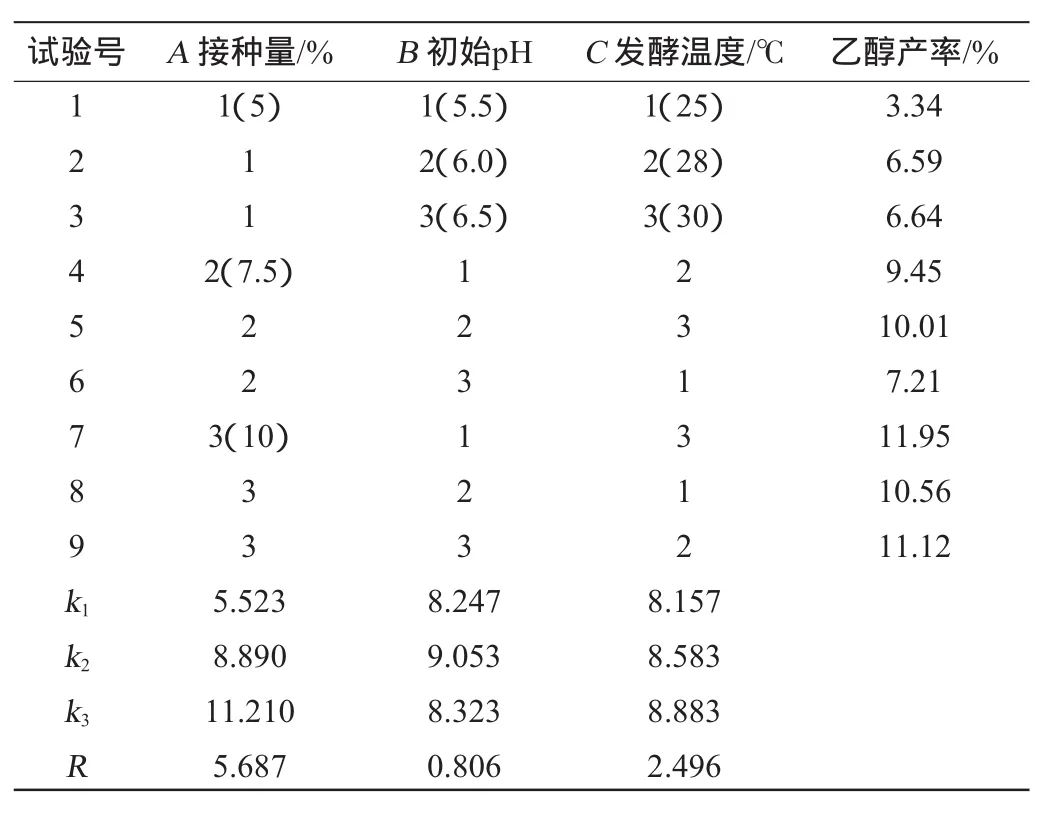
表1 浒苔酸解液乙醇发酵条件正交试验结果与分析Table 1 Results and analysis oforthogonalexperiments for E.pro lifera acid hydrolysis a lcohol ferm entation conditions optim ization

表2 正交试验结果方差分析Table 2 Variance ana lysis of orthogonalexperiments results
由表1直观分析和表2方差分析可以得出,影响浒苔酸解液乙醇发酵的因素次序为A>C>B,接种量影响显著,最优组合为A3B2C3,即最适发酵条件为接种量10%,初始pH为6.0,发酵温度30℃。由根据优化的最佳条件,进行3次验证试验,平均乙醇产率为16.46%,高于正交试验所有试验组。
2.3 讨论
试验表明,硫酸体积分数及酸解温度是决定还原糖产率的关键因素。酸解过程中还原糖的复合或分解必然影响产率,因此,分析水解糖的种类及总糖、还原糖和副产物在浒苔酸解过程的消长规律将有利于合理控制浒苔酸解过程,后续试验将对此进行深入研究。
试验发现,接种量是影响乙醇产率的显著因素。对酵母菌来讲,直接利用浒苔酸解液发酵产乙醇是一种新的挑战,从适应性生长繁殖过度到正常生产发酵既会消耗较多非生产时间,还可能因不适应而衰亡,这也是试验过程接种量较大的主要原因。因此,通过分离或育种的方式选育能快速利用浒苔酸解液高产乙醇的酵母菌是当务之急。另外,欲解决接种后酵母快速形成优势菌群的现象,生产过程中,可通过种母的同步培养获得,既能减少接种量,又能提高乙醇产率[16],从而有效抑制杂菌滋生,这些有待于进一步深入研究。
3 结论
试验研究并优化了浒苔硫酸水解条件及酸解液的乙醇发酵条件,即浒苔悬液质量浓度40 g/L、硫酸体积分数4%、80℃酸解2 h,酿酒高活性干酵母接种量10%、初始pH6.0、30℃发酵48 h。在此条件下,还原糖产率最高可达40.05%,乙醇产率最高可达16.46%,与现有文献报道相比,具有明显的优势,即酸解条件温和,还原糖产率及乙醇产率均较高。
[1]曾呈奎,张德瑞,张峻甫.中国经济海藻志[M].北京:科学出版社,1962:43-50.
[2]ZHAO J,JIANG P,LIU ZY,etal.Genetic variation of Ulva(Enteromorpha)prolifera(Ulvales,chlorophyta)-the causative species of the green tides in the Yellow Sea,China[J].J Appl Phycol,2011,23(2):227-233.
[3]林英庭,朱风华,徐坤,等.青岛海域浒苔营养成分分析与评价[J].饲料工业,2009,30(3):46-49.
[4]单俊伟,张俊杰,赵志强,等.微生物发酵法处理浒苔生产海藻肥的方法:中国,200910014718.5[P].2009-07-22.
[5]SHIM J,WEIX Y,XU J,et al.Carboxymethylated degraded polysaccharides from Enteromorpha prolifera:Preparation and in vitro antioxidantactivity[J].Food Chem,2017,215:76-83.
[6]唐启升,张晓雯,叶乃好,等.绿潮研究现状与问题[J].中国科学基金,2010(1):5-9.
[7]匡廷云,马克平,白克智.生物质能研发展望[J].中国科学基金,2005,(6):326-330.
[8]WARGACKIA J,LEONARD E,W IN M N,etal.An engineeredm icrobial platform for direct biofuel production from brown macroalgae[J]. Science,2012,335:308-313.
[9]YAGW CH,LIXG,LIU SH,etal.Directhydrothermal liquefaction of undriedmacroalgae Enteromorphaprolifera using acid catalysts[J].Energ ConversM anage,2014,87:938-945.
[10]ONG L H,HU M M,LIU D,etal.Thermal cracking of Enteromorpha prolifera with solvents to bio-oil[J].Energ ConversM anage,2014,77: 7-12.
[11]张维持,时旭,欧杰,等.酸法水解绿潮藻生物质及发酵制乙醇的效果[J].上海海洋大学学报,2011,20(1):131-136.
[12]费岚.浒苔生物质降解优化条件及发酵生产乙醇研究[D].上海:上海海洋大学,2014.
[13]刘政坤.低值海藻浒苔生物乙醇转化工艺的研究[D].青岛:中国海洋大学,2011.
[14]何川,章登政,张俊,等.重铬酸钾-DNS比色法测定发酵液中乙醇含量[J].生命科学研究,2013,17(1):1-4.
[15]冯大伟,姜鹏,李富超,等.鲜浒苔稀硫酸水解产糖工艺研究[J].海洋科学,2014,38(12):29-33.
[16]MANUKYAN A,ABRAHAM L,DUNGRAWALA H,et al.Synchronization of yeast[J].M eth M ol Biol,2011,761:173-200.
Ethanol fermentation conditionsbaseon low-value seaweed Enteromorphaprolifera
XIA Yanqiu,ZHU Qiang,LIWeiwei,YIN Fengm ing
(Jiangsu Key Laboratory ofMarine Biotechnology,Lianyungang 222005,China)
Through single factorand orthogonalexperiments,using reducing sugaryield ofacid hydrolysisasdetection index,theoptimal Enteromorpha prolifera hydrolysisconditionwasoptimized with sulfuric acid hydrolysismethod.Then using ethanolyield asevaluation index,theethanol fermentation conditionsof E.prolifera acid hydrolysiswas studied.Results showed that the optimalhydrolysis condition wasobtained as follows:E.prolifera suspension concentration 40 g/L,sulfuric acid concentration 4%,80℃acid hydrolysis for 2 h.Under the condition,the reducing sugar yield wasup to 40.05%.The optimal ethanol fermentation condition washigh activity dry yeast,inoculum 10%,initial pH 6.0,fermentation temperature 30℃, and time 48 h.Under these conditions,theethanolyield wasup to 16.46%.Theexperimental resultsprovided some theoreticalbasisand experimentaldata for the production ofbiomass fuelethanolw ith E.prolifera.
Enteromorphaprolifera;acid hydrolyzate;ethanol;fermentation
TS261.4
0254-5071(2017)08-0095-04
10.11882/j.issn.0254-5071.2017.08.021
2017-03-26
连云港市科技基金项目(社会发展SH1312);连云港市科技基金项目(农业支撑KK15007)
夏艳秋(1977-),女,讲师,硕士,主要从事发酵工程及应用微生物学研究工作。

