3-甲基腺嘌呤联合曲古霉素A抑制三阴性乳腺癌细胞生长*
朱 坤, 徐 明, 丁米娜, 林贞花, 陈丽艳,△
(延边大学医学院 1生物化学与分子生物学教研室, 2肿瘤研究中心, 吉林 延吉 133000)
3-甲基腺嘌呤联合曲古霉素A抑制三阴性乳腺癌细胞生长*
朱 坤1, 徐 明2, 丁米娜1, 林贞花2, 陈丽艳1,2△
(延边大学医学院1生物化学与分子生物学教研室,2肿瘤研究中心, 吉林 延吉 133000)
目的: 探讨自噬特异性抑制剂3-甲基腺嘌呤(3-MA)联合组蛋白去乙酰化酶抑制剂曲古霉素A(TSA)对三阴性乳腺癌细胞MDA-MB-231生长的影响及其可能的分子机制。方法: MTT法检测TSA对MDA-MB-231细胞活力的抑制作用;划痕实验检测细胞迁移能力的变化;Western blot检测细胞自噬相关蛋白的变化;MTT法检测3-MA联合TSA对细胞活力的影响。结果: TSA可有效抑制乳腺癌MDA-MB-231细胞的生长,并呈剂量和时间依赖性;TSA抑制MDA-MB-231细胞的迁移能力,并诱导细胞发生自噬;3-MA可有效抑制TSA诱导的乳腺癌细胞自噬,并进一步抑制细胞活力,差异有统计学意义。结论: 3-MA可明显增加TSA对三阴性乳腺癌细胞MDA-MB-231的生长抑制作用。
乳腺癌; 曲古霉素A; 3-甲基腺嘌呤; 自噬
三阴性乳腺癌约占乳腺癌的15%~20%,由于其缺乏临床特异性的治疗靶点,具有侵袭性强、易复发转移等特点,受到广泛的研究和关注[1-2]。自噬是细胞维持生存的重要机制之一,与肿瘤关系密切。研究表明,自噬在肿瘤发生发展中表现出双刃剑作用:一方面,自噬可提高肿瘤细胞对不利环境的耐受能力,从而维持其生存;另一方面,自噬也可成为某些肿瘤细胞的死亡途径[3]。有研究显示,抑制自噬可增加某些化疗药物的疗效。曲古霉素A(trichostatin A,TSA)属于广谱组蛋白去乙酰化酶抑制剂,是一种新型的抗肿瘤药物[4]。本实验旨在探讨自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)联合TSA对三阴性乳腺癌MDA-MB-231细胞生长的影响及其可能的分子机制,为临床治疗三阴性乳腺癌提供新的实验依据。
材 料 和 方 法
1 材料
人乳腺癌MDA-MB-231细胞系由延边大学肿瘤研究中心提供;TSA和3-MA购自Selleck;胎牛血清、DMEM培养基和青-链霉素等化学试剂为Gibco产品;MTT试剂及Western blot实验相关试剂为Sigma产品;LC3B和β-actin抗体等为Cell Signaling Technology产品。
2 方法
2.1 细胞培养 MDA-MB-231细胞置于含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基中,在37 ℃、5% CO2培养箱中常规培养,使用0.25%胰酶消化传代。
2.2 MTT法检测细胞活力变化 取对数生长期细胞,按每孔1×104接种于96孔板,37 ℃、5% CO2培养箱中常规培养,待细胞贴壁后加入不同浓度的TSA,每种浓度设6个平行复孔,对照组加入等体积的培养液。分别于24 h、48 h和72 h 后每孔加入50 μL的MTT(5 g/L),4 h后终止培养吸弃上清,每孔加入100 μL的二甲基亚砜(DMSO),用酶标仪在570 nm波长处测定各孔吸光度值,并按公式计算细胞生存率:细胞生存率(%)=实验组吸光值/对照组吸光值×100%。
2.3 划痕实验检测细胞迁移能力变化 将细胞接种于6孔板中培养,待细胞生长至90%,用 10 μL的枪头垂直划痕,PBS 洗3 次后加入无血清培养基,并给予相应浓度的TSA药物处理;置 37 ℃、5% CO2培养箱中培养,分别在划痕后 0 h、12 h和24 h 拍照,显微镜下测量划痕间隙的距离。
2.4 Western blot实验检测细胞自噬相关蛋白的变化 乳腺癌细胞经药物处理48 h后,加入RIPA裂解液提取总蛋白;Bradford法测定蛋白浓度;SDS聚丙烯酰胺凝胶电泳进行蛋白分离并转至PVDF膜上;5%脱脂奶粉室温下封闭1 h;加入 I 抗(LC3B)后4 ℃过夜;室温下洗膜,加入相应 II 抗孵育2 h;ECL 曝光,观察并拍照。
3 统计学处理
采用SPSS 17.0软件进行统计学分析。数据用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 TSA对MDA-MB-231细胞活力及迁移能力的影响
TSA处理MDA-MB-231细胞24 h、48 h和72 h后,乳腺癌细胞的活力明显受到抑制。随着给药剂量的增加,时间的延长,细胞吸收光密度值逐渐减小,细胞活力抑制率明显增加,与未加药对照组相比,差异具有统计学意义(P<0.05),见图1。倒置显微镜下可见,TSA给药后活细胞数量明显减少,细胞密度下降,细胞形态变小,固缩(图2)。划痕实验结果显示,应用不同浓度TSA处理MDA-MB-231细胞后,其划痕愈合距离较未处理组细胞明显缩短,且呈时间与浓度依赖性(P<0.05),见图3。

Figure 1.Effect of TSA on the vitality of MDA-MB-231 cells. Mean±SD.n=3
图1 TSA对乳腺癌MDA-MB-231细胞活力的影响

Figure 2.Effect of TSA on the growth of MDA-MB-231 cells (×40).
图2 TSA对乳腺癌MDA-MB-231细胞生长的影响
2 Western blot 检测TSA处理后自噬相关蛋白的表达
与未加药对照组细胞相比,TSA处理乳腺癌细胞后,给药组的自噬标志性蛋白LC3-I型转化为LC3-Ⅱ型明显增多,以200 nmol/L TSA的作用效果最为显著(P<0.05),见图4。
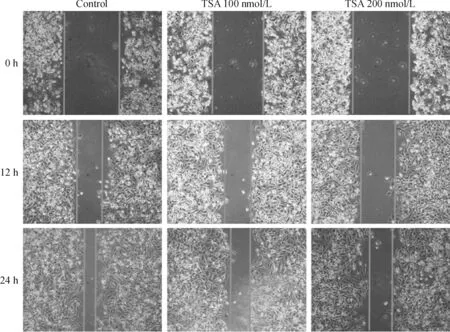
Figure 3.Effect of TSA on the migration ability of MDA-MB-231 cells (×40).
图3 TSA对乳腺癌MDA-MB-231细胞迁移能力的影响
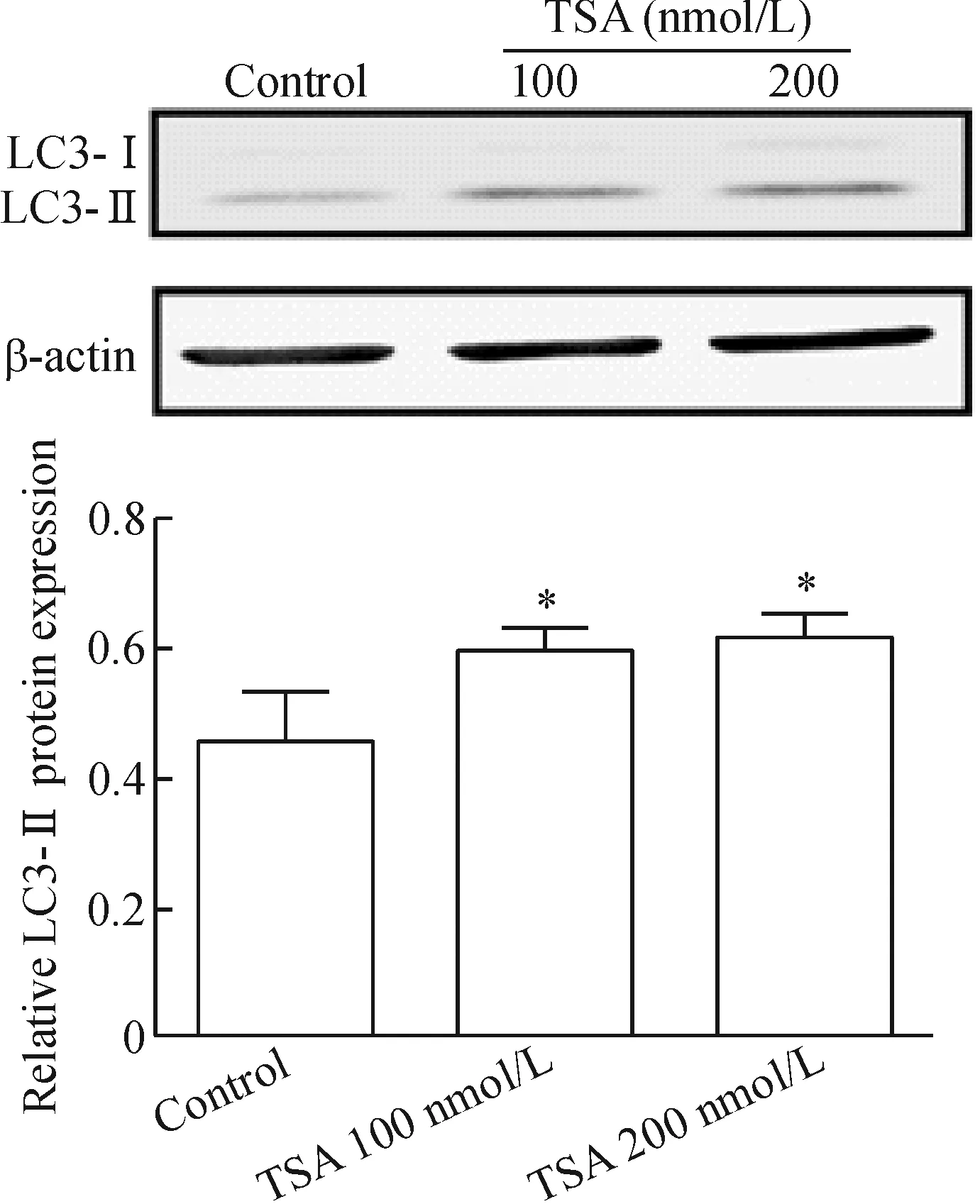
Figure 4.Expression of autophagy-related proteins in MDA-MB-231 cells induced by TSA. Mean±SD.n=3.*P<0.05vscontrol group.
图4 TSA诱导MDA-MB-231细胞自噬相关蛋白的表达
3 3-MA联合TSA对MDA-MB-231细胞增殖的影响
为进一步检测自噬抑制剂3-MA对TSA抑制MDA-MB-231细胞活力的影响,通过MTT法检测了3-MA与TSA联合处理MDA-MB-231细胞48 h后细胞活力的变化。结果表明,与TSA单独给药组比较,3-MA可进一步增加TSA对细胞活力的抑制作用(P<0.05),见图5。
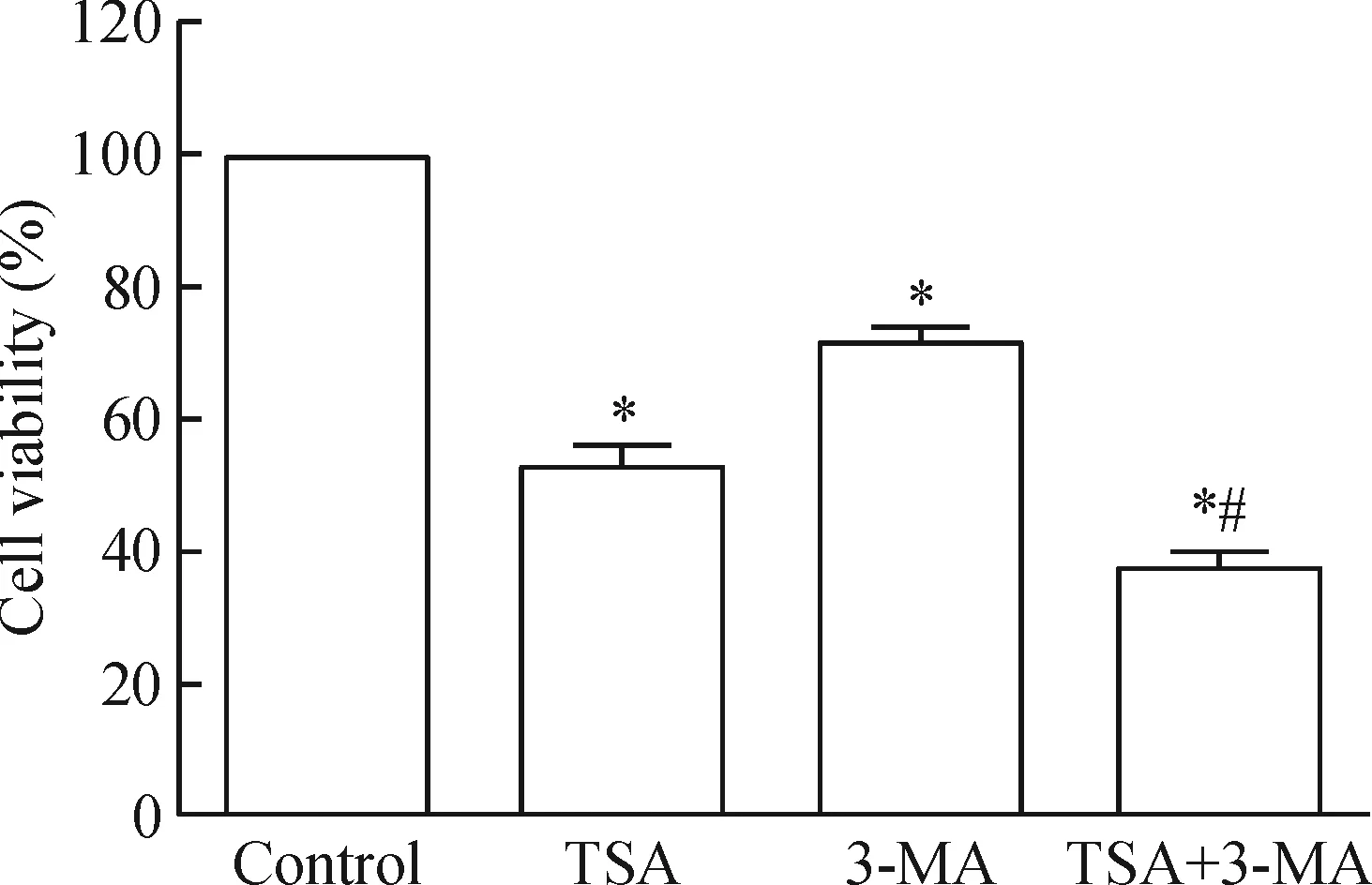
Figure 5.Effect of 3-MA combined with TSA on the growth of MDA-MB-231 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTSA group.
图5 3-MA联合TSA对MDA-MB-231细胞生长的影响
4 3-MA对TSA诱导MDA-MB-231细胞自噬的影响
Western blot实验结果表明,2.5 μmol/L的3-MA与100 nmol/L 的TSA联合处理MDA-MB-231细胞48 h后,与TSA单独用药组比较,联合用药组细胞内自噬蛋白LC3-Ⅱ的表达明显下调,差异有统计学意义(P<0.05),见图6。
讨 论
近年研究发现,组蛋白去乙酰化是肿瘤抑癌基因失活的重要机制。抑制组蛋白去乙酰化酶可在一定程度上逆转抑癌基因的低乙酰化水平,从而介导肿瘤细胞的生长及分化[5]。TSA源自链霉菌代谢产物,是发现的第一个可抑制组蛋白去乙酰化酶的天然产物,研究证实TSA对多种肿瘤细胞具有抗癌活性并以其特异性、高效性及低毒性等特点而受到关注。本实验通过体外培养三阴性乳腺癌MDA-MB-231细胞系,首先探讨了TSA对细胞增殖及迁移能力的影响。实验结果发现TSA可明显抑制MDA-MB-231细胞的生长及迁移能力,并且抑制效应与时间及剂量呈正相关。

Figure 6.Effect of 3-MA combined with TSA on the autophagy of MDA-MB-231 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsTSA group.
图6 3-MA对TSA诱导MDA-MB-231细胞自噬的影响
有研究显示,自噬与肿瘤发生发展密切相关,多种抗肿瘤治疗都可诱导肿瘤细胞发生自噬[6-7]。LC3-Ⅱ是特异性表达在自噬小体膜的分子标识,可作为自噬的特异检测指标。为探讨TSA对三阴性乳腺癌细胞自噬作用的影响,本实验通过蛋白印迹实验分析了TSA给药后乳腺癌MDA-MB-231细胞自噬相关蛋白的表达。实验结果发现,100 nmol/L的TSA处理MDA-MB-231细胞48 h后,细胞内LC3B-Ⅱ的表达明显上调,提示TSA对乳腺癌细胞具有明显的诱导自噬作用。
有学者认为,自噬可降低肿瘤对某些化疗药的敏感性,提示自噬可能是细胞对抗肿瘤治疗的一种耐受机制[8]。3-MA为自噬特异性抑制剂,既往研究报道3-MA可增强肿瘤细胞对放化疗的敏感性,并促进肿瘤细胞的凋亡或自噬[9-10],提示其作为联合治疗药物之一,具有较好的临床应用前景。因此,本文进一步探讨了自噬抑制后TSA对三阴性乳腺癌的治疗效果。结果发现,当3-MA与TSA联合处理三阴性乳腺癌MDA-MB-231细胞后,联合用药组细胞自噬蛋白LC3-Ⅱ的活化得到有效抑制;同时细胞生长能力进一步受到抑制,表明自噬作用被抑制后,肿瘤细胞对TSA的敏感性得到增强,提示乳腺癌化疗中存在的细胞自噬可能是化疗抵抗的原因之一。
综上所述,本研究结果证实,自噬抑制剂3-MA与TSA联用可明显抑制乳腺癌细胞的生长,其作用机制与肿瘤细胞的保护性自噬受到抑制密切相关。自噬抑制剂与化疗药物的联用可为三阴性乳腺癌的治疗提供更多的选择。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2015, 65(1):5-29.
[2] Cleator S, Heller W, Coombes RC. Triple-negative breast cancer: Therapeutic options[J]. Lancet Oncol, 2007, 8(3):235-244.
[3] 王 焕, 李小毛, 刘穗玲, 等. RAD001通过诱导自噬提高人子宫内膜癌细胞对紫杉醇的敏感性[J]. 中国病理生理杂志, 2013, 29(11):1966-1971.
[4] Ma J, Guo X, Zhang S, et al. Trichostatin A, a histone deacetylase inhibitor, suppresses proliferation and promotes apoptosis of esophageal squamous cell lines[J]. Mol Med Rep, 2015, 11(6):4525-4531.
[5] Fouladi M. Histone deacetylase inhibitors in cancer therapy[J]. Cancer Invest, 2006, 24(5):521-527.
[6] Chiu HW, Ho YS, Wang YJ. Arsenic trioxide induces autophagy and apoptosis in human glioma cellsinvitroandinvivothrough downregulation of survivin[J]. J Mol Med (Berl), 2011, 89(9):927-941.
[7] 叶 晶, 刘特思, 金贤国, 等. NVP-BEZ235诱导多囊肾大鼠胆管上皮细胞自噬的机制研究[J]. 中国病理生理杂志, 2016, 32(5):886-891.
[8] Huang M, Garcia JS, Thomas D, et al. Autophagy mediates proteolysis of NPM1 and HEXIM1 and sensitivity to BET inhibition in AML cells[J]. Oncotarget, 2016, 7(46):74917-74930.
[9] 刘兆芸, 贺科文, 宋兴国, 等. 自噬抑制剂可增强三阴性乳腺癌细胞系MDA-MB-468和MDA-MB-231对吉非替尼的敏感性[J]. 中华肿瘤杂志, 2016, 38(6):417-424.
[10]Aydinlik S, Erkisa M, Cevatemre B, et al. Enhanced cytotoxic activity of doxorubicin through the inhibition of autophagy in triple negative breast cancer cell line[J]. Biochim Biophys Acta, 2017, 1861(2):49-57.
(责任编辑: 陈妙玲, 罗 森)
3-MA combined with TSA inhibits growth of triple-negative breast cancer cells
ZHU Kun1, XU Ming2, DING Mi-na1, LIN Zhen-hua2, CHEN Li-yan1, 2
(1DepartmentofBiochemistryandMolecularBiology,2CancerResearchCenter,YanbianUniversityMedicalCollege,Yanji133002,China.E-mail:lychen@ybu.edu.cn)
AIM: To investigate the effect of 3-methyladenine (3-MA) combined with trichostatin A (TSA) on triple-negative breast cancer cells and the mechanism involved. METHODS: The viability of MDA-MB-231 cells was detected by MTT assay, the migration ability was determined by scratch assay, and the expression of autophagy-related proteins was detected by Western blot. RESULTS: TSA significantly inhibited the viability of MDA-MB-231 cells in a time- and dose-dependent manner. The results of scratch assay showed that TSA inhibited cell migration ability. Western blot data indicated that TSA resulted in a moderate increase in LC3-Ⅱ expression. Moreover, 3-MA inhibited cell autophagy induced by TSA, and combination of 3-MA and TSA further inhibited the viability of MDA-MB-231 cells. CONCLUSION: Combination of 3-MA and TSA may effectively inhibit the growth of triple-negative breast cancer cells.
Breast cancer; Trichostatin A; 3-methyladenine; Autophagy
1000- 4718(2017)08- 1524- 04
2016- 12- 23
2017- 03- 23
国家自然科学基金资助项目(No. 81460399 )
R730.23; R737.9
A
10.3969/j.issn.1000- 4718.2017.08.029
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0433-2435041; E-mail: lychen@ybu.edu.cn

