纳米羟基磷灰石诱导的体外特异性抗肿瘤免疫反应研究
董文韬,陈 侃,李善高,何 欢,江国华,孔祥东,
(1.浙江理工大学,a.生命科学学院;b.材料与纺织学院,杭州 310018;2.浙江中医药大学附属第一医院,杭州 310053)
纳米羟基磷灰石诱导的体外特异性抗肿瘤免疫反应研究
董文韬1a,陈 侃1a,李善高2,何 欢1a,江国华1b,孔祥东1a,1b
(1.浙江理工大学,a.生命科学学院;b.材料与纺织学院,杭州 310018;2.浙江中医药大学附属第一医院,杭州 310053)
探讨了纳米羟基磷灰石(hydroxyapatite,HAp)作为肿瘤免疫治疗佐剂或抗原载体的可行性。利用水热法合成棒状、长径200~300 nm、短径30~50 nm的纳米HAp,体外降解实验表明HAp 90 d的降解率可达30%。以人乳腺癌细胞裂解蛋白为肿瘤抗原,利用HAp负载该肿瘤抗原并刺激人外周血单个核细胞来源的树突细胞,将刺激后的树突细胞与同源淋巴细胞共培养,分离共培养后的同源淋巴细胞,并检测其对人非小细胞肺癌细胞A549、人肝癌细胞Huh-7、人乳腺癌细胞MCF-7、人乳腺正常细胞(Hs578Bst)的生长抑制效果。结果表明:所制备的纳米HAp无纳米毒性且生物相容性良好;HAp可显著增强人树突细胞对肿瘤抗原的吞噬作用,同时诱导同源淋巴细胞产生显著的抗原特异性免疫反应,杀伤率可达40%以上。
纳米羟基磷灰石;树突状细胞;肿瘤裂解蛋白;肿瘤免疫治疗
0 引 言
肿瘤免疫治疗有望成为继手术治疗、化疗、放疗、靶向治疗后肿瘤治疗领域的一场重大革新。传统肿瘤治疗方式尚存诸多弊端,如手术治疗对于已浸润、转移的肿瘤和非实体瘤来说作用非常有限,放疗、化疗会对人体正常组织和免疫系统造成极大损伤且难以彻底清除肿瘤细胞。而肿瘤免疫治疗通过提高肿瘤细胞的免疫原性和效应免疫细胞的杀伤敏感性,激发和增强自身机体的抗肿瘤免疫应答[1],继而利用患者自身免疫系统杀伤肿瘤细胞,具有毒副作用小、复发率低、治愈率高等优势,对传统方法难以治疗的淋巴瘤、恶性胶质瘤、黑色素瘤、非小细胞肺癌、肾癌等疗效显著[2-6]。
目前,肿瘤免疫治疗中所采用的树突状细胞(dendritic cell, DC)疫苗策略包括:首先将患者体内的DC进行体外扩增培养,然后在体外利用肿瘤抗原刺激DC,最后将DC回输到患者体内诱导特异性抗肿瘤免疫反应[7-8]。DC疫苗在临床上已经取得一定的疗效[9-10],但仍有许多难题需要进一步研究,如DC的获取、DC的抗原负载方式、DC的活化程度等,其中最关键为抗原负载方式。因此如何找到有效的抗原载体以增强DC诱导的抗肿瘤免疫反应,是DC疫苗研究中的重大难题[11]。
肿瘤细胞通常具有较高的突变率和种属缺失性,并且缺乏特异性标志物,难以找到肿瘤特异性抗原,从而限制肿瘤特异性抗体在肿瘤免疫治疗中的应用。肿瘤裂解蛋白(tumor lysate protein, TLP)是由多种肿瘤蛋白构成的复合物,属于肿瘤相关抗原,易于制备和应用,临床试验表明基于肿瘤裂解蛋白的免疫治疗具有良好效果[12-17]。羟基磷灰石(hydroxyapatite, HAp)是哺乳类动物骨骼和牙齿的主要成分,因其良好的生物相容性而广泛应用于组织工程和药物开发、基因载体中[18-21]。Meng等研究表明,蛋白在与纳米粒子连接之后其免疫原性可以大幅提升[22-23],因此本文构建负载肿瘤裂解蛋白的HAp,并检测其对DC诱导的同源淋巴细胞(lymphocyte, Lym)体外抑癌效果,评估纳米羟基磷灰石颗粒在肿瘤免疫治疗中的应用潜力。
1 材料与方法
1.1 HAp颗粒的制备与表征
纳米颗粒的制备方法参考文献[24]和[25]中的制备方法,具体过程如下:利用恒流泵以20滴/min的速率将50 mL 0.03 mol/L Na2HPO4(Sigma公司,美国)溶液逐滴加入到已预热至70 ℃的50 mL 0.05 mol/L CaCl2(Sigma公司,美国)溶液,磁力搅拌器的搅拌速率为300 r/min,滴加期间始终通过1 mol/L的NaOH(Sigma公司,美国)溶液调整溶液pH值为10。滴加完成后,保持300 r/min的速率和70 ℃的温度继续搅拌2 h后停止搅拌,保持70 ℃的温度水浴静置24 h。上述溶液经高速离心机8000 r/min速率离心5 min及无水乙醇反复清洗3~5次,颗粒置于70 ℃烘箱中烘干,在超净台中用无菌研钵将颗粒碾至粉末状后放入无菌离心管中进行保存。利用场发射扫描电镜(field emission scanning electron microscope,FE-SEM)、X射线粉末衍射仪(X-ray diffraction,XRD)、红外吸收光谱仪(fourier transform infrared spectroscopy,FT-IR)、热重分析仪(thermogravimetry,TGA)对制备的颗粒进行表征分析。
1.2 细胞培养
人乳腺癌细胞株MCF-7、人乳腺正常细胞株Hs578Bst、人非小细胞肺癌细胞株A549、人肝癌细胞株Huh-7均购自中科院上海细胞库,均利用含10%胎牛血清(Gibco公司,美国)和1%青-链霉素双抗溶液(碧云天公司,南京)的RPMI-1640完全培养基(Gibco公司,美国)进行培养。
DC细胞来源于健康人志愿者外周血单个核细胞。利用Ficoll密度梯度离心法从健康人外周血中分理出单个核细胞,具体方法为,先用磷酸缓冲液(Gibco公司,美国)等量稀释健康人外周血,再将稀释过的外周血缓慢加入到等量的人淋巴细胞分离液(TBD公司,天津)中,2000 r/min离心20 min后吸取离心管中的白膜层,即为单个核细胞,将所得单个核细胞过夜培养,然后小心吸出培养皿中的培养基(内含未贴壁的与DC同源的淋巴细胞)至新的培养皿中继续培养,未吸出的贴壁细胞即为单核细胞,加入含10 ng/μL rhGM-CSF(Pepro Tech公司,美国)和10 ng/μL IL-4(Pepro Tech公司,美国)的RPMI-1640完全培养基对其继续培养7~10 d(每3 d半量换液1次),即可诱导培养出未成熟的DC,在诱导DC成熟时,需补加20 ng/mL的rhTNF-α(Pepro Tech公司,美国)。
1.3 HAp颗粒体外降解与生物相容性检测
利用pH值为7.4和5.6的PBS缓冲溶液分别模拟正常体液环境和溶酶体内环境;各取10 mL两种PBS溶液溶解50 mg HAp颗粒,置于37 ℃水浴恒温摇床中,震荡速率为120 r/min,使HAp颗粒降解90 d。期间每10 d将上述溶液8000 r/min离心5 min,利用钙离子检测试剂盒(DICA-500,Bioassay systems)检测上清溶液钙离子的浓度,根据钙离子与HAp之间的关系计算出已降解HAp颗粒的质量,再利用新鲜的两种上述PBS溶液重悬HAp颗粒,震荡混匀后继续置于摇床中继续进行实验。
利用MTT法分别检测HAp浓度为0.1、1、5、10、50、100、200、500 μg/mL对生长到对数期MCF-7、Hs578Bst、Huh-7、A549细胞的相对活力影响,细胞接种密度为3×103个/孔。
1.4 HAp颗粒连接肿瘤抗原
利用RIPA细胞裂解液(碧云天公司,南京)裂解生长到对数生长期的MCF-7细胞(每107个细胞加入1 mL含10 μL 100 mmol/L的PMSF的RIPA裂解液),提取肿瘤细胞裂解蛋白作为肿瘤抗原,利用BCA试剂盒(Thermo Fisher公司,美国)测定蛋白浓度。将20 μg和40 μg HAp颗粒分别负载5、10、15、20、25、30、35、40 μg/mL及20、30、40、50、60、70、80、90 μg/mL两种浓度梯度的TLP溶液。具体方法为在避光4 ℃的环境下利用颠倒混合器温和混匀12 h,然后4 ℃ 5000 r/min离心5 min沉淀HAp颗粒,再次利用BCA试剂盒检测上清溶液中蛋白的浓度,最后通过拟合Langmuir曲线的方法测定其最大吸附量。计算方式为:以Ce为横坐标,Ce/Qe为纵坐标拟合直线,通过公式Ce/Qe=Ce/Qm+1/(Qm×b)计算出Qm,其中Ce为平衡时溶液中蛋白浓度,mg/L;Qe为平衡时蛋白的吸附量,mg/g;Qm为最大吸附量,mg/g;b为常数。
1.5 DC细胞对肿瘤抗原的吞噬
取部分肿瘤裂解蛋白利用FITC试剂盒(Sigma公司,美国)进行标记,TLP与FITC的质量比为1 mg∶150 μg,用避光冰浴透析48 h(每6 h换一次PBS透析液)的方法除去未连接的FITC,用HAp颗粒负载标记后的肿瘤抗原,分别将负载后的肿瘤抗原与游离的肿瘤抗原加入到未成熟的DC中共培养6 h,然后分别用Hoechst 33258(碧云天公司,南京)、Phalloidin(Life公司,美国)对DC的细胞核与微丝骨架进行染色,荧光显微镜观察DC细胞对肿瘤抗原的吞噬情况。
1.6 DC细胞诱导的同源淋巴细胞对MCF-7的体外杀伤效果
分别利用HAp颗粒(HAp)、游离的TLP(TLP)和负载TLP的HAp(HAp-TLP)以及双倍质量的HAp(HAp2)、TLP(TLP2)和负载TLP的HAp(HAp2-TLP2)刺激未成熟的DC(2×104个)2 d(刺激的同时补加20 ng/mL的rhTNF-α),再将刺激后的DC与同源淋巴细胞共培养3 d(淋巴细胞与DC的数量比为10∶1),将共培养后的同源淋巴细胞作为效应细胞(efect cells, E),MCF-7细胞作为靶细胞(target cells, T),利用MTT法检测了E∶T=10∶1和E∶T=20∶1条件下利用不同刺激物刺激的DC诱导的同源淋巴细胞对MCF-7的杀伤效果。
1.7 DC细胞诱导的同源淋巴细胞杀伤特异性检测
利用HAp颗粒(HAp)、游离TLP(TLP)、负载TLP后HAp颗粒(HAp-TLP)刺激DC(2×104个)2 d(刺激的同时补加20 ng/mL的rhTNF-α),再将DC与同源淋巴细胞共培养三天(淋巴细胞与DC的数量比为10∶1),收获刺激后同源淋巴细胞,MTT检测淋巴细胞对靶细胞MCF-7、Huh-7、A549、Hs578Bst(E∶T=20∶1)四种细胞的体外杀伤效应。
1.8 淋巴细胞自身对肿瘤细胞的杀伤效应
利用HAp颗粒(HAp)、游离的TLP(TLP)、负载TLP后的HAp颗粒(HAp-TLP)直接刺激淋巴细胞3 d,用MTT法检测刺激后的淋巴细胞直接对靶细胞MCF-7、Huh-7、A549、Hs578Bst(E∶T=20∶1)的体外杀伤效应。
1.9 统计学方法
应用GraphPad Prism 5软件进行统计分析,计数资料比较采用χ2检验,组间比较采用t检验。以p<0.05为具有显著性差异有统计学意义。
2 结果与分析
2.1 HAp颗粒表征
图1(a)为所制得HAp样品的FE-SEM结果图,从图中可以看出,颗粒形貌为细棒状,长径为200~400 nm,短径为30~50 nm,形貌均一。
图1(b)为所制备HAp样品的XRD检测结果,颗粒结晶性良好,具有明显的211、112、300、002等衍射峰,与标准HAp卡片CPDS#9-432比对的结果表明本研究中所制备颗粒的主要成分为HAp。
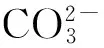
图1(d)为制得颗粒的TGA分析结果,从0 ℃到800 ℃加热过程中,颗粒在温度达到500 ℃时失重为5.32%,温度升高对样品重量的影响不明显;0~300 ℃失重应为颗粒内水分的丧失,300~500 ℃失重速率明显减缓,且失重比率非常小,其原因可能是颗粒内部少量有机物杂质的分解,而500 ℃后失重不再增加,表明所制备HAp具有较高的纯度。
2.2 HAp颗粒体外降解与生物相容性
降解实验中每10 d检测离心后上清中Ca2+浓度,根据Ca2+含量与HAp的对应关系可计算出已降解的HAp颗粒的重量,从而绘制出90 d内HAp颗粒累积降解率曲线。结果如图2所示,HAp颗粒在体外有着较好的可降解性,90 d时,在pH值为5.6与7.4的缓冲液中的HAp的降解率分别达到了49.6%与31.8%,这表明所制备的HAp颗粒降解速率适中,可避免快速降解带来的细胞内环境骤变引起的细胞应激,也能避免长期滞留体内安全性问题与毒副作用,具有较好生物安全性。并且HAp具有不同pH值降解响应性,在酸性环境中降解速率较快。而恶性肿瘤组织中的pH值呈弱酸[26-27],可加速HAp分解,从而更快的释放HAp所搭载的基因、蛋白或药物。
图3中(a)、(b)、(c)和(d)为HAp颗粒浓度在0.1~500 μg/mL范围内,分别与MCF-7、A549、Hs578Bst、Huh-7四种细胞共培3 d的细胞相对存活率检测结果。从图3中结果表明,在所选浓度范围内,HAp与这四种细胞有着良好的生物相容性,各组中细胞存活率普遍都在90%以上,且随着HAp浓度和培养时间的变化,细胞存活状况相对稳定,说明所制备的HAp颗粒样品具有较好的细胞生物相容性,可以用于后续细胞实验。
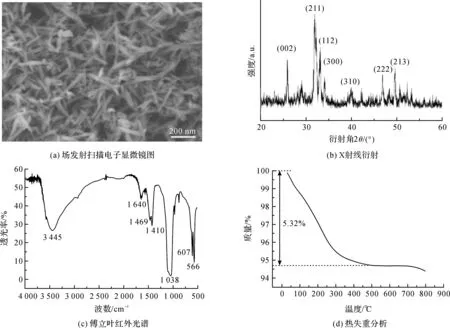
图1 HAp颗粒表征结果
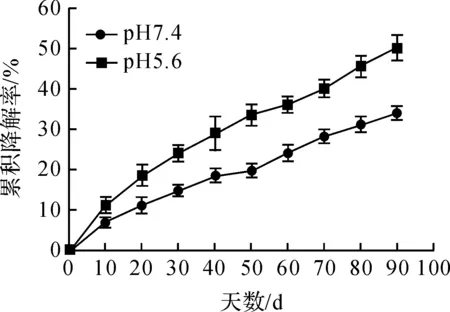
图2 HAp颗粒体外累积降解曲线
图3 HAp颗粒细胞生物相容性检测结果
2.3 诱导培养外周血单个核细胞来源的DC细胞
图4(a)—(f)分别为诱导培养1~9 d DC细胞的明场照片,培养1 d后DC细胞为规则圆形的贴壁单核细胞形态,与诱导培养前并无太大差别;培养3 d后,细胞开始聚集生长,细胞略微变大且细胞表面有少量细丝状突起产生;培养5 d后,细胞聚集生长情况进一步增强,表面丝状突起明显增多;培养7 d后,细胞聚集生长状态较之前有所下降,但部分细胞表面丝状结构明显变粗伸长,有些细胞已经初步有了DC细胞的基本形态;继续培养1 d,在第8 d时可以看到,部分细胞已明显长出伪足,已经有了成型的DC细胞形态,但数量并不多;培养到第9 d时,细胞形态较之前有显著的变化,绝大部分单核细胞已被成功诱导培养为DC细胞,且数量较第8 d有明显增加。上述结果表明本实验成功将单核细胞诱导培养为DC细胞。

图4 诱导培养不同天数的DC细胞的形态
2.4 HAp对肿瘤裂解蛋白的负载
图5(a)为20 μg HAp吸附TLP的Langmuir方程拟合直线,在实验中,各组初始TLP溶液经20 μg HAp颗粒负载后,终浓度Ce为2.9、5.6、10.9、14.8、19.4、24.6、29.9、34.8 μg/mL,由得到的直线方程计算得出Qm=1/0.1716,约为5.8。图5(b)为40 μg HAp吸附TLP的Langmuir方程拟合直线,各组初始TLP溶液经40 μg HAp颗粒负载后,Ce为12.1、17.4、22.3、34.5、48.4、56.7、65.1、75.9 μg/mL,计算可得Qm=1/0.0714,约为14.0。上述结果结果表明,HAp质量与所吸附蛋白的量基本呈线性关系,但纳米材料具有比表面积大、表面活性高等一些特殊性质,因此在颗粒质量加倍后,所吸附蛋白量要多于单倍质量颗粒吸附蛋白量的两倍。
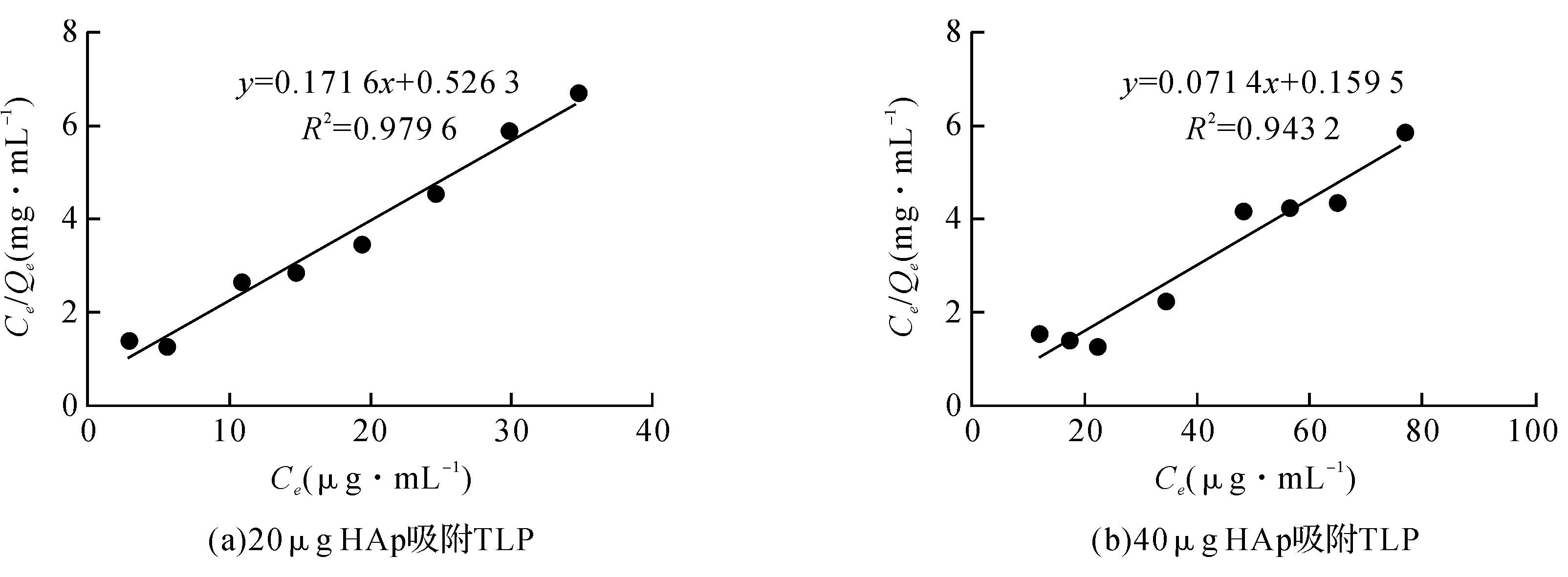
图5 HAp颗粒吸附TLP的Langmuir方程拟合直线
2.5 DC细胞吞噬肿瘤抗原
图6为分别利用TLP与HAp-TLP刺激诱导培养7 d后的DC细胞,荧光显微镜观察DC细胞对肿瘤抗原的吞噬结果。蓝色荧光为Hoechst标记的DC细胞核,红色荧光为Phalloidin标记的DC细胞骨架,绿色荧光为FITC标记的TLP。从图中可以看出,此时的细胞处于聚集生长状态,部分细胞已有伪足伸出,初步具有DC细胞的形态,在TLP未与HAp连接时(即游离的TLP),只有少量抗原被DC吞噬,但在TLP连接HAp之后(即TLP-HAp),DC细胞所吞噬的肿TLP的量明显增多,说明所制备的HAp样品对DC细胞吞噬肿瘤抗原有良好的促进作用。
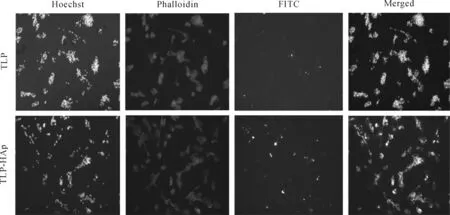
图6 DC细胞对肿瘤抗原的吞噬(Hoechst为赫斯特染色,Phalloidin为鬼笔环肽,FITC为异硫氰酸荧光素,Merged为三色荧光复合图,放大倍数:200×)
2.6 DC细胞诱导的同源淋巴细胞体外杀伤MCF-7
从图7与图8结果显示,用HAp-TLP刺激DC细胞后,DC诱导的同源淋巴细胞对MCF-7的杀伤效果显著高于单独用HAp或者TLP刺激的DC。当且用双倍量的HAp负载TLP后,其结果相似。利用HAp颗粒负载TLP后,TLP更容易被DC细胞吞噬,DC将更多的抗原呈递给效应淋巴细胞,从而增强免疫杀伤反应。单独使用HAp或TLP刺激DC所诱导的杀伤并无显著效果,其原因可能为HAp对DC的免疫原性较弱且TLP在未连接HAp之前DC细胞对TLP的吞噬量非常小,无法诱导产生足够强烈的针对肿瘤细胞的杀伤反应。
为了进一步增强肿瘤细胞杀伤效应,实验中提高同源淋巴细胞的数量,将E∶T=10∶1提高到E∶T=20∶1。结果如图8所示,HAp-TLP和HAp2-TLP2的杀伤效果明显增强,而在E∶T=10∶1的实验中,效应淋巴细胞的杀伤效果基本饱和,提高淋巴细胞的数量后有更多的淋巴细胞被激活产生抗肿瘤效应。随着实验天数的增加,抗肿瘤细胞免疫反应并没有随之增强,而是保持在一个较为稳定的状态。

(a) DC诱导的同源淋巴细胞对MCF-7杀伤效果检测(E∶T=10∶1)
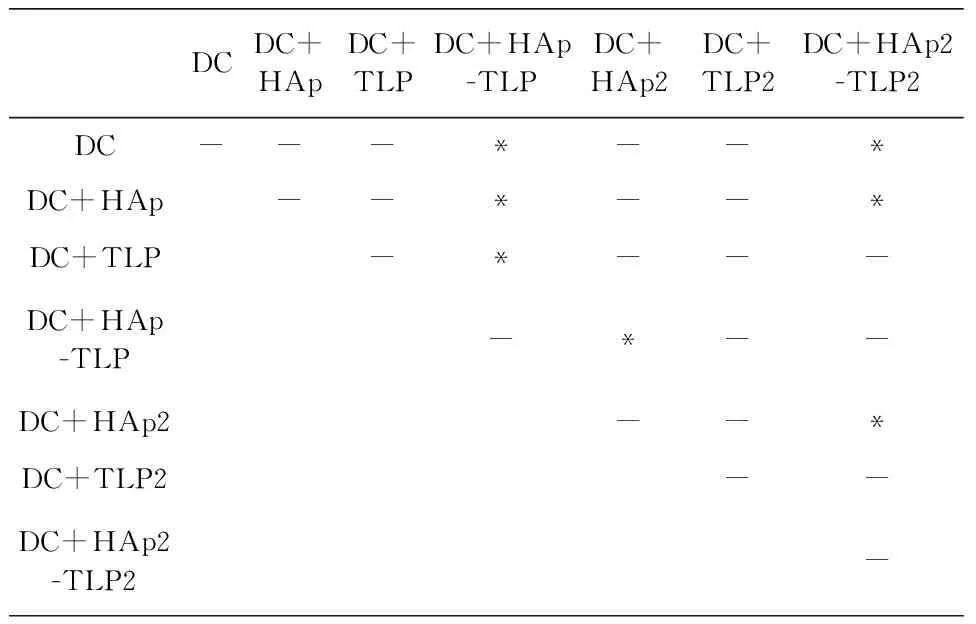
DCDC+HApDC+TLPDC+HAp-TLPDC+HAp2DC+TLP2DC+HAp2-TLP2DC---*--*DC+HAp--*--*DC+TLP-*---DC+HAp-TLP-*--DC+HAp2--*DC+TLP2--DC+HAp2-TLP2-
(b) 24 h时杀伤效果差异显著性分析(E∶T=10∶1)
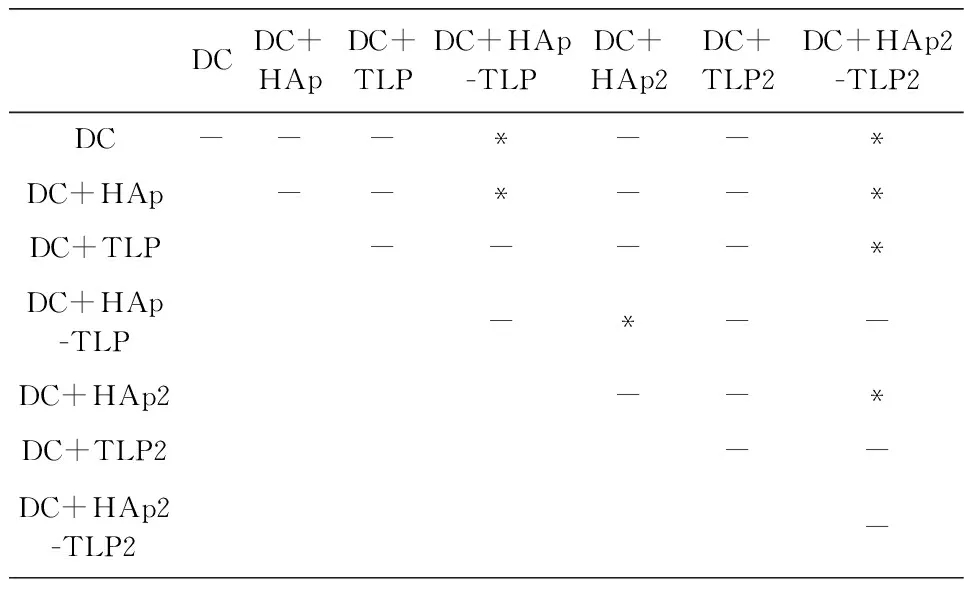
(c) 48 h时杀伤效果差异显著性分析(E∶T=10∶1)
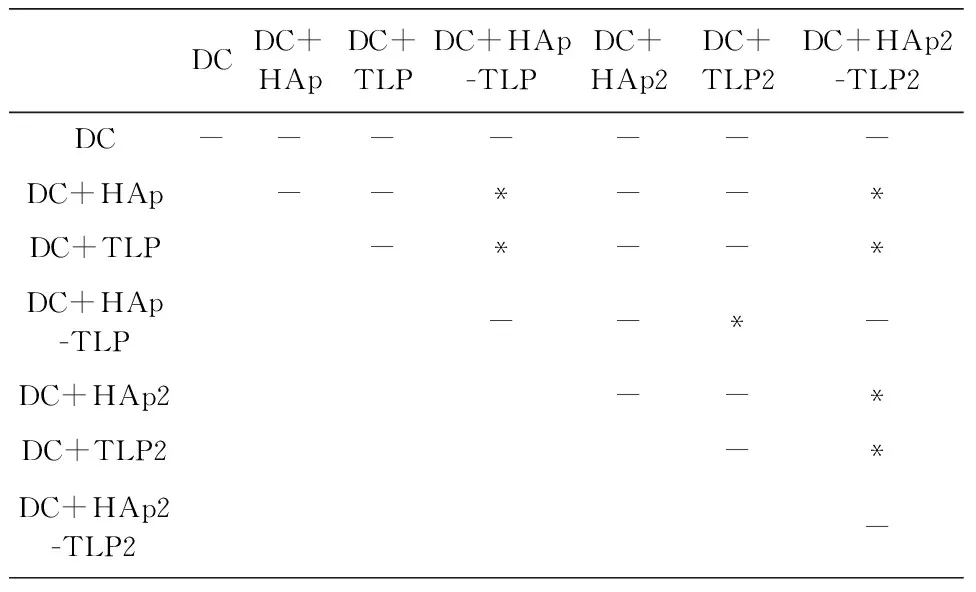
DCDC+HApDC+TLPDC+HAp-TLPDC+HAp2DC+TLP2DC+HAp2-TLP2DC-------DC+HAp--*--*DC+TLP-*--*DC+HAp-TLP--*-DC+HAp2--*DC+TLP2-*DC+HAp2-TLP2-
(d) 72 h时杀伤效果差异显著性分析(E∶T=10∶1)
图7 DC诱导的同源淋巴细胞对MCF-7杀伤效果检测(E∶T=10∶1)
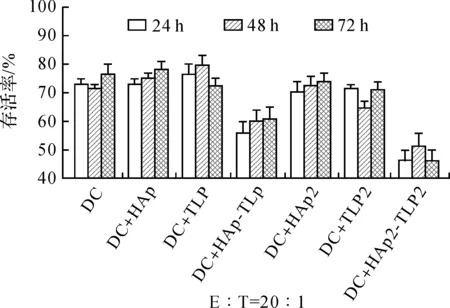
(a) DC诱导的同源淋巴细胞对MCF-7杀伤效果检测(E∶T=20∶1)

DCDC+HApDC+TLPDC+HAp-TLPDC+HAp2DC+TLP2DC+HAp2-TLP2DC---**--**DC+HAp--*--**DC+TLP-**--**DC+HAp-TLP-**-DC+HAp2--*DC+TLP2-**DC+HAp2-TLP2-
(b) 24 h时杀伤效果差异显著性分析(E∶T=20∶1)
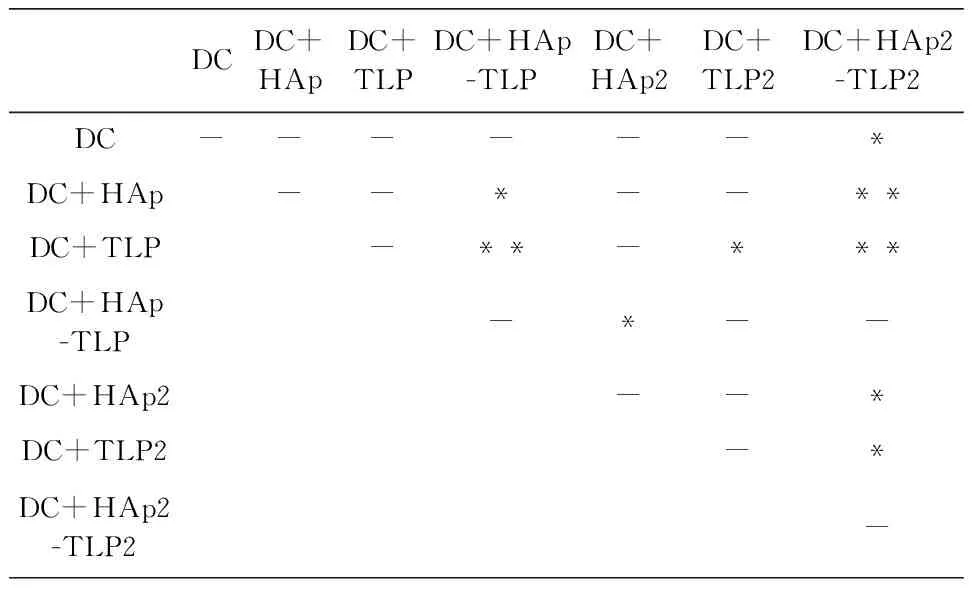
(c) 48 h时杀伤效果差异显著性分析(E∶T=20∶1)
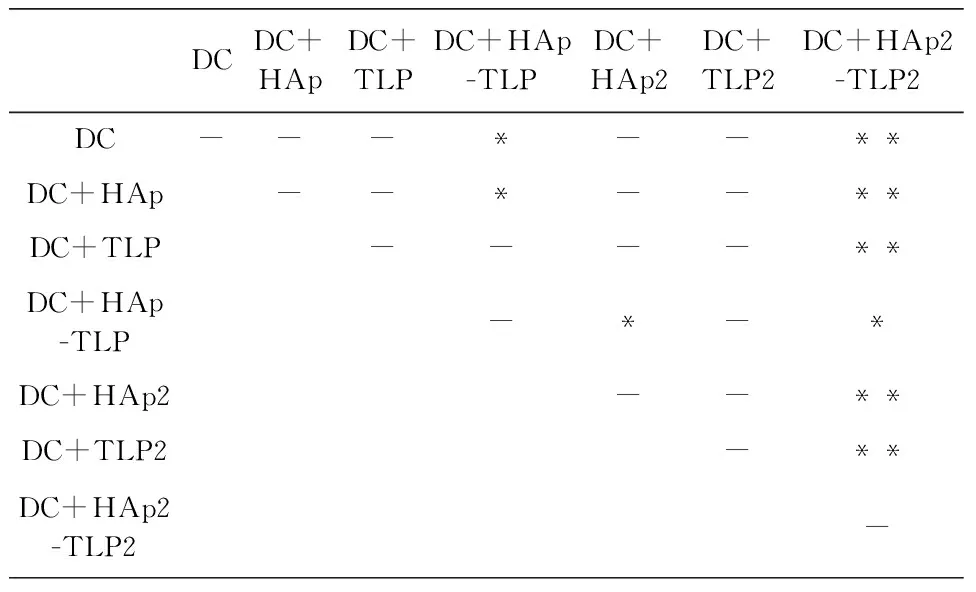
DCDC+HApDC+TLPDC+HAp-TLPDC+HAp2DC+TLP2DC+HAp2-TLP2DC---*--**DC+HAp--*--**DC+TLP----**DC+HAp-TLP-*-*DC+HAp2--**DC+TLP2-**DC+HAp2-TLP2-
(d) 72 h时杀伤效果差异显著性分析(E∶T=20∶1)
图8 DC细胞诱导的同源淋巴细胞对MCF-7杀伤效果检测(E∶T=20∶1)
2.7 DC细胞诱导的同源淋巴细胞杀伤特异性检测
图9为杀伤特异性检测结果,从图中可以看出,经DC细胞刺激的淋巴细胞对异源细胞产生杀伤作用,其中图9(d)对Hs578Bst的杀伤率达35%,这可能是因为正常细胞在脱离组织后会被淋巴细胞当作异物来清除,同时实验中所用的Hs578Bst与淋巴细胞并不同源,并且普遍来说正常细胞要比肿瘤细胞更加脆弱,这可能是淋巴细胞对其杀伤效果明显的原因。DC组、DC+HAp组、DC+TLP组对四种细胞的杀伤效果虽有不同,但组内并无明显差异,而DC+HAp-TLP组只在对MCF-7杀伤时(图9(c))显示出显著的杀伤效果,对其他种类细胞并无显著杀伤效果差异,说明DC+HAp-TLP诱导的淋巴细胞体外杀伤作用对MCF-7细胞具有一定特异性,其原因是使用的TLP是从同株MCF-7中裂解得到的,因此会产生特异性的免疫反应。
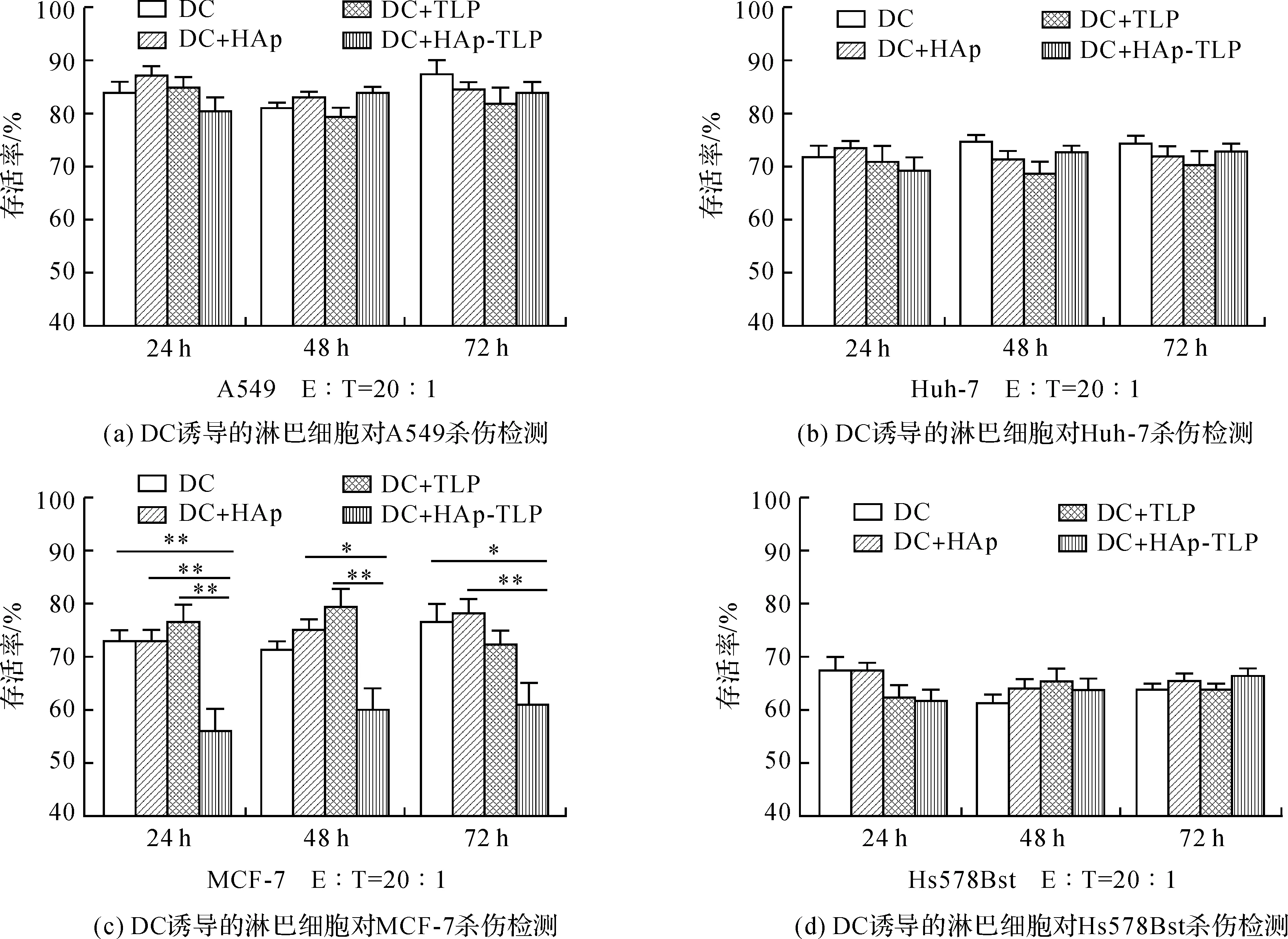
图9 DC细胞诱导的同源淋巴细胞杀伤特异性检测
2.8 淋巴细胞自身体外抑癌效果检测
为了排除实验过程中淋巴细胞自身对这4种细胞的杀伤效应,检测未经DC刺激的淋巴细胞直接对A549、Huh-7、MCF-7和Hs578Bst的体外杀伤效果。结果表明,在图9中发现的各实验组对这4种细胞的杀伤效果主要是由淋巴细胞引起的,并且在经过DC刺激后这种杀伤效果会有一定增强;虽然针对不同的细胞杀伤效果有所差异,但是对同一种细胞,经HAp、TLP和HAp-TLP刺激后的淋巴细胞的杀伤效果并没有显著差异,且随着作用时间的增长并没有显示出与时间的关联性。同时结合图9(c)与图10(c),利用HAp-TLP刺激后的DC诱导的淋巴细胞的杀伤效果显著高于未经DC诱导的淋巴细胞(约高20%),表明HAp-TLP促进DC吞噬TLP之后会诱导淋巴细胞产生更强的针对TLP来源细胞的杀伤效果。
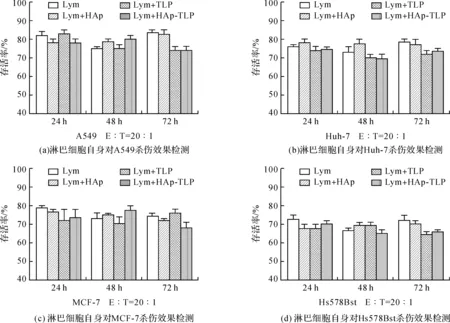
图10 淋巴细胞自身对多种细胞体外杀伤效果
3 结 论
利用水热法成功制备长径200~300 nm、短径30~50 nm的长棒状纳米羟基磷灰石,该纳米羟基磷灰石具有良好的可降解性和细胞生物相容性,对肿瘤裂解蛋白具有良好的负载能力。纳米羟基磷灰石可显著促进DC细胞对肿瘤抗原的吞噬,并显著增强DC诱导的同源淋巴细胞对肿瘤细胞的特异性杀伤作用,杀伤率可达40%以上。该研究证明纳米羟基磷灰石颗粒在肿瘤免疫治疗领域具有应用潜力,可用于新型免疫佐剂、新型抗原载体、增强树突细胞疫苗等开发领域。
[1] MCNUTT M. Cancer immunotherapy[J]. Science,2013,342(6165):1432-1433.
[2] TAKAYAMA T, SEKINE T, MAKUUCHI M, et al. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomised trial[J]. Lancet,2000,356(9232):802-807.
[3] VERMORKEN J B, CLAESSEN A M, VAN TINTEREN H, et al. Active specific immunotherapy for stage II and stage III human colon cancer: a randomised trial[J]. Lancet,1999,353(9150):345-350.
[4] HANNA M G, HOOVER H C, VERMORKEN J B, et al. Adjuvant active specific immunotherapy of stage II and stage III colon cancer with an autologous tumor cell vaccine: First randomized phase iii trials show promise[J]. Vaccine,2001,19(19):2576-2582.
[5] ROSENBERG S A. Progress in human tumour immunology and immunotherapy[J]. Nature,2001,411(6835):380-384.
[6] SCHIRRMACHER V. Clinical trials of antitumor vaccination with an autologous tumor cell vaccine modified by virus infection: Improvement of patient survival based on improved antitumor immune memory[J]. Cancer Immunol Immunother,2005,54(6):587-598.
[7] MATSUMOTO S, SAITO H, TSUJITANI S, et al. Allogeneic gastric cancer cell-dendritic cell hybrids induce tumor antigen (carcinoembryonic antigen) specific CD8+T cells[J]. Cancer Immunol Immunother,2006,55(2):131-139.
[8] KAWAHARA M, TAKAKU H. A tumor lysate is an effective vaccine antigen for the stimulation of cd4(+) T-cell function and subsequent induction of antitumor immunity mediated by CD8+T cells[J]. Cancer Biology Therapy,2015,16(11):1616-1625.
[9] ROSES R E, DATTA J, CZERNIECKI B J. Radiation as immunomodulator: Implications for dendritic cell-based immunotherapy[J]. Radiation Research,2014,182(2):211-218.
[10] PALMER D H, MIDGLEY R S, MIRZA N, et al. A phase II study of adoptive immunotherapy using dendritic cells pulsed with tumor lysate in patients with hepatocellular carcinoma[J]. Hepatology,2009,49(1):124-132.
[11] ROSENBERG S A, YANG J C, RESTIFO N P. Cancer immunotherapy: moving beyond current vaccines[J]. Nature Medicine,2004,10(9):909-915.
[12] TIAN Z. Cellular & Molecular immunology receives its first impact factor[J]. Cellular Molecular Immunology,2010,7(5):327.
[13] BARUCCA A, CAPITANI M, CESCA M, et al. Recombinant DNA technology for melanoma immunotherapy: anti-Id DNA vaccines targeting high molecular weight melanoma-associated antigen[J]. Molecular Biotechnology,2014,56(11):1032-1039.
[14] MELLMAN I, COUKOS G, DRANOFF G. Cancer immunotherapy comes of age[J]. Nature,2011,480(7378):480-489.
[15] HUMPHRIES C. Adoptive cell therapy: honing that killer instinct[J]. Nature,2013,504(7480):13-15.
[16] ARANDA F, VACCHELLI E, OBRIST F, et al. Trial watch: adoptive cell transfer for anticancer immunotherapy[J]. Oncoimmunology,2013,2(5):e24238.
[17] WEINTRAUB K, Drug development: releasing the brakes[J]. Nature,2013,504(7480):6-8.
[18] 张瑾莉,任小元,张琪,等.仿生矿化法制备HA/SF/Ti复合材料的研究进展[J].丝绸,2014,51(3):19-24.
[19] XU X, LI Z, KONG X, et al. Calcium phosphate nanoparticles-based systems for siRNA delivery[J]. Regenerative Biomaterials,2016,3(3):187-195.
[20] LAI W, CHEN C, REN X, et al. Hydrothermal fabrication of porous hollow hydroxyapatite microspheres for a drug delivery system[J]. Materials Science & Engineering C,2016,62:166-172.
[21] 韩华锋,杨卫,陈菲菲,等.碳酸钙微球合成、修饰及作为基因载体的研究[J].浙江理工大学学报,2014,31(6):685-690.
[22] MENG J, YANG M, JIA F, et al. Subcutaneous injection of water-soluble multi-walled carbon nanotubes in tumor-bearing mice boosts the host immune activity[J]. Nanotechnology,2010,21(14):145104-145112.
[23] SUN Z, WANG W, MENG J, et al. Multi-walled carbon nanotubes conjugated to tumor protein enhance the uptake of tumor antigens by human dendritic cells in vitro[J]. Cell Research,2010,20(10):1170-1173.
[24] ZHAO R, YANG X, KONG X, et al. The anti-tumor effect of p53 gene-loaded hydroxyapatite nanoparticles in vitro and in vivo[J]. Journal of Nanoparticle Research,2014,16(4):1-15.
[25] 钟云平,姚晨雪,孔祥东,等.纳米羟基磷灰石携载lefty-1基因对人乳腺癌细胞的杀伤效应[J].浙江理工大学学报,2016,35(3):450-457.
[26] VAUPEL P. Tumor microenvironmental physiology and its implications for radiation oncology[J]. Seminars in Radiation Oncology,2004,14(3):198-206.
[27] MARTINEZ-ZAGUILAN R, SEFTOR E A, SEFTOR R E, et al. Acidic pH enhances the invasive behavior of human melanoma cells[J]. Clinical Experimental Metastasis,1996,14(2):176-186.
(责任编辑: 唐志荣)
Study on In Vitro Specificity Anticancer Immune Response Induced by Nanometer Hydroxyapatite
DONG Wentao1a, CHEN Kan1a, LI Shangao2, HE Huan1a, JIANG Guohua1b, KONG Xiangdong1
(1a.College of Life Sciences; 1b.College of Materials and Textile, Zhejiang Sci-Tech University, Hangzhou 310018, China; 2.The First Affiliated Hospital of Zhejiang Chinese Medicine University, Hangzhou 310053, China)
This study explores the feasibility of using hydroxyapatite (HAp) nanoparticles as adjuvant or antigen carrier in cancer immunotherapy. Rod-shaped HAp nanoparticles 200~300 nm in length and 30~50 nm in width were synthesized with hydrothermal method. Degradation experiment in vitro indicates that the degradation rate of Hap can reach 30% in 90 days. With human breast cancer cell ce-cropins as tumor antigen, Hap was made use to carry the tumor antigen and stimulate dendritic cells from peripheral blood mononuclear cells, the stimulated dendritic cells were co-cultured with homologous lymphocytes, the co-cultured homologous lymphocytes were separated, and the growth inhibition effect of the co-cultured homologous lymphocytes on A549, Huh-7, MCF-7 and Hs578Bst was tested. The results show that the prepared HAp nanoparticles have no nanotoxicity and are of high biocompatibility; HAp can significantly enhance the phagocytosis of dendritic cells on tumor antigens, and induce homologous lymphocytes to generate significant antigen-specific antitumor immunity, which a killing rate up to above 40%.
nano-hydroxyapatite; dendritic cell; tumor lysate protein; tumor immunotherapy
10.3969/j.issn.1673-3851.2017.09.020
2016-10-28 网络出版日期: 2017-08-07
国家自然科学基金项目(51672250,51272236);浙江理工大学521人才培养计划资助项目(1610032521302)
董文韬(1990-),男,山东烟台人,硕士研究生,主要从事生物材料用于肿瘤治疗交叉科学方面的研究。
孔祥东,kongxiangdong@gmail.com
Q279
A
1673- 3851 (2017) 05- 0727- 10
——紫 苏

