两种丹参毛状根对茉莉酸甲酯的差异响应
方誉民,杨东风,梁宗锁
(浙江理工大学,a.生命科学学院;b.浙江省植物次生代谢调控重点实验室,杭州 310018)
两种丹参毛状根对茉莉酸甲酯的差异响应
方誉民,杨东风,梁宗锁
(浙江理工大学,a.生命科学学院;b.浙江省植物次生代谢调控重点实验室,杭州 310018)
为了阐明紫花丹参和藏丹参对信号分子的差异响应,选择茉莉酸甲酯作为信号分子诱导两种丹参毛状根的代谢,对比两者生长状态、次生代谢物积累变化和基因表达模式。结果表明:200 μmol/L茉莉酸甲酯显著促进藏丹参毛状根中二氢丹参酮I、隐丹参酮、丹参酮IIA、咖啡酸、迷迭香酸和丹酚酸B积累,而对紫花丹参仅仅影响其毛状根中二氢丹参酮I、隐丹参酮、咖啡酸和丹酚酸B积累;藏丹参毛状根中参与丹参酮和丹酚酸合成的关键基因比紫花丹参毛状根中相应基因更强烈地响应茉莉酸甲酯诱导,这可能导致藏丹参毛状根产生更强烈的隐丹参酮、丹参酮IIA、咖啡酸、迷迭香酸和丹酚酸B代谢响应。
紫花丹参;藏丹参;毛状根;茉莉酸甲酯;次生代谢;基因表达
0 引 言
紫花丹参(SalviamiltiorrhizaBunge)和藏丹参(SalviacastaneaDiels f.tomentosaStib)同属于唇形科药用植物,主要用于治疗心脑血管疾病[1-2]。丹参酮和丹酚酸是两种丹参的主要有效成分:丹参酮包括二氢丹参酮I(dihydrotanshinone I)、隐丹参酮(cryptotanshinone)、丹参酮I(tanshinone I)和丹参酮IIA(tanshinone IIA)等,而丹酚酸包括迷迭香酸(rosmarinic acid)、咖啡酸(caffeic acid)和丹酚酸B(salvianolic acid B)等[3-4]。紫花丹参和藏丹参中次生代谢存在差异,紫花丹参积累更高含量的丹酚酸B,而藏丹参产生更高含量的丹参酮[3-4]。目前,关于两种丹参中天然产物积累差异的形成机制尚不明确。药用植物中天然产物含量较低,并且种质退化加剧中药资源短缺问题,通过植物组织工程可以显著地提高有效成分的产生,包括培养条件优化、前体添加和诱导子处理等[5]。诱导子可以诱导药用植物毛状根中关键基因的表达,进而促进不同有效成分的积累,如丹参酮[2]、丹酚酸[6]和黄酮[7]。茉莉酸甲酯是与损伤响应相关的植物激素和信号分子,广泛用于各种药用植物次生代谢的研究,如藏丹参[2]、黄芩(Scutellariabaicalensis)[7]和黄花蒿(Artemisiaannua)[8],但茉莉酸甲酯在调控紫花丹参和藏丹参次生代谢中所起的作用尚不清楚。因此,本文通过茉莉酸甲酯分别诱导紫花丹参和藏丹参毛状根,比较两种丹参毛状根的生物量、次生代谢物含量和基因表达变化。
为了分析两种丹参次生代谢对茉莉酸甲酯的响应机制,对丹参酮和丹酚酸合成途径中16个关键基因与旁支途径中2个基因的表达模式进行分析。二萜化合物基因包括乙酰CoA酰基转移酶(acetyl-CoA C-acetyltransferase, AACT)基因、3-羟基-3-甲基戊二酰CoA还原酶(3-hydroxy-3-methylglutaryl-CoA reductase, HMGR)基因、1-脱氧-d-木酮糖-5-磷酸合成酶(1-deoxy-d-xylulose 5-phosphate synthase, DXS)基因、1-脱氧-d-木酮糖-5-磷酸还原异构酶(1-deoxy-d-xylulose 5-phosphate reductoisomerase, DXR)基因、牻牛儿基牻牛儿基焦磷酸合成酶(geranylgeranyl diphosphatesynthase, GGPPS)基因、柯巴基焦磷酸合酶(copalyl diphosphate synthase, CPS)基因、类贝壳杉烯合酶(ent-kaurene synthase like 2, KSL)基因和两个细胞色素P450(CYP76AH1和CYP76AH3)基因。酚酸生物合成基因包括苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)基因、肉桂酸-4-羟化酶(cinnamic acid 4-hydroxylase, C4H)基因、4-香豆素CoA连接酶(4-coumarate-CoA ligase, 4CL)基因、酪氨酸氨基转移酶(tyrosine aminotransferase,TAT)基因、对羟基苯丙酮酸双加氧酶(4-hydroxyphenylpyruvate dioxygenase, HPPD)基因、对羟基苯丙酮酸还原酶(4-hydroxyphenylpyruvate reductase, HPPR)基因、迷迭香酸合成酶(rosmarinic acid synthase, RAS)基因和细胞色素P450(CYP98A78)基因。
1 实验材料与方法
1.1 材料与仪器
材料:紫花丹参和藏丹参毛状根由发根农杆菌ATCC15834分别侵染紫花丹参和藏丹参无菌苗获得,茉莉酸甲酯和甲醇购自Sigma公司,多糖多酚植物总RNA提取试剂盒购自天根生化科技有限公司,反转录试剂盒PrimeScriptTMRT reagent Kit和荧光定量PCR试剂盒SYBR®Premix Ex TaqTMII购自Takara公司,荧光定量PCR引物(如表1所示)由杭州擎科梓熙生物技术有限公司合成。
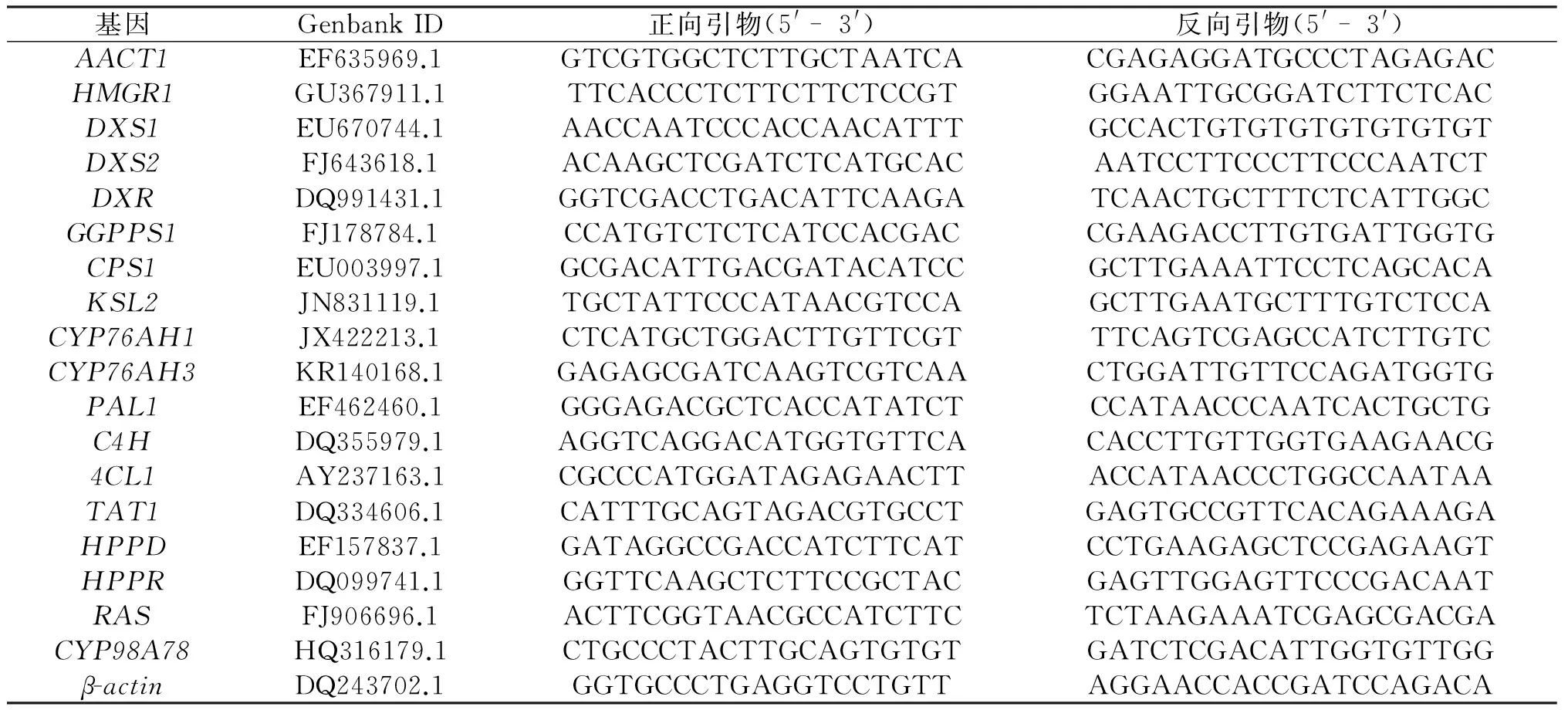
表1 丹参中次生代谢相关基因的特异性引物
仪器:生物样品均质仪(Bioprep-24,杭州奥盛仪器有限公司);超声洗涤器(KQ-500DE,昆山市超声仪器有限公司);高效液相色谱仪(Waters e2695,美国Waters公司);分光光度计(NANODROP 2000, Thermo Scientific);荧光定量PCR仪(QuantStudio 6 Flex, ABI)。
1.2 实验方法
1.2.1 丹参毛状根培养
配制6,7-V液体培养基,并将pH值调为5.8;每个100 mL锥形瓶中加入50 mL培养基,灭菌冷却备用。在超净台中向每个锥形瓶中接入0.2 g长势较好一致的新鲜丹参毛状根,放入恒温摇床中,在25 ℃、110 r/min下黑暗培养。继代培养18 d加入茉莉酸甲酯诱导子。
1.2.2 丹参毛状根诱导和样品采集
茉莉酸甲酯诱导子配制按照文献[2]中的方法进行。用无水乙醇作为助溶剂,配制200 mmol/L母液,用0.22 μm无菌滤头过滤除菌,以200 μmol/L终浓度处理继代培养到第18 d的丹参毛状根,诱导后12 h、1 d、3 d和 6 d分别取样。
1.2.3 丹参酮和丹酚酸的高效液相分析
丹参酮和丹酚酸的提取和检测参照文献[9]中的方法。
1.2.4 基因表达分析
首先,参照多糖多酚植物总RNA提取试剂盒说明书进行总RNA提取。然后,用试剂盒PrimeScriptTMRT reagent Kit配制反应液进行逆转录反应。最后,用试剂盒SYBR®Premix Ex TaqTMII配制反应液进行荧光定量PCR反应,反应条件为:95 ℃、30 s,95 ℃、5 s,59 ℃、30 s,40个循环。
1.2.5 数据分析
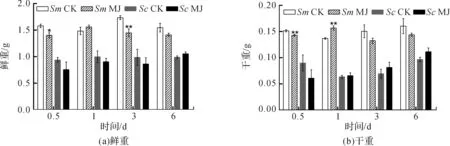
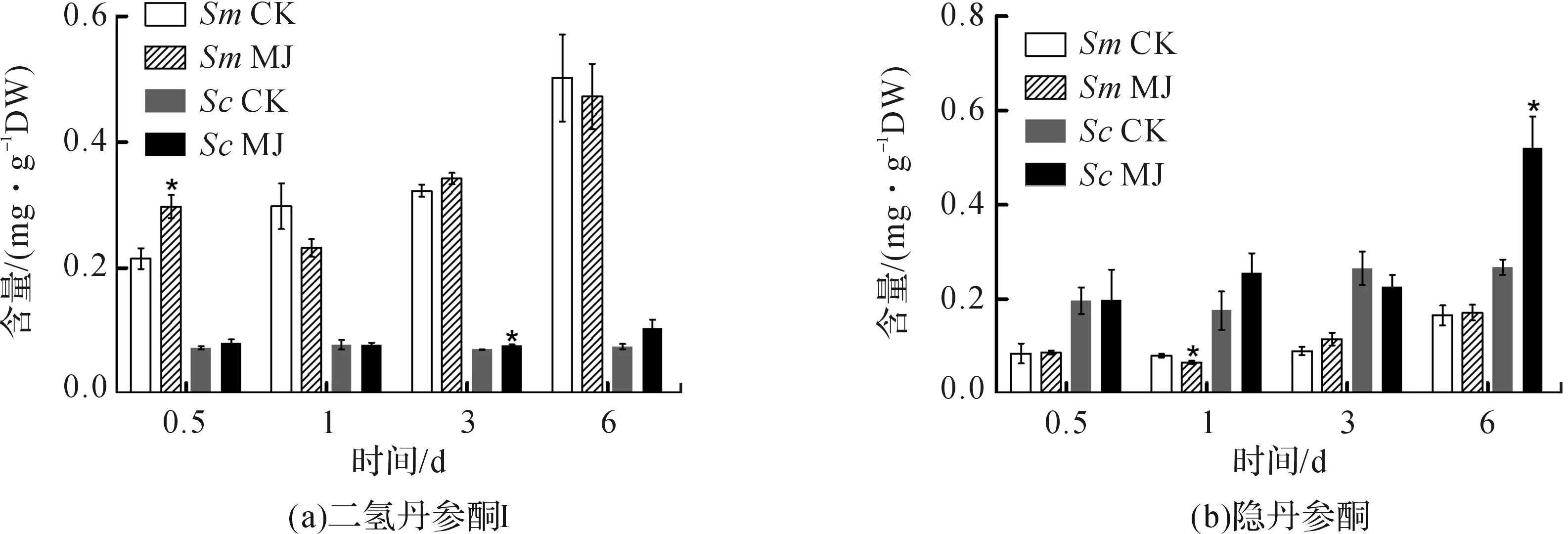
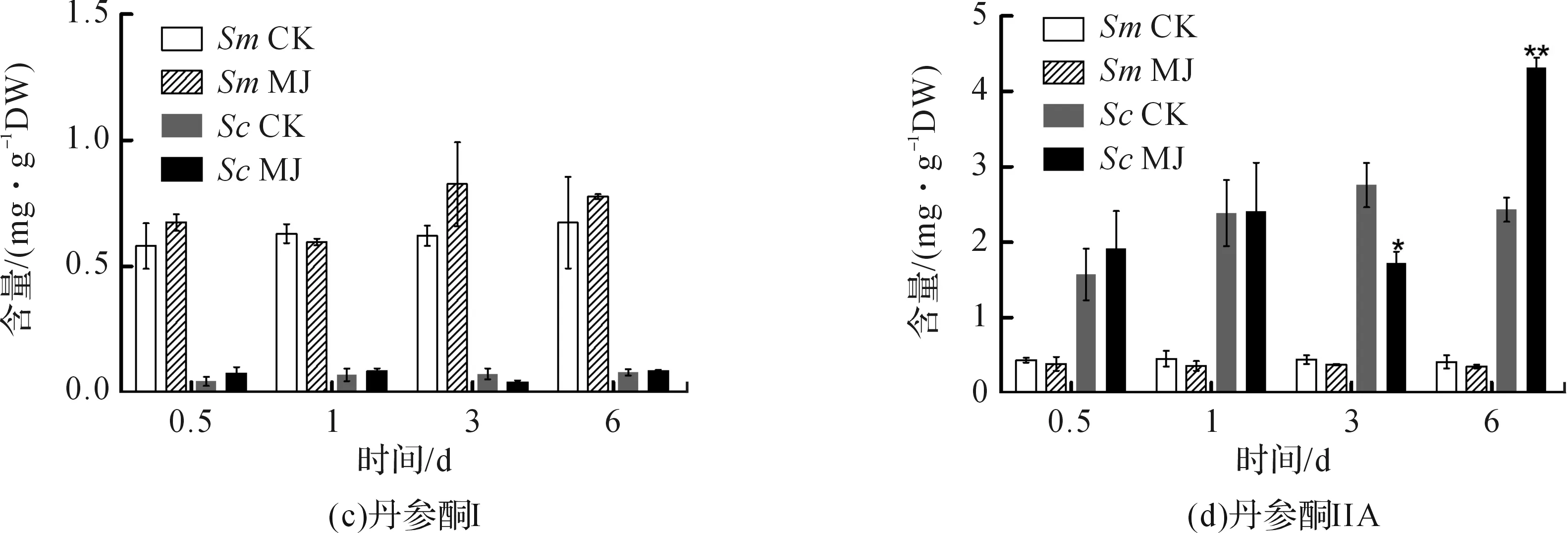
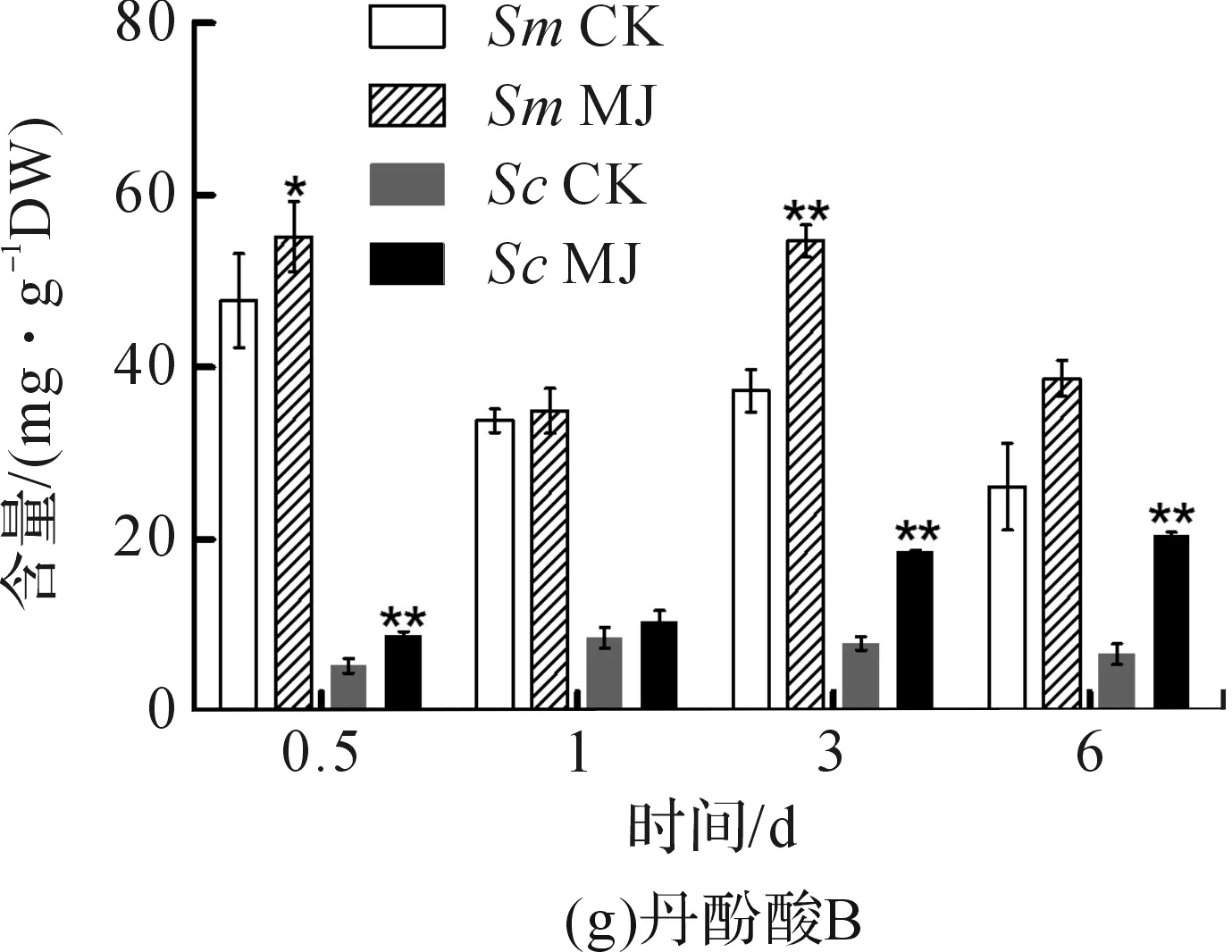
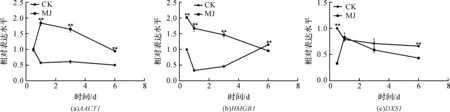
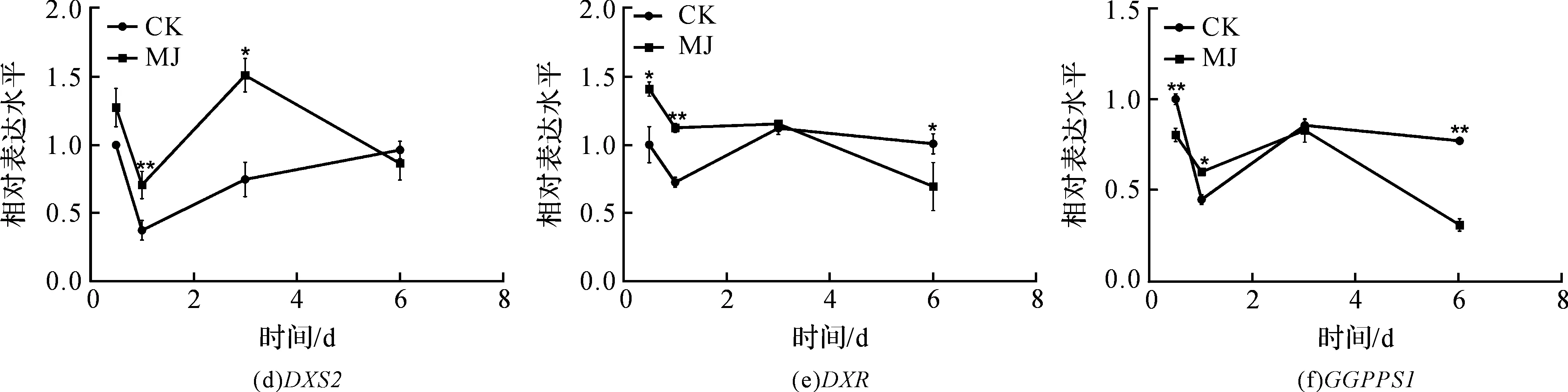
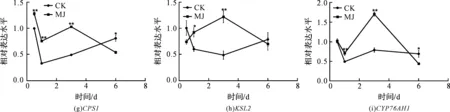
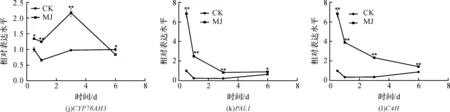
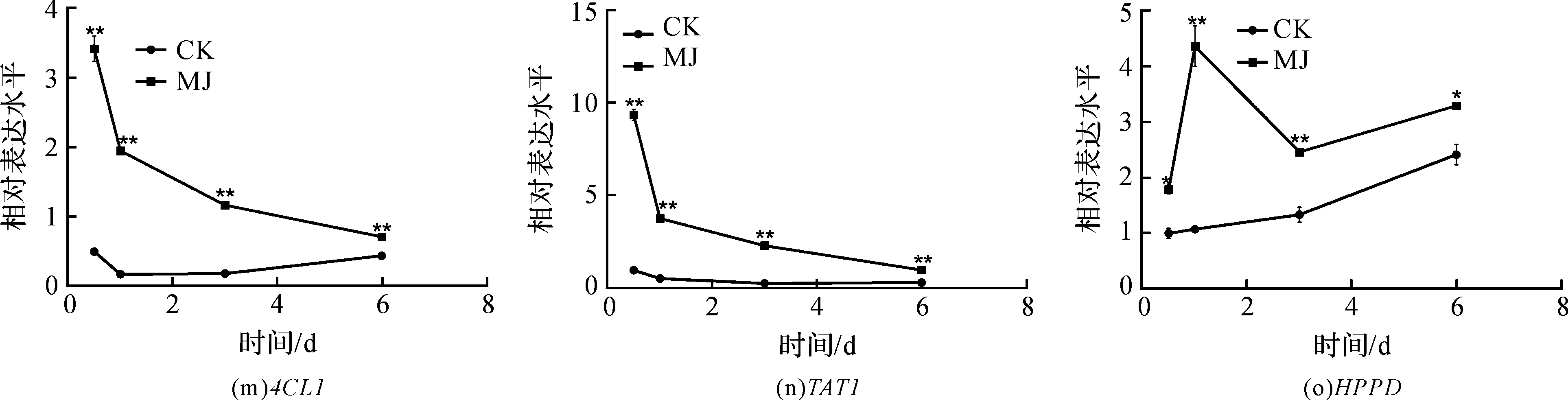
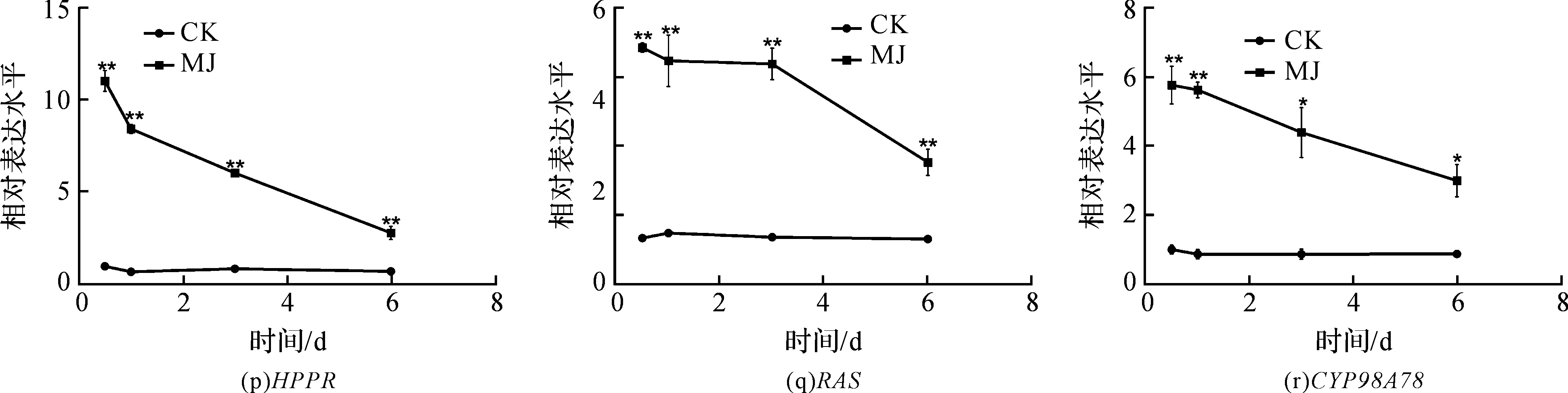
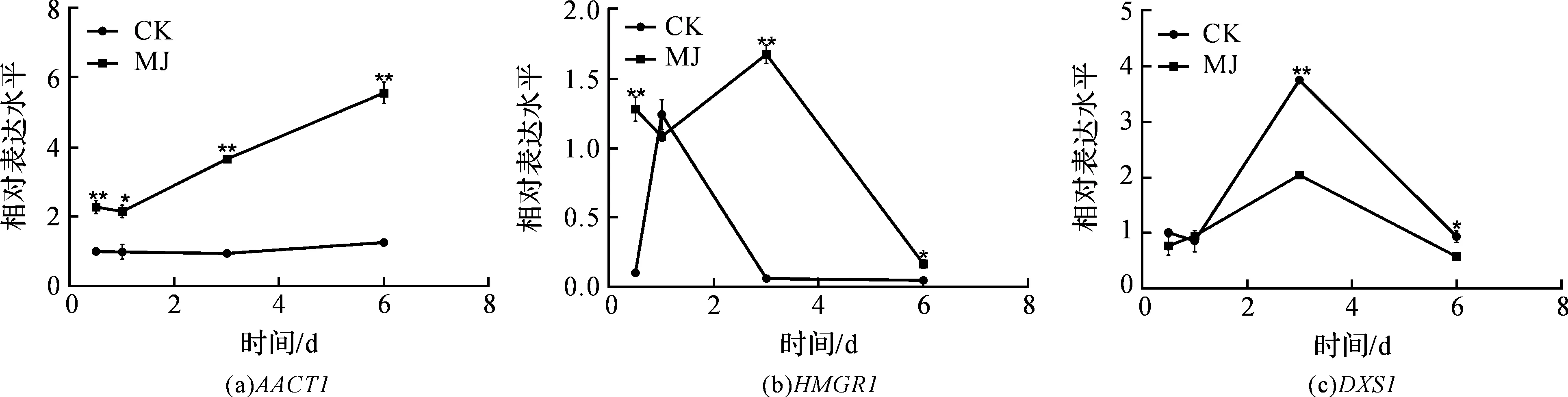
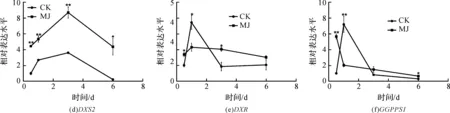
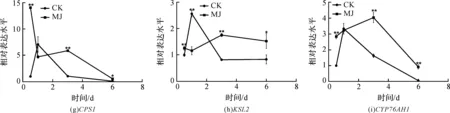
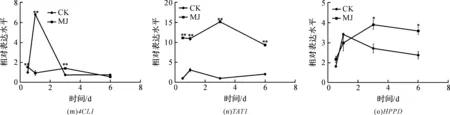
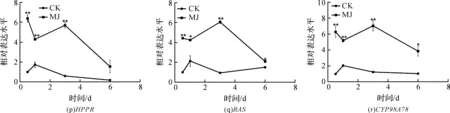
使用GraphPad Prism 5作图,结果以平均值±标准差表示,图中数据为3个生物学重复。使用SPSS软件22.0对数据进行方差分析,0.01 2.1 茉莉酸甲酯对紫花丹参和藏丹参毛状根生长的影响 为了对比茉莉酸甲酯对两种丹参毛状根生长的 影响,对紫花丹参和藏丹参毛状根的生物量(鲜重和干重)进行分析。结果表明:在茉莉酸甲酯诱导后12 h和第3 d,紫花丹参毛状根鲜重受到抑制。紫花丹参毛状根干重在12 h受到抑制,而在第1 d有所促进。然而,茉莉酸甲酯对藏丹参毛状根的生长并无显著影响,如图1所示。 图1 茉莉酸甲酯诱导下两种丹参毛状根的生长注:Sm:紫花丹参,Sc:藏丹参;CK:对照组,MJ:茉莉酸甲酯处理组;“*”表示P<0.05,“**”表示P<0.01。 2.2 茉莉酸甲酯对紫花丹参和藏丹参毛状根中次 生代谢物积累的影响 为了阐明两种丹参毛状根对茉莉酸甲酯的差异代谢响应,本文对4种丹参酮(二氢丹参酮I、隐丹参酮、丹参酮I和丹参酮IIA)和3种丹酚酸(迷迭香酸、咖啡酸和丹酚酸B)的积累变化进行分析,结果如图2所示:茉莉酸甲酯不能诱导两种丹参毛状根中丹参酮I的产生;茉莉酸甲酯在12 h促进紫花丹参毛状根中二氢丹参酮I积累,在第3 d促进藏丹参毛状根中二氢丹参酮I的积累;藏丹参毛状根中隐丹参酮积累在茉莉酸甲酯诱导后第6 d提高(1.93倍),在紫花丹参毛状根中隐丹参酮含量在诱导后第1 d受到抑制;茉莉酸甲酯不能刺激紫花丹参毛状根中丹参酮IIA积累,在诱导后第3 d抑制藏丹参毛状根中丹参酮IIA含量,并在诱导后第6 d促进藏丹参毛状根中丹参酮IIA积累(1.78倍)。藏丹参毛状根中咖啡酸积累在诱导后第6 d显著提高(1.34倍),而紫花丹参毛状根中咖啡酸含量在诱导后第3 d受到促进。茉莉酸甲酯不能诱导紫花丹参毛状根中迷迭香酸的产生,而促进藏丹参毛状根中迷迭香酸积累,其迷迭香酸积累在诱导后第6 d显著提高(2.49倍)。两种丹参毛状根中丹酚酸B的产生均能被茉莉酸甲酯诱导,但茉莉酸甲酯更强烈地诱导藏丹参毛状根中丹酚酸B积累,藏丹参毛状根中丹酚酸B积累在诱导后第6 d显著提高(3.05倍)。茉莉酸甲酯显著促进藏丹参毛状根中二氢丹参酮I、隐丹参酮、丹参酮IIA、咖啡酸、迷迭香酸和丹酚酸B的积累,而仅仅影响紫花丹参毛状根中二氢丹参酮I、隐丹参酮、咖啡酸和丹酚酸B的产生。 2.3 藏丹参和紫花丹参毛状根中关键基因的诱导 表达模式 为了进一步阐明茉莉酸甲酯诱导下两种丹参毛状根的次生代谢差异,对10个二萜化合物生物合成基因和8个酚酸生物合成基因的表达模式进行分析。茉莉酸甲酯处理后两种丹参毛状根中7个二萜化合物生物合成基因和6个酚酸生物合成基因的表达上调,包括AACT1、HMGR1、DXS2、CPS1、KSL2、CYP76AH1、CYP76AH3、PAL1、C4H、TAT1、HPPR、RAS和CYP98A78。茉莉酸甲酯在诱导后6 d内始终上调紫花丹参毛状根中TAT1、HPPR、RAS和CYP98A78的表达,而一直上调藏丹参毛状根中AACT1、C4H、TAT1和CYP98A78的表达。但是,两种丹参毛状根中一些基因的表达模式存在较大差异,这些基因包括DXS1、DXR、GGPPS1、4CL1和HPPD。茉莉酸甲酯在12 h下调紫花丹参毛状根中DXS1的表达,而不能诱导藏丹参毛状根中DXS1表达。在紫花丹参毛状根中茉莉酸甲酯不能诱导DXR表达,而在藏丹参毛状根中茉莉酸甲酯在第3 d上调DXR的表达。茉莉酸甲酯在第6 d下调紫花丹参毛状根中GGPPS1的表达,而在12 h和第1 d分别上调和下调藏丹参毛状根中GGPPS1的表达。茉莉酸甲酯上调紫花丹参毛状根中4CL1的表达,但在第1 d下调藏丹参毛状根中4CL1的表达。茉莉酸甲酯上调紫花丹参毛状根中HPPD的表达,却不能诱导藏丹参毛状根中HPPD的表达(图3-图4)。此外,与紫花丹参毛状根相比,藏丹参毛状根中一些参与特定代谢的基因对茉莉酸甲酯更敏感,包括AACT1、HMGR1、DXS2、GGPPS1、CPS1、CYP76AH3、PAL1、C4H和TAT1,可能导致藏丹参毛状根产生更强烈的隐丹参酮、丹参酮IIA、咖啡酸、迷迭香酸和丹酚酸B代谢响应(图2,图4)。 图2 茉莉酸甲酯诱导下两种丹参毛状根的次生代谢物含量注:DW:干重;Sm:紫花丹参,Sc:藏丹参;CK:对照组,MJ:茉莉酸甲酯处理组;“*”表示P<0.05,“**”表示P<0.01。 图3 紫花丹参毛状根中关键基因的表达模式注:CK:对照组,MJ:茉莉酸甲酯处理组;“*”表示P<0.05,“**”表示P<0.01。 图4 藏丹参毛状根中关键基因的表达模式注:CK:对照组,MJ:茉莉酸甲酯处理组;“*”表示P<0.05,“**”表示P<0.01。 许多生物诱导子可以促进紫花丹参毛状根的生长和丹参酮积累,如内生真菌深绿木霉(TrichodermaatrovirideD16)[10]和密旋链霉菌(StreptomycespactumAct12)[11]。而生物量结果表明茉莉酸甲酯在第1 d促进紫花丹参毛状根的生长,但对藏丹参毛状根的生长没有影响(图1)。诱导子广泛用于刺激药用植物中次生代谢物的产生,并用于鉴定参与特定代谢的候选基因的功能[2,7-8,10]。茉莉酸和茉莉酸甲酯是抵抗各种胁迫的调控因子,在植物中参与生长发育和防御反应等,并且可以在不同植物中提高各种次生代谢物的积累[12-13]。两种丹参毛状根的代谢指标表明,茉莉酸甲酯显著促进藏丹参毛状根中二氢丹参酮I、隐丹参酮、丹参酮IIA、咖啡酸、迷迭香酸和丹酚酸B的积累,而仅仅影响紫花丹参毛状根中二氢丹参酮I、隐丹参酮、咖啡酸和丹酚酸B的产生,暗示茉莉酸甲酯在两种丹参次生代谢的调控中起着不同的作用。除丹酚酸B以外,茉莉酸甲酯不能进一步刺激紫花丹参毛状根中其他几种丹参酮和丹酚酸的积累。之前的研究表明200 μmol/L茉莉酸甲酯促进藏丹参毛状根中隐丹参酮和丹参酮IIA积累[2],而本文的结果与此一致(图2)。茉莉酸甲酯上调紫花丹参毛状根中大多数基因的表达,但与二萜化合物生物合成基因相比,迷迭香酸生物合成基因对茉莉酸甲酯更敏感。茉莉酸甲酯对紫花丹参毛状根中迷迭香酸积累没有影响,而提高丹酚酸B积累。这可能是由于紫花丹参毛状根中HPPD表达的上调阻碍了酪氨酸支路中迷迭香酸合成的代谢流。HPPD催化4-羟基苯丙酮酸生成尿黑酸,和HPPR竞争结合同一底物[14]。因此,HPPD的转录水平影响迷迭香酸生物合成的代谢流(图2-图3)。KSL2参与一种泪柏醚(ent-13-epi-manoyl oxide)生物合成和赤霉素(gibberellin)代谢[15],而茉莉酸甲酯上调两种丹参毛状根中KSL2的表达,表明茉莉酸甲酯可能调控泪柏醚和赤霉素合成。因而,茉莉酸甲酯在两种丹参中可能调控多种二萜化合物和酚酸类化合物的生物合成(图2-图4)。 研究表明,茉莉酸甲酯可以诱导紫花丹参中多个关键基因的表达,这些基因包括丹参酮生物合成基因(AACT1、HMGR、DXS2、GGPPS1、CPS1)[16]和丹酚酸生物合成基因(PAL1、C4H、4CL1、TAT1、HPPR)[17],而本文的结果与此一致。藏丹参毛状根中参与丹参酮和丹酚酸合成的基因比紫花丹参毛状根中相应基因更强烈地响应茉莉酸甲酯诱导,包括AACT1、HMGR1、DXS2、GGPPS1、CPS1、CYP76AH3、PAL1、C4H和TAT1(图3-图4)。茉莉酸甲酯可能通过诱导甲基赤藓醇-4-磷酸和甲羟戊酸两条途径以及丹参酮下游途径中关键基因(AACT1、HMGR1、DXS2、GGPPS1、CPS1、CYP76AH3)的差异上调,从而导致藏丹参产生更敏感的隐丹参酮和丹参酮IIA代谢响应(图2-图4)。此外,茉莉酸甲酯差异上调苯丙氨酸途径中PAL1和C4H的表达,可能导致藏丹参产生更强烈的咖啡酸代谢响应。与紫花丹参相比,藏丹参中更强烈的迷迭香酸和丹酚酸B代谢响应可能是由于苯丙氨酸途径和酪氨酸途径中关键基因(PAL1、C4H、TAT1)的差异上调(图2-图4)。以上结果表明,茉莉酸甲酯在两种丹参次生代谢的调控中扮演着不同角色,导致两者不同的基因表达模式和代谢响应。 本文通过高效液相和荧光定量PCR对比分析了茉莉酸甲酯诱导下藏丹参与紫花丹参毛状根的次生代谢。结果表明:与紫花丹参毛状根相比,茉莉酸甲酯诱导藏丹参毛状根产生更强烈的隐丹参酮、丹参酮IIA、咖啡酸、迷迭香酸和丹酚酸B代谢响应;在两种丹参中,次生代谢相关基因差异响应茉莉酸甲酯诱导,可能导致两者产生不同的丹参酮和丹酚酸代谢响应。 [1] CHENG T O. Cardiovascular effects of Danshen[J]. International Journal of Cardiology,2007,121(1):9-22. [2] LI B, WANG B Q, Li H Y, et al. Establishment ofSalviacastaneaDiels f.tomentosaStib. hairy root cultures and the promotion of tanshinone accumulation and gene expression with Ag+, methyl jasmonate, and yeast extract elicitation[J]. Protoplasma,2016,253(1):87-100. [3] YANG D F, MA P D, LIANG X, et al. Metabolic profiles and cDNA-AFLP analysis ofSalviamiltiorrhizaandSalviacastaneaDiel f.tomentosaStib[J]. Plos One,2012,7(1):e29678. [4] YANG D F, YANG S S, ZHANG Y J, et al. Metabolic profiles of three relatedSalviaspecies[J]. Fitoterapia,2009,80(5):274-278. [5] BONFILL M, MALIK S, MIRJALILI M H, et al. Production and genetic engineering of terpenoids production in plant cell and organ cultures[M]. Natural Products. Berlin Heidelberg: Springer,2013:2761-2796. [6] XING B C, YANG D F, GUO W L, et al. Ag+as a more effective elicitor for production of tanshinones than phenolic acids inSalviamiltiorrhizahairy roots[J]. Molecules,2015,20(1):309-324. [7] ZHAO Q, ZHANG Y, WANG G, et al. A specialized flavone biosynthetic pathway has evolved in the medicinal plant,Scutellariabaicalensis[J]. Science Advances,2016,2(4):e1501780. [8] SHEN Q, LU X, YAN T X, et al. The jasmonate-responsive AaMYC2 transcription factor positively regulates artemisinin biosynthesis inArtemisiaannua[J]. New Phytologist,2016,210(4):1269-1281. [9] YANG D F, SHENG D F, DUAN Q M, et al. PEG and ABA trigger the burst of reactive oxygen species to increase tanshinone production inSalviamiltiorrhizahairy roots[J]. Journal of Plant Growth Regulation,2012,31(4):579-587. [10] MING Q L, SU C Y, ZHENG C J, et al. Elicitors from the endophytic fungusTrichodermaatroviridepromoteSalviamiltiorrhizahairy root growth and tanshinone biosynthesis[J]. Journal of Experimental Botany,2013,64(18):5687-5694. [11] YAN Y, ZHANG S C, YANG D F, et al. Effects ofStreptomycespactumAct12 onSalviamiltiorrhizahairy root growth and tanshinone synthesis and its mechanisms[J]. Applied Biochemistry and Biotechnology,2014,173(4):883-893. [12] LIANG Z S, YANG D F, LIANG X, et al. Roles of reactive oxygen species in methyl jasmonate and nitric oxide-induced tanshinone production inSalviamiltiorrhizahairy roots[J]. Plant Cell Reports,2012,31(5):873-883. [13] SHI M, ZHOU W, ZHANG J, et al. Methyl jasmonate induction of tanshinone biosynthesis inSalviamiltiorrhizahairy roots is mediated by JASMONATE ZIM-DOMAIN repressor proteins[J]. Scientific Reports,2016,6:20919. [14] XIAO Y, DI P, CHEN J F, et al. Characterization and expression profiling of 4-hydroxyphenylpyruvate dioxygenase gene (Smhppd) fromSalviamiltiorrhizahairy root cultures[J]. Molecular Biology Reports,2009,36(7):2019-2029. [15] CUI G H, DUAN L X, JIN B L, et al. Functional divergence of diterpene syntheses in the medicinal plantSalviamiltiorrhiza[J]. Plant Physiology,2015,169(3):1607-1618. [16] KAI G Y, LIAO P, XU H, et al. Molecular mechanism of elicitor-induced tanshinone accumulation inSalviamiltiorrhizahairy root cultures[J]. Acta Physiologiae Plantarum,2012,34(4):1421-1433. [17] ZHANG S C, YAN Y, WANG B Q, et al. Selective responses of enzymes in the two parallel pathways of rosmarinic acid biosynthetic pathway to elicitors inSalviamiltiorrhizahairy root cultures[J]. Journal of Bioscience and Bioengineering,2014,117(5):645-651. (责任编辑: 唐志荣) Diverse Responses to Methyl Jasmonate in Hairy Roots of TwoSalviaSpecies FANG Yumin, YANG Dongfeng, LIANG Zongsuo (a.College of Life Science; b.Key Laboratory of Plant Secondary Metabolism and Regulation of Zhejiang Province, Zhejiang Sci-Tech University, Hangzhou 310018, China) To elucidate diverse responses ofSalviamiltiorrhizaBunge (S.miltiorrhiza) andSalviacastaneaDiels f.tomentosaStib (S.castanea) to signal molecule, methyl jasmonate (MJ) was applied to induce the metabolism of hairy roots thereof, and comparison was made on growth, secondary metabolite accumulation and change, and gene expression pattern therebetween. The results suggest that MJ significantly promotes the accumulation of dihydrotanshinone I (DT-I), cryptotanshinone (CT), tanshinone IIA (T-IIA), caffeic acid (CA), rosmarinic acid (RA), and salvianolic acid B (SAB) inS.castaneahairy roots, while only has impact on the accumulation of DT-I, CT, CA, and SAB inS.miltiorrhizahairy roots; the key genes involved in the biosynthesis of tanshinone and phenolic acid inS.castaneahairy roots respond to the induction of MJ more actively than those inS.miltiorrhizahairy roots do, which could lead to more active responses of CT, T-IIA, CA, RA, and SAB inS.castaneahairy roots. SalviamiltiorrhizaBunge;SalviacastaneaDiels f.tomentosaStib; hairy roots; methyl jasmonate; secondary metabolism; gene expression 10.3969/j.issn.1673-3851.2017.09.018 2017-02-16 网络出版日期: 2017-06-21 国家自然科学基金项目(81673536,81373908,81403033);浙江省自然科学基金项目(LZ16H280001,LQ15H280009) 方誉民(1993-),男,安徽六安人,硕士研究生,主要从事丹参次生代谢方面的研究。 梁宗锁,E-mail:liangzs@ms.iswc.ac.cn Q945.78 A 1673- 3851 (2017) 05- 0712- 082 结果与分析

3 讨 论
4 结 论

