白蛋白纳米t-PA基因涂层支架的研制及其抗血栓作用*
何霞,季军,陈小玲,胡伟
(广东省深圳市孙逸仙心血管医院 1.病理科,2.心内科,广东 深圳 518020)
白蛋白纳米t-PA基因涂层支架的研制及其抗血栓作用*
何霞1,季军1,陈小玲1,胡伟2
(广东省深圳市孙逸仙心血管医院 1.病理科,2.心内科,广东 深圳 518020)
目的制备白蛋白纳米组织型纤溶酶原激活物(t-PA)基因涂层支架,观察其预防实验兔支架内血栓形成和内膜增生的效果。方法用不锈钢支架为龙骨模拟血管基底膜主要成分(透明质酸+Ⅳ型胶原蛋白+层粘连蛋白+纤维连接蛋白),配制涂层液涂于金属支架表面;制备t-PA基因质粒白蛋白纳米粒,并将其连接于涂层表面,制备成白蛋白纳米t-PA基因涂层支架。用球囊导管损伤兔髂动脉内膜制备血管内膜增生模型,将上述涂层支架植入局部血管,并用治疗性超声辅助转染。分别于术前,以及术后1、2和4周取血检测t-PA、D-二聚体含量及凝血酶原时间的变化。体视镜和常规病理观察支架植入血管堵塞及血栓形成情况。形态测量法测量内膜厚度及面积,判断内膜增生。用免疫组织化学法检测血管壁t-PA和增殖细胞核抗原的表达。结果成功制备纳米t-PA基因涂层支架。涂层支架植入血管后可见血管壁高效表达t-PA,减少支架内血栓形成和内膜增生,伴随t-PA及D-二聚体含量的增加,凝血酶原时间无明显变化。结论t-PA基因涂层支架可减少兔支架内血栓形成和内膜增生,而未影响全身凝血。将支架术与基因治疗同步完成,为该纳米基因涂层支架的研制及支架内血栓形成的防治提供实验基础。
基因涂层支架;组织型纤溶酶原激活物;白蛋白纳米粒;血栓形成
经皮冠状动脉成形和支架术是治疗冠状动脉粥样硬化性心脏病急性心肌梗死的主要方法[1]。支架内血栓形成和内膜增生是主要副作用。药物洗脱支架可明显减少内膜增生,但导致靶血管再内皮化延迟,炎症反应增加支架内晚期和超晚期血栓形成,明显延长抗血栓治疗时间[2-4]。组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA)是诱导纤溶激活、促进血栓溶解的重要因子[5]。本实验制备白蛋白纳米t-PA基因涂层支架和兔髂动脉内膜增生模型,观察该支架植入对局部血栓形成和内膜增生的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 动物 新西兰纯种兔30只,雄性,体重2.3~2.5 kg,由南方医科大学动物中心提供。
1.1.2 主要试剂和仪器 pSecTag 2B-t-PA重组质粒由本实验室构建保存,兔抗人t-PA多克隆抗体由深圳晶美生物工程有限公司提供,鼠抗平滑肌肌动蛋白(smooth muscle actin,SMA)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体购自福州迈新生物技术开发有限公司,t-PA酶联免疫分析试剂盒购自上海酶联生物科技有限公司,牛血清白蛋白购自广州翔博生物科技有限公司,透明质酸购自上海萨恩化学技术有限公司,Ⅳ型胶原蛋白和纤维连接蛋白购自美国Sigma-Aldrich有限公司,层粘连蛋白购自美国Gibco公司。超声波发生器系宁波新芝生物科技有限公司产品,超声波治疗仪US-700系日本ITO有限公司产品。
1.2 方法
1.2.1 一步法制备白蛋白纳米t-PA基因 200 mg牛血清白蛋白加入10ml双蒸水溶解,用2μl盐酸调整pH值至5.5。将2 mg纯化pSecTag 2B-t-PA重组质粒,加入上述白蛋白溶液中孵育30 min,在超声场中缓慢滴入20 ml乙醇(乙醇∶水=2∶1),直至溶液出现乳白色并逐滴滴入0.5%戊二醛溶液60 μl,适当搅拌,室温下静置2 h。减压使残余的乙醇挥发后,所得溶液17 000 r/min离心30 min以除去游离的白蛋白和多余的交联剂。双蒸水重悬沉淀,并用超声波(180 W,固定频率 20 kHz,30 s)分散成乳胶状,置于4℃储存备用。取5 ml制备扫描电镜标本,观察纳米粒形态、包封率检测及凝胶阻滞实验。用Zetasizer 3000粒度分析仪测定粒径大小。紫外分光光度计检测并计算纳米质粒DNA的包封率。首先测量加入的总质粒DNA含量,再将纳米包裹基因后的溶液离心并测量上清液中游离质粒DNA。包封率(%)=(W总-W游)/W总×100%(W总为总加入量;W游为上清液中质粒DNA测得量)。
1.2.2 白蛋白纳米t-PA基因涂层支架制备方法①无菌配制血管基底膜涂层液:按每毫升透明质酸各(0.5%)含Ⅳ型胶原蛋白、层粘连蛋白、纤维连接蛋白50、100和50μg配制支架表面涂层液;②常规316 L不锈钢支架网经无菌处理后,置于经超声波震荡处理的血管基底膜涂层液中,室温(25℃)下孵育1 h,将涂层钢网无菌常温风干,4℃保存备用;③将上述涂层支架在直径3 mm的球囊上压模成型;④无菌下将压模成型支架浸于制备的白蛋白纳米t-PA基因液中孵育30 min进行表面连接涂层,经室温晾干后浸于血管基底膜涂层液中孵育30 min。再次用白蛋白纳米t-PA基因交替涂层(见图1)。每个支架用含1 mg质粒的白蛋白纳米液涂层;⑤外表用含5%胎牛血清的培养基(roswell park memorial institute 1640,RPMI 1640)薄层封涂并自然晾干待用。
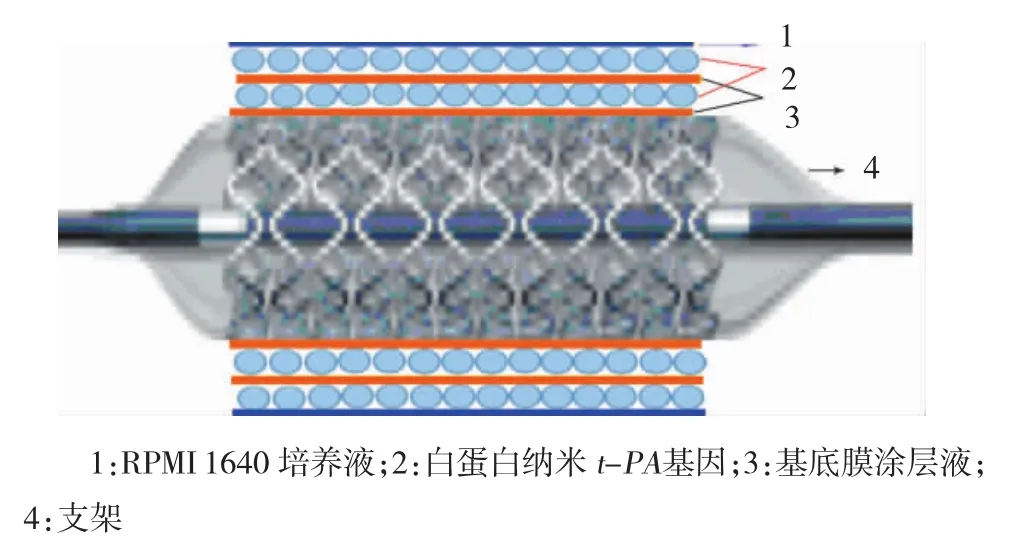
图1 涂层支架模式图
1.2.3 动物模型和支架术 将30只兔随机分成3组:实验组、对照组及阳性对照组,每组10只。实验兔用25 mg/kg戊巴比妥钠经耳缘静脉全身麻醉后,暴露一侧髂外动脉,将直径2.5 mm球囊导管插入至腹主动脉,充气[5~8个大气压(1个大气压=101.325 kPa)]后回拉将髂外动脉内膜剥脱;继续插入直径3mm球囊支架行髂动脉支架术,植入支架为的白蛋白纳米t-PA基因涂层支架,经皮肤表面对应损伤血管和周围大腿内侧肌群局部超声治疗(频率:1 kHz,强度:1.5 w/cm2,时间:10 min);对照组和阳性对照组植入相同材料和规格的裸金属支架。实验组和对照组术后不用抗凝剂,阳性对照组术后给予阿司匹林50 mg/(kg·d),观察4周。各组动物分别于术前,以及术后1、2和4周抽取静脉血检测t-PA和D-二聚体(D-dimer)含量、凝血酶原时间(prothrombin time,PT)及国际标准化比值(international normalized ratio,INR)观察全身凝血状态。
1.2.4 标本复制和检测 实验动物观察期结束后处死,取出髂动脉在大体及体视显微镜下观察动脉腔通畅及支架内血栓形成情况,计算血栓形成率。支架动脉段、血管周围组织及心、肺、肝、肾用多聚甲醛固定,石蜡包埋、切片和病理学检查。应用病理图像分析仪直接测量支架动脉横切面内膜厚度和内膜面积,判断血管内膜增生;采用免疫组织化学法Max VisionTM试剂盒检测动脉壁t-PA的表达;采用抗SMA单抗和抗PCNA单抗免疫组织化学法判断平滑肌细胞(smooth muscle cell,SMC)及其增生,计数 200 个内膜细胞,计算PCNA阳性细胞百分数。取其他重要脏器包括心、肺、肝、肾组织检测t-PA的表达。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用重复测量设计的方差分析;计数资料以率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1t-PA基因白蛋白纳米粒的表征分析
扫描电镜结果显示,白蛋白纳米粒呈球形,大小较均匀且分散良好。Zetasizer 3000粒度分析仪显示,白蛋白纳米粒粒径大小呈正态分布,有效粒径大小为229.0 nm(见图2),包封率平均为81.40%,符合实验要求。凝胶阻滞实验显示,白蛋白纳米粒对t-PA质粒DNA具有保护作用。
2.2 支架血管病理改变和体内t-PA的表达
术后4周所有实验动物健康存活。肉眼及体视显微镜观察各组实验血管,对照组10例血管支架内均可见血栓(见图3),血栓形成率为100%,管壁亦较厚,高低不平。阳性对照组中3例肉眼及体视显微镜可见血栓,血栓形成率为30%。实验组中2例肉眼及体视显微镜可见血栓,其余见管壁光滑,无明显狭窄,血栓形成率为20%。实验组与对照组血栓形成率比较,差异有统计学意义(P<0.05),而与阳性对照组比较,差异无统计学意义(P>0.05)。显微镜下,对照组和阳性对照组血管内膜明显增厚,内膜中增生的细胞呈梭形或不规则形,排列多层且紊乱,细胞间基质堆积较多,可见散在炎症细胞,管腔内可见血栓形成(见图4)。SMA抗体染色显示,增生的细胞多为SMC(见图5);PCNA抗体染色显示,其中较多细胞呈阳性反应。实验组内膜较薄,内膜细胞多为长梭形并与管腔平行(见图6),PCNA阳性细胞较少。3组支架动脉内膜厚度和面积、PCNA阳性细胞计数及血栓形成率比较,差异有统计学意义(P<0.05)(见表1)。实验组与对照组、阳性对照组比较,内膜厚度、面积及PCNA阳性细胞计数降低,可见t-PA纳米基因支架通过减缓内膜SMC增殖,限制血管内膜增生。免疫组织化学法显示,实验组t-PA阳性表达主要分布在增生的血管内膜,在血管中膜亦可见散在和较弱阳性表达(见图7);对照组血管壁t-PA阴性表达。此外,其他组织包括肝脏、心脏、肾脏和肺脏等病理大体及苏木精-伊红(hematoxylin-eosin,HE)染色显微镜下观察未发现明显异常,免疫组织化学法也未发现t-PA阳性表达。
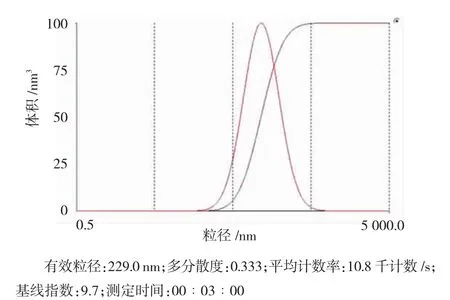
图2 制备的白蛋白纳米粒

图3 对照组血管支架内血栓形成
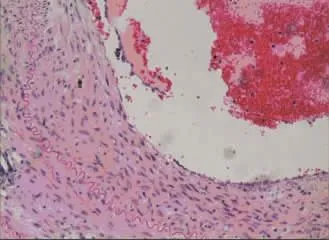
图4 对照组支架血管 (HE×200)
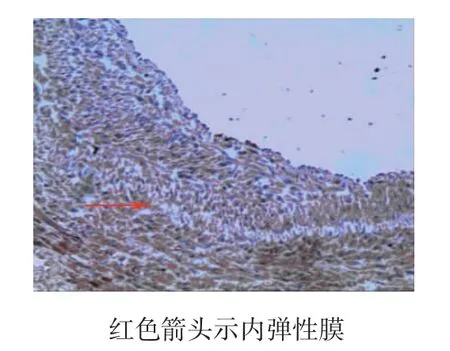
图5 对照组增生的内膜(免疫组织化学法×200)
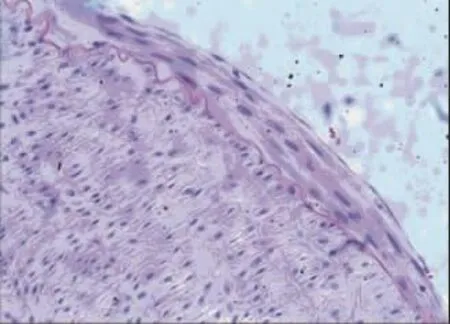
图6 实验组支架血管 (HE×200)
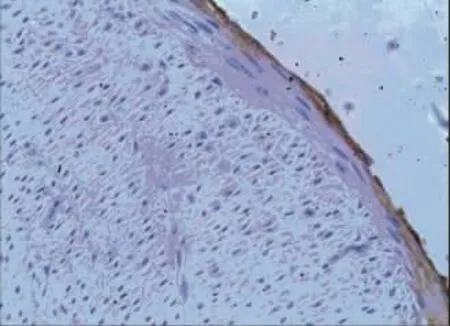
图7 实验组支架血管内膜(免疫组织化学法×200)
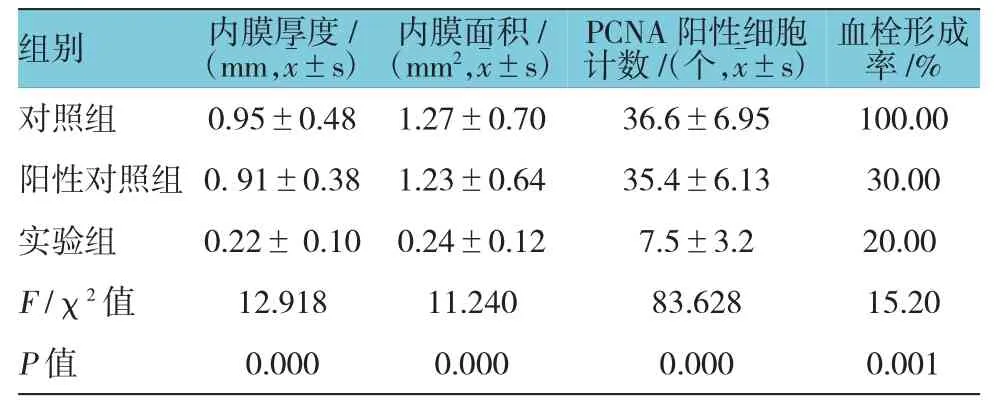
表1 3组支架植入动脉的内膜厚度、面积、内膜PCNA阳性细胞计数及血栓形成率比较 (n=10)
2.3 t-PA、D-dimer含量及PT、INR
2.3.1 t-PA、D-dimer含量 实验组、对照组及阳性对照组支架术前,以及术后1、2和4周t-PA和D-dimer含量比较,采用重复测量设计的方差分析,结果:①不同时间t-PA和D-dimer含量有差异(F=322.450和814.236,均P=0.000)。②3组t-PA和D-dimer含量有差异(F=539.373 和 864.755,均P=0.000);实验组与对照组、阳性对照组比较,术后t-PA和D-dimer含量较高。③3组t-PA和D-dimer含量变化趋势有差异(F=138.507和 452.177,均P=0.000)。与术前比较,实验组于术后1周血t-PA和D-dimer含量增高,并一直持续至第4周观察结束;而对照组和阳性对照组于术后1周血t-PA和D-dimer含量虽有增高,但之后降低并维持在正常水平。见表2和图 8、9。
2.3.2 PT、INR 实验组与对照组、阳性对照组术前,以及术后1周、2周、4周PT值和INR比较,采用重复测量设计的方差分析,结果:①不同时间PT值和INR 无差异(F=0.725和 0.814,P=0.402和 0.375)。②3组PT值和INR无差异(F=0.464和0.461,P=0.634和0.636)。③3组PT值和INR变化趋势无差异(F=0.269和0.243,P=0.766和0.786)。3组PT值和INR于支架术前,以及术后1、2和4周未见显著改变。见表3和图10、11。
表2 3组支架术前后t-PA和D-dimer含量变化(n=10,μg/L,±s)
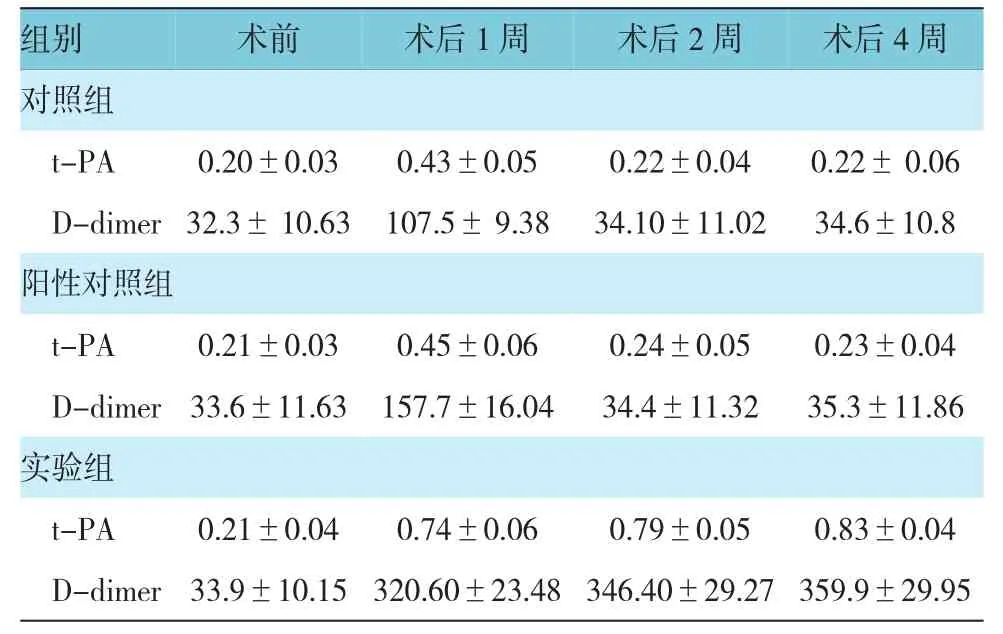
表2 3组支架术前后t-PA和D-dimer含量变化(n=10,μg/L,±s)
组别 术前 术后1周 术后2周 术后4周对照组t-PA 0.20±0.03 0.43±0.05 0.22±0.04 0.22± 0.06 D-dimer 32.3± 10.63 107.5± 9.38 34.10±11.02 34.6±10.8阳性对照组t-PA 0.21±0.03 0.45±0.06 0.24±0.05 0.23±0.04 D-dimer33.6±11.63 157.7±16.04 34.4±11.32 35.3±11.86实验组t-PA 0.21±0.04 0.74±0.06 0.79±0.05 0.83±0.04 D-dimer33.9±10.15 320.60±23.48 346.40±29.27 359.9±29.95
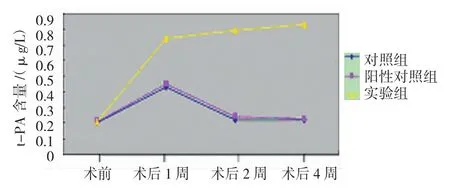
图8 3组不同时间t-PA含量变化趋势

图9 3组不同时间D-dimer含量变化趋势
表3 3组支架术前后PT和INR变化 (n=10,±s)
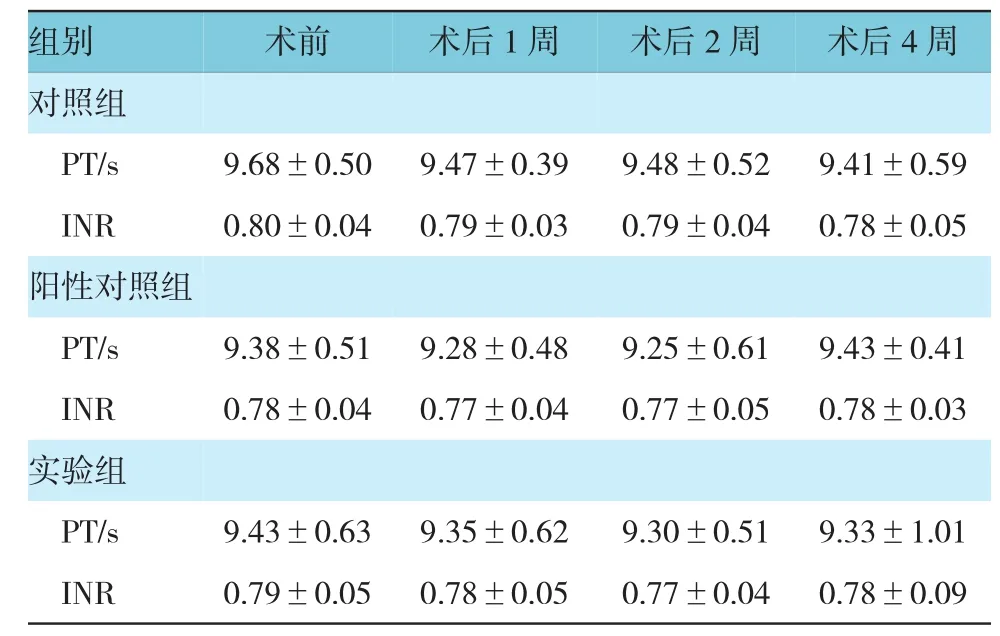
表3 3组支架术前后PT和INR变化 (n=10,±s)
组别 术前 术后1周 术后2周 术后4周对照组PT/s 9.68±0.50 9.47±0.39 9.48±0.52 9.41±0.59 INR 0.80±0.04 0.79±0.03 0.79±0.04 0.78±0.05阳性对照组PT/s 9.38±0.51 9.28±0.48 9.25±0.61 9.43±0.41 INR 0.78±0.04 0.77±0.04 0.77±0.05 0.78±0.03实验组PT/s INR 9.43±0.63 0.79±0.05 9.35±0.62 0.78±0.05 9.30±0.51 0.77±0.04 9.33±1.01 0.78±0.09
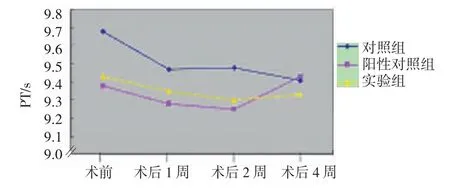
图10 3组不同时间PT变化趋势
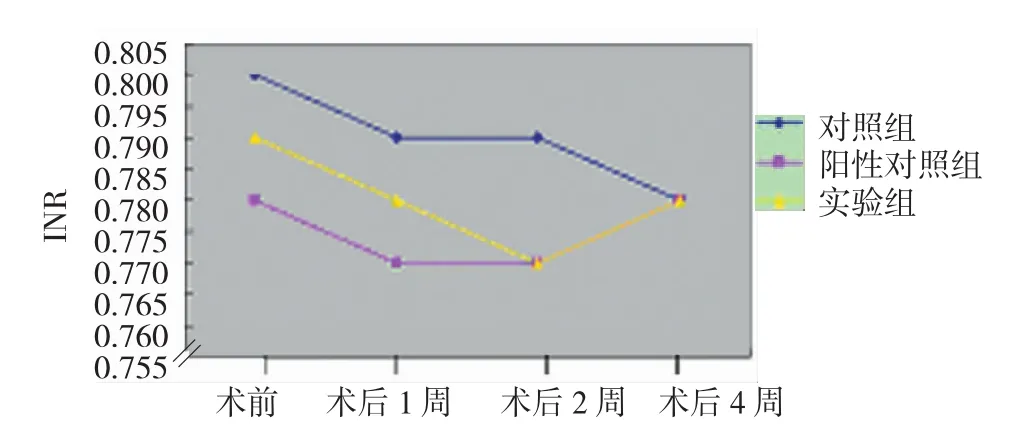
图11 3组不同时间INR变化趋势
3 讨论
冠状动脉粥样硬化性心脏病经皮冠状动脉介入治疗经历3个发展阶段:第一阶段为单纯球囊扩张时代,第二阶段为金属裸支架时代,第三阶段为药物支架时代[6]。单纯球囊扩张会导致血管弹性回缩、负性重塑、血栓形成及内膜增生[7]。金属裸支架克服血管弹性回缩,但由于血管壁损伤、血栓形成,激活的血小板释放促进SMC增殖的各种细胞因子,SMC从收缩表型转化为合成表型进行增殖并从中层向内膜迁移,形成新生内膜[8]。因此,抑制早期血栓形成可能抑制内膜增生。药物洗脱支架虽然减少内膜增生,但是其抗增殖药物在抑制平滑肌细胞增殖的同时,抑制内皮细胞再生导致内皮愈合延迟,增加后期支架内血栓形成的风险,导致抗凝治疗的时间明显延长[9-13]。而长期抗凝治疗会导致出血等并发症,一旦停药可能出现血栓再生。t-PA是一种新型的血栓溶解剂,其是由527个氨基酸构成的丝氨酸蛋白酶,在各种刺激尤其是纤维蛋白的作用下释放入血,与血栓基质有很高的特异性亲和力,可选择性激活血栓中与纤维蛋白结合的纤溶酶原促进纤维蛋白降解。其功能具有血凝块相对特异性,而在没有纤维蛋白时活性相对较低[14]。本实验室曾构建t-PA基因质粒载体,用外科缝线或纳米粒包裹,获得基因的有效转染并成功预防实验性冠状动脉搭桥术吻合口血栓形成和再狭窄及心瓣膜置换术后血栓形成。血管基底膜是维持血管壁结构完整和功能正常的必要保证,对血管起支持、保护作用,并与血管壁细胞相互作用,影响其黏附、增殖、迁移、分化等功能。透明质酸是血管基底膜的一种成分,与细胞和细胞基质高度相容,不仅维持血管壁的完整性,而且抑制血小板黏附,间接抑制平滑肌细胞的迁移并增强血管内皮细胞的增殖和迁移[15]。本实验中,针对上述支架的不足,笔者设计t-PA基因涂层支架,模拟血管基底膜主要成分(透明质酸+Ⅳ型胶原蛋白+层粘连蛋白+纤维连接蛋白),制备涂层液并涂到支架表面,促进支架植入血管的内皮愈合,用白蛋白纳米粒携带t-PA基因质粒,并连接于涂层表面促进基因的转染,从而发挥t-PA的抗凝等功能[16-17]。将t-PA基因涂层支架植入兔髂动脉后4周,与金属裸支架组相比,免疫组织化学法证实支架置入血管壁及周围组织t-PA表达增强,血液t-PA和D-二聚体含量也增高,涂层支架成功地抑制支架术后血栓形成及内膜增生。而血液凝血酶原时间和INR没有明显改变,表明涂在支架表面的基因质粒释放并转染到周围血管壁组织产生的活性t-PA仅仅是激活局部的纤溶系统导致血栓溶解,而未对全身凝血系统产生明显影响。与常规支架术后长期应用抗凝药物相比,t-PA基因涂层支架大大降低出血风险。免疫组织化学法检测在肝脏、心脏、肾脏及肺脏等,均未发现t-PA阳性表达,对该脏器进行病理大体及显微镜下观察均未发现明显异常,表明t-PA涂层支架未对全身脏器造成明显的毒性。
本实验成功制备t-PA基因涂层支架,并证实该支架能够抑制兔早期支架内血栓形成及内膜增生。将支架术与基因治疗同步完成,方便可行,为支架的设计提供一种思路,为支架内血栓形成及内膜增生的防治提供一种新的途径。在以后的实验中,通过优化每个支架所用的t-PA质粒的量,以期达到最佳的转染效果;将动物观察时间延长到6个月甚至1年或许能够更好地了解t-PA基因涂层支架的远期效果;还可以尝试将t-PA质粒涂层到其他材料的支架上进行观察。
[1]BφNAA K H,MANNSVERK J,WISETH R,et al.Drug-eluting or bare-metal stents for coronary artery disease[J].N Engl J Med,2016,375(13):1242-1252.
[2]HUANG C,ZHENG X,MEI H,et al.Rescuing impaired re-endothelialization of drug-eluting stents using the hepatocyte growth factor[J].Ann Vasc Surg,2016,36:273-282.
[3]TAGUCHI I,YONEDA S,ABE S,et al.The late-phase inflammatory response after drug-eluting stent implantation[J].Heart Vessels,2014,29(2):213-219.
[4]LIOU K,JEPSON N.Very late stent thrombosis 11 years after implantation of a drug-eluting stent[J].Tex Heart Inst J,2015,42(5):487-490.
[5]AISINA R,MUKHAMETOVA L,VARFOLOMEYEV S.Synergistic fibrinolysis:the combined effects of tissue plasminogen activa tor and recombinant staphylokinase in vitro[J].Biochim Biophys Acta,2016,1860(4):629-635.
[6]RATHORE S,KAUL U.Percutaneous coronary intervention in small coronary vessels:from balloon angioplasty to drug eluting stent era[J].Indian Heart J,2011,63(3):228-233.
[7]INDOLFI C,TORELLA D,COPPOLA C,et al.Rat carotid artery dilation by PTCA balloon catheter induces neointima formation in presence of IEL rupture[J].Am J Physiol Heart Circ Physiol,2002,283(2):H760-H767.
[8]SCOTT N A.Restenosis following implantation of bare metal coronary stents:pathophysiology and pathways involved in the vascular response to injury[J].Adv Drug Deliv Rev,2006,58(3):358-376.
[9]MIURA K,NAKAYA H,KOBAYASHI Y.Experimental assessment of effects of antiproliferative drugs of drug-eluting stents on endothelial cells[J].Cardiovasc Revasc Med,2015,16(6):344-347.
[10]SEO T,LAFONT A,CHOI S Y,et al.Drug-eluting stent design is a determinant of drug concentration at the endothelial cell surface[J].Ann Biomed Eng,2016,44(2):302-314.
[11]ZHANG J.Stent thrombosis in patients with coronary artery disease treated with biodegradable polymer drug-eluting stents:an update meta-analysis[J].Int Heart J,2014,55(3):213-218.
[12]KALIYADAN A,SIU H,FISCHMAN D L,et al."Very"very late stent thrombosis:acute myocardial infarction from drug-eluting stent thrombosis more than 5 years after implantation[J].J Invasive Cardiol,2014,26(9):413-416.
[13]MAURI L,KEREIAKES D J,YEH R W,et al.Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents[J].N Engl J Med,2014,371(23):2155-2166.
[14]KIM P Y,TIEU L D,STAFFORD A R,et al.A high affinity interaction of plasminogen with fibrin is not essential for efficient activation by tissue-typeplasminogen activator[J].J Biol Chem,2012,287(7):4652-4661.
[15]CHE H L,BAE I H,LIM K S,et al.Suppression of post-angioplasty restenosis with an Akt1 siRNA-embedded coronary stent in a rabbit model[J].Biomaterials,2012,33(33):8548-8556.
[16]WAGH J,PATEL K J,SONI P,et al.Transfecting pDNA to E.coli DH5α using bovine serum albumin nanoparticles as a delivery vehicle[J].Luminescence,2015,30(5):583-591.
[17]YU X,JIN C.Application of albumin-based nanoparticles in the management of cancer[J].J Mater Sci Mater Med,2016,27(1):4.
(童颖丹 编辑)
Preparation of nanoparticle gene-coated stent and its antithrombotic effect*
Xia He1,Jun Ji1,Xiao-ling Chen1,Wei Hu2
(1.Department of Pathology,2.Department of Cardiovascular Internal Medicine,Shenzhen Sun Yat-sen Cardiovascular Hospital,Shenzhen,Guangdong 518020,China)
s:ObjectiveTo prepare albumin nanoparticle tissue-type plasminogen activator (t-PA)genecoated stent and observe its effect on prevention of in-stent thrombosis and intimal hyperplasia in rabbits.MethodsStainlesssteel stentwascoated with thecoatingliquid which wasprepared from themain components of vascular basement membrane (hyaluronic acid+typeⅣcollagen+laminin+fibronectin).To prepare albumin nanoparticlet-PAgene-coated stent,thet-PAgene plasmid was packaged by albumin nanoparticles and then connected to the coating surface.A rabbit iliac artery intimal hyperplasia model was constructed with balloon catheter.The nanoparticlet-PAgene-coated stent was implanted into the iliac artery andt-PAgene was transfected with the aid of therapeutic ultrasound.The blood levels of prothrombin time,t-PA and D-dimer were measured before and 1,2 and 4 weeks after operation.The vascular obstruction and in-stent thrombosis after stent implantation were observed by stereoscope and routine pathological examination.Morphometry wasused to measure intimalthicknessand area to determine intimalhyperplasia.The expressions of t-PA and proliferating cell nuclear antigen (PCNA)were detected by immunohistochemistry.ResultsThet-PAgene-coated stent was successfully prepared.The expression of t-PA protein in theimplanted arteries was observed,accompanied by an increase in blood t-PA and D-dimer.There was no significant change in prothrombin time after implantation of the gene-coated stent.In-stent thrombosis and intimal hyperplasia were successfully suppressed.ConclusionsThet-PAgene-coated stent can successfully inhibit in-stent thrombosis and intimal hyperplasia without affecting systemic coagulation of the rabbit.The complete synchronization of stenting and gene therapy provides the experimental basis for the development of nano-gene-coated stent and prevention of in-stent thrombosis.
gene-coated stent;tissue-type plasminogen activator;albumin nanoparticle;thrombosis
R543;R654.2
A
10.3969/j.issn.1005-8982.2017.17.003
1005-8982(2017)17-0013-06
2016-11-10
广东省医学科研基金(No:A2015529)
季军,E-mail:jijun3@126.com

