MicroRNA-224靶向CNNM1抑制前列腺癌血管生成的实验研究*
黄亚强,黄红星,麦智鹏,黎卫,郑轶群,袁润强
(中山大学附属中山医院 泌尿外科,广东 中山 528403)
MicroRNA-224靶向CNNM1抑制前列腺癌血管生成的实验研究*
黄亚强,黄红星,麦智鹏,黎卫,郑轶群,袁润强
(中山大学附属中山医院 泌尿外科,广东 中山 528403)
目的研究microRNA-224(miR-224)对前列腺癌生化复发及血管生成的影响。方法生物信息学分析及荧光素酶报告实验预测细胞周期调节蛋白1(CNNM1)受miR-224负性调控。Taylor前列腺癌数据库分析、验证CNNM1、miR-224的表达关系及其与前列腺癌生化复发的相关性。前列腺癌PC3细胞体外培养及动物体内成瘤实验研究CNNM1、miR-224表达对前列腺癌微血管生成标志物CD31的影响。结果CNNM1表达受miR-224靶向调节,前列腺癌组织中CNNM1与miR-224的表达呈负相关(P<0.05)。miR-224与前列腺癌的生化复发呈负相关(P<0.05),CNNM1与前列腺的生化复发呈正相关(P<0.05);在过表达miR-224的PC3细胞株内,CNNM1和CD31的表达量下降;CNNM1过表达能促进CD31的生成。前列腺癌细胞裸鼠体内成瘤组织免疫组织化学法染色提示,miR-224过表达能抑制前列腺癌组织内微血管形成。结论miR-224通过靶向调控CNNM1表达,抑制前列腺癌微血管形成,控制前列腺癌生化复发。
前列腺癌;microRNA-224;细胞周期调节蛋白1;生化复发;血管生成
血管生成为肿瘤提供营养物质,是肿瘤侵袭、转移的关键环节。抗血管生成疗法为肿瘤治疗,特别是晚期恶性肿瘤的治疗提供一种有效的方法[1]。MicroRNA(miRNAs)的主要生物学功能是通过抑制翻译起始和/或降解信使RNA的途径,来调控编码基因的表达而实现[2]。研究发现,microRNA-224(miR-224)过表达能抑制前列腺癌细胞的增殖、侵袭及迁移,并促进细胞凋亡,起抑癌基因作用[3]。本研究旨在探索miR-224调节细胞周期调节蛋白1(cyclin and CBS domain divalent metal cation transport mediator 1,CNNM1)抑制前列腺癌微血管形成的机制。
1 材料与方法
1.1 一般材料
PC3细胞(美国ATCC公司),改良伊格尔培养基(dulbecco's modified eagle medium,DMEM)(北京塞默飞世尔生物),胎牛血清(fetal calf serum,FBS)(浙江天杭生物科技),过表达miRNA-224质粒/过表达CNNM1质粒(长沙赢润生物技术有限公司,haslet-7e),裸鼠(北京维通利华实验动物技术有限公司),双荧光报告分析系统(美国Promega公司),免疫组织化学法试剂盒PK-6100(美国Vector公司),Western blot试剂盒(北京鼎国昌盛生物技术有限责任公司),CNNM1、CD31抗体购自美国Abcam公司。
1.2 Taylor数据库筛选及靶基因预测
Taylor数据库是一个公用的数据平台,其中包含139例原发性前列腺癌组织的miRNAs、mRNA表达谱及临床相关数据[4]。在SPSS 17中采用Pearson相关性分析筛选Taylor数据库中与miR-224呈负相关的基因(r<-0.32,P<0.05),再用 miRNAs靶基因预测软件 Targetscan、PicTar、miRanda及 miRwalk 共同对miR-224下游靶基因进行预测,选4个预测软件共有的交集靶基因进一步研究。
1.3 过表达miR-224的PC3细胞构建及细胞保存、培养
用has-let-7e包装质粒混合液转染miR-224/miR-NC到293TN细胞株,3 d后根据包装的说明书用Lenti-Concentin病毒沉淀溶液(LV810A-1,美国SBI公司)提取收集病毒颗粒。然后用Trans Dux病毒转染试剂(LV850A-1,美国SBI公司)转染PC3细胞株。流式细胞仪分选miR-224过表达及空白对照细胞株并经逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)和 Western blot检测验证。用10%二甲基亚砜+90%FBS悬浮PC3细胞,冷冻保存于液氮中。使用时,取出冷冻的PC3细胞,置于37℃温水中致其融化,1000r/min离心5min,弃上清液,10%FBS的DMEM培养基重悬细胞,在5%CO2培养箱内培养,使其成对数生长时进行实验。
1.4 双荧光素酶报告基因实验
含有miR-224结合靶位点的野生型和突变型序列的CNNM1 3’UTR分别克隆到psi-CHECK2荧光素酶报告载体,3’UTR序列载体分别与miR-224模拟物(miR-224)或对照序列(miR-NC)共转染到PC3细胞株中,双荧光素酶报告基因实验测定PC3细胞荧光素酶的活性以判断miR-224对CNNM1 3’UTR的潜在结合位点的作用。
1.5 Western blot检测
提取PC3细胞蛋白,灌胶上样蛋白20μg/孔,浓缩胶电泳条件为80 V、30 min,分离胶电泳条件为90 V、90 min,转膜条件为 120 V、90 min。一抗 4℃过夜,二抗孵育2 h。选择合适的曝光底片,将底片进行高清扫描,通过Image J软件进行灰度值的分析。
1.6 裸鼠成瘤实验及免疫组织化学法染色
取过表达miR-224和对照组PC3细胞,分别注射到同裸鼠背部左右对称部位的皮下,接种细胞数5×106个/侧,共接种4只裸鼠。每4天测量1次肿瘤长度和宽度,并计算肿瘤体积(mm3)=宽2(mm2)×长(mm)/2。接种后第32天处死裸鼠获取移植瘤组织,绘制肿瘤生长曲线图。
裸鼠成瘤组织进行石蜡切片,常规脱蜡、抗原修复及内源性过氧化物酶灭活,加一抗4℃孵育过夜。次日依次加入生物素化二抗、二氨基联苯氨避光显色、苏木素复染、梯度乙醇脱水及二甲苯透明,中性树胶封片。染色结果判断:显微镜下随机选取10个视野,以微血管着色为基准,无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;400倍显微镜下无微血管染色为0分,1~5条微血管着色为1分,6~10条微血管着色为2分,>10条微血管着色为3分。2项结果相乘为染色总评分。
1.7 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验或重复测量设计的方差分析,两两比较用SNK-q检验;相关性分析用Pearson法,生存率的比较用Log-rank χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 前列腺癌组织miR-224、CNNM1表达与疾病生化复发的相关性
从Talyor数据库得到139例前列腺癌根治术患者的资料,其中133例患者有miR-224表达数据,采用Kaplan-Meier法分析miR-224、CNNM1与前列腺癌生化复发的相关性。miR-224高表达组的无生化复发生存率与低表达组比较,经Log-rank χ2检验,差异有统计学意义(χ2=5.593,P=0.018),高表达组的无生化复发生存率高于低表达组。CNNM1高表达组的无生化复发生存率与低表达组比较,差异有统计学意义(χ2=4.528,P=0.033),高表达组低于低表达组。见图1。
2.2 miR-224的下游靶基因CNNM1
Pearson相关性分析提示,Taylor数据库中与miR-224呈负相关的基因共39个,再经软件Targetscan、Pic Tar、miRanda及 miRwalk共同对 miR-224下游靶基因进行预测,结果显示,CNNM1为miR-224的下游靶基因(r=-0.378,P=0.010)。双荧光素酶报告实验结果显示,miR-224过表达对CNNM1野生型和突变型3’UTR序列的荧光载体活性影响比较,差异有统计学意义(F=12.926,P=0.007)。与对照组比较,miR-224过表达降低CNNM1野生型3’UTR区的荧光载体活性,而对CNNM1突变型3’UTR区的荧光载体活性无影响;在miR-224过表达的细胞中,与CNNM1突变型 3’UTR区相比,miR-224降低CNNM1野生型3’UTR区的荧光载体活性,表明miR-244能与CNNM1基因的3’UTR区特异性结合,影响CNNM1基因的表达。见图2。

图1 Kaplan-Meier生存曲线分析
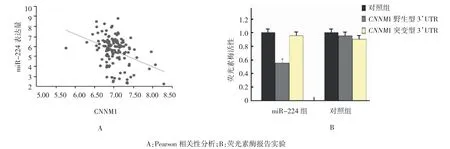
图2 miR-224与CNNM1的相关性及调控关系
2.3 miR-224通过CNNM1抑制前列腺癌细胞CD31的表达
前列腺癌PC3细胞株转染miR-224,经复苏、培养,提取细胞miRNA。经RT-PCR验证miR-224过表达成功,提取细胞蛋白用Western-blot检测CNNM1和CD31蛋白表达情况。结果提示,miR-224过表达与对照组的CNNM1表达比较,差异有统计学意义(t=4.905,P=0.008);miR-224 过表 达与对 照组CD31表达比较,差异有统计学意义(t=4.658,P=0.009)。miR-224过表达的PC3细胞CNNM1和CD31表达量较对照组减少。见图3。
为进一步明确前列腺癌细胞中CD31与CNNM1表达的关系,构建过表达CNNM1的PC3细胞,并经PCR验证,提取细胞蛋白检测CD31的变化,结果提示CNNM1表达增加能促进CD31的表达(t=3.303,P=0.030)。见图 4。
2.4 miR-224抑制前列腺癌生长及肿瘤微血管形成
将miR-224过表达和对照组PC3细胞株注射到裸鼠皮下,复制异体移植瘤模型。miR-224组与对照组细胞注射到皮下 8、12、16、20、24、28 和 32 d 后,测量移植瘤的体积,采用重复测量数据的方差分析,结果:①不同生长时间点的移植瘤体积比较,差异有统计学意义(F=14.302,P=0.003);②miR-224 组与对照组在相同生长时间的移植瘤体积比较,差异有统计学意义(F=12.620,P=0.004),miR-224组与对照组比较,在相同生长时间下其移植瘤的体积较小,miR-224能抑制肿瘤的生长;③miR-224组与对照组的移植瘤生长的变化趋势比较,差异有统计学意义(F=26.347,P=0.002)。见附表和图 5。

图3 miR-224对CNNM1和CD31表达的影响

图4 CNNM1对CD31表达的影响
附表 两组不同时间的肿瘤生长情况 (n=4,cm3,±s)

附表 两组不同时间的肿瘤生长情况 (n=4,cm3,±s)
组别 8 d 12 d 16 d 20 d 24 d 28 d 32 d miR-224 组 0.06±0.01 0.11±0.03 0.18±0.07 0.23±0.07 0.33±0.07 0.38±0.10 0.42±0.16对照组 0.12±0.02 0.21±0.06 0.31±0.07 0.46±0.07 0.54±0.09 0.63±0.12 0.76±0.19

图5 PC3细胞裸鼠皮下移植瘤模型生长曲线图
将裸鼠肿瘤组织石蜡切片,用CD31抗体进行免疫组织化学法染色以评估微血管的形成,结果提示,对照组肿瘤组织内微血管数量为(5.65±1.36)条,过表达miR-224肿瘤组织内微血管数量为(3.42±1.15)条,两者比较,差异有统计学意义(t=3.067,P=0.012),过表达miR-224肿瘤组织内微血管数量减少。见图6。

图6 miR-224对前列腺癌细胞体内成瘤标本血管形成的影响
3 讨论
miRNAs对基因的调节方式复杂,1个microRNA能调节不同的基因,不同的microRNA能调节同个基因,这样复杂的网络构成microRNAs对基因功能的精确调节。miR-224与肿瘤的关系存在肿瘤异质性,即miR-224在不同的肿瘤中发挥不同的作用。有报道称,miR-224在肝癌中高表达,能促进肝癌细胞的增殖、迁徙及侵袭,另外在乳腺癌、结肠癌中也有类似作用[5-7]。在前列腺癌中,miR-224通过靶向负性调控CAMKK2,抑制前列腺癌细胞侵袭及增殖[8]。
本研究首先通过Taylor前列腺癌数据库筛选,发现miR-224、CNNM1与前列腺癌的生化复发相关。再通过多种软件共同预测提示,CNNM1是miR-224所调控的潜在下游靶基因,进一步分析发现CNNM1与miR-224呈负相关,miR-224降低携带CNNM1野生型3’UTR序列的荧光报告载体的活性,这符合miRNAs对下游基因的调节机制。CNNM1作为一种细胞周期调节蛋白,与人类肿瘤的关系尚不明确。有研究报道,在小鼠精原细胞中,CNNM1与肿瘤细胞分化有关,低表达的CNNM1能促发精原细胞的恶性分化[9]。FURUTA等[10]研究认为,CNNM1启动子的甲基化与人类恶性黑色素瘤的形成有关。本实验结果提示,在前列腺癌细胞株PC3中,miR-224过表达能使CNNM1和CD31表达下调,CNNM1过表达能促进CD31的生成。裸鼠成瘤免疫组织化学法染色进一步证实,过表达miR-224能抑制肿瘤组织内微血管数量形成。CD31又称为血小板-内皮细胞黏附分子,主要用于证明内皮细胞组织的存在,是常用于评估肿瘤新生血管形成的标志物,CD31表达升高意味着肿瘤微血管生成增加[11]。微血管的形成能促进肿瘤细胞的局部迁徙和远处转移[12]。因此笔者推测,在前列腺癌中,miR-224与生化复发呈负相关可能与miR-224抑制前列腺癌微血管生成有关。
上世纪70年代,FOLKMAN[13]首次提出,肿瘤生长依赖于新血管生成,并逐渐使该领域成为肿瘤研究的热点。新生血管使肿瘤能够获得足够的营养物质,是促成肿瘤从无血管的缓慢生长阶段转变为有血管的快速增殖阶段的关键;抗血管治疗有望阻断肿瘤血管的生成,从而最终达到抑制肿瘤生长及转移的作用[14]。由于miRNAs功能的多样性,人们对miRNAs在肿瘤血管生成方面的作用也进行广泛研究,发现miR-494可以促进非小细胞肺癌的血管生成,miR-21可以通过蛋白激B/缺氧诱导因子1a/血管内皮生长因子通路,诱导前列腺癌新生血管形成[15-16]。可见miRNAs本身就是重要的肿瘤抗血管治疗靶标。本研究结果提示,miR-224靶向CNNM1,抑制前列腺癌生化复发及微血管生成,为研究miRNAs与前列腺癌血管生成的关系提供更多理论依据。
综上所述,本研究首次提出,miR-224靶向调控前列腺癌细胞CNNM1的表达,抑制肿瘤微血管的形成,减少前列腺癌生化复发。对miR-224-CNNM1轴的进一步研究能更深入了解前列腺癌进展的分子机制,并使miR-224成为前列腺癌治疗的潜在靶标。
[1]吴培培,邢力刚.肿瘤抗血管生成靶向药物耐药机制研究进展[J].中华肿瘤防治杂志,2012,20(19):1593-1596.
[2]FARH K K,GRIMSON A,JAN C,et al.The widespread impact of mammalian microRNAs on mRNA repression and evolution[J].Science,2005,310(5755):1817-1821.
[3]韩兆冬,林卓远,梁应科,等.微小RNA-224靶向Tribbles同源蛋白1调控前列腺癌细胞DU145的迁移和侵袭[J].中华实验外科杂志,2015,12(32):2939-2942.
[4]TAYLOR B S,SCHULTZ N,HIERONYMUS H,et al.Integrative genomic profiling of human prostate cancer[J].Cancer Cell,2010,18(1):11-22.
[5]LIN L,LU B,YU J,et al.Serum miR-224 as a biomarker for detection of hepatocellular carcinoma at early stage[J].Clin Res Hepatol Gastroenterol,2016,40(4):397-404.
[6]LIU F,LIU Y,SHEN J,et al.MicroRNA-224 inhibits proliferation and migration of breast cancer cells by down-regulating fizzled 5 expression[J].Oncotarget,2016,7(31):49130-49142.
[7]ZHU Y,XU A,LI J,et al.Fecal miR-29a and miR-224 as the noninvasive biomarkers for colorectal cancer[J].Cancer Biomark,2016,16(2):259-264.
[8]FU H,HE H C,HAN Z D,et al.MicroRNA-224 and its target CAMKK2 synergistically influence tumor progression and patient prognosis in prostate cancer[J].Tumour Biol,2015,36(3):1983-1991.
[9]CHANDRAN U,INDU S,KUMAR A T,et al.Expression of cnnm1 and its association with stemness,cell cycle,and differentiation in spermatogenic cells in mouse testis[J].Biol Reprod,2016,95(1):7.
[10]FURUTA J,NOBEYAMA Y,UMEBAYASHI Y,et al.Silencing of peroxiredoxin 2 and aberrant methylation of 33 CpG islands in putative promoter regions in human malignant melanomas[J].Cancer Res,2006,66(12):6080-6086.
[11]LERTKIATMONGKOL P,LIAO D,MEI H,et al.Endothelial functions of platelet/endothelial cell adhesion molecule-1(CD31)[J].Curr Opin Hematol,2016,23(3):253-259.
[12]李海民,赵爱志,窦科峰,等.肝癌生长、转移中的微血管生成机制[J].第四军医大学学报,2002(6):559-562.
[13]FOLKMAN J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[14]WEIS S M,CHERESH D A.Tumor angiogenesis:molecular pathways and therapeutic targets[J].Nat Med,2011,17(11):1359-1370.
[15]MAO G,LIU Y,FANG X,et al.Tumor-derived microRNA-494 promotes angiogenesis in non-small cell lung cancer[J].Angiogenesis,2015,18(3):373-382.
[16]LIU L Z,LI C,CHEN Q,et al.MiR-21 induced angiogenesis through AKT and ERK activation and HIF-1α expression[J].PLoS One,2011,6(4):DOI:10.1371/journal.pone.0019139.
(童颖丹 编辑)
miR-224 inhibits angiogenesis of prostate cancer by targeting cyclin protein M1*
Ya-qiang Huang,Hong-xing Huang,Zhi-peng Mai,Wei Li,Yi-qun Zheng,Run-qiang Yuan
(Department of Urology,Zhongshan Hospital of Sun Yat-sen University,Zhongshan,Guangdong 528403,China)
ObjectiveTo investigate the impacts of miR-224 on biochemical recurrence and angiogenesis of prostate cancer.MethodsBioinformatics analysis and luciferase reporter assay were performed to predict the gene that can be directly inhibited by miR-224.Taylor database was used for confirming the expressions of CNNM1 and miR-224,and their correlations with biochemical recurrence of prostate cancer.Finally,the impacts of CNNM1 and miR-224 on angiogenesis of prostate cancer were explored by PC3 cellin vitroandin vivo.ResultsCNNM1 was directly regulated by miR-224,and their expression levels were negatively correlated in prostate cancer tissue(r=-0.378,P<0.05).miR-224 was negatively correlated to,while CNNM1 was positively correlated to biochemical recurrence of prostate cancer (P<0.05).The expressions of CNNM1 and CD31 decreased in the PC3 cells overexpressing miR-224 (P<0.05).However,CNNM1 enhanced the expression level of CD31 (P<0.05).The immunochemical staining of the transplantation tumor in the nude mice displayed that miR-224 overexpression could suppress angiogenesis in the prostate cancer tissue.ConclusionsmiR-224 suppresses angiogenesis and biochemical recurrence of prostate cancer by targeting CNNM1.
prostate cancer;miR-224;CNNM1;biochemical recurrence;angiogenesis
R737.25
A
10.3969/j.issn.1005-8982.2017.17.004
1005-8982(2017)17-0019-06
2017-02-06
中国博士后科学基金(No:2016M590842);广东省医学科研基金(No:A2016052);广东省中山市科技计划(No:2016B1028)
黄红星,E-mail:hhxzs@21cn.com

