紫杉醇:具有里程碑意义的天然抗癌药物*
刘先芳,梁敬钰,孙建博
紫杉醇:具有里程碑意义的天然抗癌药物*
刘先芳,梁敬钰,孙建博**
(中国药科大学中药学院南京210009)
紫杉醇是从红豆杉树皮中分离得到的微量单体成分,作为世界上最优秀的植物抗癌药,紫杉醇及其衍生物是临床上常用的广谱抗癌药。自20世纪70年代发现紫杉醇后,科学家对此类化合物的构效关系、结构修饰、药理药效方面开展了大量研究,并开发出泰素、多西他赛、卡巴他赛、拉洛他赛、信立他赛、康莫他赛等抗癌药。直到40年后的今天,科学家对紫杉醇的研究依然活跃,对其生物合成、真菌培养、新剂型开发等方面也成为新的研究方向。作为源于天然的单体成分开发成新药的成功典范,紫杉醇类化合物的研发历程对当前开发天然新药提供有益的借鉴。本文对紫杉醇的研发及最新进展进行综述,回顾其开发历程及相关研究,以期为天然药物的开发带来新的思考。
紫杉醇天然活性成分广谱抗癌药研发历程研究进展
据世界卫生组织(WHO)关于癌症的实况报道,癌症已成为全球第二大死因,2012年约有1400万新发癌症病例[1],2015年导致880万人死亡,预计今后20年新发病例数将增加70%***。现今,约有60%的抗癌制剂源自天然产品,超过30种源于自然产物的化合物被用于各种不同阶段癌症的临床治疗研究[2]。紫杉醇(Taxol)类化合物是已有的最优秀的高效低毒广谱抗癌药之一,是第一种在临床试验中被认可,并通过化疗手段治疗多种肿瘤疾病的紫杉烷类化合物,被称为“晚期癌症的最后一道防线”。其在肺癌、前列腺癌、脑癌、宫颈癌、胸部肿瘤、颈部肿瘤和艾滋病相关的卡波西肉瘤的治疗中显示出了极高的药效[3],现已被WHO列为基本药物。紫杉醇类药物的成功开发是天然来源药物的开发典范,其新颖的结构、独特的抗癌机制对新的抗癌药物的研究有深远的启发。本文通过回顾紫杉醇类药物的研发过程,以期为新的天然单体成分的新药研究开发提供启示。
1 紫杉醇类药物研发历程
紫杉醇类药物的研发要追溯到1865年,德国科学家Lucas H开始对欧洲浆果红豆杉Taxusbaccata Linn进行化学成分研究,并从其叶片中分离得到粉末状碱性成分Taxine[4]。此后由于技术原因,科学家对于紫杉醇的研究并没有实质性的进展。1955年,美国国立癌症研究中心(National Cancer Institute,NCI)创办了癌症化疗全国服务中心(Cancer Chemotherapy National Service Center,CCNSC)。1960年,NCI与美国农业部(United States Department of Agriculture,USDA)联合启动了在植物和动物中筛选抗癌药物的项目。1964年,负责部分项目的Monroe E.Wall博士和MansukhWani博士发现太平洋红豆杉树皮提取物具有明显的肝细胞毒性,随后Monroe E.Wall博士及其同事在活性指导下从中分离得到具有抗肿瘤活性的单体化合物紫杉醇(paclitaxel),并于1971年运用核磁共振技术和单晶X射线衍射技术确定其化学结构[5](图1)。随后,科学家对红豆杉属植物中的其他成分进行了大量的分离提取工作,共发现了100多种的紫杉烷类化合物,为以后的活性研究和结构修饰等研究提供了物质基础。1979年美国耶什华大学爱因斯坦医学院的分子药理学家Susan B.Horwitz博士等研究紫杉醇的药理作用及机制,发现其能通过稳定微管阻滞癌细胞分裂从而抑制癌细胞增殖,尤其对黑色素瘤细胞和卵巢癌细胞的增殖抑制作用显著[6,7],这对于当时具有抗药性或现有药物治疗无效的患者无疑是一个令人充满希望的发现。1987-1999年,在NCI资助下,约翰霍普金斯大学的Ross C.Donehower博士及William P.McGuire博士等开始对紫杉醇进行治疗卵巢癌的临床试验,紫杉醇于1992年被FDA批准用于卵巢癌临床治疗药,于1994年被批准用于乳腺癌治疗[8]。1985年,欧洲研究学者L Mangatal等[9]半合成多西紫杉醇,发现其活性良好,并于1995年首次上市,1998年进入欧洲和美国市场,成为第二代紫杉烷类抗癌药。到2000年,紫杉醇成为有史以来最为畅销的抗癌药,当年销售额高达16亿美元,时至今日,仍然是最好的用于治疗癌症的天然药物之一。
2 紫杉醇类化合物的抗癌机制及临床应用
2.1 紫杉醇类化合物的抗癌机制
微管和微管蛋白在维持正常细胞形态、有丝分裂过程中染色体的移动等方面具有重要地位。紫杉醇是首个被发现作用于真核细胞微管和微管系统而发挥抗肿瘤作用的药物[10]。其独特的空间结构可以特异性的与β-微管蛋白结合,促微管蛋白装配成微管并使之稳定,从而抑制细胞中诸如运动和分泌等依赖微管蛋白的过程,阻断细胞的有丝分裂,使之停止于G2晚期和M期。多烯紫杉醇与紫杉醇的机制类似,不同点在于多烯紫杉醇把癌细胞阻滞在S期[11]。紫杉类药物可以在缺少鸟苷三磷酸(GTP)与微管相关蛋白(MAP)的条件下诱导形成无功能的微管,对DNA、RNA、蛋白的合成没有干扰,所以对正常细胞的有丝分裂和分化影响较少,副作用较少[12]。此外,紫杉醇在不同细胞中还会通过促进不同细胞凋亡机制发挥抗肿瘤作用,现有研究发现其涉及的凋亡途径[12]有诱导C-Mos原癌基因的表达及活化、促Bcl-2(抗凋亡蛋白)磷酸化激活Raf-1、促进促凋亡蛋白Caspases-3的表达等凋亡途径。紫杉醇还可通过激发巨噬细胞释放白介素及干扰素[13]并抑制一氧化氮合酶表达[13]从而调控免疫机制杀伤细胞,当其与γ-干扰素合用时,对激活巨噬细胞溶解肿瘤有增强作用。并且紫杉醇可以消除肿瘤局部调节性T细胞的产生,暴露肿瘤细胞抗原,产生肿瘤特异性免疫应答[14]。多西紫杉醇还可通过上调Beclin基因诱导前列腺癌PC-3细胞自噬。最近研究发现,紫杉醇可以通过调节FAK信号通路抑制肝癌细胞的迁移[15]。总之,紫杉醇的作用机制十分复杂,主要是通过微管聚集、免疫调节、诱导细胞凋亡以及抑制癌细胞转移4种机制完成。不同的癌细胞涉及的机制略有不同,尚未完全阐明,有待进一步研究。
2.2 紫杉醇类化合物的临床应用
目前临床使用的紫杉醇类化合物主要有美国BMS公司生产的紫杉醇(Taxol®,泰素)、法国Rhone-Poulenc Rorer公司开发的多烯紫杉醇(Docetaxel®,多西他赛)和法国的Sanofi-aventis公司研发的卡巴他赛(Cabazitaxel®)[16](图1)。1996年,多西他赛上市用于治疗乳腺癌、结肠癌和非小细胞肺癌[17]。2010年,FDA批准卡巴他赛用于治疗晚期前列腺癌[18]。目前由山西振东制药股份有限公司与沈阳药科大学和无锡靶点药物研究有限公司合作开发的1.1类新药拉洛他赛(Larotaxel®,莱龙泰素,图2)已完成乳腺癌单独用药的III期临床评价,并在全世界进行多中心多瘤谱单独用药和联合用药的II期或III期临床评价,对紫杉醇耐药的患者有效[19]。深圳信立泰药业股份有限公司研发的信立他赛和清华大学药学院刘刚课题组和中国医学科学院马瑶课题组联合研究的康莫他赛已获得临床审批。康莫他赛(图3)是在紫杉醇的结构上接入抑制NOD2介导的炎症信号通路,增敏紫杉醇的治疗效果,抑制肿瘤转移[20]。紫杉醇类抗癌药现多用于一线抗癌药物,常与其他类抗癌药联合使用。大量的临床评估发现,紫杉醇与铂类药物联用治疗一般晚期实体瘤[21],对食道癌、卵巢上皮癌、宫颈癌、肺鳞癌、胃癌、胰腺癌[22]等癌症具有更高的生存优势,耐受良好,安全有效。除了与化疗药物联用,紫杉醇在中晚期头颈部癌、鼻咽癌等鳞片状细胞癌的治疗中常作为放疗增敏剂参与放疗[23]。
近几年来,紫杉醇也常与其他天然药物联合使用,如与白藜芦醇联合给药抗肝癌、喉癌和胃癌等[24],可以降低两个药物的单独用量及副作用。紫杉醇与姜黄素联合用药中,姜黄素降低多重耐药关键蛋白p-gp的表达,并增加紫杉醇的对脑癌的靶向作用[25],联合使用治疗肺癌时,IC50值显著降低,可以考虑成为肺癌治疗的首选方案[26]。多西紫杉醇与紫杉醇虽然属于同类药物,但与其他药物联合作用时,在药动学和毒副作用的表现上效果并不等同[27],应区别研究。
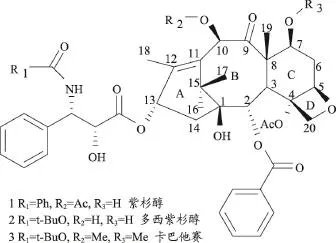
图1

图2 拉洛他赛

图3 康莫他赛
传统紫杉醇注射剂以聚氧乙烯蓖麻油(CremophorEL)和无水乙醇的混合液作为增溶剂,静脉或腹腔注射给药,会导致患者严重过敏反应。现国内外已经成功研制多种紫杉醇新型释药系统,如南京绿叶思科药业有限公司研制的注射用紫杉醇脂质体(力扑素®),美国生物制药公司赛尔基因研制的注射用白蛋白结合型紫杉醇(Abraxane®),以及韩国Samyang公司研制的注射用胶束化紫杉醇(Genexol-PM®)。新型制剂在改善治疗效果、方便临床用药、降低治疗费用等方面大大提高了患者的获益程度[28]。
紫杉醇还可以通过其抑制细胞增殖和免疫抑制机制治疗银屑病[29],稳定微管保护细胞骨架从而预防心肌细胞缺血再灌注损伤[30],可以保护海马神经元,为治疗脑中风及脑瘤提供依据[31],抑制大鼠移植性动脉增生,防治动脉硬化,抗鸡皮尿囊膜模型的血管生成等。
3 紫杉醇原料药来源
3.1 植物提取

图4 紫杉醇的构造
紫杉醇的最直接来源是从红豆杉植物中提取分离。为了避免资源枯竭并获得足够的紫杉醇用于基础研究与临床研究,人们开始逐渐采用人工栽培的方法来解决天然资源不足的问题。美国BMS公司于1991年种植了400万株,以后每年种植1 000万株。江苏红豆集团已建成红豆杉高科技产业园,每年培育红豆杉苗500多万株,是国内最大的红豆杉实生苗繁育基地之一。
在天然原料中紫杉醇的含量低,紫杉烷系列化合物共存,并含有大量植物腊、色素和树胶等杂质,因而紫杉醇的分离难度极高。红豆集团摸索出一条革新的提炼紫杉醇的工艺,采用全株发酵的方式,浓缩液直接经大孔吸附树脂层析,而并非是传统的先碎株后发酵、多次色谱过程,后期只需要两次结晶即可得目标化合物,从而缩短了提炼时间,减少了由于时间过长造成的紫杉醇的损失。可降低成本30%,紫杉醇总收率达到了85%以上,而且紫杉醇含量达到了99.0%以上[32]。
3.2 全合成
紫杉醇的分子结构非常复杂,有11个立体中心和1个17碳的四环骨架结构(图4),目前已有多个国家的世界顶级课题组研究出6个全合成路线和1个形式合成路线[33]。
1992年,斯坦佛大学的Wender等人用蒎烯构建了紫杉醇母核10-DABⅢ,完成第一个全合成[34]。1994年美国斯克瑞普斯研究所化学家Nincolaou等采用逆合成分析法成功合成紫杉醇[35]。同年,美国佛罗里达州立大学的化学家Holton RA等采用从B环开始构建C/ D环完成紫杉醇全合成[36,37]。之后1996年,美国哥伦比亚大学的Danishefsky课题组[38],1997年日本的Mukaiyama课题组[39]以及1998年日本的Kuwajima课题组[40]也分别相继报道完成了紫杉醇的全合成。进入21世纪之后,日本东京工业大学的Takahashi课题组于2005年也完成了紫杉醇的全合成[41]。尽管这些路线难于用于工业生产,但在合成过程中发现了许多新的、独特的反应以及独到的战略思路与反应创新,把天然有机合成化学提高到一个崭新水平[34]
3.3 半合成
目前,紫杉醇商业化生产研究多集中于紫杉醇的半合成。由于10-脱乙酰巴卡亭III(10-deacetyl baccatin III,10-DAB III)在红豆杉、马尾松和粗榧等植物针叶中含量较高且针叶产量大,再生能力强,因此半合成成为紫杉醇的有效来源。以10-DABⅢ为原料合成紫杉醇根据所用侧链不同可分为5种方法,13条路线[42]。1988年,法国Universite Joseph Fourier的Denis博士首次从欧洲红豆杉的针叶中获得了10-DABⅢ,并以此半合成了紫杉醇,产率为53%。与此同时,得到了同系物多烯紫杉醇[43]。中国科学家王九一[44]用N-苯甲酰-(2R,3S)-3-苯基异丝氨酸对7,10位羟基保护后的10-DABⅢ13位进行酯化,再在盐酸下脱保护,三步得到紫杉醇,产率达到92.2%,值得推广。
除了10-DABⅢ,科学家还采用巴卡亭(Baccatin III)半合成紫杉醇。尽管由Baccatin III半合成紫杉醇仅仅是一步简单的酰化反应,但由于13位羟基周围的立体位阻,使得该反应较为困难。法国的Potier教授首先用肉桂酸对Baccatin III进行酰化,然后利用Sharpless羟基氨基化反应得到紫杉醇[45]。美国BMS公司获得美国FDA批准利用Holton教授Baccatin III半合成紫杉醇的专利生产紫杉醇,并决定在1994年底停止从红豆杉树皮中萃取生产紫杉醇。
值得一提的是,红豆杉针叶萃取物中的其他紫杉烷类成分特别是含7-木糖苷类别的,可以通过高碘酸和苯肼处理后去掉木糖醇,得到半合成紫杉醇的中间产物[46]。
3.4 生物合成
面对日益增多的肿瘤患者,除了半合成,研究紫杉醇的新的来源途径越发显得重要。最近几年最受关注的是真菌培养、细胞培养和生物合成。
1993年,美国Montana州立大学植物病理学家Stierle和化学家Strobel首次从太平洋红豆杉树皮中分离出一株产紫杉醇的内生真菌,产量约为25-50 ng·L-1[47]。目前已发现20多属真菌。2011年,汕头市双骏生物科技有限公司以高产紫杉醇菌株013为出发菌株,采用紫外线诱变、亚硝基胍诱变交替进行的方法,同时复合含1%乙酰胺的理性化筛选模型,获得一株遗传性状稳定的链格孢单孢变种ST 026,摇瓶发酵产量可稳定达到227mg·L-1,比出发菌株产量提高81.6%[48]。此外,加拿大学者Soliman等将来源于同种红豆杉的Paraconiothyrium SSM001、Alternaria属和Phomopsis属内生菌共同培养,产量达到原来的8倍[49]。真菌发酵产率低,没有高效的产量,紫杉醇提取回收率低于50%,进一步对各个环节进行改进,有望实现产业化生产。
细胞培养不受时间地点限制,在培养液中加入紫杉醇生物合成关键酶催化剂,并给予特定的合成前体物质,促使细胞针对性的合成紫杉醇。中国科学家邱德有课题组和美国华盛顿大学Croteau教授课题组长期研究紫杉醇的生物合成过程。已经确定紫杉醇合成途径基本框架,紫杉醇生物合成过程所需要的20个酶,主要类型包括GGPP合成酶、紫杉二烯合成酶、羟基化酶、酰基化酶、变位酶等,并完成了其中12个酶的基因克隆[50]。Hampel等[51]发现紫杉素酰基化的酰基转移酶基因(TAX9和TAX14)阻碍次生代谢前体向紫杉醇转化,敲除该基因可提高紫杉醇生物合成。本草基因组学(Herbgenomics)的快速发展为合成生物学研究提供了大量可供选择和改造的生物学元器件,综合运用各种组学技术,将极大地加速天然产物合成途径的解析研究[52]。
4 紫杉醇类化合物结构修饰研究
紫杉醇结构并不稳定,在常温下放置两个星期,70%的化合物会发生水解和酰基转移,在酸碱环境中更易被破坏。在药动学性质和抗癌活性引导下,科学家围绕紫杉醇做了大量的结构修饰,旨在阐明其构效关系。
4.1 构效关系研究
研究紫杉醇各基团的构效关系有利于解释其在稳定微管蛋白,破坏有丝分裂使癌细胞程序性死亡过程中的结合位点与具体作用机理,确定相关有效基团,从而合成新一代紫杉醇类似物或者简化其结构。紫杉醇1位羟基、2位苯甲酰氧基、4位乙酰氧基、D环以及13位侧链在紫杉烷母核三环二萜骨架的基础上构成伞型腔穴结构,与β-微管能够特异性稳定结合,这是紫杉醇主要的活性和细胞毒性的来源。
4.2 A环的研究
A环中13位侧链是紫杉醇的活性基团,而12和14位的改变对其活性同样会产生一定影响。在A环的14位引入羟基,其活性和细胞毒性几乎不变。在多烯紫杉醇的1/14位引入碳酸基后,其细胞毒性和活性与多烯紫杉醇相似,而向紫杉醇引入碳酸基,其活性和细胞毒性降低几倍[11]。将C11-C12位的双键移到C12-C13位,其细胞毒性比紫杉醇稍微增强[12]。
4.3 B环的研究
B环中的1位羟基、2位苯甲酰氧基为紫杉醇的重要活性基团。Guo等发现从植物中分离得到的1位去羟基紫杉醇比紫杉醇的细胞毒性降低了3倍。除去紫杉醇2位的苯甲酰氧基或用乙酰基、戊酰基、异戊酰基等非芳香族基取代苯甲酰氯基团,紫杉醇活性均下降甚至失活[53],微管蛋白T型紫杉醇模型观察到微管疏水部位与2位苯基的邻对位结合,形成疏水折拢结构。修饰苯基间位通常会使活性增强,而修饰邻对位则降低化合物活性和细胞毒性。
将9位羰基转换为羟基取代后,再进行羟基的甲基化,得到的化合物活性与原药几乎相同,表明9位并非其活性基团。对10位去酯基化可改善化合物的水溶性,并降低对MCF-7和MCEF-R的细胞毒活性,当10位乙酰基由β型转为α型,化合物活性和细胞毒性增加两倍左右[38]。B环9、10位可作为改变其药动学参数的修饰位点。
4.4 C环的研究
紫杉醇C环4位脱去乙酰基或乙酰氧基后,化合物活性均降低,表明4位的羰基基团是紫杉醇的活性基团之一[14]。4位的末端电子性质会影响其与微管蛋白氨基酸残基的结合。C环的6位被羟基取代是紫杉醇在体内主要的代谢失活形式。6位被卤素原子取代后,化合物细胞毒性变化不大,但其在体内的代谢变慢,发挥作用时间变长[9]。
C环的7位也是紫杉醇结构修饰的重点。7位去羟基或者酯化,衍生物的活性不会降低[55]。因此可以对紫杉醇7位进行修饰,引入水溶性侧链改善其水溶性,如接入聚乙烯侧链得到7-PEG-taxol[56]得到水溶性前药,以期改变其生物利用度。
4.5 D环的研究
将D环的氧原子用硫原子或者氮原子取代,其细胞活性下降[57],一般认为D环的氧原子与微管蛋白276位的苏氨酸形成氢键[53]。然而有研究发现氧原子用碳原子取代后,其活性与紫杉醇相似[58]。综合以上,可推断D环改变对化合物药效的影响主要来自对邻近基团空间结构的影响,可能与其本身的特性无关。

图5 紫杉醇类化合物主要构效关系图
4.6 侧链的研究
紫杉醇前体巴卡亭几乎没有促微管聚合的作用和细胞毒性,说明侧链在紫杉醇的构效关系中扮演重要角色。侧链的结构和构型是影响紫杉醇类药物与微管作用的主要因素。只有侧链构型为(2′R,3′S)时,化合物活性最强[59]。对紫杉醇13位侧链的2′和3′上的基团进行修饰,其活性变化明显。计算机模拟实验发现2′位羟基与微管蛋白369位精氨酸氨基末端形成氢键[53],许多研究者考虑将2′位接入易被体内酶水解的基团制成前药,其中值得注意的是,以吗啉基系列衍生基团对2′位羟基氢进行取代后,产物水溶性增加,活性与紫杉醇相当。对2′位氢进行甲基取代,细胞毒性增强1.5倍,这可能是甲基限制2′-3′位间碳键旋转或增加化合物与微管蛋白的结合力导致[53]。
另外,科学家用芳香族、杂环族或者脂肪族取代3′位的苯环[53],或者在苯环的对位引入甲氧基、羟基,均会增强化合物的活性。脂肪族取代苯环时,叔丁基取代物活性最强。总体来说3′位取代基的大小对紫杉醇衍生物的活性影响最大。基于2-叠氮基巴马亭III展现出很强的细胞毒性[60],可推断13位侧链与2位共同形成一个特别结构与蛋白质结合,我们可以在2位引入基团从而独自形成类似空间结构,以此思路为指导开发新一代的紫杉烷类抗癌药。
4.7 紫杉烷骨架的研究
基于对侧链的改造发现,紫杉醇类药物的细胞毒性与整个结构的空间结构关系非常大,一些科学家开始致力于简化紫杉烷骨架,意在合成简单却有效的结构。含有C13紫杉醇型侧链,且结构简化的紫杉烷和重排的A环紫杉烷类似物仍具有抑制微管解聚的活性。紫杉醇类化合物主要构效关系如图5所示。
5 紫杉醇类化合物新剂型研究
目前,针对紫杉醇类化合物的低溶解度,低生物利用度以及助溶剂带来的过敏反应等问题,主要研制的新剂型有紫杉醇脂质体和白蛋白结合型紫杉醇,已有多家企业和机构在申请此类专利。2005年,江苏省药物研究所联合医药公司研究了紫杉醇脂质体(力扑素)并进行临床试验,发现此种新剂型可以显著降低患者过敏反应,不需要激素预处理,还能有效延长半衰期,增加药效[54]。2005年,国外进行ABI-007天然白蛋白结合型紫杉醇治疗转移性乳腺癌[62],可以靶向性的将药物蓄积在肿瘤细胞内,提高了耐受剂量,发挥更显著的疗效。此外,由美国NeoPharm公司研制的紫杉醇脂质体-LEP-ETU®、德国MediGene公司开发的基于阳离子脂质体形成的一种新型紫杉醇制剂EndoTAG-1®、日本NanoCarrier公司开发的长循环紫杉醇聚合物胶束化纳米粒NK105®和韩国DAE HWA制药公司研制的一种紫杉醇新型口服制剂DHP107®也先后进入到不同的临床研究阶段[28]。与紫杉醇市售注射液相比,新型制剂在肿瘤组织中药物浓度显著增加,具有良好的靶向性和显著的抗肿瘤效果,同时减轻了市售注射液治疗时的毒副作用[61]。随着药剂学技术的不断发展,相信会有更多功能性的新型紫杉醇制剂进入临床,不仅能消除过敏反应、降低毒副作用,还能够提高肿瘤靶向性、改善治疗效果,方便临床用药、降低治疗费用,大大提高患者的获益程度。
6 紫杉醇类药物研发启示
紫杉醇从发现到临床应用经历了30余年,上市后至今仍然对其进行孜孜不倦的研究,不断进行构效关系研究、积极改进药物剂型以及拓展药物来源,以期在临床上更好的应用。紫杉醇的发现是偶然中的必然,是在大量艰苦繁琐的工作中产生,而国外对其的研究开发一直处于前列。在药物的创新研究上,我们不仅需要先进的仪器设备,更要培养创新思维,提高能力,通过在专业上的深入学习和实践获得发现创新点的专业直觉。创新药物研发需要多学科交叉渗透、相互合作,这也要求中国药物研究者应加强交叉渗透、团队合作、建设多学科专业人员结合的研究队伍,这样才能在药物研究和创新药物开发研究中取得新的突破。我们应以国家制定的中医药发展“十三五”规划及中医药发展战略规划为契机,充分利用中草药以及民族药物这一巨大的宝库,通过将传统与现代科学技术结合,拓宽研发领域和思路,有助于开发下一个“紫杉醇”式的重磅药物。
1Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortalityworldwide:Sources,methodsandmajorpatternsin GLOBOCAN 2012.Int.J.Cancer,2015,136:E359–E386.
2Tachibana Y,Zhu X K,Krishnan P,et al.Characterization of human lung cancer cells resistant to 4′-O-demethyl-4β-(2″-nitro-4″-fluoroanilino)-4-desoxypodophyllotoxin,a unique compound in the epipodophyllotoxin antitumor class.Anticancer Drugs,2000,11(1):19-28.
3邓立新.抗癌新药紫杉醇简介.化学教学,2006,1:46-48.
4周波,姜虎生.红豆杉及其产物紫杉醇研究概况.吉林师范大学学报(自然科学版),2001,1:78-81.
5Wani M C,Taylor H L,Wall M E,et al.Plant antitumor agents.VI.The isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxusbrevifolia.J Am Chem Soc,1971,93(9):2325-2327.
6Schiff P B,Fant J,Horwitz S B.Promotion of microtubule assembly in vitro by taxol.Nature,1979,277(5698):665-667.
7Horwitz S B.Personal Recollections on the Early Development of Taxol. J Nat Prod,2004,67(2):136-138.
8王莺.紫杉醇类抗癌药物的临床应用概述.海峡药学,2007,19(8): 97-99.
9Pronk L C,Stoter G,Verweij J.Docetaxel(Taxotere):single agent activity,development of combination treatment and reducing sideeffects.Cancer Treat Rev,1995,21(5):463-478.
10张学玉,曲玮,梁敬钰.红豆杉属植物化学成分及药理作用研究进展.海峡药学,2011,23(6):5-9.
11李春元,李梓.抗癌药紫杉烷类临床应用现况.世界临床药物,2001, 22(3):140-141.
12谢宝芬,潘柏良.紫杉醇的药理与临床研究进展.中国药业,2008,17 (15):76-78.
13 Sunters A,Madureira P A,Pomeranz K M,et al.Paclitaxel-induced nuclear translocation of FOXO3a in breast cancer cells is mediated by c-Jun NH2-terminal kinase and Akt.Cancer Res,2006,66(1):212-220.
14张桂芝,方向群.紫杉醇参与逆转肺部肿瘤细胞免疫逃逸的机制研究.中国药业,2015,24(22):41-43.
15徐律韵.紫杉醇对人肝癌细胞SMMC-7721黏附及侵袭转移潜能的影响.现代医药卫生,2014,30(5):655-657.
16 Meden H,Rath W,Kuhn W.Taxol-a new cytostatic drug for therapy of ovarian and breast cancer.Geburtshilfe Frauenheilk,1994,54(4):187-193.
17宋沁馨,于立洁.多西他赛的临床应用进展.中国新药杂志,2001,10 (12):900-903.
18 Tang P,Wang F.Recent Progresses in the Synthesis of Taxol.Chinese J Org Chem,2013,33(3):458.
19冯双双,钞艳惠,何海冰,等.拉洛他赛共聚物脂质杂合纳米粒的制备及其性能评价.沈阳药科大学学报,2017,34(1):14-22.
20 Dong Y,Wang S,Wang C,et al.Antagonizing NOD2 Signaling with Conjugates of Paclitaxel and Muramyl Dipeptide Derivatives Sensitizes Paclitaxel Therapy and Significantly Prevents Tumor Metastasis.J Med Chem,2017,60(3):1219-1224.
21陆红霞.紫杉醇剂型、临床用药方式及联合用药的研究进展.国外医学药学分册,2005,32(2):73-77.
22 Von Hoff DD,Ervin T,Arena F P,et al.Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine.N Engl J Med,2013,369 (18):1691-1703.
22肖秀兰,任统伟.奈达铂联合紫杉醇同期放化疗治疗局部晚期鼻咽癌分析.中国医学工程,2012,20(10):52-53.
24卢晨欣,孙警辉,伍春莲.白藜芦醇与紫杉醇联合用药对人喉癌Hep-2细胞凋亡机制的研究.中国中药杂志,2016,41(3):476-483.
25 Manju S,Sharma C P,Sreenivasan K.Targeted coadministration of sparingly soluble paclitaxel and curcumin into cancer cells by surface engineered magnetic nanoparticles.J Mater Chem,2011,21(39):15708.
26蒲新霖.紫杉醇和姜黄素在肿瘤治疗中的联合应用.西南军医, 2017,19(2):161-164.
27杨孝来.紫杉醇与多烯紫杉醇.实用药物与临床,2010,13(4):281-283.
28徐佳茗,夏学军,刘玉玲.紫杉醇新型制剂及临床研究进展.实用药物与临床,2016,19(4):510-517.
29王懿娜,方红,张幸国,等.紫杉醇溶液外用治疗豚鼠耳部银屑病样病理改变的疗效观察.中华皮肤科杂志,2004,37(3):156-158.
30冯健,童德兵,羊镇宇,等.紫杉醇预防心肌细胞线粒体缺血再灌注损伤的机制研究.中华全科医学,2014,12(11):1724-1726.
31齐素华,巩娟娟,倪小宇.紫杉醇通过MLK_3/JNK_3信号通路对海马神经元损伤的保护作用.苏州大学学报:医学版,2012,32(1):1-5. 32李弟贵,任莉.一种从人工种植南方红豆杉中全株提取紫杉醇的方法,中国:CN 1958580 A,2007-05-09.
33唐培,王锋鹏.近年来紫杉醇的合成研究进展.有机化学,2013,33 (3):458-468.
34韩广甸,丁炬平,谢蓝.紫杉醇的合成进展.有机化学,1993,13(4): 337-346.
35 Nicolaou K C,Yang Z,Liu J J,et al.Total synthesis of taxol.Nature, 1994,367(6464):630-634.
36 Holton R A,Somoza C,Kim H B,et al.ChemInform Abstract:First Total Synthesis of Taxol.Part 1.Functionalization of the B Ring.J Am Chem Soc,1994,116(4):1597-1598.
37 Holton R A,Kim H B,Somoza C,et al.ChemInform Abstract:First Total Synthesis of Taxol.Part 2.Completion of the C and D Rings.Cheminform,1994,25(26):1599-1600.
38 Walsh C.Molecular mechanisms that confer antibacterial drug resistance. Nature,2000,406(6797):775-781.
39陆怡,陈大明,熊燕.抗肿瘤药物的研发态势分析.生命科学,2012, 24(6):535-542.
40 Osheroff N,Corbett A H,Robinson M J.Mechanism of Action of Topoisomerase II-Targeted Antineoplastic Drugs.Adv Pharmacol Academic Press,1994,9B:105-126.
41 Doi T,Fuse S,Miyamoto S,et al.A Formal Total Synthesis of Taxol Aided by an Automated Synthesizer.Chem Asian J,2006,1(3):370-383.
42 Yang W,Sun J,Lu W,et al.Synthesis of kaempferol 3-O-(3″,6″-di-OE-p-coumaroyl)-β-D-glucopyranoside,efficient glycosylation of flavonol 3-OH with glycosyl O-alkynylbenzoates as donors.J Org Chem,2010,75(20):6879-6888.
43 Denis J N,Greene A E,Guenard D,et al.Highly efficient,practical approach to natural taxol.J Am Chem Soc,1988,110(17):5917-5919.
44王九一,阎家麒.紫杉醇的半合成.中国药物化学杂志,1999,6(24): 56-58.
45 Mangatal L,Adeline M T,Guenard D,et al.Application of the vicinal oxyamination reaction with asymmetric induction to the hemisynthesis of taxol and analogues.Tetrahedron,1989,45(13):4177-4190.
46Rao K V.Semi-synthesis of paclitaxel from naturally occurring glycosidic precursors.J Heterocyclic Chem,2010,34(2):675-680.
47王雪松,孙剑秋,臧威,等.从Strobel的发现看植物内生真菌研究的未来.生物学通报,2012,47(10):1-3.
48段丽丽,陈鸿锐,陈杰鹏,等.选育紫杉醇高产菌种链格孢单孢变种.中国抗生素杂志,2008,33(11):650-652.
49 Soliman S S,Trobacher C P,Rong T,et al.A fungal endophyte induces transcription of genes encoding a redundant fungicide pathway in its host plant.Bmc Plant Biology,2013,13(1):93.
50邱德有.紫杉醇生物合成研究历史、现状及展望.生物技术通报, 2015,31(4):56-64.
51 Hampel D,Mau C J,Croteau R B.Taxol biosynthesis:Identification and characterization of two acetyl CoA:taxoid-O-acetyltransferases that divert pathway flux away from Taxol production.Arch Biochem Biophys, 2009,487(2):91-97.
52 Chen S,Song J,Sun C,et al.Herbal genomics:Examining the biology of traditional medicines.Science,2015,347(6219):S27-S29.
53 Zefirova O N,Nurieva E V,Ryzhov A N,et al.Taxol:Synthesis, Bioactive Conformations,and Structure-Activity Relationships in Its Analogues.Russ J Org Chem,2005,41(3):315-351.
54 Chen S H,Farina V,Wei J M,et al.ChemInform Abstract:Structure-Activity Relationships of Taxol®:Synthesis and Biological Evaluation of C2 Taxol Analogues.Bioorg Med Chem Lett,1994,4(3):479-482.
55 Chen S H,Kant J,Mamber S W,et al.Taxol®;structure-activity relationships:synthesis and biological evaluation of taxol analogs modified at C-7.Bioorg Med Chem Lett,1994,4(18):2223-2228.
56 Greenwald R B,Pendri A,Bolikal D.Highly Water Soluble Taxol Derivatives:7-Polyethylene Glycol Carbamates and Carbonates.J Org Chem,1995,60(2):331-336.
57 Marder-Karsenti R,Dubois J,Bricard L,et al.Synthesis and Biological Evaluation of D-Ring-Modified Taxanes:15(20)-Azadocetaxel Analogs. Cheminform,1998,29(62).
58 Raphaële M K,Joëlle D,Laurent B,et al.Synthesis and Biological Evaluation of D-Ring-Modified Taxanes:5(20)-AzadocetaxelAnalogs. J Org Chem,1997,62(19):6631-6637.
59 Dubois J,Guénard D,Guéritte-Voegelein F,et al.Conformation of Taxotere®,and analogues determined by NMR spectroscopy and molecular modeling studies.Tetrahedron,1993,49(30):6533-6544.
60 Ojima I,Inoue T,Chakravarty S.ChemInform Abstract:Enantiopure Fluorine-Containing Taxoids:Potent Anticancer Agents and Versatile Probes for Biomedical Problems.Cheminform,1999,30(42):3-10.
61 Nicolaou K C,Dai W M,Guy M R K.Chemistry and Biology of Taxol. Angew Chem Int Edit,1994,33(106):15-44.
62高锦明,傅建熙,张鞍灵.抗癌新药紫杉醇的构效关系.西北农林科技大学学报自然科学版,1997,25(5):96-99.
Paclitaxel:ALandmark NaturalAnticancer Drug
Liu Xianfang,Liang Jingyu,Sun Jianbo
(College of Traditional Chinese Medicine,China Pharmaceutical University,Nanjing 210009,China)
As a most effective monomer composition from bark of Pacific Yew,paclitaxel and its derivatives are used in clinical practice as broad spectrum anticancer drugs.Since its discovery in the 1970 s,many researches had been carried out,mainly focusing on the modification,structure-activity relationship and pharmacological activity.The great successes pressed ahead the development of a series of taxol-like drugs,including taxol,docetaxel,cabazitaxel,larotaxel. Nowadays,studies of taxol are still the hotpots,which concentrated on the new source such as cultivation of tissue,fungus culture and new dosage forms.As the representative of drugs research from natural source,taxol is worth to besummarized of its history and ongoing development for looking forward to bring new innovation mentality in new drugs.
Paclitaxel,natural active constituents,broad-spectrum anticancer drug,research and development course, research progress
10.11842/wst.2017.06.009
R283
A
(责任编辑:马雅静,责任译审:王晶)
2017-03-20
修回日期:2017-05-20
*基于中药有效单体成分的新药研究系列讨论-IV。
**通讯作者:孙建博,副教授,主要研究方向:中药及天然产物活性成分研究。
***世界卫生组织官方网站:http://www.who.int/mediacentre/factsheets/fs297/zh/。
——水芹主要害虫识别与为害症状

