宫内缺氧胎儿脐血流超声参数与母体、胎儿氧化应激损伤的关系
瓦增成,杜婷
(青海红十字医院,西宁 810001)
宫内缺氧胎儿脐血流超声参数与母体、胎儿氧化应激损伤的关系
瓦增成,杜婷
(青海红十字医院,西宁 810001)
目的 探究宫内缺氧胎儿脐血流超声参数与母体、胎儿氧化应激损伤的相关性。方法 分娩的产妇200例,根据新生儿Apgar评分分为正常组与缺氧组。孕龄24~30周、31~36周、37~41周时分别记录孕产妇彩超检测的脐血流超声参数,检测脐带血中氧化应激产物、胎盘组织中氧化应激产物与相关细胞凋亡分子的水平,并分析其与超声参数的相关性。结果 不同孕周缺氧组脐血流超声参数阻力指数(RI)、搏动指数(PI)、收缩期最大血流速度/舒张末期血流速度(S/D)均高于正常组(P均<0.05);与正常组比较,缺氧组脐带血与胎盘组织中氧化应激产物丙二醛(MDA)、氧化低密度脂蛋白(ox-LDL)、8-异前列腺素(8-ios)、热休克蛋白70(HSP-70),胎盘组织中脂肪酸合成酶(Fas)、脂肪酸合成酶配体(FasL)、Bcl-2相关X蛋白(Bax)水平高(P均<0.05),胎盘组织中B细胞淋巴瘤/白血病基因2(Bcl-2)、X连锁凋亡抑制蛋白(XIAP)水平低(P均<0.05)。RI、PI、S/D分别与脐带血和胎盘组织中MDA、ox-LDL、8-ios、HSP-70及胎盘组织中Fas、FasL、Bax水平呈正相关(P均<0.05),与胎盘组织中Bcl-2、XIAP呈负相关(P均<0.05)。结论 宫内缺氧胎儿脐血流超声参数出现明显异常,其与母体、胎儿氧化应激损伤程度有相关性。
宫内缺氧;超声参数;氧化应激产物;凋亡产物;脐带血流
胎儿宫内缺氧是脐带血管因某种疾病导致血流量异常,胎儿在子宫内发生缺氧缺血,严重损害胎儿生命,这种现象又称胎儿窘迫[1]。胎儿宫内缺氧多发生于剖宫产临产时,也可发生在妊娠后期[2]。主要症状是胎盘功能不全、高危妊娠如高血压、肾炎、心脏病、重度贫血、难产等[3]。宫内缺氧是因血管病变导致脐血流量减少、无法正常给胎儿供氧,胎儿与胎盘发生氧化应激反应,产生的相关凋亡因子会导致胎儿生长迟缓,胎动减少,严重者导致死亡。宫内缺氧状态下存活的新生儿因缺氧损伤神经系统,造成智力发育不全或不可逆后遗症;影响心脏基因表达,心肌程序性细胞过早死亡,抑制胎儿心脏发育,造成不可逆损伤。因此宫内缺氧造成的损伤是不可逆的,严重影响胎儿的生长发育[4]。目前临床判断宫内缺氧主要检测胎心与胎动,暂无明确的宫内缺氧检测项目。超声检测可通过检测脐动脉的相关参数判断脐血流变化,进而可判断是否出现宫内缺氧。本文评估了脐血流与母体和胎儿氧化应激产物、细胞凋亡分子之间的关系,有助推断缺氧给胎儿带来的损伤,对临床预防与治疗具有积极意义。
1 资料与方法
1.1 临床资料 选择2013年1月~2017年1月在青海红十字医院分娩的产妇200例。纳入标准:胎心监护频繁现晚期减速,重度变异减速,羊水粪染Ⅲ度,胎盘异常。排除标准:有染色体遗传史的产妇,患有其他器质性病变者,畸形儿。将产妇根据新生儿Apgar评分分为缺氧组(Apgar评分≤7分)110例,年龄23~33(27.65±4.31)岁,初产妇76例、经产妇34例,孕周33~35(34.25±0.33)周,轻度窒息74例、重度窒息36例,新生儿体质量1.4~4.8(2.5±1.8)kg;正常组(Apgar评分>7分)90例,年龄23~33(27.65±4.31)岁,初产妇77例、经产妇13例,孕周33~36(33.54±0.42)周,新生儿体质量1.5~4.9(2.5±1.9)kg。两组基线资料有可比性。此次研究获得伦理委员会批准,且与研究对象签署自愿同意书。
1.2 脐血流超声参数的检测 孕龄24~30周、31~36周、37~41周时分别记录脐血流超声参数。采用彩色多普勒超声仪(生产厂商:美国 GE公司E8)进行检测,探头频率设为2~6 MHz,记录胎儿双顶径、胎盘、脐带生长发育情况,后移探头观测脐动脉血液流动、选取5个连续的舒张期检测其阻力指数(RI)、搏动指数(PI)、收缩期最大血流速度/舒张末期血流速度(S/D)。胎儿出生后立即进行Apgar评分,4~7分为轻度宫内缺氧,0~3分为重度宫内缺氧。
1.3 脐带血和胎盘组织中氧化应激产物与细胞凋亡分子的检测 分娩后30 min内采集实验用量的胎盘母体面中央部位组织与脐带血5 mL分别标记,生理盐水清洗血液后液氮速冻,加入RIPA裂解液充分研磨,去悬浊液放入4 ℃离心机中分离,转速12 000 r/min,离心20 min后取上层澄清液体2 mL;用ELISA法检测热休克蛋白70(HSP-70)、氧化低密度脂蛋白(ox-LDL)、脂肪酸合成酶(Fas)、脂肪酸合成酶配体(FasL)、B细胞淋巴瘤/白血病基因2(Bcl-2)、Bcl-2相关X蛋白(Bax)、X连锁凋亡抑制蛋白(XIAP)的水平;采用放射免疫法检测8-异前列腺素(8-iso)、丙二醛(MDA)水平。
2 结果
2.1 两组不同孕期脐血流超声参数比较 不同孕期缺氧组RI、PI、S/D高于正常组(P均<0.05)。见表1。
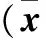
表1 两组不同孕期脐血流超声参数比较±s)
注:与正常组同时期相比,*P<0.05。
2.2 两组脐带血和胎盘组织中氧化应激产物水平比较 缺氧组脐带血和胎盘组织中MDA、oxLDL、8-ios及HSP-70水平高于正常组(P均<0.05)。见表2。
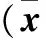
表2 两组脐带血、胎盘组织中氧化应激产物水平比较±s)
注:与正常组同部位相比,#P<0.05。
2.3 两组胎盘组织中细胞凋亡分子水平比较 与正常组比较,缺氧组胎盘组织中Fas、FasL、Bax水平高,Bcl-2、XIAP水平低(P均<0.05)。见表3。
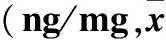
表3 两组胎盘组织中细胞凋亡分子水平比较±s)
注:与正常组比较,*P<0.05。
2.4 相关性分析 RI、PI、S/D分别与脐带血及胎盘组织中的MDA、oxLDL、8-ios、HSP-70呈正相关(脐带血:RI:r分别为0.707、0.695、0.713、0.738,P均<0.05);PI:r分别为0.721、0.715、0.728、0.719,P均<0.05; S/D::r分别为0.689、0.697、0.735、0.727,P均<0.05;胎盘组织:RI:r分别为0.657、0.631、0.598、0.586,P均<0.05;PI:r分别为0.586、0.647、0.659、0.568,P均<0.05;S/D:r分别为0.623、0.712、0.681、0.569,P均<0.05),与胎盘组织中Fas、FasL、Bax呈正相关(RI :r分别为0.698、0.715、0.703,P均<0.05;PI:r分别为0.722、0.717、0.719,P均<0.05: S/D:r分别为0.683、0.731、0.729,P均<0.05),与胎盘组织中Bcl-2、XIAP呈负相关(RI :r分别为-0.711、-0.716,P均<0.05;PI:r分别为-0.709、-0.699,P均<0.05:S/D:r分别为-0.708、-0.734,P均<0.05)。
3 讨论
胎儿宫内缺氧主要原因是脐带异常,脐带血流受阻导致胎盘缺氧缺血进而影响胎儿发育[5];而胎盘前置、早剥或胎儿先天性血管因素都会影响脐带血流异常,检测脐带血流对评估胎儿是否健康生长具有重要意义[6]。脐动脉是胎儿与胎盘相连的主要血管,其血流动力变化受心脏收缩力和血管终末阻力的影响[7]。血管终末阻力增大时,舒张期的血流量减少或消失,甚至出现负性血流;当阻力减小,舒张期血流量增大[8]。脐带血的血流动力学的变化与胎盘、胎儿和母体的生理学变化相关。健康孕妇的脐带血流会呈现高流速低阻力,到妊娠后期绒毛间隙逐渐增大、血管阻力减小、血流量增多[9],疾病可导致脐动脉或胎盘绒毛血管痉挛坏死,都能导致血管狭窄、阻力增大、血流量减少,从而使胎盘供血不足,出现功能性障碍[10]。脐带血可通过超声观测其流速,得出脐动脉相关参数。超声检查中RI、PI、S/D是代表血流量的重要参数,血管阻力越高,血流量越少,RI、PI、S/D越大。
在宫内缺氧持续发展过程中,胎盘组织因血流的低灌注而导致细胞凋亡进程加快,滋养细胞、内皮细胞的凋亡会严重阻碍母胎间的物质交换[11]。细胞凋亡过程主要有死亡受体凋亡通路与线粒体凋亡通路共同调解[12],其中死亡受体凋亡通路有Fas、FasL因子参与调解、线粒体凋亡通路需要Bax、Bcl-2因子调解。Fas是肿瘤坏死因子,可与FasL结合后刺激多种有Caspase参与诱发的凋亡反应,最终刺激Caspase-3因子增多、导致细胞凋亡[13]。Bax、Bcl-2主要作用为调节线粒体膜通透性及细胞色素C的释放。Bax可增加细胞色素C的释放量,Bcl-2可对Bax增加细胞色素C的释放量过程起到拮抗作用,抑制细胞色素C的释放;XIAP是抗细胞凋亡分子,可拮抗多种Caspase介导的凋亡反应。胎儿在宫内缺氧环境下会出现氧化应激反应,产生自由基,造成氧化性损伤[14]。自由基产生过程中会导致胎儿体内各组织发生氧化反应,其中脂质的氧化产物为MDA与ox-LDL[15],花生四烯酸氧化产物有8-ios,因此MDA、ox-LDL、8-ios的产生均与自由基生成量有着密切联系[16]。HSP-70则是细胞中的伴生分子。细胞发生氧化损伤时,机体出现代偿性反应[17],而HSP-70在代偿性反应时具有高表达特征。从MDA、ox-LDL、8-ios、HSP-70等反应产物的含量能推测出胎儿与母体的损伤程度,当脐血流量减少时,氧化反应加剧,MDA、ox-LDL、8-ios、HSP-70含量增加。
本试验结果显示,缺氧组不同孕期RI、PI、S/D高于正常组,说明缺氧组血流量减少,血管终末阻力增大。缺氧组脐带血和胎盘组织中测得的氧化应激产物MDA、oxLDL、8-ios、HSP-70高于正常组,且RI、PI、S/D分别与MDA、oxLDL、8-ios、HSP-70呈正相关,说明宫内缺氧过程中氧化反应加剧,细胞凋亡进程加快,相关氧化应激产物增加。缺氧组胎盘组织中细胞凋亡分子Fas、FasL、Bax水平高于正常组;Bcl-2、XIAP低于正常组。超声参数RI、PI、S/D与Fas、FasL、Bax呈正相关,与Bcl-2、XIAP呈负相关,说明因氧化反应加剧,促进细胞凋亡的Fas、FasL、Bax含量增加,具有拮抗作用的Bcl-2、XIA会相应减少。因此,检测宫内缺氧胎儿脐血流超声参数可以有效预测胎儿缺氧情况,避免减少因缺氧导致的氧化损伤,提早指导临床诊断及干预。
[1] Wang KC, Botting KJ, Zhang S, et al. Aktsignaling as a mediator of cardiac adaptation to low birth weight[J]. J Endocrinol, 2017,233(2):R81-R94.
[2] 郭琳娜,张志坤.脑胎盘率诊断胎儿宫内缺氧的研究进展[J].国际妇产科学杂志,2017,44(1):71-74.
[3] Mehboob R, Substance P. Neurokinin 1 and trigeminal system: a possible link to the pathogenesis in sudden perinatal deaths[J]. Front Neurol, 2017,3(12):82-83.
[4] Nardozza LM, Caetano AC, Zamarian AC, et al. Fetal growth restriction: current knowledge[J]. Arch Gynecol Obstet, 2017,3(11):35-37.
[5] Soto SM, Blake AC, Wesolowski SR, et al. Myoblastreplication is reduced in the IUGR fetus despite maintained proliferative capacity in vitro[J]. J Endocrinol, 2017,232(3):475-491.
[6] Depoix CL, de Selliers I, Hubinont C, et al. HIF1A and EPAS1 potentiatehypoxia-induced upregulation of inhibin alpha chain expression in human termcytotrophoblasts in vitro[J]. Mol Hum Reprod, 2017,23(3):199-209.
[7] 柳艳丽,唐震海,王能里,等.腺苷A_(2A)受体拮抗剂SCH58261减轻胎兔缺氧缺血性脑损伤[J].中国病理生理杂志,2016,12(14):2139-2146.
[8] Chevallier M, Debillon T, Pierrat V, et al. Leading causes of preterm delivery as risk factors for intraventricular hemorrhage in very preterm infants: results of the EPIPAGE 2 cohort study[J]. Am J Obstet Gynecol, 2017,1(16):77-79.
[9] Bavis RW, MacFarlane PM. Developmental plasticity in the neural control ofbreathing[J]. Exp Neurol, 2017,287(Pt2):176-191.
[10] 方丽君,熊大明.三维彩超用于绕颈脐带胎儿宫内缺氧的诊断价值分析[J].现代诊断与治疗,2016,22(54):4343-4344.
[11] Um J, Jung DW, Williams DR. Lessons from the swamp:developing small moleculesthat confer salamander muscle cellularization in mammals[J]. Clin Transl Med, 2017,6(1):13-14.
[12] M HR, Ghosh D, Banerjee R, et al. Suppression of VEGF-inducedangiogenesis and tumor growth by Eugenia jambolana Musa paradisiaca and Coccinia indica extracts[J]. Pharm Biol, 2017,55(1):1489-1499.
[13] 肖青,彭娟.彩色多普勒超声联合监测重度子痫前期患者胎儿脐动脉及大脑中动脉的价值探讨[J].中国妇幼卫生杂志,2016,6(54):56-60.
[14] Bitto A, Giuliani D, Pallio G, et al. Effects of COX1-2/5-LOX blockade in Alzheimer transgenic 3xTg-AD mice[J]. Inflamm Res, 2017,66(5):389-398.
[15] 邹学红.围手术期胎儿宫内缺氧对剖宫产术后母体氧化应激损伤的影响[J].海南医学院学报,2017,3(32):394-396,400.
[16] Almeida MF, Kawakami MD, Moreira LM, et al. Early neonatal deaths associated with perinatal asphyxia in infants ≥2 500 g in Brazil[J]. J Pediatr (Rio J), 2017,3(2):32-34.
[17] Barhoumi MH, Bannour B, Barhoumi T, et al. Acute organophosphorus intoxications in pregnant women[J]. Pan Afr Med J, 2016,25(4):227.
青海省卫生计生指导性科研课题(2016-wjqn-84)。
10.3969/j.issn.1002-266X.2017.29.014
R714
B
1002-266X(2017)29-0044-03
2017-04-26)

