早期胃癌浸润深度影响因素及DPS对浸润深度的预测价值
程畅,叶乐平,汪胡根,汪祺,李杨,张亚铭,李敏,王亚雷
(1安徽医科大学第一附属医院,合肥230022;2安徽医科大学附属安庆医院)
早期胃癌浸润深度影响因素及DPS对浸润深度的预测价值
程畅1,2,叶乐平2,汪胡根2,汪祺2,李杨2,张亚铭2,李敏2,王亚雷1
(1安徽医科大学第一附属医院,合肥230022;2安徽医科大学附属安庆医院)
目的 探讨早期胃癌浸润深度的影响因素及浸润深度预测评分系统(DPS)协助判断浸润深度的价值。方法 经内镜下黏膜剥离术或外科手术确诊的早期胃癌患者38例,收集其临床资料及术前胃镜图片,选择本科室5年以上内镜操作经验的同年资主治医师6位,将其随机分为评分组和对照组各3位,评分组采用DPS、对照组采用白光内镜判断早期胃癌浸润深度。判断结果分为黏膜内或黏膜下层浅浸润、黏膜下层深浸润,评分组的判断结果分别命名为S1、S2、S3组,对照组分别命名为C1、C2、C3组。比较各组判定结果,并分析早期胃癌浸润深度的影响因素。结果 病灶合并溃疡和边缘隆起与黏膜下层深浸润相关(P均<0.05),而性别、年龄、肿瘤部位、肿瘤大小、内镜形态学分型、组织学分型、脉管癌栓、病灶显著发红以及表面不整与浸润深度无关(P均﹥0.05);评分组的各亚组判断准确率均高于对照组各亚组(P均<0.05)。结论 早期胃癌黏膜下层深浸润的影响因素为合并溃疡和病灶边缘隆起;DPS能提高早期胃癌浸润深度判断的准确率。
胃癌;浸润深度预测评分系统;胃镜;浸润深度
近年随着内镜下黏膜剥离术(ESD)技术的成熟,不超过黏膜下层浅层的早期胃癌患者接受ESD治疗效果与传统外科手术类似[1]。术前准确判断病灶的浸润深度及淋巴结转移风险成为决定治疗方式和效果的关键。目前大多采用普通白光内镜下观察病灶形态以及超声内镜检查判断早期胃癌浸润深度,但这两种方法均存在较大的主观性,导致判断结果存在较大差异。近年有国外学者建立了浸润深度预测评分系统(DPS)[2],根据分值辅助判断是否存在黏膜下层深浸润。但该评分系统目前并未得到广泛应用,且国内相关研究较少。本研究回顾分析了安徽医科大学附属安庆医院近几年进行ESD或者外科手术治疗的早期胃癌患者资料,分析早期胃癌浸润深度的影响因素,比较内镜医师经验性判断与依据DPS判断的准确性,探讨DPS对早期胃癌浸润深度判断的价值。
1 资料与方法
1.1 临床资料 选择2010年11月~2016年9月经ESD或者外科手术治疗的早期胃癌患者38例,均经病理检查确诊。纳入标准:①按照2010年世界卫生组织新分类(维也纳分类)标准[3],确诊为早期胃癌(包括高级别上皮内瘤变);②术前在本院行胃镜检查,有完整清晰内镜图片资料。排除标准:①术前胃镜资料不全面以及胃镜图片不清晰;②因外院胃镜下取活组织检查,影响本院病变形态判断。其中男29例(76.3%)、女9例(23.7%),年龄35~85(60.8±10.2)岁。分化型癌(高-中分化管状腺癌、乳头状腺癌)22例(57.9%),未分化型癌(低分化腺癌、未分化癌、印戒细胞癌、黏液腺癌)16例(42.1%);黏膜内或黏膜下层浅浸润癌28例(73.7%),黏膜下层深浸润癌10例(26.3%);合并溃疡16例(42.1%),未合并溃疡 22例(57.9%);肿瘤位于上1/3胃6例,中1/3胃16例,下1/3胃16例;最大直径≤1 cm 6例,>1~2 cm 10例,>2~3 cm 10例,>3 cm 12例;内镜分型参照巴黎分型[4]分为Ⅰ型2例,Ⅱ型18例,Ⅲ型18例;合并有脉管癌栓5例,无脉管癌栓33例;病灶边缘隆起8例,无隆起30例;病灶显著发红21例,非显著发红17例;病灶表面平整22例,不平整16例。
1.2 研究方法 通过内镜资料库调取38例患者术前白光内镜图片,选择本科室5年以上内镜操作经验的同年资主治医师6位,将其随机分为评分组和对照组,每组3位。对照内镜图片分别判断浸润深度,判断结果分为黏膜内或黏膜下层浅浸润,黏膜下层深浸润。比较两组判定结果差异。评分组:3位医师对病灶浸润深度依据DPS判断,评分标准[2]:病变长径≥30 mm为2分,边缘隆起为2分,显著发红为1分,表面不平整为1分。通过以上4项判断病变浸润深度,总分≥3分则判断为黏膜下层深浸润,<3分为黏膜内或黏膜下层浅浸润;判断结果依次编号为S1、S2、S3组。对照组:3位医师对病灶浸润深度进行经验性判断,经验性判断依据为:①黏膜内或黏膜下层浅浸润:隆起型病灶表面或者凹陷型病灶基底部平滑,边缘隆起不显著,皱襞平缓地集中;②黏膜下层深浸润:不规则的表面,显著的边缘隆起,皱襞杵状增大、中断以及融合[5]。所得结果编号为C1、C2、C3组。
1.3 统计学方法 采用SPSS17.0统计软件。计数资料采用频次或百分比表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 早期胃癌浸润深度的影响因素 病变是否合并溃疡(P=0.037)、边缘隆起(P=0.013)与早期胃癌黏膜下深浸润相关。性别、年龄、肿瘤部位、肿瘤大小、内镜形态学分型、组织学分型、脉管癌栓、病灶显著发红、病灶表面不整与胃癌是否有深部浸润无关(P均>0.05)。见表1。
2.2 DPS对于早期胃癌浸润深度的诊断价值 S1、S2、S3 组判断准确率分别为84.2%(32/38)、81.6%(31/38)、78.9%(30/38),C1、C2、C3组判断准确率分别为 57.9%(22/38)、63.1%(24/38)、55.3%(21/38),评分组判断准确率均高于对照组(P均<0.05)。其中S1、S2、S3组之间以及C1、C2、C3组之间比较,P均﹥0.05;C1、C3与 S1、S2、S3组之间差异均有统计学意义(P均<0.05);C2与S1之间差异有统计学意义(P<0.05),与S2、S3之间差异无统计学意义(P均﹥0.05)。22例分化型早期胃癌判断结果中,S1、S2、S3 组判断准确率分别为95.5%(21/22)、90.9%(20/22)、90.9%(20/22),C1、C2、C3组判断准确率分别为 68.2%(15/22)、77.3%(17/22)、72.7%(16/22),S1与C1、C3之间差异有统计学意义(P均<0.05)。16例未分化型早期胃癌判断结果中,S1、S2、S3 组判断准确率分别为68.8%(11/16)、68.8%(11/16)、62.5%(10/16),C1、C2、C3组判断准确率分别为 43.8%(7/16)、43.8%(7/16)、31.3%(5/16), C3组与S1、S2组之间差异有统计学意义(P均<0.05)。
2.3 DPS误诊患者资料 评分组共有8例患者判断错误,诊断过度(将黏膜内癌诊断为黏膜下层癌)7例,诊断不足(将黏膜下层癌诊断为黏膜内癌)1例。 其中年龄≥60岁5例(62.5%),年龄<60岁3例(37.5%);肿瘤位于中1/3 3例(37.5%),下1/35例(62.5%);肿瘤大小≥3.0 cm 3例(37.5%),<3.0 cm 5例(62.5%);内镜形态学分型Ⅰ型2例(25.0%),Ⅱ型1例(12.5%),Ⅲ型5例(67.5%);合并溃疡3例(37.5%),未合并溃疡5例(62.5%);未分化型癌6例(75.0%),分化型癌2例(25.0%);有脉管癌栓1例(12.5%),无 7例(87.5%);浸润深度为黏膜肌层2例,固有层4例,上皮层1例,黏膜下深层1例;DPS评分为4分3例,3分4例,1分1例。
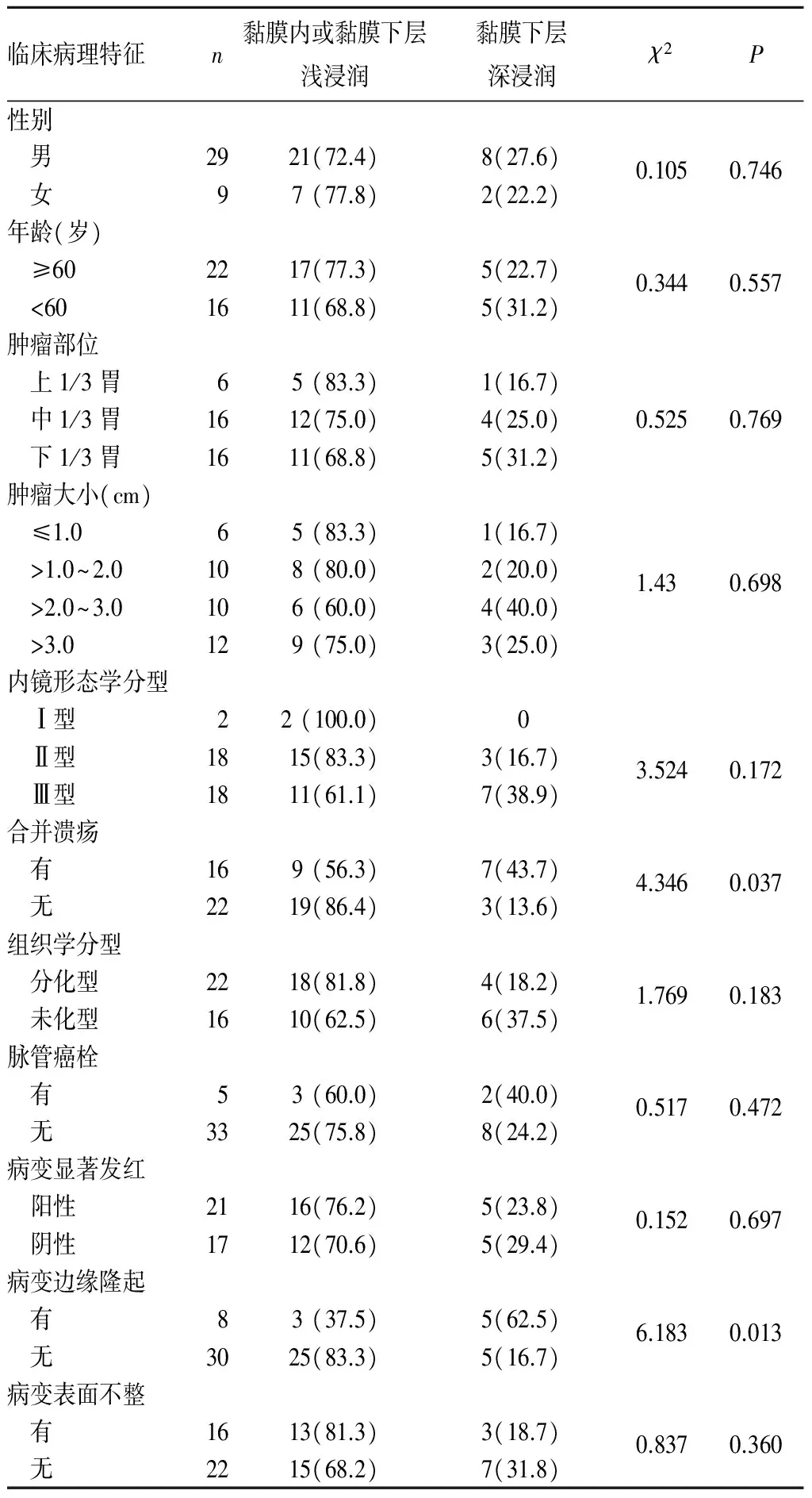
表1 患者临床病理特征与浸润深度关系[例(%)]
3 讨论
随着内镜下治疗技术的进步,对于不伴有淋巴结转移的早期胃癌,内镜治疗效果类似于外科手术,能达到90%以上的治愈率[1],且患者花费低、术后恢复快、不影响消化道生理功能,因此近年ESD逐渐在临床得到普及。而准确判断肿瘤的浸润深度是选择最佳治疗方式,使患者获得最佳预后的重要步骤。对于食道和大肠而言,采用窄带谱成像放大内镜观察食道癌表面的鳞状上皮乳头内毛细血管袢和大肠癌表面的微血管形态,可以对肿瘤的浸润深度作出较准确的诊断,准确率为80%~90%[6,7]。但目前早期胃癌的浸润深度判断尚没有标准化的理论体系,临床操作也很难把握,存在很大主观性。目前大多通过白光内镜下经验性判断和超声内镜检查来进行[8]。有研究指出,术前对于浸润深度的误判是导致ESD后追加手术的最常见原因[9]。因此建立术前有效判断早期胃癌浸润深度的标准化方法非常重要。
本研究发现性别、年龄、肿瘤部位、肿瘤大小、内镜形态学分型、组织学分型、脉管癌栓等与浸润深度无关,病灶显著发红、表面不整也与浸润深度无关,而病灶边缘不整齐提示黏膜下层深浸润。研究结果与国外部分研究[10,11]类似。但在Abe等[2]研究中,病灶的大小、内镜下形态,病灶边缘隆起、显著发红、表面不整 、存在溃疡、粗大皱襞等均与浸润深度有关。这种差异反映早期胃癌浸润深度的影响因素仍存在部分争议,现阶段尚无标准体系用于临床判断。
普通白光胃镜下判断早期胃癌浸润深度准确率多在70%~80%[10]。有研究[5]通过白光内镜特点判断2 105例早期胃癌患者的浸润深度,正确率为78.0%,其中黏膜下癌的判断正确率为72%。另有研究[11]则指出隆起型黏膜内癌多小于3 cm,黏膜下层癌相对更大,多呈溃疡型,通过大小和隆起的表面是否光整可判断浸润深度,若边缘皱襞出现融合以及基底部凹凸不平则更支持黏膜下癌诊断。然而,这种判断方法更多依赖于医生的临床经验。本研究中3例医生经验判断的准确性为55.3%~63.1%(平均58.8%),低于国外相关报道,这可能与中国医生缺乏系统的培训,对病变观察不够细致有关。
Abe等[2]2011年根据不同浸润深度病变的内镜特点不同,提出DPS评分标准,该评分系统通过四项指标来简化诊断步骤,减少主观性,易于初学者掌握,其判断分化型早期胃癌浸润深度的准确率为82.5%~84.8%。而本研究对比6位内镜医师白光内镜判断结果,发现使用DPS的3位医师,判断结果为78.9%~84.2%(平均81.6%),均优于对照组,提示该评分标准能提高判断准确性。
一般认为,未分化型癌浸润深度判断难度大于分化型癌,且因其恶性度高,早期易发生转移[12],镜下判断更需慎重。未分化型早期胃癌呈弥漫性浸润、破坏性增殖,黏膜色泽发白为主,常有正常上皮覆盖表面,干扰镜下判断边界及表面形态,所以Abe建立的评分系统主要针对分化型癌。本研究中,分化型癌中评分组判断准确率高于对照组,优于Abe报道结果。分析DPS对未分化型癌的浸润深度判断价值,发现评分组判断准确率同样高于对照组,但由于样本量限制,该评分系统对于判断未分化型癌浸润深度的准确性仍需要进一步研究。
本研究发现,使用DPS更易发生诊断过度。分析8例患者的临床病理特征,发现肿瘤位于胃的中下部、未分化癌发生误判比率相对较高。但因样本量过小,未进行统计学分析,有待建立更大样本量来进一步证实。
本研究尚有不足之处,一是样本量较少,二是参与研究的内镜医师通过图片判断浸润深度,非亲自操作内镜并动态观察,可能对于判断结果有一定影响。按照日本学者经验,无论经验性判断还是使用该评分系统判断早期胃癌浸润深度,规范内镜操作、术前积极进行胃腔清洁、术中控制充气量,配合化学染色多方面观察病灶形态,有利于提高诊断准确率[13]。
综上所述,本研究表明早期胃癌合并溃疡、边缘隆起易出现黏膜下层深浸润,通过辅助使用DPS能提高白光内镜下判断早期胃癌浸润深度的准确率。
[1] Chiu PW, Teoh AY, To KF, et al. Endoscopic submucosal dissection (ESD) compared with gastrectomy for treatment of early gastric neoplasia: a retrospective cohort study[J]. Surg Endosc, 2012,26(12):3584-3591.
[2] Abe S, Oda I, Shimazu T, et al. Depth-predicting score for differentiated early gastric cancer[J]. Gastric Cancer, 2011,14(1):35-40.
[3] 李增山,李青.2010年版消化系统肿瘤WHO分类解读[J].中华病理学杂志,2011,40(5):351-354.
[4] Participants in the Paris Workshop. The Paris endoscopic classification of superficial neoplastic lesions:esophagus, stomach, and colon:November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003,58(6 Suppl):S3-S43.
[5] Choi J, Kim SG, Lm JP, et al. Endoscopic prediction of tumor invasion depth in early gastric cancer[J]. Gastrointest Endosc, 2011,73(5):917-927.
[6] 王亚雷,冯慧,孙斌,等.窄带谱成像放大胃镜在早期食管鳞癌及癌前病变中的诊断价值[J].安徽医科大学学报,2015,50(11):1708-1710.
[7] Ikematsu H, Kaneko K, Fukuda D, et al. Accuracy of capillary pattern classification using NBI magnification for diagnosis of eolorectal lesions[J]. Gastrointest Endosc, 2008,67(5):AB311.
[8] 中华医学会消化内镜分会,中国抗癌协会消化内镜专业委员会.中国早期胃癌筛查及内镜诊治共识意见[J].中华消化内镜杂志,2014,31(7):361-377.
[9] Lee JH, Min YW, Lee JH, et al. Diagnostic group classifications of gastric neoplasms by endoscopic resection criteria before and after treatment: real-world experience[J]. Surg Endosc, 2016,30(9):3987-3993.
[10] Sano T, Okuyama Y, Kobori O, et al. Early gastric cancer. Endoscopic diagnosis of depth of invasion[J]. Dig Dis Sci, 1990,35(11):1340-1344.
[11] Seo SW, Jeong HY, Lee SM, et al. Endoscopic diagnosis of the depth of invasion in early gastric cancer[J]. J Korean Med Sci, 2001,60(4):330-336.
[12] Gotoda T, Yanagisawa A, Sasako M, et al. Incidence of lymph node metastasis from early gastric cancer:estimation with a large number of cases at two large centers[J]. Gastric Cancer, 2000,3(4):219-225.
[13] Gotoda T, Uedo N, Yoshinaga S, et al. Basic principles and practice of gastric cancer screeningusing high-definition white light gastroscopy: eyes can only see what the brain knows[J]. Dig Endosc, 2016,28(Suppl1):2-15.
Influencing factors of invasion depth and the diagnostic value of depth-predicting score in early gastric cancer
CHENGChang1,YELeping,WANGHugen,WANGQi,LIYang,ZHANGYaming,LIMin,WANGYalei
(1TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China)
Objective To study the influencing factors of early gastric cancer invasion depth and the clinical value of depth-predicting score (DPS) in the diagnosis of invasion depth of early gastric cancer.Methods We collected the clinical data and gastroscope images before surgery from 38 early gastric cancer patients diagnosed by ESD or surgery in our hospital. Six physicians with more than 5 years of endoscopic operation experience were randomly divided into the score group and control group with 3 in each group. DPS was used by the score group and white light endoscope was used in the control group to determine the invasion depth of early gastric cancer. The results were divided into the superficial infiltration of intramucosa or submucosa, and deep infiltration of submucosa. The judgment results of the scoring group were named group S1, group S2 and group S3, and those of the control group were named group C1, group C3 and group C3. The results of each group were compared and the influencing factors of invasion depth of early gastric cancer were analyzed.Results Lesions combined with ulcer and marginal eminence were related to deep submucosal infiltration (all P <0.05), while other factors, including gender, age, tumor location, tumor size, morphological type, histological type, vascular tumor emboli, marked redness, and surface irregularity, were not related factors (allP>0.05). The accuracy of each subgroup in the scoring group was higher than that in the control group (allP<0.05).Conclusion Early gastric cancer complicated with ulcer and marginal eminence are the risk factors for submucosal invasion, and DPS could improve the accuracy of determining invasive depth of early gastric cancer.
gastric carcinoma; depth-predicting score; gastroscopy; depth of invation
安徽省公益性技术应用研究联动计划项目(1501LD04043)。
程畅(1982-),男,主治医师,主要研究方向为消化道肿瘤。E-mail:31374558@qq.com
王亚雷(1973-),男,副教授,主要研究方向为消化道肿瘤、功能性消化疾病等。E-mail:alei416@163.com
10.3969/j.issn.1002-266X.2017.29.005
R735.2
A
1002-266X(2017)29-0016-04
2017-04-27)

