蛛网膜下腔内注射TSA对RTX诱导神经病理性疼痛的影响及机制
陈文佳,孟晓文,王丽娜,詹英,嵇富海,杨建平
(苏州大学附属第一医院,江苏苏州215000)
蛛网膜下腔内注射TSA对RTX诱导神经病理性疼痛的影响及机制
陈文佳,孟晓文,王丽娜,詹英,嵇富海,杨建平
(苏州大学附属第一医院,江苏苏州215000)
目的 探讨蛛网膜下腔内注射古菌素A(TSA)对树酯毒素(RTX)诱导的神经病理性疼痛的影响及机制。方法 雄性健康SD大鼠24只,用随机数字表法均分成Vehicle组、RTX组、RTX+DMSO组、RTX+TSA组。除Vehicle组外均进行神经病理性疼痛造模处理,并于建模前1周对RTX+DMSO组及RTX+TSA组进行蛛网膜下腔置管。Vehicle组单次腹腔注射RTX的溶媒1.5 mL;RTX组单次腹腔注射RTX 210 μg/kg; RTX+DMSO组建模前60 min及建模后每天蛛网膜下腔内注射5%的DMSO 10 μL,连续注射7 d;RTX+TSA组建模前60 min及建模后每天蛛网膜下腔内注射TSA 0.5 μg/kg,其溶媒为5%的DMSO。建模前各组大鼠采用von Frey丝检测后肢足底基础痛阈值,建模后第1、3、5、7天测定机械痛阈值。于最后1次蛛网膜下腔内注射后2 h取材,采用qRT-PCR方法测定脊髓及脊神经背根节脑源性神经营养因子(BDNF) mRNA的表达。结果 与Vehicle组相比,RTX组、RTX+DMSO组、RTX+TSA组在建模后第3、5、7天,机械痛阈值降低(P均<0.05);与RTX组和RTX+DMSO组相比,RTX+TSA组第5、7天建模机械痛阈值升高(P均<0.05);RTX组与RTX+DMSO组各时点相比,P均>0.05。与Vehicle组相比,RTX组和RTX+DMSO组脊髓及脊神经背根节 BDNF mRNA表达下调(P均<0.05);与RTX组和RTX+DMSO组比较,RTX+TSA组脊髓及脊神经背根节 BDNF mRNA表达上调(P均<0.05);RTX组与RTX+DMSO组相比,P均>0.05。结论 蛛网膜下腔内注射TSA可通过上调BDNF的表达缓解RTX诱导的大鼠神经病理性疼痛。
神经病理性疼痛;曲古菌素A;脑源性神经营养因子;树酯毒素;大鼠
带状疱疹后遗神经痛(PHN)继发于水痘带状疱疹病毒感染,是最常见和最严重的并发症,严重影响患者的生活质量,且其发病率近年随人口老龄化增加而升高[1]。脑源性神经营养因子(BDNF)作为疼痛研究的靶点越来越得到关注。BDNF与表观遗传学的关系近年也得到验证。研究表明,曲古菌素A(TSA)是一种组蛋白去乙酰化酶抑制剂(HDACI),可以通过抑制甲基化CpG结合蛋白2[2],进而恢复细胞因子、趋化因子和BDNF的稳态平衡,从而起到神经修复与镇痛作用。基于树酯毒素(RTX)诱导的神经病理性疼痛模型模拟PHN得到世界认可[3],2016年9月~2017年2月,本研究应用该神经病理性疼痛模型探讨蛛网膜下腔内注射TSA对该模型大鼠神经病理性疼痛的影响及其机制,以期为PHN的治疗提供理论依据。
1 材料与方法
1.1 动物、试剂、仪器及其来源 成年雄性SD大鼠24只,体质量180~200 g,由昭衍(苏州)新药研究中心有限公司提供,许可证号SCXK(苏)2013-0003。实验室光照时间8:00~20:00,温度18~22 ℃,湿度40%~60%,单笼喂养,自由充分饮食。主要试剂和仪器:TSA(Sigma公司,美国),RTX(LC Labs公司,美国);LightCycler®480 模块式高通量实时荧光定量PCR(Roche公司,瑞士),von Frey针刺触觉测量仪(Stoelting公司,美国)。
1.2 分组与模型建立 大鼠适应实验环境1周后,采用随机数字表法均分成4组(n=6):Vehicle组、RTX组、RTX+DMSO组和RTX+TSA组。于造模前1周对RTX+DMSO组及RTX+TSA组进行蛛网膜下腔置管:大鼠俯卧位于操作台,背部皮肤备皮后消毒,大鼠L3~4椎间隙作一竖直切口,长度2 cm左右,逐层暴露,钝性分离竖脊肌,充分暴露3~4椎间隙。用25号穿刺针行腰椎穿刺,感觉有突破感,则说明穿刺针头端已挑破椎间孔。缓慢退针,从椎间孔破口沿着穿刺针的径路插入PE-10导管,导管向大鼠头端置入约2 cm,大鼠出现甩尾,且有清亮的脑脊液流出,说明导管已经置入蛛网膜下腔。将PE导管的近端用手术缝线与韧带结扎,逐层缝合肌肉、筋膜。妥善固定,用碘伏消毒皮肤伤口,缝皮。于第6天用利多卡因验证是否置管成功,如出现肢体瘫痪、感染或导管脱出则剔除实验。在蛛网膜下腔内置管1周大鼠损伤恢复后,测定各组大鼠基础痛阈值,除Vehicle组外,其余三组均建模处理,建模方式为每只大鼠在氟烷(2%氧)麻醉下接受单次RTX腹腔注射210 μg/kg建立神经病理性疼痛模型。Vehicle组建模方式为单次腹腔注射RTX的溶媒,其成分为10% Tween 80、10%乙醇与生理盐水组成的混合液[3];RTX组单次腹腔注射RTX;RTX+TSA组在RTX腹腔注射建模前60 min以及建模后每天予大鼠蛛网膜下腔内注射TSA,并持续到建模后7 d。TSA蛛网膜下腔内注射剂量为0.5 μg/kg,TSA的溶剂为5%的DMSO。RTX+DMSO组在单次RTX腹腔注射前60 min与建模后蛛网膜下腔内注射5% DMSO,同样持续至建模后7 d。
1.3 机械痛阈值测定 建模前测定各组大鼠基础痛阈值,建模后第1、3、5、7天测定机械痛阈值,测定时间为蛛网膜下腔内给药后2 h。测量时将大鼠置于底部为铁丝网的有机玻璃笼中,待其适应后采用序贯法进行实验。机械痛阈值的测量采用Chaplan等(1994)报道的“up and down”方法[4]:将大鼠放在铁丝网架子上,待动物适应测试环境并能保持安静开始测量。将一系列校准的von Frey毛针垂直作用于后肢足底表面中部,注意避开不敏感的足垫位置,以不同强度(1.0、1.4、2、4、6、8、10、15、26、60、100 g)的力量弯曲6 s,大鼠轻快地撤回爪子或缩足则认为是阳性反应。连续测量5次取平均值。
1.4 脊髓及脊神经背根节 BDNF mRNA表达的测定 于最后一次蛛网膜下腔内给药后,随机取6只大鼠,腹腔注射4%水合氯醛400 mg/kg麻醉后,取L4~6脊髓组织,采用TRIzol Reagent提取总RNA。逆转录条件:42 ℃ 60 min,70 ℃ 5 min,4 ℃ 5 min终止反应。引物序列由上海生工公司合成。BDNF上游引物:5′-TGGCAAGACTTCAACTCAGC-3′,下游引物:5′-CTCCATCATCAAAAAGCCCCA-3′,产物长度146 bp;β-actin上游引物:5′-CCCATCTATGAGGGTTACGC-3′,下游引物:5′-TTTAATGTCACGCACGATTTC-3′,产物长度150 bp。建立如下反应体系:Eva green 5 μL,上游引物 1 μL,下游引物 1 μL,DEPC水 1.5μL,cDNA模版 1.5 μL。扩增条件为95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,共40个循环。采用2-ΔΔCT法计算目的基因的相对表达水平。
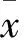
2 结果
2.1 四组各时点机械痛阈值比较 见表1。
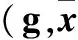
表1 四组各时点机械痛阈值比较±s)
注:与Vehicle组比较,aP<0.05;与RTX组或RTX+DMSO组比较,bP<0.05。
2.2 四组不同部位BDNF mRNA相对表达比较 Vehicle组、RTX组、RTX+DMSO组、RTX+TSA组脊髓中BDNF mRNA分别为1.01±0.03、0.20±0.04、0.23±0.02、0.54±0.03;脊神经背根节中BDNF mRNA分别为1.00±0.03、0.33±0.02、0.35±0.03、0.61±0.03。RTX组与RTX+DMSO组脊髓与脊神经背根节中BDNF mRNA呈低表达,两组比较,P>0.05。RTX组和RTX+DMSO组脊髓及脊神经背根节中BDNF mRNA较Vehicle组表达下降(P均<0.01);与RTX组和(或)RTX+DMSO组比较,RTX+TSA组脊髓及脊神经背根节BDNF mRNA表达升高(P均<0.05)。
3 讨论
PHN以老年患者多见,疼痛顽固而剧烈,常持续数月甚至数年,治疗困难,其发生机制复杂。由于临床研究纳入标准不一致、缺乏严格的对照使其影响因素较多,试验结果差异很大。因此动物实验的基础研究尤为重要。传统的PHN模型应用水痘-带状疱疹病毒诱导,其结果是造成机械痛超敏与热痛过敏,而临床上PHN患者多数为机械痛超敏而无热痛过敏[3]。本文应用的神经病理性疼痛模型即给大鼠单次腹腔注射辣椒素受体激动剂RTX,模拟病毒对脊神经节感觉神经元的损毁,有效地去除了表达热敏感通道辣椒素受体的脊神经节小直径神经元和无髓传入C纤维,故出现热痛失敏现象;同时仅损伤部分Aβ有髓传入神经纤维,引起有髓神经纤维轴突肿胀和髓鞘变形,并向脊髓背角浅层长芽,引起机械痛觉超敏,这两种痛行为的改变很好地模拟了PHN患者的临床症状[3]。
近期研究[5]显示,BDNF可能参与了神经病理性疼痛和炎性痛的发生过程。在慢性疼痛等异常状态下,由非神经细胞(主要是小胶质细胞)合成和分泌的较正常状态下高出数十倍乃至上千倍BDNF,可促使痛觉过敏的发生和发展。也有研究显示,BDNF的合成增加,可作用于脊髓神经元的酪氨酸激酶受体B,从而抑制钾氯转运体表达,使得细胞内氯离子的内稳态破坏,造成抑制性神经递质的异常去极化,出现神经病理性疼痛[6]。另一方面,BDNF在中枢可以通过增加自由基清道夫的活性减少氧自由基诱导的神经元凋亡;并通过调节细胞外钙流入或释放细胞内储存钙维持细胞内钙浓度,从而抑制氨基酸中毒[7],促进神经干细胞的分化和神经细胞生长,对神经起保护作用。可见BDNF在神经系统中具有双重作用。目前,BDNF在PHN中作用的研究较少,其作用机制尚不明确。
BDNF在中枢的来源主要为胶质细胞,在外周为中小直径的神经元,已知在某些疾病中,尽管存在胶质细胞的激活,但BDNF的表达却是减少的,因此BDNF的减少在其疾病的发生发展中可能发挥重要作用[8]。本试验发现,BDNF在PHN疼痛模型中的中枢脊髓与外周脊神经背根节的表达降低。国内外研究中也指出,PHN患者中枢神经系统BDNF等神经因子表达降低[9,10],本研究结果与其一致。有学者应用恩再适及普瑞巴林治疗PHN患者,结果外周血BDNF的表达水平上升,患者疼痛减轻,且恩再适或普瑞巴林应用后BDNF的表达上升,其水平与VAS呈正相关,提示BDNF的增加与PHN患者疼痛减轻具有相关性[10]。
TSA作为一种HDACI对多种炎症反应起到调节作用,由于不同的HDACs具有不同的乙酰化模式,调节不同的基因,所以HDACI在免疫性疾病中通过调节不同的免疫因子而起作用[11]。TSA在疼痛中应用的研究较少,目前基于多发性硬化症所致的中枢神经病理性疼痛研究显示,TSA在神经修复与镇痛中发挥重要作用[2]。Hasan等[12]的研究也指出,TSA增强BDNF的表达在神经保护和受损神经系统恢复中起重要作用,而一定浓度的BDNF也会增加脊神经节神经元的存活数量。BDNF在表观遗传学上调控途径的实现还可以通过其他途径。有试验表明,RE1沉默转录因子(REST)和CoREST是两个转录抑制因子,参与BDNF基因转录抑制,REST和CoREST可能是髓鞘再生和(或)髓鞘修复潜在的生物学靶点[13]。无论基于何种理论基础,BDNF的表达在癌性疼痛、神经病理性疼痛等疼痛相关疾病的发病机理与治疗中发挥重要作用。
PHN发病过程中存在外周中小神经元的损伤[14],某些PHN模型证实在中枢神经系统中,存在星形胶质细胞的活化[15]。基于上述理论,我们推测,在外周神经系统,比如脊神经节中,中小直径神经元的减少或者破坏导致BDNF表达降低,而中枢星形胶质细胞虽然广泛活化表达,但该模型胶质细胞源性BDNF的表达却减少。有研究者认为TSA可以作用于星形胶质细胞,从而在中枢增加星形胶质细胞源性的BDNF增加,在RTX诱导的神经痛模型中起到中枢神经保护作用,促进RTX组大鼠感觉器官的恢复[16]。而在外周,在脊神经节中TSA增加BDNF的表达,可能使得神经细胞存活增多[17],神经纤维功能得以恢复从而减轻疼痛或者延缓疼痛的产生。另外,在诸多PHN模型及临床病例中显示,PHN大鼠或者患者在中枢或外周存在炎症反应,基于TSA调节免疫反应的特性,在本模型中,TSA可能降低了中枢与外周的炎性反应,从而达到镇痛的效应,但其具体机制还需进一步探究。
综上所述,TSA作为HDACI可能通过调节中枢及外周BDNF的表达,缓解RTX诱导的神经病理性疼痛。
[1] 涂涛,董蜀华.带状疱疹后遗神经痛大鼠脊髓背角组织MITOL表达变化及意义[J].山东医药,2015,55(23):24-25.
[2] KhorshidAhmad T, Acosta C, Cortes C, et al. Transcriptional regulation of brain-derived neurotrophic factor (BDNF) by methyl CpG binding protein 2 (MeCP2): a novel mechanism for re-myelination and/or myelin repair involved in the treatment of multiple sclerosis (MS)[J]. Mol Neurobiol, 2016,53(2):1092-1107.
[3] Chen SR, Pan HL. Effect of systemic and intrathecal gabapentin on allodynia in a new rat model of postherpetic neuralgia[J]. Brain Res, 2005,1042(1):108-113.
[4] Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994,53(1):55-63.
[5] Geremia NM, Pettersson LM, Hasmatali JC, et al. Endogenous BDNF regulates induction of intrinsic neuronal growth programs in injured sensory neurons[J]. Exp Neurol, 2010,223(1):128-142.
[6] 郭晓强.脑源性神经营养因子信号转导在神经病理性疼痛中的作用[J].中国神经精神疾病杂志,2007,33(7):445-446.
[7] Wang Y, Cao M, Liu A, et al. Changes of inflammatory cytokines and neurotrophins emphasized their roles in hypoxic-ischemic brain damage[J]. Int J Neurosci, 2013,123(3):191-195.
[8] Wei H, Qu H, Wang H, et al. Serum brain-derived neurotrophic factor levels and sleep disorders in Chinese healthy and newly diagnosed type 2 diabetic subjects[J]. J Diabetes, 2017,9(2):180-189.
[9] Zhao W, Wang Y, Fang Q, et al. Changes in neurotrophic and inflammatory factors in the cerebrospinal fluid of patients with postherpetic neuralgia[J]. Lett, 2017,10(637):108-113.
[10] Saxena AK, Lakshman K, Sharma T, et al. Modulation of serum BDNF levels in postherpetic neuralgia following pulsed radiofrequency of intercostal nerve and pregabalin[J]. Pain Manag, 2016,6(3):217-227.
[11] Royce SG, Dang W, Yuan G, et al. Effects of the histone deacetylase inhibitor, trichostatin A, in a chronic allergic airways disease model in mice[J]. Arch Immunol Ther Exp (Warsz), 2012,60(4):295-306.
[12] Hasan MR, Kim JH, Kim YJ, et al. Effect of HDAC inhibitors on neuroprotection and neurite outgrowth in primary rat cortical neurons following ischemic insult[J]. Neurochem Res, 2013,38(9):1921-1934.
[13] Abuhatzira L, Makedonski K, Kaufman Y, et al. MeCP2 deficiency in the brain decreases BDNF levels by REST/CoREST-mediated repression and increases TRKB production[J]. Epigenetics, 2007,2(4):214-222.
[14] Eyler N. Small fiber pathology——a culprit for many painful disorders[J]. Pain, 2016,157(Suppl 1):S60-S66.
[15] Blackbeard J, Wallace VC, O′Dea KP, et al.The correlation between pain-related behaviour and spinal microgliosis in four distinct models of peripheral neuropathy[J]. Eur J Pain, 2012,16(10):1357-1367.
[16] Wu X, Chen PS, Dallas S, et al. Histone deacetylase inhibitors up-regulate astrocyte GDNF and BDNF gene transcription and protect dopaminergic neurons[J]. Int J Neuropsychopharmacol, 2008,11(8):1123-1134.
[17] Lu J, Frerich JM, Turtzo LC, et al. Histone deacetylase inhibitors are neuroprotective and preserve NGF-mediated cell survival following traumatic brain injury[J]. Proc Natl Acad Sci U S A, 2013,110(26):10747-10752.
Effects of subarachnoid injection of TSA on RTX-induced neuropathic pain and its mechanism
CHENWenjia,MENGXiaowen,WANGLina,ZHANYing,JIFuhai,YANGJianping
(TheFirstAffiliatedHospitalofSoochowUniversity,Suzhou215000,China)
Objective To study the effects of subarachnoid injection of trichostatin A (TSA) on resiniferatoxin (RTX)-induced neuropathic pain in rats and its mechanism.Methods Twenty-four male SD rats were randomly divided into four groups (n=6): Vehicle group, RTX group, RTX+DMSO group, and RTX+TSA group. The models of neuropathic pain were established in the remaining three groups except Vehicle group. Subarachnoid catheterization was performed in the RTX+DMSO group and RTX+TSA group one week prior to modeling. Before the establishment of the models, the rats were sacrificed with von Frey filaments to detect the basal value of the pain, and the mechanical pain threshold was measured on the 1st, 3rd, 5th, and 7th days after modeling. Vehicle group was treated with a single peritoneal RTX solvent 1.5 mL; rats in the RTX group
intraperitoneal injection of RTX (210 μg/kg); from 60 min before RTX injection, 5% DMSO (10 μL) was injected into rats of the RTX+DMSO group intrathecally once a day for 7 days; from 60 min before RTX injection, TSA (0.5 μg/kg) with solvent of 5% DMSO was injected into rats of the RTX+TSA group intrathecally once a day. The expression of BDNF mRNA in the spinal cord (SC) and dorsal root ganglion (DRG) was measured by qRT-PCR at 2 h after last time of TSA injection.Results Compared with the Vehicle group, the RTX group, RTX+DMSO group, and RTX+TSA group displayed a significantly decrease in mechanical allodynia on the 3th, 5th, and 7th days (P<0.05). Compared with the RTX group and RTX+DMSO group, the RTX+TSA group had significantly higher mechanical pain threshold on 5th and 7th days (allP<0.05). There was no statistically significant difference between the RTX group and RTX+DMSO group (P>0.05). Compared with the Vehicle group, the expression of BDNF mRNA was down-regulated in the spinal cord and DRG in the RTX group and RTX+DMSO group (P<0.05). Compared with the RTX group and RTX+DMSO group, the expression of BDNF mRNA in the spinal cord was up-regulated in the RTX+TSA group (P<0.05). There was no statistically significant difference between the RTX+DMSO group and RTX group (P>0.05).Conclusion The subarachnoid injection of TSA can relieve RTX-induced neuropathic pain by up-regulating the expression of brain-derived neurotrophic factor (BDNF).
neuropathic pain; trichostatin A; brain-derived neurotrophic factor; resiniferatoxin; rats
国家自然科学基金资助项目(81471136);江苏省青年医学人才基金资助项目(QNRC2016740)。
陈文佳(1990-),男,硕士,主要研究方向为痛觉信息的传递与调控。E-mail:653377045@qq.com
王丽娜(1979-),女,副主任医师,主要研究方向为痛觉信息的传递与调控。E-mail:wangln@suda.edu.cn
10.3969/j.issn.1002-266X.2017.29.004
R741
A
1002-266X(2017)29-0012-04
2017-04-12)

