干热环境创伤失血性休克猪模型凝血功能的变化
段 越,李新宇,刘江伟,邢颜超,沈才福,张力民,安宗仁
干热环境创伤失血性休克猪模型凝血功能的变化
段 越1,2,李新宇2,刘江伟2,邢颜超2,沈才福1,2,张力民2,安宗仁1,2
目的 对比研究干热环境和常温环境下创伤失血性休克猪凝血功能的变化特点,以期为临床救治提供参考。方法 雄性长白仔猪40头,采用随机数字表法分为4组:干热环境创伤失血性休克组(简称干热休克组)、干热环境假手术组(简称干热假手术组)、常温环境创伤失血性休克组(简称常温休克组)和常温环境假手术组(简称常温假手术组),每组10只。干热环境组实验在人工干热环境中进行,在舱内热暴露3 h后建立创伤失血性休克模型。常温环境组的实验在常温常湿环境中进行,假手术组仅有剖腹手术,无创伤和放血相关操作。各组分别于实验前(基线),热暴露后3 h,休克后0 h、0.5 h、1 h、2 h、3 h共7个时间点取血。所取血液标本用于检测:血乳酸(lactate acid concentration,Lac)、血小板计数(platelet count,PLT)、凝血酶原时间(prothrombin time,PT)、纤维蛋白原(fibrinogen,Fbg)、血栓弹力图(thrombelastography,TEG)、D-二聚体(D-dimer),实验结束后取肺脏组织做病理检查。 结果 (1)实验结束时,干热休克组平均动脉压(mean arterial pressure,MAP)为各组最低,Lac为各组最高,PLT为各组最低(P<0.01);(2)实验过程中各组、各时间点间PT无统计学差异;实验结束时,干热休克组Fbg水平为各组最低,D-dimer水平为各组最高(P<0.01);(3)TEG结果显示:干热和常温休克组在创伤失血性休克后0.5 h均处于血液高凝期,实验结束时干热休克组血液呈低凝状态,而常温休克组仅表现为弹力图最大振幅(maximal amplitude,MA)的降低。 结论 (1)相较于常温环境,干热环境中发生创伤失血性休克的凝血功能紊乱更复杂,休克程度更严重。由于干热环境中发生创伤失血性休克可导致消耗性低凝,在创伤失血性休克后3 h,其凝血功能即可处于弥散性血管内凝血(disseminated intravascular coagulation,DIC)阶段。(2)TEG对干热环境创伤失血性休克凝血功能的监测有一定价值。
干热环境;创伤失血性休克;凝血功能;血栓弹力图
创伤导致的凝血功能障碍是创伤领域的主要研究内容,据统计,一部分创伤患者在大量液体复苏前就可能出现凝血功能障碍,导致的死亡风险明显增加[1,2]。这种创伤后早期的凝血功能障碍被称为急性创伤性凝血病(acute traumatic coagulopathy,ATC),实验室检查表现为凝血酶原时间(prothrombin time,PT)和活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长。临床研究和动物实验的结果均已证实,当机体经受严重组织损伤和低灌注后,血液中抗凝系统作用增强,导致血液处于低凝状态[3-7]。严重创伤患者若出现低体温、酸中毒、凝血功能障碍,即“致死三联征”,可迅速危及生命[8]。我国西北地区夏季气温高、空气湿度低、紫外线强,人处于干热环境时较湿热环境蒸发量更大,体液丧失更多,热应激反应明显增加,在干热环境发生创伤失血性休克所致伤势会更加严重[9]。Mashhadani等[10]发现,在干热环境中发生中暑的患者蛋白C和抗凝血酶Ⅲ等血液循环中的抗凝物质均低于正常水平,微循环中血液处于病理性高凝状态。创伤失血性休克和干热环境这两种影响因素分别导致机体出现相反的凝血状态,但在干热环境中发生创伤失血性休克后凝血功能处在何种状态,国内外鲜有文献报道。本研究通过观察干热环境创伤失血性休克猪模型凝血功能变化的特点,为临床救治提供参考。
1 材料与方法
1.1 实验动物及分组 健康雄性长白仔猪40头,体重(30±5)kg,购于新疆天康畜牧生物技术股份有限公司。饲养环境温度(23±5)℃,湿度(40±15)%,用日光灯模拟昼夜交替,正常喂养,保证实验用猪符合国家普通实验动物健康标准。40头猪按随机数字法分至4个组:干热环境创伤失血性休克组(简称干热休克组),干热环境假手术组(简称干热假手术组),常温常湿环境创伤失血性休克组(简称常温休克组),常温常湿环境假手术组(简称常温假手术组),每组10只。本研究已获得新疆军区总医院伦理委员会的审查和批准(批准编号:2016003)。
1.2 主要仪器和试剂 BC-2800 Vet全自动动物血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司);CA7000血凝仪(日本SYSMEX株式会社);CFMS血栓弹力图仪(北京乐普医疗科技有限责任公司);CFMS血栓弹力图普通杯检测试剂盒(北京乐普医疗科技有限责任公司)。
1.3 实验方法 干热休克组和干热假手术组全程均于模拟干热环境的人工实验舱内(由新疆军区总医院提供)进行实验,温度(40.0±0.5)℃,相对湿度(10±2)%。常温休克组和常温假手术组实验全程处于常温常湿环境,温度(25±1)℃,相对湿度(35±5)%。所有实验动物均给予气管插管、持续吸入七氟醚麻醉(2%~3%),颈内静脉置管、髂动脉置管和腹部正中切口。随后,干热休克组和常温休克组切除肝左下叶的1/4造成肝Ⅲ级创伤,从颈部深静脉置管处放血,使平均动脉压(mean arterial pressure,MAP)降至(45±5)mmHg(1 mmHg=0.133 kPa),至此完成创伤失血性休克操作,稳定10 min后记为休克0 h。干热假手术组和常温假手术组无肝切除和放血操作。成模后3 h实验结束,对动物实行安乐死并取材[11]。
1.4 检测指标及方法 于预定时间点记录MAP的数据,并留取血标本。记录数据并留取血液标本的时间点为:实验前(基线),热暴露3 h、休克后0 h(创伤失血性休克模型制作成功后)、0.5 h、1 h、2 h和3 h,共7个时间点。检测的指标为:血乳酸(lactate acid concentration,Lac)、血小板计数(platelet count,PLT)、PT、纤维蛋白原(fibrinogen,Fbg)、血栓弹力图(thrombelastography,TEG)和D-二聚体(D-dimer)。其中TEG的主要参数为凝血因子激活时间(reaction time,R)、血块形成速率参数(K)、弹力图最大切角(αAngle,α)和弹力图最大振幅(maximal amplitude, MA)。实验结束时取肺脏组织行病理检查。
1.5 统计学处理 采用SPSS 20.0软件进行统计分析,计量资料以表示,本研究采用多因素重复测量资料的方差分析,若数据服从球形检验假设,则参看一元分析结果;若不服从球形检验假设,则参看多元分析结果。当组内主效应检验差异有统计学意义时,再用LSD法进行同一时间点不同组间的两两比较。以Bonferroni法进行同组内不同时间点上的两两比较。以P<0.05为差异有统计学意义。
2 结 果
所有动物在实验结束时均存活。本研究中常温假手术组基线的各项测量结果与其余时间点比较差异无统计学意义(P>0.05)。
2.1 MAP检测 组内主效应检验结果提示,MAP各时间点差异有统计学意义(F=172.60,P<0.01),干热与时间(F=11.87,P<0.01),创伤失血性休克与时间(F=130.78,P<0.01),干热环境创伤失血性休克与时间(F=1163.20,P<0.01)有交互作用。组间主效应检验提示,不同组间MAP水平不同(P<0.01)。在实验前和热暴露3 h这两个时间点各组的MAP无统计学差异,在创伤失血性休克模型完成后0 h时,常温休克组和干热休克组MAP显著降低,常温休克组成模后MAP稳定在低水平,但干热休克组MAP继续下降,在3 h干热休克组MAP为各组最低(P<0.05),干热假手术组MAP在试验过程中较常温假手术组低(表1)。
2.2 Lac检测 组内主效应检验提示,体温各时间点差异有统计学意义(F=25.90,P<0.01),干热与时间(F=132.40,P<0.01),创伤失血性休克与时间(F=9.53,P<0.01),干热环境创伤失血性休克与时间有交互作用(F=26.60,P<0.01)。组间主效应检验提示,不同组间Lac水平不同(P<0.01)。两假手术组组内各时间点与实验前比均无统计学差异。两休克组在休克0.5 h Lac开始升高(P<0.01),随着休克时间的延长,常温休克组的Lac水平逐渐升高至休克3 h的值为(3.55±0.43)mmol/L,但干热休克组Lac休克1 h后明显升高,至休克3 h达(8.35±1.19)mmol/L,且高于其余三组的Lac水平(P<0.01,表1)。
2.3 PLT检测 组内主效应检验结果提示PLT因时间点不同有差异(F=138.30,P<0.01),干热与时间(F=35.00,P<0.01),创伤失血性休克与时间(F=52.40,P<0.01),干热环境创伤失血性休克与时间(F=6.90,P<0.01)有交互作用。组间主效应检验提示,不同组间PLT不同(P<0.01)。实验开始后干热休克组,干热假手术组和常温休克组的PLT随着实验的进行而下降,其中干热休克组和常温休克组在成模后PLT大幅度下降,但干热休克组PLT更低,在1 h、2 h和3 h干热休克组的PLT较其余三组更低。常温休克组PLT也呈现进行性减少的趋势,但较干热休克组高(表1)。
2.4 常规凝血功能检测
2.4.1 PT检测 组内主效应检验结果提示,PT各时间点差异有统计学意义(F=3.30,P=0.02)。此外,干热与时间(F=1.20,P=0.30),创伤失血性休克与时间(F=1.20,P=0.34),干热环境创伤失血性休克与时间(F=2.24,P=0.08)无交互作用。组内主效应检验,提示分组对PT无影响(P=0.06)。每组各时间点上的数据两两比较无统计学差异,各时间点组间两两比较比较也无统计学差异,见表2。
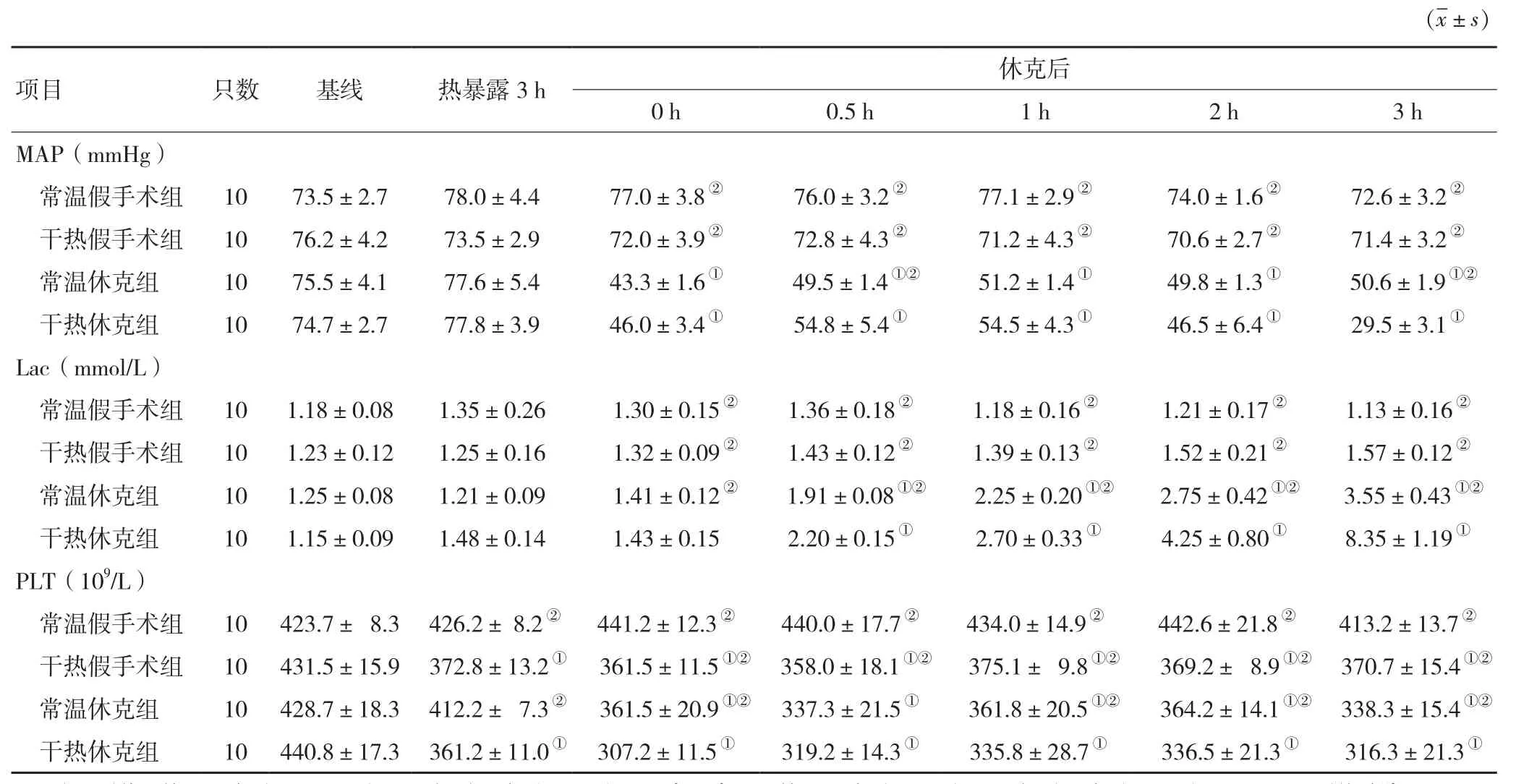
表1 四组各时间点MAP、Lac和PLT的比较
2.4.2 Fbg检测 组内主效应检验结果提示,Fbg水平因时间点不同有差异(F=89.50,P<0.01),干热与时间(F=15.40,P<0.01),创伤失血性休克与时间(F=34.40,P<0.01),干热环境创伤失血性休克与时间(F=2.80,P<0.05)有交互作用。组间主效应检验分组,提示分组对Fbg有影响(P<0.01)。干热休克组、干热假手术组和常温休克组在实验开始后Fbg水平均逐渐下降,干热假手术组Fbg水平在3 h与基线比有统计学差异(P<0.05);而两个休克组在成模后Fbg水平显著降低,随后略有回升,至试验结束时常温休克组的Fbg未见明显下降,但干热休克组在3 h下降明显,且在该时间点与其余三组相比为最低(P<0.05,表2)。
2.4.3 D-dimer体检测 组内主效应检验提示,D-dimer因时间点不同有差异(F=374.50,P<0.01),干热与时间(F=161.10,P<0.01),创伤失血性休克与时间(F=117.80,P<0.01),干热环境创伤失血性休克与时间(F=16.70,P<0.01)有交互作用。组间主效应检验分组,提示分组对D-dimer有影响(P<0.01)。干热休克组、常温休克组和干热假手术组D-dimer水平呈逐渐升高趋势,但在2 h和3 h干热休克组D-dimer水平上升明显,在所有分组中D-dimer最高(P<0.05),干热假手术组和常温休克组D-dimer上升幅度相似,见表2。
2.5 TEG检测 干热休克组和常温休克组在创伤失血性休克后血液暂时表现为高凝状态,随后干热休克组呈低凝状态,常温休克组表现为血凝块强度降低。干热假手术组随着实验的进行血液逐渐变为高凝状态。常温假手术组相关参数无明显变化(表3)。
2.5.1 R值 组内主效应检验提示,R值因时间点不同有差异(F=48.90,P<0.01),干热与时间(F=31.90,P<0.01),创伤失血性休克与时间(F=103.00,P<0.01),干热环境创伤失血性休克与时间(F=103.00,P<0.01)有交互作用。组间主效应检验为P<0.01,提示分组对R值有影响。经过3 h干热环境刺激后,干热休克组和干热假手术组的R值在热暴露3 h时略有延长。经创伤失血性休克的相关操作干热休克组和常温休克组R值在0 h时开始缩短,随后两休克组的R值均延长,其中干热休克组的R值延长幅度较常温休克组更大,干热休克组1 h、2 h和3 h的R值均长于其余三组(P<0.05)。干热假手术组R值在热暴露3 h后呈逐渐缩短的趋势,常温休克组R值逐渐恢复至基线水平,在3 h与基线比无统计学差异。
2.5.2 K值 组内主效应检验提示,K值因时间点不同有差异(F=29.90,P<0.01),干热与时间(F=12.50,P<0.01),创伤失血性休克与时间(F=52.30,P<0.01),干热环境创伤失血性休克与时间(F=48.90,P<0.01)有交互作用。组间主效应检验提示,分组对K值有影响(P=0.021)。干热休克组和常温休克组K值均在成模后,即0 h后开始缩短,干热休克组K值在0.5 h为各组最低(P<0.05),随后两休克组K值逐渐延长,干热休克组在1 h、2 h和3 h均长于其他三组(P<0.05),其在试验结束时的K值明显高于其他三组。而常温休克组在实验结束时逐渐回升至基线水平。干热假手术组K值逐渐缩短,3 h与基线比较,差异有统计学意义。

表2 各组各时间点凝血指标的比较
2.5.3 α值 组内主效应检验提示,α值因时间点不同有差异(F=47.40,P<0.01),干热与时间(F=7.50,P<0.01),创伤失血性休克与时间(F=62.40,P<0.01),干热环境创伤失血性休克与时间(F=34.40,P<0.01)有交互作用。组间主效应检验提示,分组对α值有影响(P<0.01)。干热休克组和常温休克组α值在成模后呈逐渐增大的趋势,1 h后开始减小,随后常温休克组逐渐减小至基线水平,而干热休克组进行性减小,至2 h和3 h时为各组最小(P<0.05)。干热假手术组α值在干热环境刺激3 h后减小,随实验的进行逐渐增大,3 h时差异有统计学意义(P<0.05)。
2.5.4 MA 组内主效应检验结果提示,MA因时间点不同有差异(F=38.10,P<0.01),干热与时间(F=26.80, P<0.01),创伤失血性休克与时间(F=154.70,P<0.01),干热环境创伤失血性休克与时间(F=43.80,P<0.01)有交互作用。组间主效应检验P<0.01,提示分组对MA有影响。干热休克组和干热假手术组在干热环境刺激3 h后MA逐渐升高,试验结束时干热假手术组仍呈升高趋势,但干热休克组在1 h开始进行性下降(P<0.05),在3 h降至最低,且与其余三组相比更低(P<0.05)。常温休克组MA在创伤失血性休克后逐渐降低,2 h和3 h与基线比差异有统计学意义。
2.6 肺脏病理学改变 常温假手术组肺泡结构完整,无肺不张,未见血栓(图1A)。常温休克组和干热假手术组可见肺不张,但未见血栓(图1B、图1C)。干热休克组,正常肺泡结构消失,可见肺不张,可见血栓(图1D)。
3 讨 论
目前已知ATC时血液呈低凝状态,而热损伤时血液呈高凝状态。但当机体同时受热刺激和创伤失血性休克打击时,凝血功能该如何改变目前尚不明确。在本研究中,模拟了机体在干热环境中发生创伤失血性休克后至复苏前的创伤后早期阶段。通过PLT、PT、Fbg、TEG和D-dimer这些已经应用于临床的检测项目来监测这一阶段凝血功能的变化。研究数据表明,在干热环境中发生创伤失血性休克导致的凝血功能异常与常温常湿环境不同。

表3 四组各时间点血栓弹力图的比较
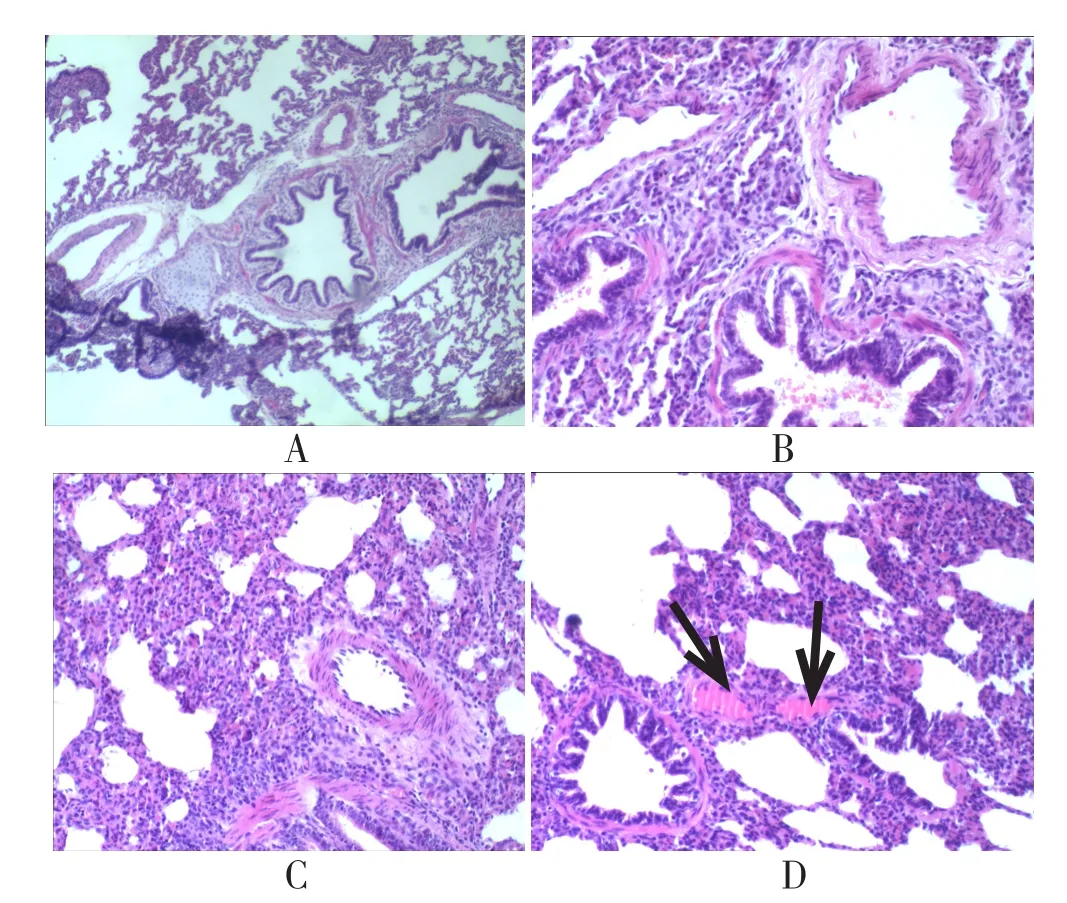
图1 各组肺脏病理学改变(HE染色×200)
所有动物在创伤失血性休克初期出现灌注压不足、高凝状态,干热和常温休克组的主要差别在休克初期之后。随着休克时间的延长,在1 h后常温休克组R、K和α在高凝期后逐渐恢复至实验前水平,3 h时与实验前相比无统计学差异,但MA在休克初期后进行性减小,提示血凝块强度降低,常温休克组MAP尚可维持在较低水平,Lac和D-dimer水平较前有所升高,PLT和Fbg未持续下降,以上提示常温休克组在创伤失血性休克后病情尚未明显加重。但干热休克组持续暴露在热环境中,在1 h后MAP进行性下降,Lac显著升高,表明组织灌注严重不足;D-dimer水平显著增高和肺脏病理结果提示广泛微血栓形成;PLT和Fbg的显著降低提示凝血底物的大量消耗;R值进行性延长,提示凝血因子不足;K延长和α角减小提示血凝块形成速率减慢,这主要与纤维蛋白原减少有关;MA值显著减小,提示血凝块强度减弱,且在干热休克组3 h时TEG结果与其他三组同时间点相比均有差异,提示血液严重低凝状态。根据弥散性血管内凝血(disseminated intravascular coagulation,DIC)定义,本研究中,热刺激合并创伤失血性休克,导致实验动物休克3 h后广泛微血栓形成,凝血底物大量消耗合并纤溶亢进,并引起微循环衰竭,已达到DIC诊断标准。提示干热环境可加快创伤失血性休克疾病进程,其中病理性促凝因素可能起了重要作用,所以尽早应用抗凝剂可能有益的[12]。
实验结束时,干热休克组在时间上判断仅为创伤后早期阶段,但从凝血功能的角度考虑却已经进入DIC阶段,可能的机制如下:放血时一部分凝血因子和血小板随血液丢失,导致凝血物质减少;造成肝Ⅲ级创伤后,组织因子入血,经外源性凝血途径启动凝血级联反应,凝血物质被消耗,在局部形成血凝块[13,14];肝脏是凝血因子合成的主要场所,肝脏损伤后凝血因子的合成也受损。机体休克后微循环发生障碍,组织灌注不足导致缺氧、酸中毒,再加上热的直接细胞毒性作用均可导致内皮细胞损伤。内皮细胞损伤后其本身的抗凝屏障功能被破坏,释放炎性介质,内皮下胶原组织暴露,以上均可促使凝血级联反应启动,而热刺激可使抗凝及纤溶功能受损,进一步加重了血液的高凝状态[15]。因此,干热环境失血性休克发生后因凝血级联反应被激活,加之抗凝作用不足导致微循环水平大量微血栓形成,使本就处于低水平的凝血底物进一步消耗,而肝脏又不能及时补充凝血因子,最终凝血功能因消耗性低凝处于DIC阶段。微循环中大量血栓形成,使原有的器官灌注不足加重,最终导致多功能脏器衰竭。
干热休克组和常温休克组的TEG数据提示,所有的动物创伤失血性休克初期血液呈高凝状态,但随着休克时间的延续,常温休克组仅MA下降,其余参数恢复至实验前水平,提示创伤失血性休克打击后,机体的凝血功能尚维持稳态;但随着热暴露时间的延长,在1 h,干热休克组R和K延长,在3 h最长,α和MA减小,在3 h达最小值,提示相应凝血底物的缺乏和严重低凝状态。即机体在受热刺激和创伤失血性休克同时打击后,凝血状态为:初期高凝,休克1 h即开始发生消耗性低凝。
本研究各组PT的变化均不明显,组间比较也无统计学差异。目前已证实创伤后早期的凝血功能障碍是由组织损伤和组织低灌注共同作用的结果[6]。White等[16]和Martini等[17]建立的创伤失血性休克猪模型的PT和APTT监测数据也未观察到明显变化,这与本研究结果相一致,且以猪为实验对象的TEG研究认为猪较人类的凝血功能略强[18]。此外,PT主要反映外源性凝血途径和共同通路中凝血因子的活性,其检测所用标本为血浆,去除了PLT在凝血过程中的作用,而凝血过程非常复杂且常处于动态变化之中,所以可能由于上述原因导致PT这一临床常用的凝血检测项目未能在本实验中有明显变化,提示传统凝血功能检测可能存在一定局限性。
综上所述,本研究通过观察干热环境创伤失血性休克猪模型凝血功能变化,发现干热环境可使创伤失血性休克疾病进程加快。此外,干热环境中发生创伤失血性休克后,在初期处于高凝状态,休克1 h即发生消耗性凝血病。同时发现,粘弹性凝血试验对于干热环境创伤失血性休克后凝血功能变化监测有一定价值。
[1]Khan S, Davenport R, Raza I, et al. Damage control resuscitation using blood component therapy in standard doses has a limited effect on coagulopathy during trauma hemorrhage [J]. Intensive Care Med, 2015, 41(2): 239-247. DOI: 10.1007/s00134-014-3584-1.
[2]Cap A, Hunt B J. The pathogenesis of traumatic coagulopathy [J]. Anaesthesia, 2015, 70( Suppl 1): 96-101. DOI: 10.1111/ anae.12914.
[3]Maegele M, Schochl H, Cohen M J. An update on the coagulopathy of trauma [J]. Shock, 2014, 41( Suppl 1): 21-25. DOI: 10.1097/SHK.0000000000000088.
[4]Frith D, Brohi K. The pathophysiology of trauma-induced coagulopathy [J]. Curr Opin Crit Care, 2012, 18(6): 631-636. DOI: 10.1097/MCC.0b013e3283599ab9.
[5]Cohen M J, Call M, Nelson M, et al. Critical role of activated protein C in early coagulopathy and later organ failure, infection and death in trauma patients [J]. Ann Surg, 2012, 255(2): 379-385. DOI: 10.1097/SLA.0b013e318235d9e6.
[6]Hagemo J S, Christiaans S C, Stanworth S J, et al. Detection of acute traumatic coagulopathy and massive transfusion requirements by means of rotational thromboelastometry: an international prospective validation study [J]. Crit Care, 2015, 19(1): 97. DOI: 10.1186/s13054-015-0823-y.
[7]Howard B M, Kornblith L Z, Cheung C K, et al. Inducing acute traumatic coagulopathy in vitro: the effects of activated protein C on healthy human whole blood [J]. PLoS One, 2016, 11(3): e0150930. DOI: 10.1371/journal.pone.0150930. eCollection 2016.
[8]Frith D, Davenport R, Brohi K. Acute traumatic coagulopathy [J]. Curr Opin Anaesthesiol, 2012, 25(2): 229-234. DOI: 10.1097/ACO.0b013e3283509675.
[9]李 瑞.沙漠干热环境创伤失血性休克大鼠继发性肺损伤时一氧化氮合酶等变化研究[J].中华急诊医学杂志, 2015, 24(2): 163-168. DOI: 10.3760/cma.j.issn.1671-02 82.2015.02.011.
[10]al-Mashhadani S A, Gader A G, al Harthi S S, et al. The coagulopathy of heat stroke: alterations in coagulation and fibrinolysis in heat stroke patients during the pilgrimage (Haj) to Makkah [J]. Blood Coagul Fibrinolysis, 1994, 5(5): 731-736.
[11]沈才福, 刘江伟, 钱若筠, 等. 沙漠干热环境不同温度对创伤失血性休克猪生存时间的影响[J]. 实验动物科学, 2016, 33(4): 48-51. DOI: 10.3969/j.issn.1006-6179. 2016.04.009.
[12]Taylor F B Jr, Toh C H, Hoots W K, et al. Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation [J]. Thromb Haemost, 2001, 86(5): 1327-1330.
[13]Eichhorn M E, Ney L, Massberg S, et al. Platelet kinetics in the pulmonary microcirculation in vivo assessed by intravital microscopy [J]. J Vasc Res, 2002, 39(4): 330-339. DOI: 10.1159/000065545.
[14]Spahn D R, Rossaint R. Coagulopathy and blood component transfusion in trauma [J]. Br J Anaesth, 2005, 95(2): 130-139. DOI: 10.1093/bja/aei169.
[15]Bouchama A, Kunzelmann C, Dehbi M, et al. Recombinant activated protein C attenuates endothelial injury and inhibits procoagulant microparticles release in baboon heatstroke [J]. Arterioscler Thromb Vasc Biol, 2008, 28(7): 1318-1325. DOI:10.1161/ATVBAHA.107.161737.
[16]White N J, Martin E J, Brophy D F, et al. Coagulopathy and traumatic shock: characterizing hemostatic function during the critical period prior to fluid resuscitation [J]. Resuscitation, 2010, 81(1): 111-116. DOI: 10.1016/ j.resuscitation.2009.09.017.
[17]Martini W Z, Cortez D S, Dubick M A, et al. Thrombelastography is better than PT, a PTT, and activated clotting time in detecting clinically relevant clotting abnormalities after hypothermia, hemorrhagic shock and resuscitation in pigs [J]. J Trauma, 2008, 65(3): 535-543.DOI: 10.1097/ TA.0b013e31818379a6.
[18]Velik-Salchner C, Schnurer C, Fries D, et al. Normal values for thrombelastography (ROTEM) and selected coagulation parameters in porcine blood [J]. Thromb Res, 2006, 117(5): 597-602. DOI: 10.1016/j.thromres.2005.05.015.
(2017-03-14收稿 2017-06-15修回)
(本文编辑 罗发菊)
Changes in coagulation function following traumatic hemorrhagic shock in a porcine model in heated environment
DUAN Yue1,2, LI Xinyu2, LIU Jiangwei2, XING Yanchao2, SHEN Caifu1,2, ZHANG Limin1, and AN Zongren1,2. 1. School of Clinical Medicine, Medical College of Shihezi University, Xinjiang Uygur Autonomous Region, Shihezi 832002, China; 2. The Key Labortary of Special Environmental Medicine of Xinjiang, General Hospital of Xinjiang Military Region, Chinese People's Liberation Army, Urumuq 830000, China
LIU Jiangwei, E-mail: ljw273273@163.com
Objective The study objective was to compare the changes of blood coagulation following the onset of traumatic hemorrhagic shock in a porcine model in heated environment and normo-thermic environment, and offer valuable references for clinical treatment. Methods A sample of 40 male landrace pigs were randomly assigned to 4 groups: traumatic hemorrhagic shock in heated environment, non-shock operation in heated environment, traumatic hemorrhagic shock in normo-thermic environment and non-shock operation in normo-thermic environment. The pigs assigned to the heated environment groups were placed in the heated environment for 3 h prior to either the induction of traumatic shock or the non-shock operation. The pigs in normo-thermic environment groups were placed in a normal temperature environment. Animals in the non-shock operation groups underwent laparotomy without receiving trauma and blood loss. Lactate acid concentration (Lac), platelet (PLT), prothrombin time (PT), fibrinogen (Fbg), thrombelastography (TEG) and D-dimer were measured by taking blood samples before exposure to heat (Baseline), after 3 h of heat exposure, at the onset of shock (0 h), and then at 0.5 h,1 h, 2 h and 3 h intervals. A histopathological examination of a lung specimen was examined at the end of experiment. Results (1) At the end of the experiment, the mean arterial pressure (MAP) in the heated shock group was the lowest and Lac was the highest of all groups (P<0.01). (2) No significant changes in PT at each time point compared with corresponding baseline nor between the heated shock group and other three groups was observed. At the end of the experiment, the levels of fibrinogen in the heated shock group were the lowest andthe level of D-dimer was highest of all groups (P<0.01). (3) The data suggested that both the heated shock group and normo-thermic shock group were in hypercoagulable state at 0.5 h after shock. At the end of the experiment, the heated shock group showed hypocoagulable state, but the normo-thermic shock group only showed a decrease of maximal amplitude (MA). Conclusions (1) Traumatic hemorrhagic shock in a heated environment leads to more severe coagulation function disorder and higher magnitude of shock than in normo-thermic environment. The occurrence of traumatic hemorrhagic shock in the heated environment can lead to disseminated intravascular coagulation (DIC) stage 3 h after traumatic hemorrhagic shock. (2) TEG may be of value in the management of patients with traumatic hemorrhagic shock in heated environment.
heated environment; traumatic hemorrhagic shock; coagulation function; thrombelastography
Q494
10.13919/j.issn.2095-6274.2017.08.002
总后勤部面上基金项目(CLZ13J003)
1. 832000,新疆维吾尔自治区石河子大学医学院临床医学院;2. 830000 乌鲁木齐,新疆军区总医院新疆特殊环境医学重点实验室
刘江伟,E-mail:ljw273273@163.com

