骨髓间充质干细胞对软骨诱导分化过程中microRNA调控机制
刘军政,张书艳,高建强
1.陕西省第四人民医院(西安 710043),2.西安市东方医院(西安 710043)
骨髓间充质干细胞对软骨诱导分化过程中microRNA调控机制
刘军政1,张书艳1,高建强2
1.陕西省第四人民医院(西安 710043),2.西安市东方医院(西安 710043)
目的:探讨microRNA(miRNA)在骨髓间充质干细胞对软骨诱导分化过程中的调控机制。方法:以大鼠骨髓中分离出的骨髓间充质干细胞(BMSCs)作为研究对象,用转化生长因子-β1(TGF-β1)诱导MSCs软骨分化,利用基因芯片技术检测软骨诱导分化过程中miRNA表达情况,并用实时荧光定量PCR验证;采用SAM软件筛选出软骨诱导过程中差异表达的miRNA。结果:基因芯片技术共筛选出BMSCs向软骨分化过程中9个表达差异miRNA,其中表达上调的共有7个,分别为miR-34a、miR-130b、miR-193b、miR-30a、miR-152、miR-90a、miR-99a;表达下调的共有2个,分别为miR-424、miR-135。选择软骨诱导分化过程中表达明显升高的miR-130b、miR-193b,及表达明显降低的miR-424、miR-135;在原样本中进行实时荧光定量PCR,结果显示实时荧光定量PCR验证结果与基因芯片结果一致,证实了芯片结果真实可信。结论:高表达的miR-34a、miR-130b、miR-193b、miR-30a、miR-152、miR-90a、miR-99a和低表达的miR-424、miR-135共同参与了骨髓间充质干细胞软骨分化的调节过程。
microRNA(miRNA)是一种存在于生物体中、参与转录后调控的小RNA,其通过与靶基因mRNA碱基配对,导致靶基因mRNA碱基翻译受阻或直接使其降解,进而发挥调控作用[1]。骨髓间充质干细胞(Bone Mesenchymal stem cells,BMSCs)具有多向分化和自我更新潜能的一类干细胞,国外研究证实BMSCs能够分化为脂肪细胞、软骨细胞、成骨细胞等多种细胞株,亦是软骨自我修复主要的种子细胞。虽然已有研究[2]称将BMSCs用于治疗关节软骨缺损,然而这种干细胞治疗方法的安全性依然存在较大争议;究其原因,可能与BMSCs来源、诱导方式不同所致miRNA有较大差异有关。鉴于此,本研究分离大鼠骨髓来源的MSCs,并诱导软骨分化,通过基因芯片技术观察miRNA差异表达,筛选出与软骨分化调节相关的miRNA,旨在探讨miRNA在软骨分化中的调控机制,现将研究成果报告如下。
材料和方法
1 动物来源 5只SPF级SD大鼠购自陕西省第四人民医院动物中心,周龄4~6周,体质量110~140g,雌雄不限,所有大鼠均给予自由进食进水,保持室温20℃~22℃;光照12 h、黑暗12 h昼夜交替饲养,使用1周后进行实验。本研究方案经医院动物伦理委员会批准。
2 试剂与仪器 生物标志物兔抗大鼠单克隆抗体CD29- FITC(异硫氰酸荧光素)、CD45-FITC、CD54-FITC、CD90-FITC均购自美国Santa公司,转化生长因子-β1(Transforming growth factor-β1,TGF-β1)、兔抗大鼠神经元特异性烯醇化酶(Neuron-specific enolase,NSE)单克隆抗体、兔抗大鼠神经巢蛋白(Nestin)单克隆抗体由上海岚派生物科技有限公司提供。PCR引物由上海吉凯基因化学技术有限公司设计、合成,Trizol试剂盒、转染试剂Transfectamin 2000由美国Invitrogen公司提供,miRNA Isolation Kit由罗氏公司提供。
美国ABI GeneAmp 9700 PCR仪,倒置相差显微镜购自日本奥林巴斯公司, FC500MCL/MPL流式细胞仪购自贝克曼库尔特公司。
3 方 法
3.1 BMSCs细胞分离与培养:喂养1周后,将大鼠颈椎脱臼处死,解剖分离大鼠下肢股骨,于无菌环境下抽取大鼠股骨骨髓,置于肝素抗凝管中,磷酸盐缓冲液稀释,加入人淋巴细胞分离液,1 400 g离心10 min,取中间层,PBS冲洗2次,再接种于培养瓶中,培养密度1×109/L。培养条件:5%CO2、37℃、培养湿度95%,培养第3 d首次换液,以后每2 d换液1次。每次换液后于显微镜下观察细胞的形态和生长情况,待细胞单层融合至80%时,胰蛋白酶消化,按照1∶2比例传代培养,此为第1代细胞(P1,以后培养代数记为P2、P3…,以此类推)。
3.2 大鼠BMSCs细胞鉴定:取P4代大鼠BMSCs细胞,PBS洗涤3次,细胞浓度1.0×106个/L,制成细胞悬液1 ml,置于EP管中,分别加入CD29- FITC、CD45-FITC、CD54-FITC、CD90-FITC单克隆抗体5 μL,并设立同型阴性对照,37 ℃反应30 min,800 g离心20 min,PBS重悬细胞,采用流式细胞仪进行检测。
3.3 大鼠BMSCs软骨诱导培养及鉴定:将P4代大鼠BMSCs细胞以5×106个/L浓度抽取1 ml,加入基础培养液,按照培养液的组成将细胞分为两组:阳性组和对照组,阳性组基础培养液组成:1g/ml TGF-β1、1×10-7mmol/L地塞米松、6.25 ng/L胰岛素、0.05 mg/L维生素C、1.25 μg/ml牛血清白蛋白;对照组不加TGF-β1,其余同阳性组;两组细胞培养3 d后首次更换培养液,以后每2 d更换1次培养液,共培养21 d。诱导结束后弃去培养液,PBS冲洗3次,以4%的多聚甲醛固定20 min,常规石蜡包埋并切片,蒸馏水脱蜡冲洗,甲苯胺蓝染色,显微镜下观察并拍照记录。
3.4 基因芯片检查miRNA表达:分别收集软骨诱导前(T0),培养后7 d(T1)、14 d(T2)、21 d(T3)的BMSCs细胞,一步法提取总RNA,用miRNA Isolation Kit将低于100nt的RNA片段分离,再进行poly(A)加尾及反转录,将扩增后的RNA样品进行荧光标记,双通道激光扫描仪进行扫描;用Significance Analysis of Microarrays (SAM version 2.1) 分析软骨诱导后存在差异表达的miRNA,筛选出表达差异的miRNA为对照组表达2倍以上。
3.5 实时荧光定量PCR验证:将软骨诱导培养21 d的总RNA反转录成cDNA,以cDNA为模板、实时定量miRNA作为引物进行PCR反应,反应条件:引物浓度0.3 μmmol/L,96℃变性20 s,60℃退火45 s,总计35个循环。70℃~94℃绘制熔解曲线,分析PCR熔解曲线,每个样本设3个平行孔,以miRNA U6作为内参照计算miRNA的相对表达量。
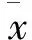
结 果
1 大鼠BMSCs细胞及软骨诱导培养细胞形态特征 BMSCs细胞原代培养1 d后即可见细胞贴壁生长,细胞形态均一,外观多呈梭型;培养3~4 d后贴壁生长的细胞可单层融合(图1A)。P4代的BMSCs细胞经软骨诱导培养21 d后,细胞呈圆形改变,细胞核明显缩小;经甲苯胺蓝染色后可见细胞浆呈均一蓝色,提示软骨细胞的细胞外基质存在大量的糖胺多糖成分(图1B)。
2 诱导BMSCs软骨分化鉴定 流式细胞仪对细胞表面标志物检测显示,P4代BMSCs细胞中CD29、CD90呈阳性表达,CD45、CD54呈阴性表达,与间充质干细胞特性一致(图2)。
3 软骨分化后差异表达miRNA检测 BMSCs细胞软骨诱导培养21d后,经基因芯片检测,并由SAM分析共筛选出9个表达差异相对于对照组2倍以上的miRNA,其中表达上调的共有7个,分别为miR-34a、miR-130b、miR-193b、miR-30a、miR-152、miR-90a、miR-99a;表达下调的共有2个,分别为miR-424、miR-135。
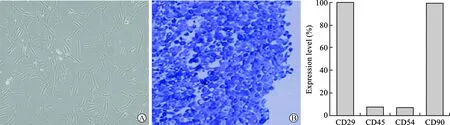
A BMSCs细胞的形态特征 B 成软骨细胞的形态特征
图1 BMSCs与成软骨细胞培养中的形态特征 图2 细胞表面抗原的表达水平
4 差异表达miRNA的验证 选择软骨诱导分化过程中表达明显升高的miR-130b、miR-193b,及表达明显降低的miR-424、miR-135,在原样本中进行实时荧光定量PCR,结果显示实时荧光定量PCR验证结果与基因芯片结果一致,见表1。
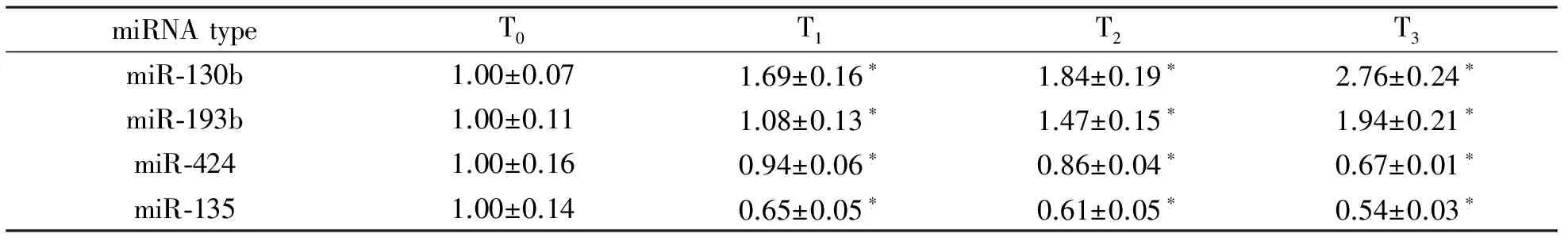
表1 RT-PCR检测miRNA表达(2-△△CT)
注:与 T0比较,*P<0.05
讨 论
BMSCs细胞作为具有多向分化和自我更新能力的一类干细胞。目前研究已证实miRNA参与调节BMSCs的多向分化,然而miRNA调节作用是一个复杂的调节网络,当前对其尚处于初步研究阶段。Clark等[3]报道称miR-90参与了BMSCs向软骨分化的调控;Ham等[4]则证实miR-23b同时参与了BMSCs向成骨、软骨和脂肪的分化。由于BMSCs的来源及诱导方式的不同,导致各家报道中miRNA种类差异较大,因此究竟何种miRNA参与调控BMSCs向软骨分化还需要更大的样本证实。
本研究通过基因芯片检测及实时荧光定量PCR验证,共筛选出9种表达差异的miRNA,包括高表达趋势的miR-34a、miR-130b、miR-193b、miR-30a、miR-152、miR-90a、miR-99a和低表达趋势的miR-424、miR-135。周峰等[5]报道称miR-130b、miR-193b主要参与调控CAMTA1、GDF11、CD44等基因,而上述这些基因在维持干细胞分化特性方面发挥着重要作用。低表达的miR-135、miR-424参与调节COL4A1、BMP8A等骨形成基因。Crobu等[6]亦证实miR-424在诱导成骨转化的BMSCs细胞中高表达,结合本研究结论,似乎可以验证上述结论。
综上所述,高表达的miR-34a、miR-130b、miR-193b、miR-30a、miR-152、miR-90a、miR-99a和低表达的miR-424、miR-135共同参与了骨髓间充质干细胞软骨分化的调节过程。然而需要注意的是,人类基因组中有多达1000多种miRNA,由于miRNA之间也会相互调节,导致整个调节过程异常复杂;加之本研究选择的样本仅为大鼠来源的骨髓间充质干细胞,因此本研究结论仍需要进一步证实。
[1] Bakhshandeh B,Hafizi M,Ghaemi N,etal.Down-regulation of miRNA-221 triggers osteogenic differentiation in human stem cells[J].Biotechnol Lett,2012,34(8):1579-1587.
[2] 毕晓娟,郭晨明,李 亮,等.三维培养诱导人脂肪间充质干细胞微球的成软骨分化能力[J].中国组织工程研究,2015,1:24-29.
[3] Clark EA,Kalomoiris S,Nolta JA,etal.Concise review: MicroRNA function in multipotent mesenchymal stromal cells[J].Stem Cells,2014,32(5):1074-1082.
[4] Ham O,Song BW,Lee SY,etal.The role of microRNA-23b in the differentiation of MSC into chondrocyte by targeting protein kinase A signaling[J].Biomaterials,2012,33(18):4500-4507.
[5] 周 峰,王英振,张海宁,等.人软骨细胞培养上清诱导脐血间充质干细胞向软骨细胞分化[J].中国组织工程研究,2013,40:7034-7039.
[6] Crobu F,Latini V,Marongiu MF,etal.Differentiation of single cell derived human mesenchymal stem cells into cells with a neuronal phenotype: RNA and microRNA expression profile[J].Mol Biol Rep,2012,39(4):3995-4007.
(收稿:2017-03-13)
Regulation mechanism of microRNA on bone mesenchymal stemcells during chondrogenic differentiation
Liu Junzheng,Zhang Shuyan,Gao Jianqiang
The Fourth People’s Hospital of Shaanxi(Xi’an 710043)
Objective: To explore the regulation mechanism of microRNA on bone mesenchymal stem cells during chondrogenic differentiation.Methods: Bone mesenchymal stem cells (BMSCs) isolated from rat bone marrow were used as the research objects,chondrogenic differentiation of BMSCs was induced by transforming growth factor-β1(TGF-β1),the expression of miRNA in during differentiation was detected by gene chip technology,and validation by real time fluorescent quantitative PCR,screened the differentially expressed miRNA in the process of cartilage induction by SAM software.Results: A total of 9 differentially expressed miRNA of BMSCs during chondrogenic differentiation was screened by gene chip technology,and increased expression with 7,included miR-34a,miR-130b,miR-193b,miR-30a,miR-152,miR-90a,miR-99a,2 with down expression,included miR-424 and miR-135.The significantly increased expression of miR-130b,miR-193,and the significantly decreased expression of miR-424 and miR-135 were selected,real time fluorescence quantitative PCR was used in the original sample,the results showed that the results of real-time fluorescence quantitative PCR were consistent with the results of gene chip,confirmed the authenticity of the chip results.Conclusion: High expression of miR-34a,miR-130b,miR-193b,miR-30a,miR-152,miR-90a,miR-99a and low expression of miR-424,miR-135 together to participate the bone mesenchymal stem cells during chondrogenic differentiation.
Hematopoietic stem cells Bone marrow Chondrogenic differentiation Micro RNA/immunology
造血干细胞 骨髓 软骨分化 微小RNA/免疫学
R446.63
A
10.3969/j.issn.1000-7377.2017.08.002

