人参皂苷Rb1后处理对大鼠缺血海马磷酸化蛋白激酶C信号通路的干预作用*
陆学海 杨建宇 李 娜 郭 英 杨春艳 赵丽琴 蒲里津 罗海芸,#
人参皂苷Rb1后处理对大鼠缺血海马磷酸化蛋白激酶C信号通路的干预作用*
陆学海1,3杨建宇1李 娜1郭 英1杨春艳1赵丽琴1蒲里津2罗海芸1,#
目的:探讨人参皂苷Rb1(GS-Rb1)后处理对缺血海马磷酸化蛋白激酶C(P-PKC)的干预作用。方法:72只健康雄性SD大鼠按随机数字法分为6组,每组12只,即假手术组(Sham组),局灶脑缺血模组(MCAO组),GS-Rb1后处理(低剂量25mg/kg、中剂量50mg/kg、高剂量100mg/kg)组和尼莫地平(1mg/kg)对照组(Nim组)。各药物干预组于成模后4h一次性腹腔给药,Sham组、MCAO组给予等量生理盐水。20h后取各组大鼠海马组织,采用免疫组织化学及 Western Blotting 分别检测其CA1 区神经元细胞的PKC、P-PKC 蛋白表达量。结果:PKC蛋白无论采用免疫组织化学或Western Blotting检测,其结果在各组间差异均无统计学意义(P>0.05)。P-PKC 无论采用免疫组织化学或 Western Blotting 检测,其结果在各组间均有显著差异(P<0.01);MCAO 组 P-PKC 蛋白表达显著少于Sham 组(P<0.01),不同GS-Rb1各剂量组P-PKC蛋白表达均较 MCAO 组增加(P<0.05) ,尤以高剂量 GS-Rb1 组更加明显,其水平接近 Nim组(P>0.05)。结论:GS-Rb1 后处理可上调缺血海马 P-PKC 蛋白表达,发挥脑保护作用。
人参皂苷-Rb1;脑缺血;海马;蛋白激酸C
脑缺血所致脑异常微环境在脑损伤后发挥的巨大作用逐渐为人们所认识[1,2],海马是脑缺血时较易受损的神经组织之一[3]。而细胞信号转导在脑缺血中的作用日益受到重视,蛋白激酶 C (PKC)作为细胞信号转导途径中的重要物质,其 PKCγ、PKCδ 的异常表达在脑缺血再灌注病理机制中扮演重要角色[6,7]。如何在应激过程中触发蛋白激酶级联反应,包括 PKC 和钙离子/钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+/Calmodulin-dependent KinaseⅡ,CaMKⅡ),使其磷酸化后发挥生理调节作用,改善神经突触可塑性和行为,对脑保护作用非常重要。
已有研究表明,人参总皂苷(Ginsenoside,GS)能从多个环节对脑血管发挥保护性作用,人参皂苷 Rb1 (GS-Rb1) 是其抗脑缺血的活性成分[4,5]。但目前未见 GS-Rb1 对异常微环境内PKC磷酸化发挥脑保护作用的相关报道。本文采用大脑局灶性脑缺血(MCAO)模型,研究不同剂量 GS-Rb1 后处理缺血海马神经元细胞 PKC、磷酸化PKC(P-PKC)蛋白表达的干预作用,为其临床应用提供新的理论依据。
1 材料与方法
1.1 实验动物
72 只健康成年 SD 大鼠,雄性,体重 250-300 g,SPF级,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2013-0004。在室温 25 ℃,湿度 45% 环境喂养,每日 12h光照,术前禁食 12h,术后自由进食和饮水。
1.2 主要药品和试剂
GS-Rb1购自昆明制药集团,为白色粉末(纯度>98.57%,批号110704-200318),实验时取 1g 加 75%乙醇2.5ml,混匀后用蒸馏水使其充分溶解,并定容至100ml备用。尼莫地平(Nimodipine,Nim,批号:BXH5SZ1)注射液由德国拜耳先灵医药保健股份公司提供,每瓶50ml,含药 10mg。兔单克隆一抗 PKC 和 P-PKC(1∶5 000)购自 Abcam 公司,山羊抗兔IgG购自中杉金桥生物技术有限公司。
1.3 大鼠局灶性脑缺血(MCAO)模型的复制
所有实验大鼠腹腔注射 3% 戊巴比妥钠(30 ml/kg)麻醉,头顶部剪毛,消毒。左侧仰卧固定,于右侧外眦后方约 0.4cm 处,垂直于右眼裂,用手术刀切开皮肤约 0.4-0.5cm,暴露颞肌并用组织剪剪开其腱膜;用止血钳和手术镊钝性分离肌肉至颞骨,而后用牙科钻轻轻磨穿颅骨,再用咬骨钳小心扩大颅窗,充分暴露大脑中动脉。其中60只用高频电刀凝闭大脑中动脉,制备右侧大脑局灶性缺血模型(MCAO)[8]。另12只不予凝闭中动脉。术后缝合皮肤,单笼饲养(注意保暖)。术后 4h 对手术造模的60 只大鼠根据 Bederson 评分标准[9]进行评分(0 分:无神经功能缺损症状;1 分:对侧前肢屈曲;2 分:拉尾时其对侧前肢抓力减弱;3 分:无定向运动,提尾时向其对侧转圈;4 分:自发转向其对侧且伴随意识障碍),其分值>2分,确认成模,进入后续实验。本实验中60只造模大鼠全部造模成功。
1.4 动物分组与给药
60只 MCAO模型大鼠按随机数字表法分为5组(每组 12 只):即MCAO 组,GS-Rb1低剂量组(25mg/kg)、中剂量组(50mg/kg)、高剂量组(100mg/kg),Nim组(1mg/kg);12只非模大鼠作为假手术组(Sham组)。4h后药物组大鼠均一次性腹腔注射给药,Sham组和MCAO组给予等量生理盐水。给药后喂养20h,断头取脑,迅速分离右侧大脑海马组织,液氮保存。
1.5 免疫组化染色法和Western Blotting检测PKC和P-PCK蛋白表达
从液氮中取出各组海马组织,常规复苏后进行以下检测。
1.5.1 免疫组化染色: 取各组海马组织,于 4% 多聚甲醛 4℃ 固定 24h后转入由 0.1M PBS 配制的 30% 蔗糖溶液中,行冰冻切片(约 10μm)。将切片放入盛有 0.1M PB 的 24孔板中。0.01M 柠檬酸缓冲液微波修复,然后加相应的一抗(PKC 和 P-PKC)和二抗。DAB 显色,光镜观察每组切片中海马 CA1 区 5 个视野,用HPIAS-1000 病理图像分析系统,半定量分析PKC 和 P-PKC 蛋白表达。海马神经元细胞 PKC 和 P-PKC蛋白阳性表达者呈棕色,分布于胞浆及胞膜,其表达强度用阳性细胞的平均灰度值表示,该灰度值越低,则阳性蛋白表达越强。
1.5.2 Western Blotting:取各组海马组织,加入蛋白裂解液,采用循环流动式超声波仪制备组织匀浆,用蛋白质定量试剂盒(BCA 法)测定蛋白浓度,制备 10% 的 SDS-PAGE 下层分离胶和 5% 的上层压缩胶,上样量40μg,转膜 35min,5% 脱脂奶粉封闭 2h。加兔单克隆一抗PKC和P-PKC(1∶5 000),4℃ 孵育过夜,加入二抗抗兔室温下孵育 1.5h,曝光洗片,扫描图像后用 Image J 1.4.3.67 软件计算各条带的平均灰度值,灰度值越大,阳性蛋白表达越多。以β-actin为内参,以待检样本与β-actin条带灰度值的比值表示该样本目标蛋白的相对表达量。
1.6 统计学处理
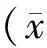
2 结果
2.1 各组大鼠海马CA1区PKC蛋白表达
2.1.1 免疫组织化学结果:如图1、2 所示,各组海马神经元细胞PKC蛋白表达阳性细胞(棕色)数量和形态比较接近,各组阳性细胞平均灰度值差异亦无统计学意义(F=0.3704,P>0.05)。

注:海马神经元PKC蛋白阳性细胞呈棕色,位于细胞膜和细胞浆中,各组阳性细胞数目和形态相近
2.1.2 Western Blotting 检测结果:如图3所示,各组海马神经元细胞 PKC 蛋白表达(相对表达量)差异无统计学意义(F=0.0397,P>0.05)。

图2 各组PKC表达阳性细胞平均灰度值
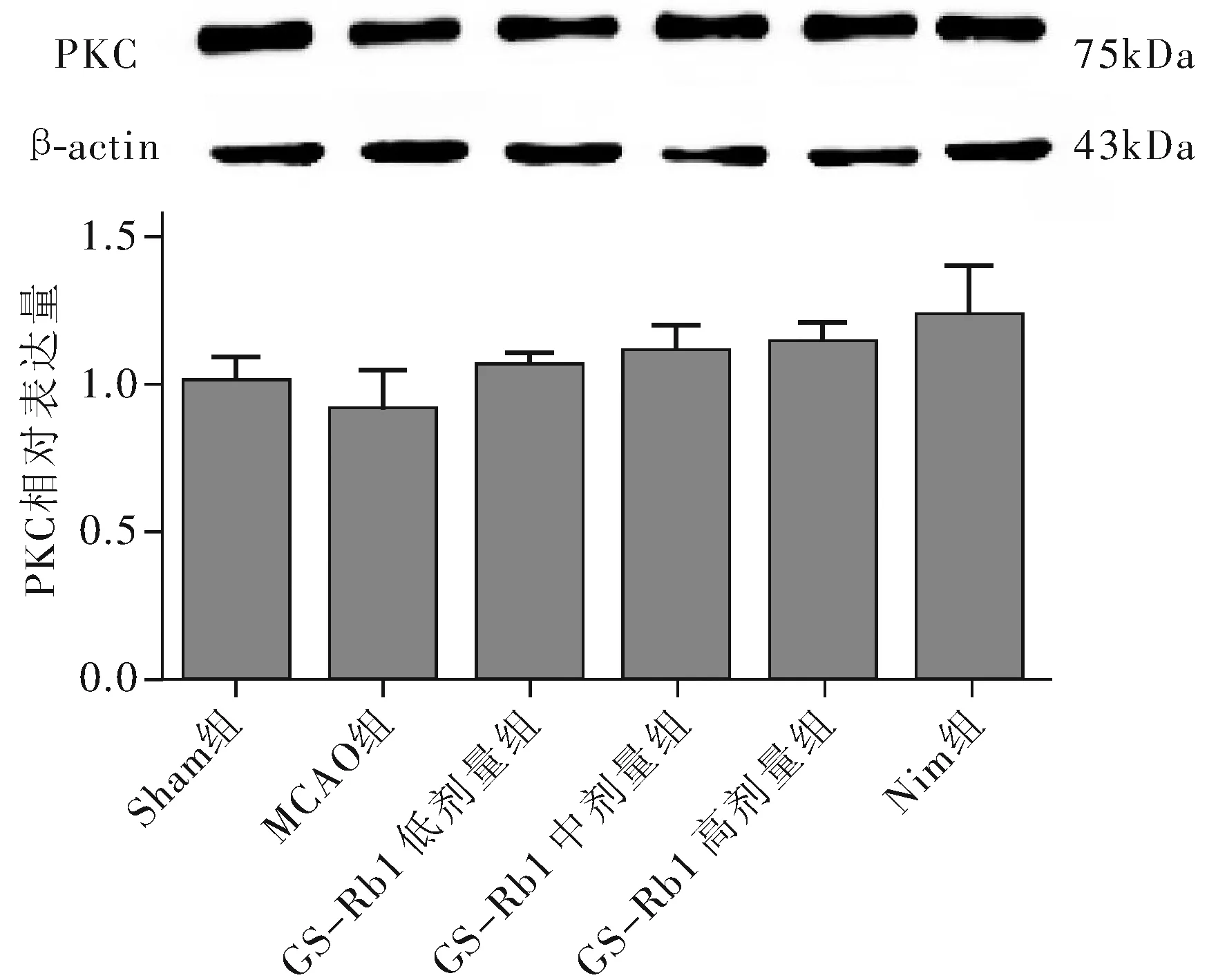
图3 各组大鼠右脑海马CA1区PKC蛋白表达(Western Blotting)
2.2 各组大鼠海马CA1区P-PKC蛋白表达
2.2.1 免疫组织化学结果:各组海马神经元细胞的 P-PKC 蛋白表达阳性细胞(棕色)数量和形态则有明显变化,MCAO 组海马神经元细胞中 P-PKC 阳性细胞数量较Sham 组少,海马细胞排列稀疏,细胞间隙增宽,大部分细胞水肿变形,核固缩;GS-Rb1 低剂量组海马细胞形态比模型组有所改善,但细胞仍排列稀疏,间隙增宽;GS-Rb1 中剂量组细胞形态改善但间隙还是较宽;GS-Rb1 高剂量组阳性细胞数较中剂量组增多,细胞形态改善明显,与Nim组相似,见图4。定量分析显示各组阳性细胞平均灰度值差异有统计学意义(F=33.41,P<0.01);MCAO 组阳性细胞平均灰度值显著高于Sham 组(t=6.725,P<0.01),GS-Rb1 低剂量-高剂量组平均灰度值均低于 MCAO 组(t=2.191、4.698、7.641,P均 <0.05),GS-Rb1 高剂量组平均灰度值与 Nim组差异无统计学意义(t=0.8147,P>0.05)。见图5。
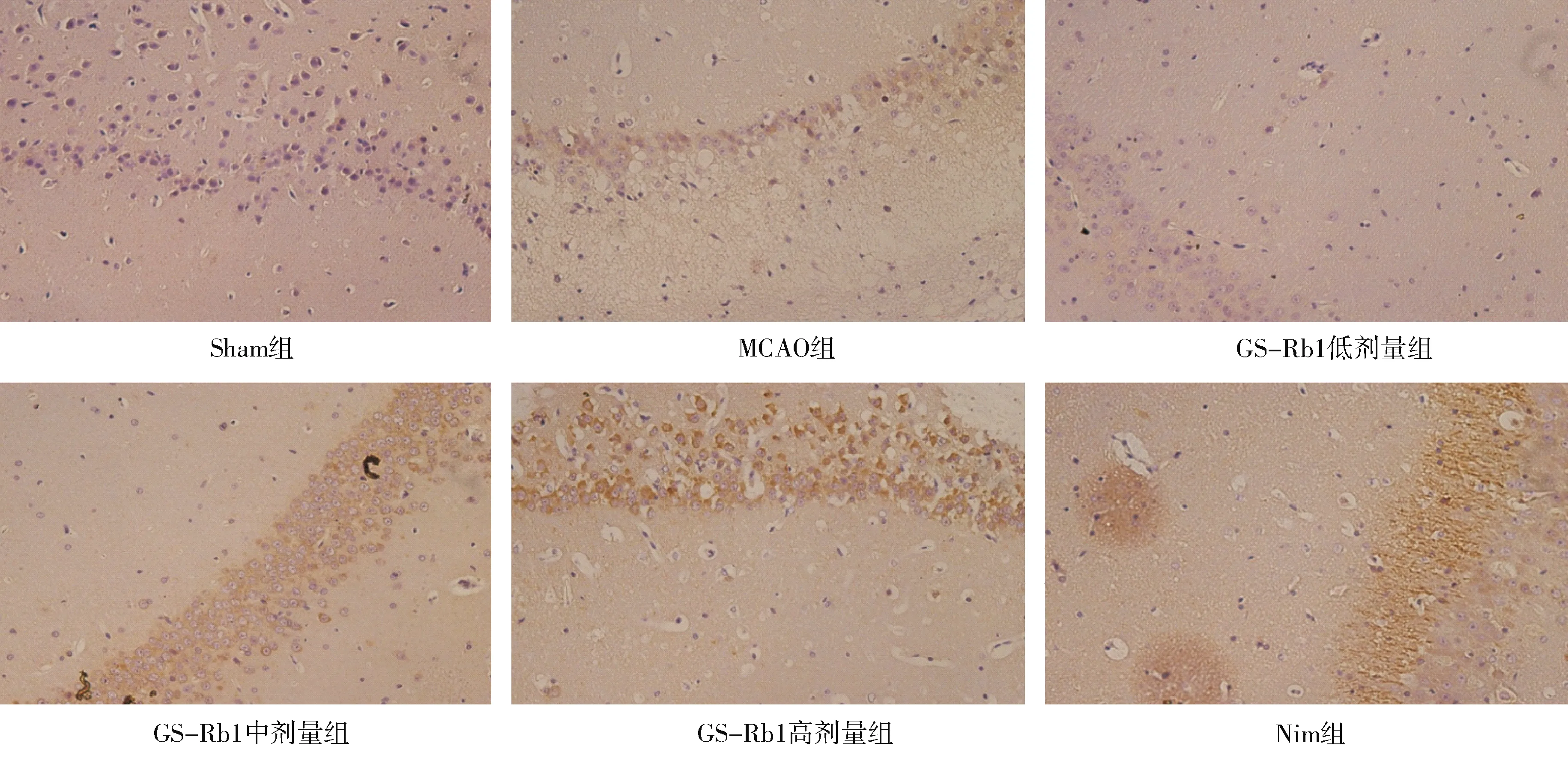
注:海马神经元P-PKC蛋白阳性细胞呈棕色,位于细胞膜和细胞浆中
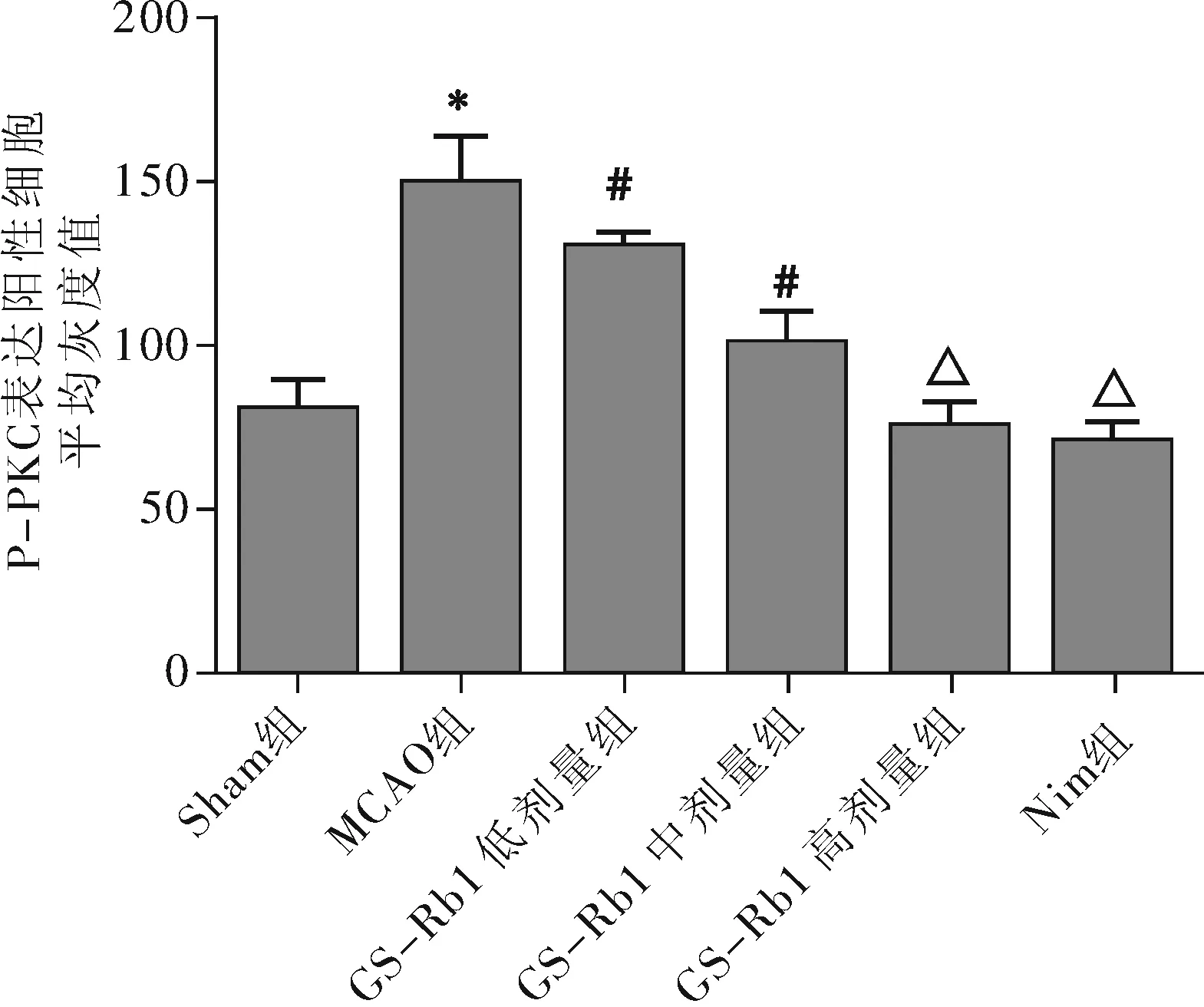
注:与Sham 组比较,*P<0.01;与 MCAO 组比较,#P<0.05,ΔP<0.01
2.2.2 Westeon Blotling检测结果:如图6所示,
各组海马神经元细胞 P-PKC 蛋白表达(相对表达量)差异有统计学意义(F=43.33,P<0.01);MCAO 组明显低于Sham 组(t=33.51,P<0.01),GS-Rb1 各剂量组均较 MCAO 组增加(t=3.955、8.928、11.53,P<0.05,P<0.01),GS-Rb1 高剂量组的增加与Nim组相似(t=0.6545,P>0.05)。
3 讨论
Rg1 和 Rb1 是 GS 的主要活性组分,以 GS-Rb1 生物利用度高[10]。研究表明 GS-Rb1 具有钙通道阻滞剂样和抗氧化自由基作用,能显著促纤溶,降低纤维蛋白原水平,抗血小板聚集,减少血栓形成和动脉硬化作用等,对防治心脑血管疾病具有积极意义[11-13]。
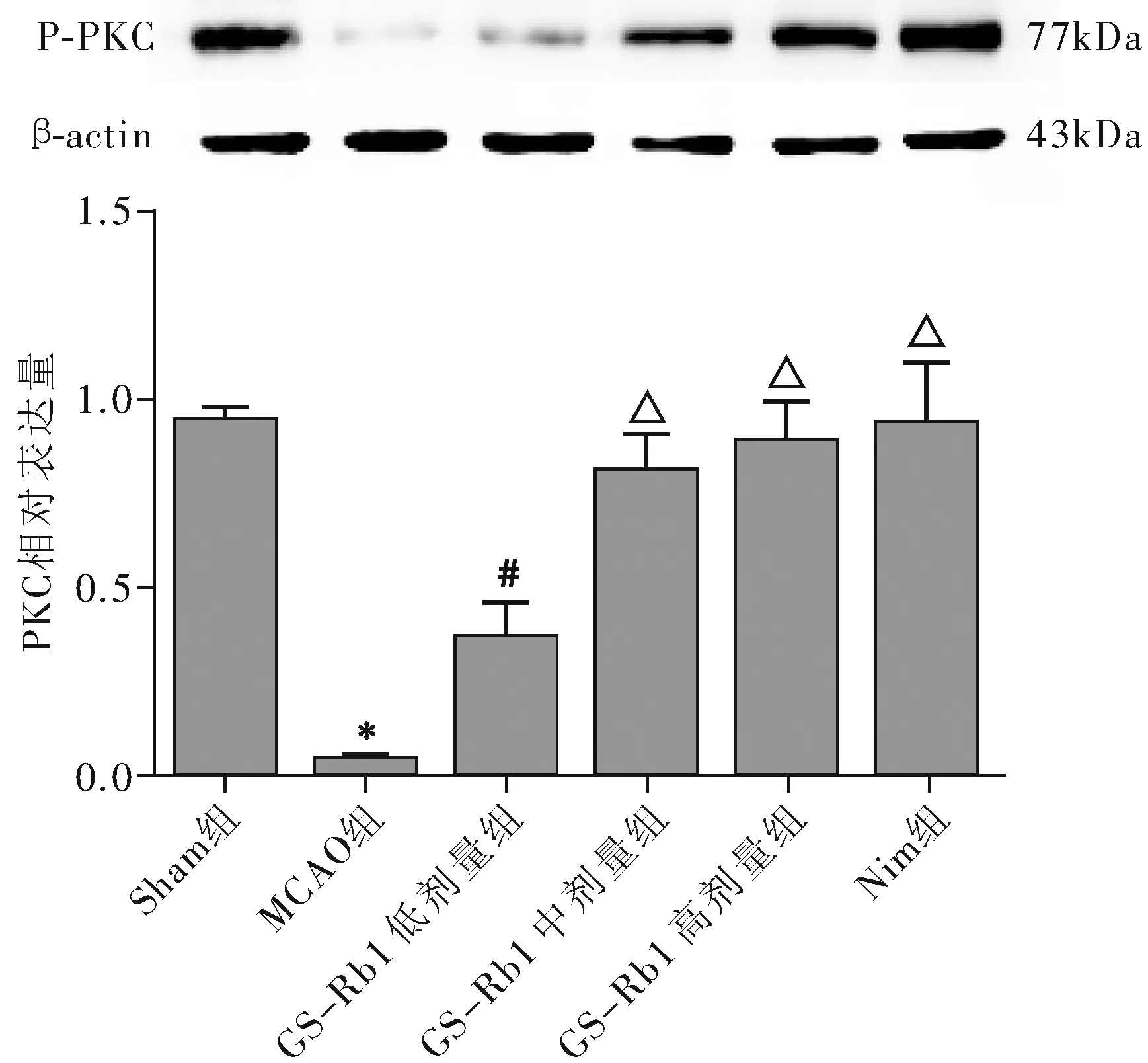
注:与Sham 组比较,*P<0.01;与 MCAO 组比较,#P<0.05,ΔP<0.01
PKC属于多功能丝氨酸和苏氨酸激酶,在中枢神经系统广泛分布,是许多信号传导通路的汇聚点,可启动和调节信号转导。研究认为,PKC 磷酸化能促进新合成的 PKC 稳定性,P-PKC活性调节主要通过DAG和钙离子等诱导变构而暴露其kinase区来实现,可保护神经细胞免受氧化应激损伤[14]。在缺血性脑损害过程中可能有多种 PKC 同工酶参与,PKC 的活性和表达变化与脑组织缺血紧密相关,尤其中枢神经系统的缺血损伤[15-17]。本实验在大鼠右脑缺血后 4 h 实施 GS-Rb1 干预,观察其不同剂量干预20 h后,大鼠海马 CA1 区 PKC 及 P-PKC 蛋白表达水平变化。结果显示,P-PKC蛋白表达在 MCAO 组明显低于Sham组,而随着 GS-Rb1 干预剂量增加,P-PKC蛋白表达逐渐增加,其作用与Nim相似。提示 GS-Rb1 可通过 PKC 磷酸化使脑损伤减轻,从而对脑缺血神经元起到保护作用。本文结果表明 GS-Rb1 可作为P-PKC 的非特异性激活剂,通过提高 PKC 磷酸化水平,减少神经元凋亡或坏死,改善缺血性脑损害,发挥脑保护作用。但 GS-Rb1 上述作用的确切机制尚需进一步研究。
本文第一作者简介:
陆学海(1991-),男,汉族,硕士研究生, 从事心脑血管疾病的防治研究
注:杨建宇与第一作者具有同等贡献
1 Kong LL, Wang ZY, Hu JF, et al. Inhibition of chemokine-like factor 1 protects against focal cerebral ischemia through the promotion of energy metabolism and anti-apoptotic effect[J]. Neurochemistry International, 2014, 76(10):91-98.
2 王时云, 罗海芸, 吴兰鸥. 三七皂苷改善实验性脑异常微环境及机制研究进展[J]. 中国实验方剂学杂志, 2013, 19(1):328-332.
3 詹合琴, 杨锦南, 吴蓝鸥, 等. 三七皂苷Rg1对脑缺血后海马CA1和CA3区BDNF蛋白的干预[J]. 中成药, 2006, 28(5):739-741.
4 Zhang HS, Wang SQ. Notoginsenoside R1 from Panax notoginseng, inhibits TNF-α-induced PAI-1 production in human aortic smooth muscle cells[J]. Vascular Pharmacology, 2006, 44(4):224-230.
5 Zhang W, Chen G, Deng CQ. Effects and mechanisms of total Panax notoginseng saponins on proliferation of vascular smooth muscle cells with plasma pharmacology method[J].Journal of Pharmacy and Pharmacology, 2012, 64(1): 139-145.
6 Aronowski J, Labiche LA. Perspectives on reperfusion-induced damage in rodent models of experimental focal ischemia and role of gamma-protein kinase C[J]. Ilar Journal, 2003, 44(2):105-109.
7 Miettinen S, Roivainen R, Keinnen R, et al. Specific induction of protein kinase C delta subspecies after transient middle cerebral artery occlusion in the rat brain: inhibition by MK-801[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 1996, 16(19):6 236-6 245.
8 罗 燕, 许能贵, 易 玮, 等. 电针对局灶性脑缺血大鼠缺血灶周围区星形胶质细胞谷氨酸转运体的影响[J]. 安徽中医药大学学报, 2009, 28(1):30-33.
9 Peng B, Guo QL, He ZJ, et al. Remote ischemic postconditioning protects the brain from global cerebral ischemia/reperfusion injury by up-regulating endothelial nitric oxide synthase through the PI3K/Akt pathway[J]. Brain Research, 2012, 1 445(2):92-102.
10 胡锦芳, 温金华, 蒋丽华. 复方血栓通片中人参皂苷Rb1与Rg1在大鼠体内的药代动力学研究[J]. 南昌大学学报(医学版), 2011, 51(11):6-9.
11 Zhong GG,Sun CW,Li YY, et al.Calcium channel blockade and anti-free-radical actions of panaxadiol saponins Rb1,Rb2,Rb3,Rc,and Rd[J].Acta Pharmacologica Sinica,1995,16(3): 255-260.
12 周家明, 叶祖光, 崔秀明,等. 三七皂苷R1、R2和人参皂苷Rb1药效学研究[J]. 中成药, 2010, 32(9):1494-1497.
13 Sunwoo YY, Park SI, Chung YA, et al. A pilot study for the neuroprotective effect of gongjin-dan on transient middle cerebral artery occlusion-induced ischemic rat brain[J]. Evidence-Based Complementray and Alternative Medicine,2012,2012:682720.
14 姜恩平. 蒺藜皂苷对脑缺血再灌注损伤的保护作用及其机制的研究[D]. 吉林大学, 2010:15-26.
15 Ni S, Chen L, Mei L, et al. PKC iota promotes cellular proliferation by accelerated G1/S transition via interaction with CDK7 in esophageal squamous cell carcinoma[J]. Tumor Biology,2016,37(10):1-11.
16 Wu D, Wang J, Li H, et al. Role of hydrogen sulfide in ischemia-reperfusion injury[J]. Oxidative Medicine & Cellular Longevity, 2015, 2015(16):186908.
17 Krupska O, Sarnowska A, Fedorczyk B, et al. Ischemia/reperfusion-induced translocation of PKCβII to mitochondria as an important mediator of a protective signaling mechanism in an ischemia-resistant region of the hippocampus[J]. Neurochemical Research, 2017,42(8):2 392-2 403.
Effects of Ginsenoside Rb1 on Phosphorylation PKC Signaling Pathways after Ischemic Hippocampus in Rats
LU Xue-hai1,3, YANG Jian-yu1,LI Na1, GUO Ying1,YANG Chun-yan1,ZHAO Li-qin1,PU Li-jin2,LUO Hai-yun1,#
1Department of Pharmacology, School of Basic Medicine, Kunming 650500, China;2Department of Cardiology, First Affiliated Hospital of Kunming Medical University, Kunming 650500,China;3Second People's Hospital of Qujing 655000,China;#
Objective: To explore effects of ginsenoside rb1 on phosphorylation PKC signaling pathways after Ischemic Hippocampus in Rats.Method: 72 healthy and male Sprague-Dawley rats were randomly divided into 6 groups: sham group, MCAO group, GS-Rb1 at low-dose group ( 25mg/kg ) , GS-Rb1 at medium-dose group ( 50mg/kg ), GS-Rb1 at high-dose group (100mg/kg ), nimodipine group ( 1mg/kg ). Different drugs were administrated by intraperitoneal at 4h after ischemia. Sham group and model group were given equal volume of saline. The hippocampi were taken at 20h after operation The expression of PKC and P-PKC in hippocampal CA1 were detected respectively by immunohistochemistry and Western Blotting. Results:Immunohistochemistry and Western Blotting showed that the expression of PKC were no statistical difference among all groups(P>0.05).Immunohistochemistry and Western Blotting showed that the expression of P-PKC in MCAO group was less than that of sham group(P<0.01).GS-Rb1 dose-dependently increased the expression of P-PKC (P<0.05),especially at high-dose PNS-Rb1 group, which were similar to that of nimodipine.Conclusion:Our data suggest that ginsenoside Rb1 may be an effective drug for neuroprotection by the up-regulation of P-PKC.
GS-Rb1; Cerebral ischemia; Hippocampus; PKC
2016年云南省科技厅-昆明医科大学联合专项基金 (2016LZ035)
昆明医科大学,昆明 650500,1基础医学院药理学系;2昆明医科大学第一附属医院心内科,昆明,650500;3云南省曲靖市第二人民医院,曲靖市 655000;#
,E-mail:luohaiyun12@163.com
本文2017-04-26收到,2017-06-23修回
R285.5
A
1005-1740(2017)03-0005-06