化学缺氧对小鼠胰腺星状细胞增殖活化的影响
关宇昕, 成洪杰, 崔培林
1.北京积水潭医院消化内科,北京 100096;2.首都医科大学附属北京天坛医院消化内科
论著·胰腺疾病
化学缺氧对小鼠胰腺星状细胞增殖活化的影响
关宇昕1, 成洪杰2, 崔培林2
1.北京积水潭医院消化内科,北京 100096;2.首都医科大学附属北京天坛医院消化内科
目的 探讨化学缺氧对小鼠胰腺星状细胞(pancreatic stellate cells,PSCs)增殖活化的影响。方法 原代培养出小鼠PSCs并进行鉴定,于培养基中加入CoCl2(使其在培养基中的终浓度分别为0、50、100、200 μmol/L)培养18 h以诱导化学低氧状态,免疫组化检测低氧诱导因子-1α(HIF-1α)表达情况,免疫荧光测定PSCs活化情况,细胞计数明确细胞增殖情况。结果 随着培养基中CoCl2终浓度的增加,表达HIF-1α阳性的细胞百分比逐渐增加,由0增加至32.000%(31.325%,34.175%)(H=42.333,P=0.000)。活化的PSCs比例逐渐增加,由(3.833±2.234)%上调至(21.950±1.446)%(F=258.774,P=0.000),PSCs计数逐渐增加,由(61.08±2.712)×104ml-1增加至(71.67±2.309)×104ml-1(F=28.967,P=0.000)。结论 缺氧条件下通过HIF-1α引起PSCs增殖及活化程度的增加。
缺氧;胰腺星状细胞;低氧诱导因子-1α
胰腺纤维化是多种慢性胰腺疾病共同的病理学改变,其本质是细胞外基质沉积和降解的失平衡,胰腺星状细胞(pancreatic stellate cells, PSCs)的活化是这种失衡的关键因素[1]。1998年Apte和Bachem等首次用密度梯度离心法从胰腺组织中分离、培养出星状细胞[2-3]。该细胞位于胰腺小叶间和腺泡周围,约占胰腺细胞数的3.99%。在正常组织中,PSCs非常少,免疫组织化学染色显示其处于静止状态,只是偶尔阳性表达,但在慢性胰腺炎组织中PSCs数量明显增多,并处于激活状态,表现为α-平滑肌肌动蛋白抗原(α-smooth muscle antigen,α-SMA)表达明显增加,从而引起细胞外基质(ECM)的合成显著增加。缺血缺氧广泛存在于胰腺纤维化这一病理学改变过程中。胰腺小叶内中央动脉是唯一一支供应胰腺腺叶的动脉,这种解剖结构决定胰腺组织对缺氧的代偿反应非常差。HIF-1α是组织细胞维持氧平衡的重要转录调节因子,在慢性胰腺疾病缺氧应答、胰腺纤维化的发生和发展中起关键作用。本实验将阐明缺氧通过低氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)对体外培养的PSCs增殖活化的影响。
1 材料与方法
1.1 实验动物 清洁级昆明小鼠,体质量约20 g,购自北京天坛医院动物实验中心。
1.2 实验材料 胰酶抑制剂、兔抗鼠α-SMA单克隆抗体、兔抗鼠HIF-1α单克隆抗体购自美国Sigma公司,SP免疫组化试剂盒购自北京中山生物技术有限公司。
1.3 实验方法
1.3.1 原代细胞分离:小鼠PSCs分离、培养:取体质量20 g左右的清洁级昆明小鼠,乙醚深度麻醉后采用脊髓脱臼法处死,酒精消毒后迅速剖腹取出胰腺,放入预冷PBS中清洗,于解剖显微镜下剔除胰腺被膜及血管。PBS清洗后将组织剪成1 mm×1 mm×1 mm大小,置于多聚赖氨酸包被的6孔培养板中。1 h后取出培养瓶,加入含200 g/L胎牛血清、1 g/L胰酶抑制剂、10 g/L青链霉素的DMEM培养基5 ml,24 h后换液。48 h后细胞贴壁。
1.3.2 PSCs鉴定:显微镜下观察PSCs形态。对PSCs进行油红O染色。6孔培养板每孔加入1.5 ml, 40 g/L多聚甲醛室温固定20 min,将配置好的浓度为5 g/L的油红溶液与蒸馏水按照3∶2配制为工作液。吸出多聚甲醛,加入工作液,10 min后吸净,并蒸馏水清洗一遍,显微镜下观察。免疫荧光染色测定传代后以及化学诱导缺氧后PSCs中α-SMA表达情况。甲醛固定30 min。后按1∶800加入0.5 μg/ml抗α-SMA一抗,1孔为对照组加入等体积的PBS替代一抗,室温90 min。向每孔按1∶100加入FITC标记的二抗30 min。避光条件下分别于每孔中加入DAPI荧光染剂。对照组用相同量的PBS替代,3 min。避光条件吸干,于荧光显微镜下观察,蓝色荧光为DAPI染的细胞核,绿色荧光为α-SMA阳性细胞。观察4个高倍镜视野(50×)计算阳性率。
1.3.3 诱导缺氧状态:将细胞分为4组,每组3个孔板,细胞长至孔板约70%更换为无血清培养基培养24 h后向培养基中加入CoCl2,使其终浓度分别为0、50、100、200 μmol/L。
1.3.4 SP法(辣根过氧化物酶标记的链酶卵白素免疫组化染色方法)测定HIF-1α表达情况:操作步骤参照SP免疫组化试剂盒说明书进行,40 g/L多聚甲醛1 ml于4 ℃固定30 min,PBS冲洗后加入灭活内源性过氧化物酶1 ml室温15 min,PBS冲洗后加入PBS+3 g/L Triton+5 g/L FBS封闭液1 ml 30 min,吸出多余液体后加入兔抗鼠HIF-1α单克隆抗体1 ml 2 μg/ml(Sigma USA),4 ℃过夜。37 ℃复温1 h,PBS洗后加入生物素标记的抗兔的Ⅱ抗1 ml,室温30 min,PBS冲洗,滴加辣根过氧化酶标记的链酶卵白素1 ml,室温30 min,PBS冲洗,滴加DAB显色液,15 min后于显微镜下观察。HIF-1α阳性染色主要定位于细胞胞核中,细胞核有浅黄色、棕色、棕褐色颗粒为阳性细胞,观察4个高倍镜视野(50×)计算阳性率。
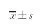
2 结果
2.1 小鼠PSCs鉴定
2.1.1 形态学观察:细胞原代培养48 h,可见大量PSCs贴壁,呈未活化状态,形态呈球形,胞核较大,胞浆内有许多明亮脂滴,数量从几个甚至到几十个(见图1)。传代后细胞完全活化,形态发生改变,细胞向四周伸出突起由圆形逐渐变为不规则三角形或星形,并伴有脂滴减少(见图2)。
2.1.2 油红O染色法:观察脂肪滴可见细胞质中有大量被染成红色的脂滴,围绕着细胞核环形排列(见图3)。
2.1.3 免疫荧光染色:测定α-SMA表达:原代培养出的尚未传代的PSCs几乎没有α-SMA蛋白的特异表达,传代后PSCs基本完全活化,可见明显的α-SMA表达(见图4)。
2.2 不同缺氧条件下HIF-1α表达 免疫组化染色显示,随着CoCl2浓度增加,表达HIF-1α阳性的细胞比例增加。4组间差异有统计学意义(H=42.333,P=0.000,见图5、表1)。
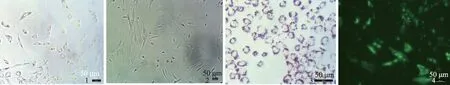
图1 未活化的PSCs;图2 活化后PSCs;图3 油红O染色;图4 活化后PSCs中α-SMA表达
Fig 1 Non-activated PSCs; Fig 2 PSCs after activation; Fig 3 Oil Red O staining; Fig 4 Immunostaining of α-SMA in cells after activation
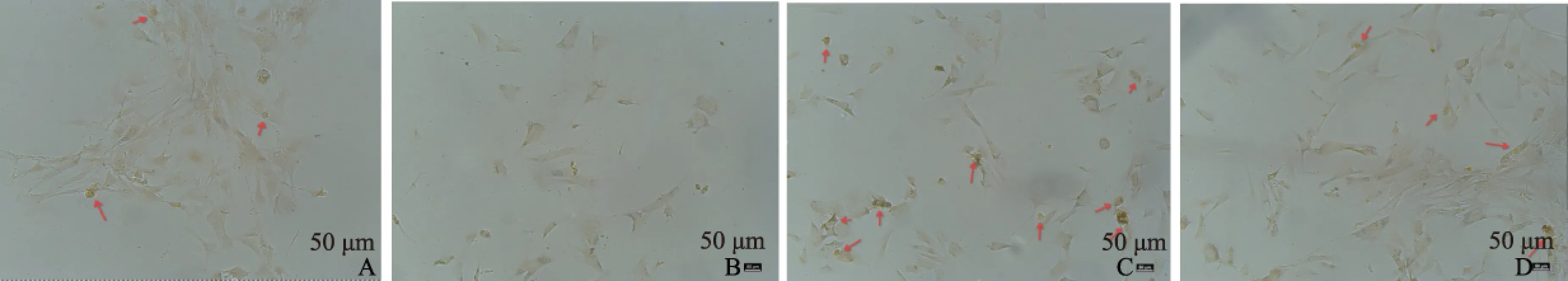
图5 不同CoCl2浓度下HIF-1α蛋白在PSCs中的表达情况 A: 0 μmol/L;B: 50 μmol/L;C: 100 μmol/L;D: 200 μmol/L
Fig 5 Expression of HIF-1α protein in PSCs at different concentrations of CoCl2A: 0 μmol/L; B: 50 μmol/L; C: 100 μmol/L; D: 200 μmol/L
表1 不同CoCl2终浓度下HIF-1α表达
Tab 1 Expression of HIF-1α at different final concentrations of CoCl2
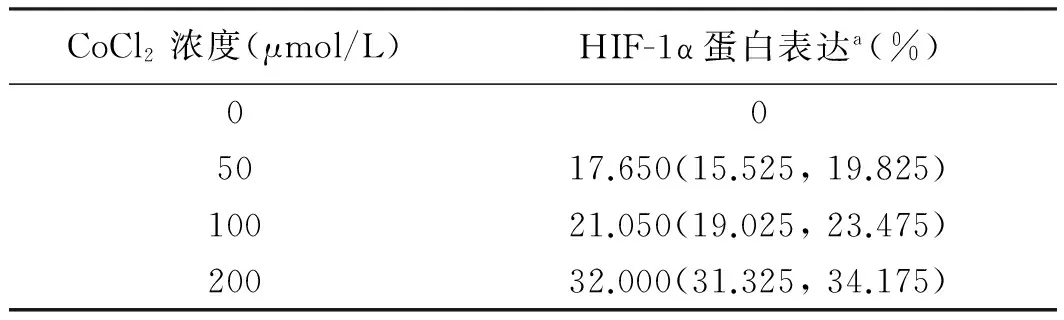
CoCl2浓度(μmol/L)HIF-1α蛋白表达a(%)005017.650(15.525,19.825)10021.050(19.025,23.475)20032.000(31.325,34.175)
注:a:H=42.333,P=0.000。
2.3 低氧条件下PSCs细胞增殖、活化情况
2.3.1 细胞计数:不同终浓度的CoCl2条件培养基处理PSC细胞18 h后,PSCs细胞增殖呈增加趋势(F=28.967,P=0.000,见图6、表2),α-SMA阳性表达的细胞百分比也呈现增加趋势(F=258.774,P=0.000,见表2),4组间差异均有统计学意义(P<0.05)。
表2 不同CoCl2终浓度下α-SMA表达及PSCs数量
Tab 2 Expression of α-SMA and counting of PSCs at different final concentrations of CoCl2
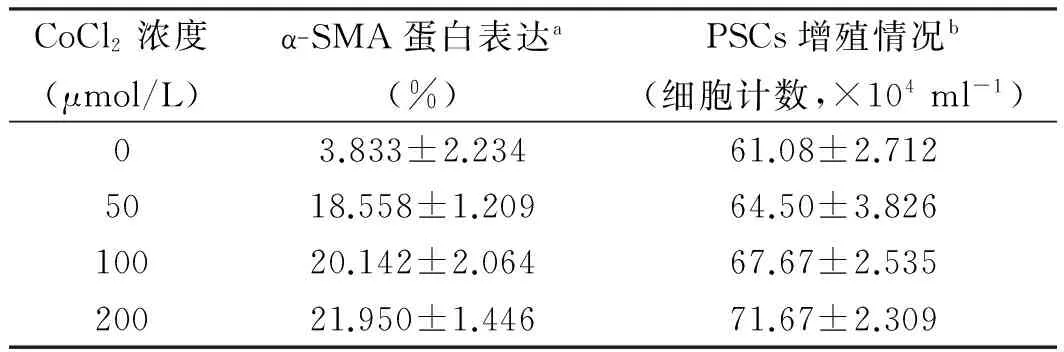
CoCl2浓度(μmol/L)α-SMA蛋白表达a(%)PSCs增殖情况b(细胞计数,×104ml-1)03.833±2.23461.08±2.7125018.558±1.20964.50±3.82610020.142±2.06467.67±2.53520021.950±1.44671.67±2.309
注:a:F=258.774,P=0.000;b:F=28.967,P=0.000。

图6 不同CoCl2浓度下细胞的数量 A: 0 μmol/L;B: 50 μmol/L;C: 100 μmol/L;D: 200 μmol/L Fig 6 Cell numbers at different concentrations of CoCl2 A: 0 μmol/L; B: 50 μmol/L; C: 100 μmol/L; D: 200 μmol/L
2.3.2 相关性分析: 将HIF1-α表达分别与PSCs计数、α-SMA表达进行相关性分析发现均呈正相关(HIF1-α与PSCs计数的Spearman相关系数为0.790;HIF1-α与α-SMA表达的Spearman相关系数为0.828);且以上两组均有较强相关性(P<0.05)。说明缺氧状态下,PSCs中HIF1-α表达明显上调,其上调程度与PSCs的增殖活化呈正相关。
3 讨论
胰腺纤维化将会导致胰腺结构的损坏及功能的缺失。这一病理过程在早期可以控制,甚至逆转,长期而持久存在的促纤维化因素将会引起胰腺结构及功能不可逆的损伤。所以研究导致胰腺纤维化可能的机制,将会有助于找到抑制胰腺纤维化的因素,对治疗胰腺纤维化的发生、发展有重要意义。
已有实验证实活化的PSCs是造成细胞外基质过度沉积的核心环节,大量研究表明,在导致慢性胰腺纤维化的众多因素中,缺血缺氧是其中一个重要的病理生理过程。已有一项对照研究[4]发现,在胰腺癌、慢性胰腺炎和正常胰腺组织中HIF1-α蛋白的阳性表达率分别为76.2%、22.2%和0,提示HIF1-α表达可能与胰腺疾病的发生、发展有密切关系。
本研究中我们采用组织块培养法[5]成功分离并培养了原代小鼠PSCs,并对其进行鉴定。实验中原代培养出的小鼠PSCs呈球形,核较大,胞浆周围有大量被油红O染色的脂肪滴,活化后可见有α-SMA表达。为了模拟细胞缺氧状态,本研究中采用CoCl2诱导化学缺氧状态。实验中我们发现,在观察期限内加入CoCl2后,随着溶液中CoCl2终浓度的增加,PSCs中HIF1-α阳性的细胞比例逐渐增加,证明我们成功诱导出缺氧状态,另一方面细胞计数及免疫荧光结果提示,PSCs的增殖和活化明显增加,说明缺氧条件能够促进PSCs的增殖和活化,且程度随着培养基中CoCl2终浓度增加而增加;众多研究表明,PSCs的增殖和活化受到包括细胞因子[6-7]和氧化应激[8]在内的多种因素影响,如TGF-β1、PDGF、IL-1、IL-6、IL-10、TNF-α等,这些细胞因子一方面可刺激PSCs产生胶原蛋白,促进胰腺的纤维化,同时活化的PSCs本身也可分泌多种细胞因子,形成自分泌环,导致PSCs的持续激活[9-10]。
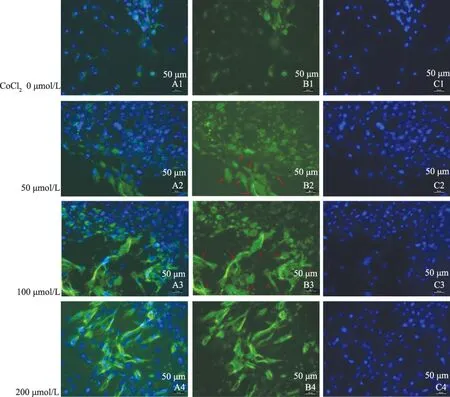
图7 不同CoCl2浓度下PSCs细胞中α-SMA阳性表达 A:DAPI染镜下所有细胞的细胞核α-SMA阳性表达;B:免疫荧光染色下α-SMA阳性表达;C:两者合并后α-SMA阳性表达
Fig 7 The positive expression of α-SMA in PSCs cells at different concentrations of CoCl2A: positive expression of α-SMA by DAPI staining; B: positive expression of α-SMA by immunofluorescent staining; C: positive expression of α-SMA after the combination of the two staining methods
HIF-1是目前发现的氧信号相关传导途经中重要的环节。HIF-1存在于大部分人体组织内,包含HIF-1α和HIF-1β两个亚单位[11],当环境氧浓度小于5%时,HIF-1α羟化受阻不被降解,与HIF-1β形成二聚体,通过与靶基因上的缺氧反应元件(hypoxia response element,HRE)结合而促进相关靶基因转录,影响下游因子表达[12]。众多研究表明,HIF-1α参与调控多种与组织纤维化相关的因子的表达:如血管内皮生长因子(vascular endothelial growth factor,VEGF)、TNF、胰岛素样生长因子(insulin-like growth factors,IGF)、TGFα,β以及结缔组织因子(CTGF)等,这些因子和介质均参与PSCs的激活和增殖过程[13-16]。
本研究中,进一步将HIF-1α分别与PSCs的增殖及活化情况进行相关性分析发现,随着HIF-1α表达的增加,PSC细胞增殖和活化也呈增加趋势,均为线性正相关。说明缺氧条件是通过HIF-1α介导PSCs的增殖活化,具体机制本实验中未继续深入研究。此前已有实验验证:HIF-1α对肝星状细胞分泌的细基质金属蛋白酶-2(matric metalloprotease,MMP-2)表达及酶活性有影响,MMP-2可间接促进肝星状细胞活化,而活化后的肝星状细胞不仅能产生大量的细胞外基质也是肝内MMP-2的主要来源[17]。由于PSCs和肝星状细胞组织结构、蛋白表达均有很多相关性,可以此为切入点进一步探讨HIF-1α引起PSCs活化以及胰腺纤维化可能的机制。
本研究结果提示,化学缺氧能使PSCs的增殖活化程度增加,且呈现剂量相关性,HIF-1α介导的细胞通路可能参与这一过程,具体机制还有待进一步研究。HIF-1α可能是抑制PSCs活化的潜在靶点。
[1]王瑜萍, 王瑜真, 张智高, 等. 胰腺纤维化发生机制的研究进展[J]. 实用医药杂志, 2011, 28(3): 274-276.
[2]Apte MV, Haber PS, Applegate TL, et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture [J]. Gut, 1998, 43(1): 128-133.
[3]Bachem MG, Schneider E, Gross H, et al. Identification, culture, and characterization of pancreatic stellate cells in rats and humans [J]. Gastroenterology, 1998, 115(2): 421-432.
[4]陆晔斌, 孙维佳, 胡娟娟, 等. 胰腺癌组织HIF-1α和MIC A/B的表达及意义[J]. 临床肿瘤学杂志, 2012, 17(7): 616-620. Lu YB, Sun WJ, Hu JJ, et al. The action on immunity of hypoxia in pancreatic carcinoma: the expression and significance of HIF-1α and MIC A/B [J]. Chinese Clinical Oncology, 2012, 17(7): 616-620.
[5]范昕, 卢旷逸, 马小艳, 等. 一种小鼠胰腺星状细胞分离培养方法[J]. 中华实验外科杂志, 2012, 29(4): 751.
[6]Takahashi M, Mutoh M, Ishigamori R, et al. Involvement of inflammatory factors in pancreatic carcinogenesis and preventive effects of anti-inflammatory agents [J]. Semin Immunopathol, 2013, 35(2): 203-227.
[7]Landskron G, De la Fuente M, Thuwajit P, et al. Chronic inflammation and cytokines in the tumor microenvironment [J]. J Immunol Res, 2014, 2014: 149185.
[8]Lei J, Huo X, Duan W, et al. α-Mangostin inhibits hypoxia-driven ROS-induced PSC activation and pancreatic cancer cell invasion [J]. Cancer Lett, 2014, 347(1): 129-138.
[9]姜婷婷, 许小凡, 张红. TGF-β/Smads信号通路与胰腺纤维化[J].中华临床医师杂志(电子版), 2013, 7(24): 11619-11622. Jiang TT, Xu XF, Zhang H. The role of TGF-β/Smads signaling pathway in the pancreatic fibrosis [J]. Chinese Journal of Clinicians (Electronic Edition), 2013, 7(24): 11619-11622.
[10]Manresa MC, Godson C, Taylor CT. Hypoxia-sensitive pathways in inflammation-driven fibrosis [J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307(12): R1369-1380.
[11]Wang GL, Jiang BH, Rue EA, et al. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension [J]. Proc Natl Acad Sci U S A, 1995, 92(12): 5510-5514.
[12]Semenza GL, Agani F, Booth G, et al. Structural and functional analysis of hypoxia-inducible factor 1 [J]. Kidney Int, 1997, 51(2): 553-555.
[13]Ahluwalia A, Tarnawski AS. Critical role of hypoxia sensor-HIF-1α in VEGF gene activation. Implications for angiogenesis and tissue injury healing [J]. Curr Med Chem, 2012, 19(1): 90-97.
[14]Hu Y, Wan R, Yu G, et al. Imbalance of Wnt/Dkk negative feedback promotes persistent activation of pancreatic stellate cells in chronic pancreatitis [J]. PLoS One, 2014, 9(4): e95145.
[15]Corporation HP. Chronic inflammation and cytokines in the tumor microenvironment [J]. J Immunol Res, 2014, 2014(1): 392-407.
[16]Zang G, Sandberg M, Carlsson PO, et al. Activated pancreatic stellate cells can impair pancreatic islet function in mice [J]. Ups J Med Sci, 2015, 120(3): 169-180.
[17]Wang B, Ding YM, Fan P, et al. Expression and significance of MMP2 and HIF-1α in hepatocellular carcinoma [J]. Oncol Lett, 2014, 8(2): 539-546.
(责任编辑:马 军)
Hypoxia influencing the proliferation and activation of pancreatic stellate cells
GUAN Yuxin1, CHENG Hongjie2, CUI Peilin2
1.Department of Gastroenterology, Beijing Jishuitan Hospital, Beijing 100096; 2.Department of Gastroenterology, Beijing Tian Tan Hospital, Capital Medical University, China
Objective To investigate the effects of hypoxia on the proliferation and activation of pancreatic stellate cells (PSCs). Methods The mouse PSCs were isalated and indentified, when reached confluence, the cells were incubated in the DMEM with cobalt chloride (to make the final concentration to 0, 50, 100, 200 μmol/L) for 18 hours. The expression of HIF-1α was investigated by immunohistochemistry. Then the α-SMA expression was determined by immunofluorescence staining. And the cell proliferation was defined by the method of cell count. Results When the final concentration of CoCl2solution were increased from 0 to 200 μmol/L, the expression of HIF-1α was increased from 0 to 32.000%(31.325%, 34.175%). The difference among these four groups was significant (H=42.333,P=0.000); after 18 hours, the expressions of α-SMA were increased: (3.833±2.234)% for 0 μmol/L and (21.950±1.446)% for 200 μmol/L (F=258.774,P=0.000). The number of PSCs also showed an increasing trend, the final concentration of CoCl2from 0 to 200 μmol/L, cell counts were increased from (61.08±2.712)×104ml-1to (71.67±2.309)×104ml-1(F=28.967,P=0.000). Conclusion The proliferation and activation of PSCs increase significantly under hypoxia condition; HIF-1α is involved in the pathophysiological process of proliferation and activation of PSCs.
Hypoxia; Pancreatic stellate cells; Hypoxia-inducible factor-1α
10.3969/j.issn.1006-5709.2017.07.005
北京市优秀人才基金资助(2013D003034000032)
关宇昕,硕士研究生,E-mail:guanyx_7@126.com
崔培林,博士,副教授,研究生导师,研究方向:胰腺癌发病机制。E-mail:cuipl@aliyun.com
R576
A
1006-5709(2017)07-0736-05
2017-06-05

